大鼠体外循环前后血浆蛋白质差异性表达*
王寿勇,马琳玉,王 颖,张 洲,邓薇菲
(重庆医科大学附属儿童医院:1.麻醉科;2.血液肿瘤科,重庆 400014)
大鼠体外循环前后血浆蛋白质差异性表达*
王寿勇1,马琳玉2,王 颖1,张 洲1,邓薇菲1
(重庆医科大学附属儿童医院:1.麻醉科;2.血液肿瘤科,重庆 400014)
目的 实施大鼠体外循环(CPB)前后血浆比较蛋白质组学研究,了解CPB前、后血浆蛋白质的差异性表达,以期发现对早期诊断CPB后并发症有参考价值的血浆标志物。方法 将成年雄性SD大鼠10只分为实验组和对照组,每组5只,术前自由进食进水。实验组大鼠建立CPB模型,对照组只进行麻醉和动、静脉穿刺操作。两组动物分别在CPB前和CPB结束时采取血液标本1mL,肝素抗凝,分离血浆。血浆蛋白提纯后进行二维凝胶电泳、用ImageScanner扫描仪扫描成像。将被认定为差异表达的蛋白质斑点进行切胶、酶解和肽段提取后,用质谱仪分析鉴定。结果CPB后,大鼠血浆蛋白质表达斑点数目明显增加,共有17个表达上调的蛋白质斑点被认定为CPB所致。经质谱分析,共鉴定出5种蛋白质,分别为:凝溶胶蛋白、结合珠蛋白、载脂蛋白A1(ApoA1)、免疫球蛋白和Ba1-647。结论CPB可引起大鼠血浆蛋白质出现差异性表达,从功能上分析,凝溶胶蛋白、结合珠蛋白、ApoA1有可能作为研究CPB并发症的血浆标志物。
血浆;蛋白质组学;生物学标记;心肺转流术;模型,动物;大鼠
体外循环(cardiopulmonary bypass,CPB)下心内直视手术,是矫治各种先天性心血管畸形和挽救部分终末期心脏病患者的最有效手段。但是,对CPB这一非生理过程所伴随的内环境紊乱,目前尚缺乏全面认识。有研究者采用基因芯片技术获得了CPB前、后人血白细胞基因差异性表达谱[1],但信息量巨大,缺乏特异性,加上基因表达与病理、生理功能之间并非一一对应关系,对于全面认识CPB的影响未获得突破性进展。与基因表达相比,蛋白质表达的变化,尤其是血浆蛋白质表达的变化,对于早期发现和诊断损伤性病理、生理过程,判断转归,评估预后,指导临床治疗等方面,具有更为重要的意义。本研究拟以SD大鼠CPB模型为研究对象,实施血浆比较蛋白质组学研究。目的是要了解CPB引起的血浆蛋白质差异性表达,期望筛选出对判断CPB后重要器官、系统损伤等并发症具有指导意义的血浆标志性蛋白质。
1 材料与方法
1.1 材料 选取成年雄性SD大鼠10只,体质量300~350 g,由重庆医科大学动物实验中心提供,将10只SD大鼠分为实验组和对照组,每组5只,术前自由进食进水。实验组大鼠按照文献[2]的方法建立CPB模型,对照组只进行麻醉和动、静脉穿刺操作,不进行CPB。
1.2 方法
1.2.1 标本采集 实验组动物在CPB前和CPB结束后分别采血液标本1 mL,肝素抗凝,立即以2 000 r/min离心10 min,再以13 000 r/min离心10 min分离血浆,置于-70 ℃保存。对照组大鼠在与实验组平行的时刻同时留取血液标本并分离血浆。
1.2.2 样品制备 采用Bio-Rad Aurum Serum Protein Mini Kit对血浆样本进行处理,操作步骤严格按照试剂盒操作说明书进行。所获得的纯化蛋白析出液采用TCA-丙酮法沉淀,-20 ℃静置过夜,然后以16 000 r/min低温离心5 min,丢弃上清液。用丙酮清洗沉淀3次,加入裂解液100 μL,低温超声促溶5 min。纯化蛋白样品采用Bradford法进行定量。
1.2.3 固相pH梯度-十二烷基磺酸钠(SDS)双向凝胶电泳(2-DE) 蛋白上样量为1 mg,加入DTT 8.0 μL,IPG buffer 2.3 μL,用重泡胀液补足总体积至450.0 μL,旋涡振荡器上充分混匀。IPG胶条重泡胀12 h以上,然后转移到等电聚焦槽中,聚焦参数设置如下:40 V聚焦6 h,500 V聚焦1 h,1 000、3 000、5 000 V分别聚焦2 h,10 000 V聚焦6.3 h。再将胶板转移到垂直平板电泳仪中,恒温20 ℃,恒流电泳,4 W 60 min,10 W 320 min,3 W持续至溴酚蓝下沿泳动至玻璃板下沿时停止。
1.2.4 图像分析 胶块采用考马斯亮蓝染色后小心移至ImageScanner扫描仪的成像台上,启动扫描仪。图像采用ImageMaster 2D Platium软件分析,每一研究时刻所获标本进行3次平行重复,将3块实际胶图结果形成1张虚拟平均胶,在3次重复胶图中至少表达2次者被定义为有效表达点。最后将虚拟平均胶上的蛋白质表达点进行组间和组内的比较,差异表达的定义如下:(1)未能匹配的表达点;(2)虽然匹配,但二者蛋白质点锥状图体积比(v%比值)达到2.5以上。
1.2.5 质谱鉴定 在超净工作台上用切胶笔仔细将差异表达的蛋白质点切下,胶粒用超纯水清洗3遍,37 ℃浸泡30 min,加入脱色液脱色2次;加入胰蛋白酶消化后,采用70%乙腈和0.1%三氟乙酸提取,真空冷冻抽干。采用Bruker公司的AutoFlex型MALDI-TOF质谱仪进行分析,使用混合标准肽作为外标效正。获得的肽段数据用Mascot软件进行数据库检索,数据库地址为:www.matrixscience.com 或http://agilentl/mascot/cgi。
2 结 果
2.1 两组大鼠基本情况 实验组5只大鼠全部成功建立CPB模型,CPB结束后存活观察2 h以上。对照组5只大鼠在实验观察过程中生命体征平稳。
2.2 两组大鼠2-DE结果比较 胶图上大部分蛋白质点聚焦良好。在同一血浆样品的重复实验中,胶图上蛋白质点的表达、分布、点数、染色、背景噪音等方面差异不明显。匹配分析发现,CPB后,实验组和对照组血浆蛋白质表达点数均有较明显增加。CPB前,实验组和对照组未能匹配的蛋白质点有10个。其中,在对照组中高表达的有6个,在实验组中高表达的有4个(图1),但这10个蛋白质点在CPB后均未出现差异性表达。CPB后,对照组和实验组未能匹配的蛋白质点共有17个,全部为实验组中高表达(图2),这17个点被认为是CPB引起的差异性表达蛋白质。
2.3 质谱分析 将上述被认定为表达差异的17个蛋白质点进行切胶、酶解、肽段提取,经MALDI-TOF质谱仪鉴定,共鉴定出5种蛋白质,分别为:凝溶胶蛋白(gelsolin)、结合珠蛋白(haptoglobin)、载脂蛋白A1(apolipoprotein A-1,Apo A1)、免疫球蛋白(immunoglobulin gamma-2b)和Ba1-647。
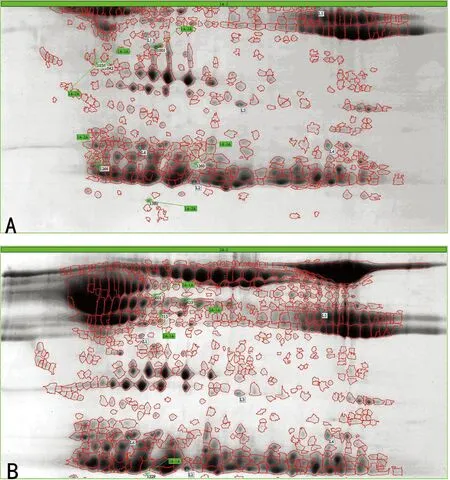
A:注释部分为对照组较实验组表达增高的血浆蛋白质斑点;B:注释部分为对照组较实验组表达降低的血浆蛋白质斑点。
图1 CPB前两组大鼠2-DE凝像图比较

图2 CPB后实验组表达升高的蛋白点
3 讨 论
CPB会严重干扰机体内环境的平衡,常导致以急性肺损伤为主的重要器官、系统功能障碍[3-4]。由于缺乏明确的预警信号或早期标志物,导致临床上对某些CPB相关并发症的预防和治疗缺乏足够的预见性。从血液(血浆或血清)中发现生命现象的执行者——蛋白质的变化,是目前临床上最简单、最常用和最有效的疾病诊断、监测、预后判断方法。通过对模型鼠的研究,本实验发现了CPB引起的血浆差异性表达蛋白质,有可能成为监测CPB损伤效应的候选标志物。
本研究发现,CPB后,2-DE凝胶图上所识别的蛋白质斑点数较CPB前增加了120~150个(20%),表明在CPB这种非生理状态下,大鼠机体内发生了一系列基因转录、翻译和蛋白质的合成与释放过程。同时,对照组经假手术处理后,凝胶图上所识别的蛋白质斑点数也出现了明显增加,这说明实验组CPB后血浆蛋白质表达的变化,还可能与麻醉、手术操作等非CPB因素有关。作为一种应用价值巨大的模式生物,大鼠体型微小,对手术创伤耐受力相对较弱,因此在本实验中,采用了经过改良的闭胸式、自主呼吸CPB模型,以尽量减少非CPB因素对机体的干扰,突出CPB的“孤立”作用[2]。
经过基质辅助激光解吸电离飞行时间质谱分析,CPB后17个被判定为差异表达的蛋白质斑点中,共鉴定出5种蛋白质,分别为凝溶胶蛋白、结合珠蛋白、ApoA1、免疫球蛋白和Ba1-647。(1)凝溶胶蛋白:CPB中,白细胞向肺部的浸润、激活,是引起肺组织损伤的基本环节[5-7]。凝溶胶蛋白是一种重要的肌动蛋白结合蛋白,它能够调节细胞骨架的重组,控制细胞质在凝胶态和溶胶态之间转换,从而调控包括炎症细胞在内的各种细胞的运动[8]。提示CPB中凝溶胶蛋白水平的变化,可能与肺组织损伤程度存在关联。此外,CPB期间,细胞破坏导致大量肌动蛋白进入血液循环,可通过聚合成微丝或形成微血栓,参与术后认知功能障碍的发生[9-10]。而凝溶胶蛋白能够阻止微丝的形成。因此,凝溶胶蛋白表达水平的变化,有可能成为CPB中肺部和中枢神经系统并发症的潜在标志物。(2)结合珠蛋白:结合珠蛋白属于一种急时相反应蛋白,其主要功能就是与血液中的游离血红蛋白相结合。游离血红蛋白为一具有活泼氧化效应的成分,能直接引起细胞膜和组织损伤,加重炎性反应。结合珠蛋白可与CPB中出现的游离血红蛋白不可逆结合,经清道夫受体介导,被网状内皮系统所清除。因此,推测其在减轻CPB相关的全身炎性反应中具有积极的作用。(3)Apo A1:Apo A1为243个氨基酸残基组成的非糖基化蛋白质,除了参与脂质代谢,对抗动脉粥样硬化之外,它还具有强大的抗炎症效应。在CPB过程中,由于黏膜屏障功能下降,导致内毒素吸收入血或胃肠菌群转位,产生内毒素血症[11-12]。内毒素激活单核细胞、巨噬细胞、中性粒细胞,促使其释放出各种炎性细胞因子,引起和加重CPB中的全身炎性反应。而Apo A1可能对此具有拮抗作用,Apo A1分子结构中含有两个内毒素结合位点,分别对内毒素和内毒素结合蛋白具有亲和力,因此,能够同时阻断游离内毒素和内毒素-内毒素结合蛋白复合物的作用,抑制内毒素的致炎效应。有动物实验证实,Apo A1能显著降低小鼠内毒素肺损伤模型的死亡率,延长存活时间[13]。(4)Ba1-647:Ba1-647为肝脏再生相关蛋白LRRG173。目前,国内外与之相关的研究报道非常少见[14-15],其是否与CPB后肝脏功能变化有内在联系,需通过进一步研究来予以明确。(5)免疫球蛋白:属于Ig重链恒定区,它在血浆中的增加,是体液免疫功能增强的表现。
综上所述,本研究发现了CPB引起的某些血浆蛋白质表达变化,从功能上分析,它们可能成为CPB中全身炎性反应综合征(SIRS)发生、发展和消退过程的标志物,进一步研究它们在CPB围术期的表达变化规律,对今后临床工作具有重要的参考意义。
[志谢:衷心感谢西农生(北京)生物科技有限公司周建军、张京强二位老师在蛋白质组学实验中给予的指导和帮助。]
[1]王寿勇,张诗海,姚尚龙.心内直视术患儿体外循环前后静脉血白细胞基因表达的比较[J].中华麻醉学杂志,2004,24(8):565-569.
[2]王寿勇,李廷玉[J].大鼠体外循环模型的建立与改进[J].中国实验动物学报,2009,17(1):21-24.
[3]Hirai S.Systemic inflammatory response syndrome after cardiac surgery under cardiopulmonary bypass[J].Ann Thorac Cardiovasc Surg,2003,9(6):365-370.
[4]Krdzalic A,Klokocovnik T,Krdzalic G,et al.The influence of cardiopulmonary bypass on respiratory function in patients who underwent coronary disease surgery[J].Med Arh,2013,67(2):97-100.
[5]Onorati F,Santini F,Mariscalco G,et al.Leukocyte filtration ameliorates the inflammatory response in patients with mild to moderate lung dysfunction[J].Ann Thorac Surg,2011,92(1):111-121.
[6]Kohira S,Oka N,Inoue N,et al.Effect of the neutrophil elastase inhibitor sivelestat on perioperative inflammatory response after pediatric heart surgery with cardiopulmonary bypass:a prospective randomized study[J].Artif Organs,2013,37(12):1027-1033.
[7]Yamazaki S,Inamori S,Nakatani T,et al.Activated protein C attenuates cardiopulmonary bypass-induced acute lung injury through the regulation of neutrophil activation[J].J Thorac Cardiovasc Surg,2011,141(5):1246-1252.
[8]Naq S,Larsson M,Robinson RC,et al.Gelsolin:the tail of a molecular gymnast[J].Cytoskeleton (Hoboken),2013,70(7):360-384.
[9]Newman MF,Mathew JP,Grocott HP,et al.Central nervous system injury associated with cardiac surgery[J].Lancet,2006,368(9536):694-703.
[10]Zanatta P,Forti A,Minniti G,et al.Brain emboli distribution and differentiation during cardiopulmonary bypass[J].J Cardiothorac Vasc Anesth,2013,27(5):865-875.
[11]Kats S,Schönberger JP,Brands R,et al.Endotoxin release in cardiac surgery with cardiopulmonary bypass:pathophysiology and possible therapeutic strategies.An update[J].Eur J Cardiothorac Surg,2011,39(4):451-458.
[12]Sun YJ,Sonq DD,Diao YG,et al.Penehyclidine hydrochloride preserves the intestinal barrier function in patients undergoing cardiopulmonary bypass[J].J Thorac Surg,2013,146(1):179-185..
[13]Ma J,Liao XL,Lou B,et al.Role of apolipoprotein A-I in protecting against endotoxin toxicity[J].Acta Biochim Biophys Sin(Shanghai),2004,36(6):419-424.
[14]徐存拴,韩鸿鹏,袁金云,等.大鼠短间隔连续部分肝切除中再生肝的基因表达差异[J].世界华人消化杂志,2004,12(3):654-663.
[15]钟小兰,吕志平,钱令嘉.肝郁证模型大鼠血清蛋白质组的差异表达研究[J].中华中医药杂志,2006,21(7):399-401.
Plasma protein differential expression before and after cardiopulmonary bypass*
WangShouyong1,MaLinyu2,WangYing1,ZhangZhou1,DengWeifei1
(1.DepartmentofAnesthesiology;2.DepartmentofHemotology,AffiliatedChildren′sHospitalofChongqingMedicalUniversity,Chongqing400014,China)
Objective To understand the plasma protein differential expression before and after cardiopulmonary bypass(CPB) through conducting the comparative proteomics study on rats in order to find the plasma markers with potential value in the early diagnosis of CPB resulted complications.Methods 10 adult male SD rats were divided into the experiment group and the control group randomly (n=5),and took food and water freely before operation.The rat models of CPB were constructed in the experiment group.But no any CPB operation was administered in the control group in addition to anesthesia induction,arterial and venous puncture procedure.1 mL of blood sample was extracted for separating plasma before CPB and at the end of CPB in the two groups.The total plasma protein was purified.Then the 2-dimensional electrophoresis and the scanning imaging by ImageScanner were performed.The protein spots verified to be differential expression were performed the cutting,enzymolysis and peptide fragment extraction.Finally the mass spectrometer was adopted to conduct the analysis and identification.Results The number of visualized spots was increased significantly after CPB.17 protein spots with up-regulated expression were identified as differential expression caused by CPB.5 proteins were verified by mass spectrometer analysis and database research.They were gelsolin,haptoglobin,apolipoprotein A-1,immunoglobulin gamma-2b and Ba1-647 respectively.Conclusion CPB can cause the differential expression of plasma proteins in rat model.According to the function analysis,gelsolin,haptoglobin and apolipoprotein A-1 have the potentiality of being the plasma markers for studying CPB complications.
plasma;proteomics;biomarker;cardiopulmonary bypass;models,animal;rats
� 著·
10.3969/j.issn.1671-8348.2015.10.005
国家自然科学基金资助项目(30700785);中国博士后科学基金资助项目(200704100779)。 作者简介:王寿勇(1972-),副主任医师、副教授,博士研究生,主要从事体外循环并发症发生机制研究。
R
A
1671-8348(2015)10-1311-03
2014-11-08
2014-12-28)

