大鼠脑缺血再灌注损伤过程中TRAF6的表达变化*
袁 平,何晓英,李小刚
(泸州医学院附属医院神经内科,四川泸州 646000)
大鼠脑缺血再灌注损伤过程中TRAF6的表达变化*
袁 平,何晓英,李小刚
(泸州医学院附属医院神经内科,四川泸州 646000)
目的 观察肿瘤坏死因子受体相关因子6(TRAF6)在大鼠脑缺血再灌注损伤中的作用。方法 将40只成年健康SD大鼠按照随机对照的原则,分成5组,每组8只:假手术组,缺血组,缺血再灌注2 h组 (R2 h组),缺血再灌注12 h组(R12 h组),缺血再灌注24 h组(R24 h组)。构建大鼠脑缺血再灌注损伤模型,RT-PCR和Western blot检测TRAF6的表达变化。免疫组化检测定位TRAF6蛋白。结果 与假手术组比较,缺血组和R2 h组、R12 h组、R24 h组TRAF6表达明显升高,差异有统计学意义(P<0.05)。TRAF6主要定位于神经元细胞细胞质。结论 大脑遭受缺血再灌注损伤时,活化的TRAF6参与脑细胞死亡。
肿瘤坏死因子受体相关肽和相关蛋白质类;脑缺血;再灌注损伤;细胞死亡
缺血性脑卒中仍旧是全球主要致死和致残的疾病之一,其病理、生理特点是脑血管的缺血以及再灌注,伴随血流的减少以及再灌注时自由基等的生成,最终导致脑细胞的损伤以及死亡[1]。有研究发现,Toll样受体信号通路介导的炎症免疫反应参与脑缺血再灌注损伤过程,但具体的分子机制不清楚[2]。本研究通过构建大鼠脑缺血再灌注损伤(ischemic-reperfusion injury,I/R)模型,检测Toll样受体下游关键接头蛋白肿瘤坏死因子受体相关因子6(tumor necrosis factor-associated 6,TRAF6)的表达变化,旨在探讨脑I/R的分子机制。
1 材料与方法
1.1 材料 成年健康SD大鼠40只,体质量220~260 g,购于泸州医学院实验动物中心。2,3,5-triphenyletetrazolium chloride (TTC)染色试剂购自美国Sigma公司,Trizol试剂盒购自Invitrogen 公司,Reagents试剂盒购自宝生物工程公司,荧光定量仪iCycler iQ购自美国Bio-Rad公司,蛋白定量试剂盒购自武汉博士德生物工程有限公司。一抗购自美国Upstate公司,二抗购自美国Santa Cruz公司。
1.2 方法
1.2.1 实验动物分组 将40只成年健康SD大鼠按照随机对照的原则,分成假手术组、缺血组、缺血再灌注2 h组(R2 h组),缺血再灌注12 h组(R12 h组),缺血再灌注24 h组(R24 h组),每组8只。
1.2.2 建立大鼠大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)动物模型 应用Zea Longa 线栓法经左侧颈外-颈内动脉插线建立大鼠大脑中动脉I/R模型,在脑缺血1 h后,抽去线恢复血流灌注,分别于再灌注2、12、24 h处死动物,取脑组织和外周血备用[3]。
1.2.3 TTC染色和脑梗死面积的计算 脑组织切片,TTC染色,37 ℃ 20 min,梗死区变白色,非梗死区变红色。计算梗死面积,为校正脑水肿带来梗死体积的偏差,梗死体积以所占大脑半球的百分率来表示,梗死体积百分比=脑梗死体积/对侧正常脑组织体积×100%。
1.2.4 实时荧光定量PCR(RT-PCR)检测TRAF6 mRNA表达 每只大鼠取下约50 mg脑组织,在Trizol中提取总RNA按照说明书进行,cDNA合成按Reagents试剂盒说明书。引物、荧光探针由中国大连TaKaRa公司合成,TRAF6上游引物:5′-TCT GCT TGA TGG CTT TAC G-3′,下游引物:5′-ACC GTC AGG GAA AGA ATC T-3′,探针序列:5′-FAM-AGC AGT GCA AAC ACC ATG TGG C-ECLIPSE-3′,片段长度为181 bp;β-actin上游引物:5′-CGT GAA AAG ATG ACC CAG AT-3′,下游引物:5′-ACC CTC ATA GAT GGG CAC A-3′,探针序列:5′-FAM-TCA ACA CCC CAG CCA TGT ACG T-TAMRA-3′,片段长度为158 bp。RT-PCR检测:30 μL反应体系,PCR反应为94 ℃ 变性3 min;51 ℃(TRAF6)退火20 s;72 ℃延伸30 s,共40个循环,β-actin作为内参照基因,所有反应均在荧光定量仪iCycler iQ上进行。PCR产物采用2%琼脂糖凝胶进行电泳。
1.2.5 Western blot检测TRAF6蛋白表达 取100 g脑组织进行匀浆,4 ℃下离心5 min,取上清液。用蛋白定量试剂盒进行蛋白定量;10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,根据各样品蛋白浓度计算上样体积进行上样,经分离、电泳等将蛋白电转移至硝酸纤维素膜,用丽春红染色,蒸馏水冲洗,以含脱脂奶粉的1×三羟甲基氨基甲烷缓冲盐水吐温(TBST)溶液封闭,TBST洗涤。加入一抗,孵育,TBST冲洗,加入1∶5 000辣根过氧化物酶标记的二抗,孵育,再冲洗,加入化学发光剂显影。将硝酸纤维素膜用图像分析仪分析,以相应蛋白条带面积的平均灰度值来表示TRAF6活化水平的相对水平。
1.2.6 免疫组化(IHC) 定位TRAF6蛋白 常规石蜡切片,二甲苯脱蜡2次;乙醇浸泡,PBS冲洗。滴加50 μL山羊血清封闭液,37 ℃孵育30 min。甩去封闭血清,按1∶25滴加羊抗鼠TRAF6单克隆抗体,4 ℃冰箱过夜。PBS冲洗。滴加50 μL生物素标记兔抗羊IgG(二抗),37 ℃孵箱孵育。PBS冲洗3次。滴加50 μL辣根过氧化物酶标记链霉卵白素工作液(S-A/HRP),37 ℃孵箱孵育。PBS冲洗。DAB显色后,及时终止显色。苏木素复染,自来水冲洗,酸乙醇分色。将所有切片分批在80%、90%、95%、100%乙醇中脱水,二甲苯透明,加拿大树胶封片。高倍显微镜下观察,细胞膜或细胞质内出现棕黄色颗粒为阳性表达。

2 结 果
2.1 脑梗死面积 在缺血组和R2组、R12h组、R24h组都发现脑梗死,而假手术组未发现脑梗死。计算脑梗死面积发现,缺血组梗死最严重,再灌注组随着时间推移,梗死程度逐渐减轻,见图1。
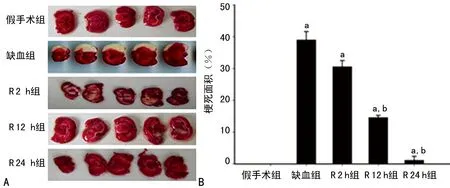
A:TTC染色结果;B:脑梗死面积柱状图;a:P<0.05与假手术组比较;b:P<0.05,与缺血组比较。
图1 各组大鼠脑组织梗死面积比较
2.2 各组大鼠脑组织TRAF6 表达比较 与假手术组比较,缺血组、R2h组、R12h组脑组织TRAF6mRNA明显升高(P<0.05)。Westernblot检测也证实,TRAF6蛋白水平在缺血组、R2h组、R12h组明显升高,见图2、3。
2.3IHC定位TRAF6蛋白 与RT-PCR、Westernblot检测结果相似,在假手术组脑组织中,TRAF6蛋白呈低表达,在缺血组以及各再灌注组,TRAF6表达明显升高。且TRAF6蛋白主要分布在神经元细胞细胞质,部分分布在血管内皮细胞。与假手术组比较,缺血组和各再灌注组阳性细胞率明显升高,其中缺血组最高,R2组、R12h组逐渐减低,而R24h组又再度升高,见图4、5。
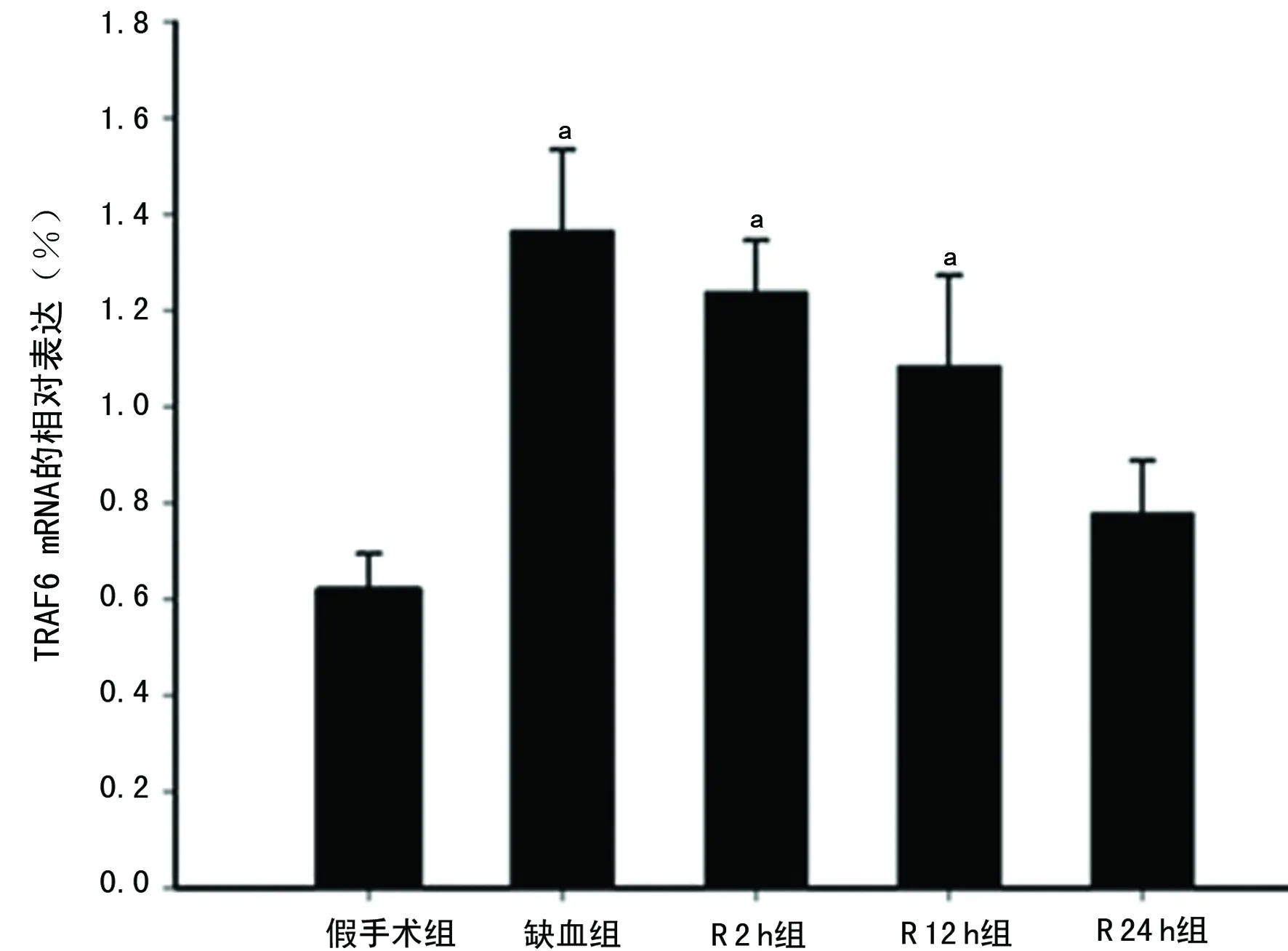
a:P<0.05与假手术组比较。
图2 各组大鼠脑组织TRAF6基因表达比较
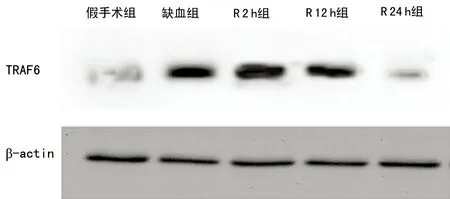
图3 Western blot检测各组脑组织TRAF6蛋白表达
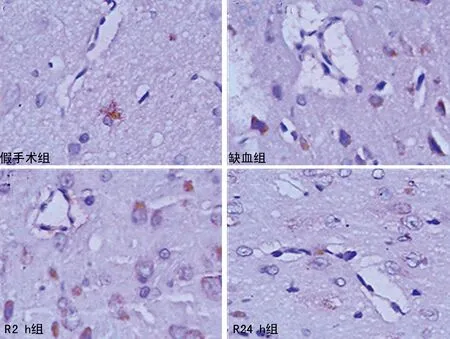
图4 IHC检测各组脑组织TRAF6蛋白表达
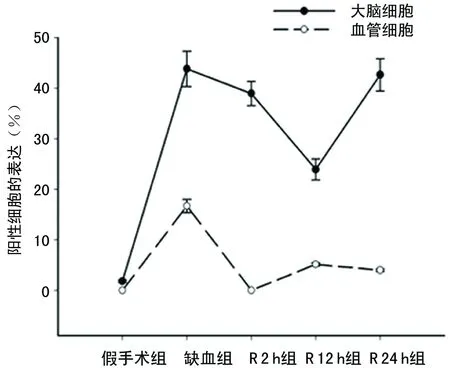
图5 各组TRAF6阳性细胞率比较
3 讨 论
临床上,脑梗死及溶栓后血管再通所引起的I/R是加剧脑损伤及功能障碍的主要原因[4]。Toll样受体介导的炎症免疫在脑I/R过程中的作用日益受到重视[5-6],本研究通过观察其下游接头分子TRAF6表达变化,以探讨TRAF6在大鼠脑缺血和再灌注过程中的作用。
本研究采用经典的大鼠脑I/R模型,缺血组和各再灌注组大鼠脑组织都有不同程度梗死灶存在,证实建立模型成功,且梗死的面积随着再灌注的恢复逐渐减少。从基因水平和蛋白水平分别检测TRAF6表达,结果发现,无论缺血还是再灌注早期(12h),TRAF6表达均明显升高,表明TRAF6参与了大鼠脑I/R病理、生理过程。TRAF6在大脑遭受缺血和再灌注打击时,明显激活,其变化趋势与大脑梗死面积变化相似,表明TRAF6参与介导了大脑细胞的死亡信号。
TRAF6是肿瘤坏死因子受体 (TNFR) 家族重要的成员,其不但能介导TNFR家族信号,还能介导TLR家族信号[7-8]。所以,TRAF6可能通过介导不同信号通路,调控炎症免疫和凋亡效应。TRAF6的缺失将导致信号的缺失,NF-κB去激活以及下游细胞因子的减少[9-10]。有研究证实,TRAF6可能广泛参与各种细胞的死亡,尤其是细胞凋亡[11-12]。Liu等[13]证实TRAF6可以通过Caspase-8依赖的方式介导细胞死亡。在LPS诱导的兔肾小管细胞,通过抑制TRAF6表达可以抑制肾炎性反应,其机制为抑制Caspase-3活化,证实TRAF6通过介导Caspase-3信号参与细胞凋亡[14]。有研究还证实,TRAF6通过介导细胞凋亡参与了中枢神经系统的发育过程[15]。本研究认为,在大脑遭受缺血和再灌注损伤以后,TRAF6可能通过介导细胞凋亡信号来参与调控脑细胞死亡,但具体的机制还有待进一步的探讨。
免疫组化用来定位TRAF6在脑组织中的表达,结果与RT-PCR、Westernblot检测结果相似,在缺血期和再灌注期,TRAF6表达明显升高的。着色强的TRAF6主要位于神经元细胞细胞质,较弱的TRAF6着色在脑血管内皮细胞被发现。因此,本研究推测在TRAF6介导脑细胞死亡过程中,神经元细胞是主要的靶细胞。
本研究结果表明,在大鼠脑I/R过程中,TRAF6可能参与了调节脑损伤的炎症过程,可能的机制是介导脑细胞的死亡信号。进一步的研究需要证实TRAF6与脑细胞凋亡的相互作用机制。
[1]FisherM.Acuteischemicstroketherapy:currentstatusandfuturedirections[J].ExpertRevCardiovascTher,2013,11(9):1097-1099.
[2]ZhangJ,FuB,ZhangX,etal.Neuroprotectiveeffectofbicyclolinratischemicstroke:Down-regulatesTLR4,TLR9,TRAF6,NF-κB,MMP-9andup-regulatesclaudin-5expression[J].BrainRes,2013,1528(8):80-88.
[3]DurukanA,TatlisumakT.Acuteischemicstroke:overviewofmajorexperimentalrodentmodels,pathophysiology,andtherapyoffocalcerebralischemia[J].PharmacolBiochemBehav,2007,87(1):179-197.
[4]ChangR,WangY,ChangJ,etal.LPSpreconditioningamelioratesintestinalinjuryinaratmodelofhemorrhagicshock[J].InflammRes,2014,63(8):675-682.
[5]LiH,JinM,LvT,etal.MechanismoffocalcerebralischemictoleranceinratswithischemicpreconditioninginvolvesMyD88-andTRIF-dependentpathways[J].ExpTherMed,2013,6(6):1375-1379.
[6]WangL,LiZ,ZhangX,etal.Protectiveeffectofshikonininexperimentalischemicstroke:attenuatedTLR4,p-p38MAPK,NF-κB,TNF-αandMMP-9expression,up-regulatedclaudin-5expression,amelioratedBBBpermeability[J].NeurochemRes,2014,39(1):97-106.
[7]LiangY,LeiZ,ZhangH,etal.Toll-likereceptor4isassociatedwithseizuresfollowingischemiawithhyperglycemia[J].BrainRes,2014,8993(14):1229-1233.
[8]MoragaA,PradilloJM,CuarteroMI,etal.Toll-likereceptor4modulatescellmigrationandcorticalneurogenesisafterfocalcerebralischemia[J].FASEBJ,2014,28(11):4710-4718.
[9]GohdaJ,MatsumuraT,InoueJ.Cuttingedge:TNFR-associatedfactor(TRAF) 6isessentialforMyD88-dependentpathwaybutnottoll/IL-1receptordomain-containingadaptor-inducingIFN-beta(TRIF)-dependentpathwayinTLRsignaling[J].JImmunol,2004,173(5):2913-2917.
[10]SongZ,JinR,YuS,etal.CrucialroleofCD40signalinginvascularwallcellsinneointimalformationandvascularremodelingaftervascularinterventions[J].ArteriosclerThrombVascBiol,2012,32(1):50-64.
[11]BruneauS,DattaD,FlaxenburgJA,etal.TRAF6inhibitsproangiogenicsignalsinendothelialcellsandregulatestheexpressionofvascularendothelialgrowthfactor[J].BiochemBiophysResCommun,2012,419(1):66-71.
[12]HeL,WuX,SiegelR,etal.TRAF6regulatescellfatedecisionsbyinducingcaspase8-dependentapoptosisandtheactivationofNF-kappaB[J].JBiolChem,2006,281(16):11235-11249.
[13]LiuS,LutzJ,ChangJ,etal.TRAF6knockdownpromotessurvivalandinhibitsinflammatoryresponsetolipopolysaccharidesinratprimaryrenalproximaltubulecells[J].ActaPhysiol(Oxf),2010,199(3):339-346.
[14]LomagaMA,HendersonJT,EliaAJ,etal.Tumornecrosisfactorreceptor-associatedfactor6 (TRAF6)deficiencyresultsinexencephalyandisrequiredforapoptosiswithinthedevelopingCNS[J].JNeurosci,2000,20(19):7384- 7393.
[15]YeiserEC,RutkoskiNJ,NaitoA,etal.Neurotrophinsignalingthroughthep75receptorisdeficientintraf6-/-mice[J].JNeurosci,2004,24(46):10521-10529.
Change of TRAF6 expression in rat cerebral ischemia reperfusion injury*
YuanPing,HeXiaoying,LiXiaogang
(DepartmentofNeurology,AffiliatedHospitalofLuzhouMedicalCollege,Luzhou,Sichuan646000,China)
Objective To investigate the potential role of tumor necrosis factor receptor-associated factor-6(TRAF6) in the rat cerebral ischema- reperfusion injury.Methods 40 healthy adult SD rats were divided into 5 groups(n=8) according to the random control principle:sham operation group,ischemia group,reperfusion 2 h group(R2 h),reperfusion 12 h group(R12 h) and reperfusion 24 h group(R24 h).The rat cerebral ischemia -reperfusion injury model was constructed.The change of TRAF6 expression was examined by RT-PCR and Western-blot.Then,the immunohistochemistry was adopted to locate the TRAF6 protein.Results Compared with the sham group,the expression of TRAF6 in the ischemia group and the R2 h,R12 h and R 24 h groups was obviously increased,but the difference had no statistical significance (P<0.05).TRAF6 was mainly located in the cytoplasm of neuronal cells.Conclusion Activated TRAF6 is involved in the brain cell death induced by cerebral ischemia-reperfusion.
tumor necrosis factor receptor-associated peptides and related proteins;brain ischemia;reperfusion injury;cell death
��·基础研究
10.3969/j.issn.1671-8348.2015.10.006
四川省卫生厅课题资助项目(100272)。 作者简介:袁平(1978-),主治医师,主要从事缺血性脑血管疾病的诊治研究。
R743.33
A
1671-8348(2015)10-1314-03
2014-10-18
2014-12-15)

