晚期胃癌应用多西他赛联合顺铂、5-FU一线方案化疗引起的中性粒细胞减少与疗效和生存的相关性
王艳荣,陈 杨,石 燕,茅 慧,陈 丽,戴广海
解放军总医院 肿瘤内二科,北京 100853
晚期胃癌应用多西他赛联合顺铂、5-FU一线方案化疗引起的中性粒细胞减少与疗效和生存的相关性
王艳荣,陈 杨,石 燕,茅 慧,陈 丽,戴广海
解放军总医院 肿瘤内二科,北京 100853
目的探讨晚期胃癌一线应用多西他赛联合顺铂、5-FU方案(DCF方案)化疗引起的中性粒细胞减少(chemotherapyinduced neutropenia,CIN)程度与疗效和生存的相关性。方法回顾性分析2007 - 2012年在我院病理科诊断为胃癌的无法手术、有可评估病灶且接受一线DCF方案化疗至少2周期,但不超过6周期的患者临床资料。根据美国癌症研究所常见毒性判定标准4.0(Common Terminology Criteria for Adverse Events,CTCAE 4.0)将CIN分为G0、G1/2、G3、G4组。G0为无中性粒细胞抑制组,G1/2为轻度中性粒细胞抑制组,G3为中度中性粒细胞抑制组,G4为重度中性粒细胞抑制组。了解化疗期间CIN程度与化疗疗效及预后的关系。结果与G0组相比,G1/2组可降低48%疾病进展风险(HR=0.52,95% CI:0.44 ~0.69),G3组可降低31%(HR=0.69,95% CI:0.37~0.89),G4组可降低25%(HR=0.75,95% CI:0.46~0.98);与G0组相比,G1/2组可降低41%死亡风险(HR=0.59,95% CI:0.49~0.72),G3组可降低29%(HR=0.71,95% CI:0.52~0.90),G4组可降低26%(HR=0.74,95% CI:0.46~0.93)。CIN G0组客观缓解率(objective response rate,ORR)为13.3%,疾病控制率(disease control rate,DCR)为33.3%;G1/2组ORR为53.7%,DCR为75.9%;G3组ORR为45.5%,DCR为68.2%;G4组ORR为10.5%,DCR为57.9%。4组DCR和ORR的差异有统计学意义,其中G1/2组疗效最佳。结论晚期胃癌患者化疗中出现G1/2级CIN预示着更好的疗效和预后,而G0级疗效及预后最差,提示此组患者化疗药物或许未达到最佳有效剂量,另外G4级疗效和预后并未优于G3级。监测中性粒细胞水平有利于早期疗效评估及预后判断,并有助于调整化疗药物剂量。
胃癌;化疗不良反应;中性粒细胞减少
胃癌是全球癌症相关死亡的第二大常见原因,多数患者就诊时已属晚期,失去手术机会[1]。因此,化疗成为晚期胃癌主要的治疗方法[2]。血液学毒性是许多细胞毒性化疗药物的主要剂量限制性毒性[3]。接受化疗的病人在治疗过程中会出现不同程度的骨髓抑制,其中中性粒细胞减少最常见。近年来,已经有大量的研究报道化疗引起的中性粒细胞减少与疗效和生存密切相关,例如非小细胞肺癌、乳腺癌、结直肠癌、头颈部鳞癌等,并有专家提出以适度中性粒细胞减少的出现为基准进行化疗药物的调整[4-7]。本文主要探讨晚期胃癌一线应用多西他赛联合顺铂、5-FU方案(DCF方案)化疗引起的中性粒细胞减少(chemotherapy-induced neutropenia,CIN)程度与疗效和生存的相关性。
资料和方法
1 一般资料 2007年1月- 2012年12月在我院病理科诊断为胃癌且无法手术的晚期患者。纳入标准:病理学证实为胃癌,年龄<75岁,伴有远处转移无法手术的晚期患者,确诊后未曾接受任何治疗。排除标准:年龄>75岁、接受过其他方案化疗、接受过胃癌手术、肝肾功能异常和骨髓异常[6]。共纳入患者110例,年龄25~75岁,男90例、女20例,其他病理生理特征见表1。该研究通过解放军总医院伦理委员会批准。
2 化疗方案 美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南推荐转移性或晚期胃癌一线化疗选择DCF或ECF方案,但中性粒细胞减少是多西他赛最常见的不良反应,故本研究所纳入的患者均接受一线DCF方案化疗至少2周期(多西他赛75 mg/m2静滴d1,顺铂75 mg/m2静滴d1,氟尿嘧啶750 mg/m2静滴d1~5;21 d为1周期);美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分0~2分;肝肾功能正常,有足够的骨髓储备功能(白细胞>4×109且<10×109,中性粒细胞>2×109,血小板>10×109,血红蛋白>10 g/L)。根据最新美国NCCN指南胃癌分期标准进行TNM分期,在患者每次入院开始化疗前进行血液中性粒细胞水平的检测,并采集患者其他病理情况、ECOG评分等。每3周为1个化疗周期,每2个周期进行1次全面复查,包括常规腹部CT、肺部CT、盆腔CT等。当疾病进展或者完成6个周期DCF化疗时,该方案结束。
3 中性粒细胞减少水平分级 取患者化疗期间出现的中性粒细胞最低水平进行分析,中性粒细胞减少的情况按美国癌症研究所常见毒性判定标准4.0版(Common Terminology Criteria for Adverse Events,CTCAE 4.0)进行分级[6]:G0级,>2.0×109;G1级,(1.5~2.0)×109;G2级,(1.0~1.5)×109;G3级,(0.5 ~1.0)×109;G4级,<0.5×109。G0为无中性粒细胞抑制组,G1/2为轻度中性粒细胞抑制组,G3为中度中性粒细胞抑制组,G4为重度中性粒细胞抑制组。所有患者化疗前禁止预防性使用促中性粒细胞升高白细胞。
4 疗效评价 按实体肿瘤疗效评价标准RECIST1.1版分为完全缓解(CR):所有目标病灶消失;部分缓解(PR):基线病灶长径总和缩小≥30%;病情进展(PD):基线病灶长径总和增加≥20%或出现新病灶;病情稳定(SD):基线病灶长径总和有缩小但未达PR或有增加但未达PD。以CR+PR计算客观缓解率(objective response rate,ORR),以CR+PR+SD计算疾病控制率(disease control rate,DCR)[8-9]。
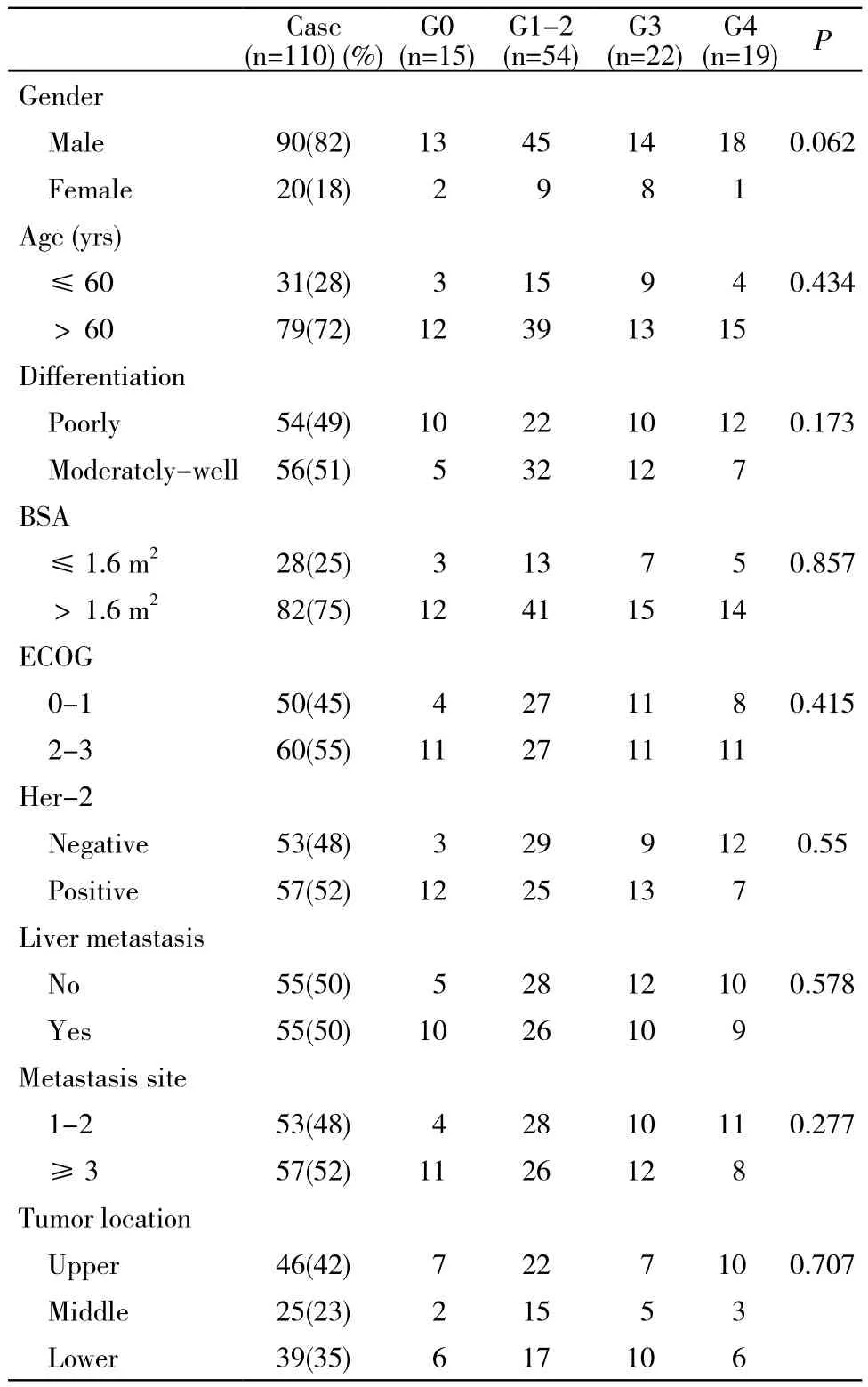
表1 晚期胃癌患者临床资料及化疗后中性粒细胞减少分级Tab. 1 Baseline demographics and clinical characteristics in subgroups (n)
5 预后评价 计算患者无进展生存期(progression free survival,PFS)及总生存期(overall survival,OS)来评价预后,PFS定义为从化疗开始至疾病进展或末次随访时间,OS定义为化疗开始至死亡或末次随访时间[8]。随访截止时间为2014年1月1日,中位随访时间51.8个月。
6 统计学处理 采用SPSS21.0软件进行数据分析。计量数据以中位数表示,两样本中位数比较采用独立样本t检验;两样本率的比较用χ2检验;影响生存率的危险因素分析采用单因素及多因素Cox回归分析,生存率的比较采用Log-Rank检验及K-M生存曲线法;P<0.05为差异有统计学意义。
结 果
1 患者基本临床资料 110例患者,其中男性90例(82%),女性20例(18%);中位年龄55(20~75)岁;合并肝转移55例;合并1~2个部位转移53例,3个及以上部位转移57例。G0级患者15例,G1/2级患者54例,G3级患者22例,G4级患者19例。不同分级之间的性别、年龄、病理分级、体表面积、ECOG评分、Her-2扩增情况、肝转移、转移部位等无统计学差异(P>0.05)。见表1。
2 中性粒细胞抑制与生存之间的单因素统计分析截止2014年1月1日,全部患者中位PFS为6.0个月(95% CI:5.5~6.5个月),OS为12.7个月(95% CI:11.2~14.2个月)。经单因素分析显示,病理分级、KPS评分、Her-2扩增情况、肝转移、转移部位、中性粒细胞抑制为PFS和OS的显著影响因子。见表2,图1。
3 中性粒细胞抑制与生存之间的多因素统计分析经Cox多因素分析,KPS评分、Her-2扩增情况、肝转移、化疗引起的中性粒细胞减少是PFS的独立影响因子;而有无肝转移、CIN程度是OS的独立影响因子。与G0级患者相比,G1/2级患者可降低73.2%疾病进展风险(HR=0.268,95% CI:0.123 ~0.582),G3级患者可降低40.5%(HR=0.595,95% CI:0.368~0.720),G4级患者可降低28.8%(HR= 0.712,95% CI:0.380~1.333);与G0级患者相比,G1/2级患者可降低63.8%死亡风险(HR=0.362,95% CI:0.178~0.736),G3级患者可降低23.5% (HR=0.765,95% CI:0.448~0.997),G4级患者可降低20.9%(HR=0.791,95% CI:0.470~1.688)(表3)。轻度骨髓抑制患者的OS>中度骨髓抑制患者>重度骨髓抑制患者,但都优于无骨髓抑制患者的OS。这说明骨髓抑制和OS有关,并可以以化疗导致的轻度骨髓抑制为衡量药物剂量的监测指标。见图2。
4 化疗引起的中性粒细胞抑制与疗效的关系110例患者均可评价疗效,完成2个周期以上化疗,中位化疗时间为4个周期(2~6个周期)。4组间ORR和DCR差异有统计学意义(P<0.05),其中G1/2组疗效最佳。见表4。

表2 胃癌化疗后CIN与无进展生存和总生存时间之间的单因素分析Tab. 2 Univariate analysis for the association between chemotherapy-induced neutropenia and survival

表3 化疗后CIN与无进展生存和总生存时间之间的多因素分析Tab. 3 Multivariate Cox models for the association between chemotherapy-induced neutropenia and survival

表4 不同CIN程度与疗效的关系Tab. 4 Relationship between efficacy and different stages of CIN (n,%)

图 1 晚期胃癌化疗后不同CIN程度与PFS(月)的关系Fig. 1 Kaplan-Meier curves of relationship between progressionfree survival for all patients and different stages of CIN
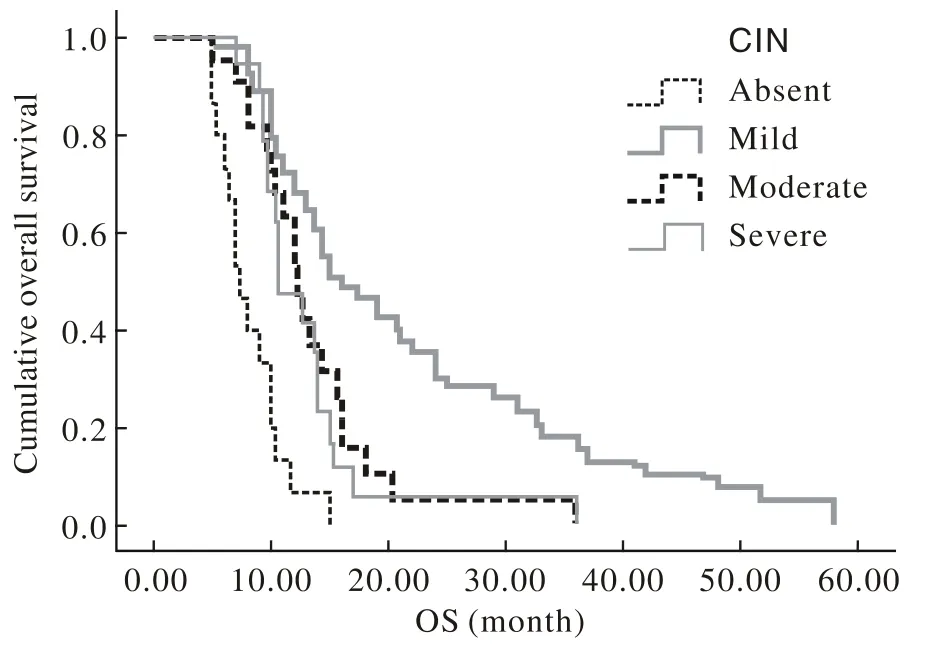
图 2 晚期胃癌化疗后不同CIN程度与OS (月)的关系Fig. 2 Kaplan-Meier curves of relationship between overall survival for all patients and different stages of CIN
讨 论
近年来,越来越多的研究支持化疗相关性中性粒细胞减少可以成为化疗判断是否有效的监测指标。化疗期间发生中性粒细胞减少的患者比无中性粒细胞减少者要有更好的获益[10]。
中性粒细胞可以通过以下几种机制促进肿瘤的发生和发展:1)中性粒细胞弹性蛋白酶(neutrophil elastase,NE)通过刺激肿瘤生长因子、血管内皮生长因子等细胞生长因子的释放,同时抑制TNF介导的细胞凋亡来促进肿瘤的发生和增殖;2)中性粒细胞与血管内皮间的黏附作用促使血管内皮通透性增加,从而促使肿瘤的转移;3)肿瘤细胞可以表达各种黏附分子,转移的肿瘤细胞与中性粒细胞通过黏附分子结合,进而形成瘤栓黏附到血管内皮细胞上完成肿瘤细胞转移。因此,中性粒细胞增多可以作为肿瘤细胞发生增殖和转移的“警灯”,是提示肿瘤预后的不良因素[10-11]。通过对这一现象的关注,可以对我们的临床治疗起指示作用。是否可以考虑通过适度抑制中性粒细胞的免疫学功能或细胞学功能,来达到抑制肿瘤细胞生长和转移的目的?
化疗是否有效主要取决于两个方面:1)肿瘤细胞对该药的敏感性;2)作用于肿瘤细胞的药物剂量[12]。细胞毒性药物具有比较窄的治疗窗,药物剂量不足往往意味着疗效降低,而药物过量往往导致明显的不良反应,甚至危及生命。因此,寻求一个能够反映细胞毒性药物最佳剂量的可监测指标至关重要[13]。目前,所沿用的利用体表面积来确定细胞毒性药物的标准剂量在治疗上可能存在药物剂量不足或者过量[14]。有学者提出化疗药物生物有效剂量的概念,实现剂量个体化。近年来的相关研究提示,化疗过程中骨髓抑制的出现与患者是否接受足量的化疗相关,和患者PFS及OS都具有明显相关性[10],且在临床上通过对中性粒细胞降低水平的监测来指导临床药物的个体化剂量确定。使多数肿瘤患者能够接受最佳药物剂量化疗,从而获得更好的远期疗效。
本研究经单因素分析显示,病理分级、KPS评分、Her-2扩增情况、肝转移、转移部位、中性粒细胞抑制为PFS和OS的显著影响因子。G1/2级患者的mPFS为7.0个月,较G3、G4、G0级CIN者长(7.0 vs 6.0,P=0.008;7.0 vs 4.3,P=0.00;7.0 vs 3.5,P=0.00)。G1/2级患者mOS为16.0个月,较G3、G4、G0患者长(16.0 vs 12.2,P=0.00;16.0 vs 10.7,P=0.002;16.0 vs 7.3,P=0.00)。G1~G4级不同CIN水平患者PFS都要优于G0级患者,但并不是中性粒细胞抑制越严重,预后越好,达到G1/2级CIN患者预后最好,而G4级患者预后差于G1/2、G3级患者,可能与重度中性粒细胞抑制患者并发感染、治疗依从性差有关。因此,可以将化疗导致的轻度骨髓抑制作为衡量药物剂量是否足够的监测指标。
经多因素分析结果显示,KPS评分、Her-2扩增情况、肝转移、化疗引起的中性粒细胞减少是PFS的独立影响因子;而有无肝转移、CIN程度是OS的独立影响因子。与G0级患者相比,G1/2级患者可降低73.2%疾病进展风险(HR=0.268,95% CI:0.123~0.582),G3级患者可降低40.5% (HR=0.595,95% CI:0.368~0.720),G4级患者可降低28.8%(HR=0.712,95% CI:0.380~1.333);与G0级患者相比,G1/2级患者可降低63.8%死亡风险(HR=0.362,95% CI:0.178~0.736),G3级患者可降低23.5%(HR=0.765,95% CI:0.448~ 0.997),G4级患者可降低20.9%(HR=0.791,95% CI:0.470 ~1.688)。轻度骨髓抑制患者的OS>中度骨髓抑制患者>重度骨髓抑制患者,但都优于无骨髓抑制患者的OS。这说明骨髓抑制和OS有关,并可以化疗导致的轻度骨髓抑制为衡量药物剂量的监测指标。
110例患者均可评价疗效,完成2个周期以上化疗,中位化疗时间为4个周期(2~6个周期)。CR 0例,PR 43例,SD 29例,PD 38例,ORR 39.0%,DCR 65.0%(ORR=PR + CR,DCR=CR + PR + SD)。CIN G0组ORR为13.3%,DCR为33.3%;G1/2组的ORR为53.7%,DCR为75.9%;G3组的ORR为45.5%,DCR为68.2%;G4组的ORR为10.5%,DCR为57.9%。4组间ORR和DCR差异有统计学意义(P<0.05),其中G1/2组疗效最佳。
对于晚期胃癌患者,化疗过程中出现中性粒细胞减少者预后要优于未出现中性粒细胞减少者。其中,G1/2级CIN预示着更好的疗效和预后,而G0级预后最差,说明此组化疗剂量不足,然而G4级CIN与G3级相比,并没有表现出更好的疗效和预后,可能和严重中性粒细胞抑制发生后,相关并发症以及由此导致患者治疗的依从性降低、治疗的疗程和剂量发生改变有关[15]。故监测中性粒细胞水平有利于疗效评估及预后判断[16-19]。本研究所得结论与日本学者Yamanaka等[6]2007年所报道的结果相符,这为我们寻找更可靠的评估化疗疗效的指标开拓了更广阔的思路,不应该单纯依靠体表面积来评估化疗剂量是否足够,而以达到G1/2级CIN为标准来调整细胞毒性药物的剂量可能会是一个更好的指标。
但我们的研究也有不足之处。首先,这是回顾性研究;其次,未发生中性粒细胞减少的患者在后续的化疗过程中仍有可能发生;最后,CIN并不是唯一影响OS的因素,也不是最重要的影响因素,它只是OS影响因子之一。
1 秦叔逵,龚新雷.晚期胃癌化疗的现状和新进展[J].临床肿瘤学杂志,2006,11(9):641-652.
2 张国伟,宋丽杰.进展期胃癌化疗现状与进展[J].临床药物治疗杂志,2009,7(5):14-18.
3 刘淑, 郑玉龙, 周黎阳, 等. 晚期非小细胞肺癌患者化疗骨髓抑制与生存相关性研究[J]. 临床肺科杂志, 2010, 15(11):1544-1545.
4 Martin M, Villar A, Sole-Calvo A, et al. Doxorubicin in combination with fluorouracil and cyclophosphamide (i.v. FAC regimen, day 1, 21) versus methotrexate in combination with fluorouracil and cyclophosphamide (i.v. CMF regimen, day 1, 21) as adjuvant chemotherapy for operable breast cancer: a study by the GEICAM group[J]. Ann Oncol, 2003, 14(6): 833-842.
5 Di Maio M, Gridelli C, Gallo C, et al. Chemotherapy-induced neutropenia and treatment efficacy in advanced non-small-cell lung cancer: a pooled analysis of three randomised trials[J]. Lancet Oncol, 2005, 6(9): 669-677.
6 Yamanaka T, Matsumoto S, Teramukai S, et al. Predictive value of chemotherapy-induced neutropenia for the efficacy of oral fluoropyrimidine S-1 in advanced gastric carcinoma[J]. Br J Cancer, 2007, 97(1): 37-42.
7 龚晶,曲秀娟,刘云鹏,等.晚期非小细胞肺癌患者化疗前中性粒细胞计数与预后相关性研究[J].检验医学与临床,2013,10(12):1537-1539.
8 Jang SH, Kim SY, Kim JH, et al. Timing of chemotherapy-induced neutropenia is a prognostic factor in patients with metastatic nonsmall-cell lung cancer: a retrospective analysis in gemcitabineplus-platinum-treated patients[J]. J Cancer Res Clin Oncol,2013, 139(3):409-417.
9 Shitara K, Matsuo K, Yokota T, et al. Prognostic factors for metastatic colorectal cancer patients undergoing irinotecan-based second-line chemotherapy[J]. Gastrointest Cancer Res, 2011, 4(5/6): 168-172.
10 Han Y, Yu Z, Wen S, et al. Prognostic value of chemotherapyinduced neutropenia in early-stage breast cancer[J]. Breast Cancer Res Treat, 2012, 131(2): 483-490.
11 田宁,张培彤.中性粒细胞增多与恶性肿瘤进展及转移关系的研究[J].中国肿瘤,2010,19(7):470-476.
12 Di Maio M, Gridelli C, Gallo C, et al. Chemotherapy-induced neutropenia and treatment efficacy in advanced non-small-cell lung cancer: a pooled analysis of three randomised trials[J]. Lancet Oncol, 2005, 6(9):669-677.
13 Gurney H. How to calculate the dose of chemotherapy[J]. Br J Cancer, 2002, 86(8):1297-1302.
14 Banerji U, Ashley S, Coward J, et al. The association of chemotherapy induced neutropenia on treatment outcomes in small cell lung cancer[J]. Lung Cancer, 2006, 54(3):371-377.
15 刘淑,郑玉龙,周黎阳,等.晚期非小细胞肺癌患者化疗骨髓抑制与生存相关性研究[J].临床肺科杂志,2010,15(11):1544-1545.
16 Kvinnsland S. The leucocyte nadir, a predictor of chemotherapy efficacy?[J]. Br J Cancer, 1999, 80(11):1681.
17 Kishida Y, Kawahara M, Teramukai S, et al. Chemotherapy-induced neutropenia as a prognostic factor in advanced non-small-cell lung cancer: results from Japan Multinational Trial Organization LC00-03[J]. Br J Cancer, 2009, 101(9): 1537-1542.
18 Kalikaki A, Koutsopoulos A, Hatzidaki D, et al. Clinical outcome of patients with non-small cell lung cancer receiving front-line chemotherapy according to EGFR and K-RAS mutation status[J]. Lung Cancer, 2010, 69(1): 110-115.
19 Lin CC, Hsu HH, Sun CT, et al. Chemotherapy response in East Asian non-small cell lung cancer patients harboring wild-type or activating mutation of epidermal growth factor receptors[J]. J Thorac Oncol, 2010, 5(9): 1424-1429.
Correlation between degree of chemotherapy-induced neutropenia (CIN) caused by the first line DCF scheme and curative effect and survival in patients with advanced gastric cancer
WANG Yanrong, CHEN Yang, SHI Yan, MAO Hui, CHEN Li, DAI Guanghai
No.2 Department of Oncology, Chinese PLA General Hospital, Beijing 100853, China
DAI Guanghai. Email: daigh60@sohu.com
ObjectiveTo investigate the correlation between the degree of chemotherapy-induced neutropenia (CIN) caused by the first line DCF scheme and the curative effect and survival in patients with advanced gastric cancer.MethodsClinical data about 110 patients diagnosed with advanced gastric cancer from 2007 to 2012 in our hospital who underwent first-line chemotherapy of DCF regimen at least 2 cycles were retrospectively analyzed. According to the CTCAE 4, CIN was divided into: G0, G1/2, G3, G4 group. The association between CIN and chemotherapy curative effect and prognosis was assessed.ResultsThe multivariate analysis showed that compared with G0 group, the hazard ratio of disease-progression was decreased by 48% (HR=0.52, 95% CI: 0.44 - 0.69, P=0.005) in G1/2 group, 31% (HR=0.69, 95% CI: 0.37 - 0.89, P=0.001) in G3 group and 25% (HR=0.75, 95% CI: 0.46 - 0.98, P=0.023) in G4 group. Similarly, the hazard ratio of death was decreased by 41% (HR=0.59, 95% CI: 0.49 - 0.72, P=0.001) in G1/2 group in comparison with G0 group, 29% (HR=0.71, 95% CI: 0.52 - 0.90, P=0.000) in G3 group, and 26% (HR=0.74, 95% CI: 0.46 - 0.93, P=0.009) in G4 group. The ORR value of G0, G1/2, G3, G4 group were 13.3%, 53.7%, 45.5%, 10.5%, respectively; The DCR value of G0, G1/2, G3, G4 group were 33.3%, 75.9%, 68.2%, 57.9%, respectively. Both ORR and DCR value of the four groups showed significantly statistical differences with the best efficacy showed in G1/2 group.ConclusionPatients who experience G1/2 CIN have a more favorable treatment response and prognosis, however, absence of CIN represents poor efficacy and survival, which suggests that patients in G0 group may not achieve the best effective dose. In addition, G4 CIN does not show better efficacy and prognosis. Therefore, monitoring of CIN is conducive to the early evaluation of curative effect and prognosis, and it is helpful in adjusting the dosage of chemotherapy drugs.
gastric cancer; chemotherapeutic adverse effects; neutropenia
R 735.2
A
2095-5227(2015)03-0237-06
10.3969/j.issn.2095-5227.2015.03.011
时间:2014-12-10 08:50
http://www.cnki.net/kcms/detail/11.3275.R.20141210.0850.001.html
2014-09-16
王艳荣,女,在读硕士。研究方向:消化道肿瘤。Email: bellasince1987@163.com
戴广海,男,主任医师,教授,博士生导师。Email: dai gh60@sohu.com

