内源活性肽Apelin-13对高血压大鼠心肌纤维化的影响及机制
陶 阳,张 志,王滢滢辽宁医学院附属第三医院 心内科,辽宁锦州 00;辽宁医学院附属第一医院 呼吸内科,辽宁锦州00
内源活性肽Apelin-13对高血压大鼠心肌纤维化的影响及机制
陶 阳1,张 志1,王滢滢2
1辽宁医学院附属第三医院 心内科,辽宁锦州 121001;2辽宁医学院附属第一医院 呼吸内科,辽宁锦州121001
目的探讨内源性活性肽Apelin-13对高血压大鼠心肌纤维化(myocardial fibrosis,MF)的影响并初步探讨其机制。方法将40只8周龄雄性SD大鼠随机分组,对其中32只大鼠施行腹主动脉狭窄(abdominal aorta coarctation,AAC)术,8只施行假手术,将造模后成活的大鼠随机分成模型组、Apelin-13组(10μg/kg),缬沙坦(valsartan,VST)组[5 mg/(kg·d)]。观察Apelin-13对高血压大鼠心脏功能及血流动力学指标的影响;ELISA法测定血清Ang(1-7)、AngⅡ的浓度;Western观察大鼠心肌转化生长因子β1(transforming growth factor beat 1,TGF-β1)、组织抑制因子(tissue inhibitor of metalloproteinase,TIMP)、血浆纤溶酶原激活抑制剂-1(plasminogen activator onhibitor,PAI-1)、金属蛋白酶-2(matrix metalloproteinase 2,MMP-2)的表达水平;HE和Masson染色观察心肌组织胶原沉积情况,图像分析测量心肌组织胶原容积分数(collagen volume fraction,CVF)。结果心功能AAC组较假手术组、Apelin-13组、VST组明显降低(P<0.05),VST组较Apelin组减低(P<0.05)。血清Ang-(1-7) AAC组较药物治疗组降低,Ang(Ⅱ)增加(P<0.05),Apelin组与VST组差异无统计学意义(P>0.05)。Apelin-13组、VST组和AAC组中CVF及蛋白TIPM-1、TGF-β1、PAI-1的表达高于假手术组(P<0.05),且两种药物治疗组明显低于AAC组,Apelin-13组低于VST组(P<0.05),而MMP-2蛋白的表达低于假手术组。结论Apelin-13可能通过抑制肾素-血管紧张素-醛固酮系统,进而抑制TGF-β1、PAI-1、TIMP-1和增加MMP-2的表达以改善高血压心肌纤维化。
Apelin-13;高血压;腹主动脉缩窄;心肌纤维化;大鼠
高血压心脏病(hypertensive cardiovascular disease,HHD)是高血压主要的并发症之一,其主要的致病机制是长期压力超负荷,使儿茶酚胺与血管紧张素AngⅡ等生长因子刺激心肌细胞肥大和间质纤维化[1]。有研究认为,神经内分泌系统的激活,使心肌成纤维细胞过度增殖,以及基质金属蛋白酶(matrix metalloproteinases,MMP)与组织抑制因子(tissue inhibitor of metalloproteinase,TIMP)平衡失调,合成细胞外基质增加,导致胶原合成代谢和降解代谢失衡是心肌纤维化(myocardial fibrosis,MF)不断进展的内在机制之一。Apelins是由同一基因编码的具有不同分子结构的一组内源活性肽,血管紧张素1型相关蛋白受体APJ(又命名为AGTRL1)是它的内源型配体[2]。Apelin/APJ具有降低血压、改善心脏功能、保护心肌损伤、促进新生血管生成、调节水盐及脂肪代谢等重要作用[3]。Apelin前蛋白原可生成Apelin-36、Apelin-13、Apelin-12等多肽,其中以Apelin-13生物活性较高,有很好的降压作用。我们猜想Apelin-13改善心功能的作用是否与抑制心肌纤维化有关。本实验在成功建立高血压大鼠模型的基础上,外源性给予Apelin-13,观察高血压大鼠心脏功能,血浆Ang(1-7)、AngⅡ的浓度,心肌转化生长因子β1(transforming growth factor beat 1,TGF-β1)、TIMP、血浆纤溶酶原激活抑制剂-1(plasminogen activator onhibitor,PAI-1)、金属蛋白酶-2(matrix metalloproteinase 2,MMP-2)蛋白的表达水平,以探讨Apelin-13预防高血压心脏病心肌纤维化的可能机制。
材料和方法
1 主要试剂 Apelin-13(北京康肽生物科技有限公司),缬沙坦(valsartan,VST)(桂林华信制药有限公司),Elisa试剂盒(上海恒远技术发展有限公司),Masson试剂盒[将来试剂(上海)有限公司],Western一抗(北京博奥森生物技术有限公司)。
2 腹主动脉缩窄高血压模型建立 SPF级8周龄雄性Sprague Dawly(SD)大鼠40只,体质量为220 ~250 g,由辽宁医学院实验动物研究所提供,并取得辽宁医学院动物伦理委员会许可。大鼠5只/笼,在恒温(22~24℃),恒湿(60%),12 h明暗交替环境中饲养,自由进食水。适应环境1周后行腹主动脉狭窄(abdominal aorta coarctation,AAC)术(随机选取32)。1%戊巴比妥50 mg/kg腹腔注射麻醉,固定、剃毛、常规消毒,分层打开腹腔,在右肾上缘分开腹膜等软组织,暴露腹主动脉,并在双肾动脉上0.5 cm处用内径0.7 mm的银夹造成腹主动脉狭窄,分层关闭腹腔。8只未用银夹分离腹主动脉的大鼠作假手术组。造模7 d内32只造模大鼠6只死亡退出实验。
3 实验分组 共分4组,假手术组8只,AAC组8只,Apelin组8只(分组时为10只,置入微量泵2 d内死亡2只退出实验),缬沙坦组8只。其中Apelin组背部除毛并用75%乙醇消毒,剪刀剪开背部皮肤、皮下,置入预装Apelin-13的微量泵,Apelin-13的释放量为3 μg/d(约10 μg/kg),然后缝合。缬沙坦组5 mg/(kg·d)(原药粉剂用蒸馏水配制1 g/L,每天上午9:00 - 10:00灌胃),各组均正常进食水,8周后进行各指标检测。
4 心脏超声检查 置入微量泵8周后,行超声检查,大鼠称重后给予1%戊巴比妥30 mg/kg浅麻醉,仰卧位固定,前胸剪毛,PHILIPSONOS7500型超声扫描仪及12 MHz探头,测定其心脏舒张末期室间隔厚度、舒张末期左心室后壁、射血分数及左心室缩短分数,每一超声测定值取3个连续心动周期测量的均值。
5 血流动力学检查及取材 置入微量泵第9周,以异戊巴比妥50 mg/kg腹腔注射将大鼠麻醉,仰卧位固定,颈部切开,分离右颈总动脉,切开后插入直径1 mm且有1%肝素的心导管,接BL420F生物机能分析系统,测量完毕后,断脊髓处死大鼠,开胸取出心脏,称重,保存心肌组织。
6 HE及Masson染色观察心肌组织形态学变化、计算心肌组织胶原容积分数(collagen volume fraction,CVF) 心尖组织经4%甲醛溶液固定24 h,脱水,石蜡包埋,切片后行Masson染色。光镜下观察心肌组织形态学变化,Image Proplus 6.0分析图像,通过灰度调节区别胶原和非胶原成分,测算心肌组织胶原容积分数,CVF=心肌血管周围胶原面积/血管腔面积,每张切片均随机取4个视野测量,计算其平均值。
7 ELISA法检测血浆AngⅡ、Ang(1-7)浓度 每只大鼠在行血流动力学检测后经心脏取血5 ml,离心(2 000 r/min,20 min)经心脏取血5~6 ml并分离血浆后,采用ELISA法进行测定。检测步骤严格按照试剂盒说明书的要求进行操作,结果在全自动酶标仪上进行比色分析。
8 Western-blotting检测心肌组织中TIPM-1、TGF-β1、PAI-1、MMP-2的蛋白表达 1)制备蛋白提取液:取-70℃冻存的小鼠心肌组织标本100 mg,在RIPA裂解缓冲液500 μl中裂解,冰浴下超声匀浆,4℃离心(2 000 r/min,30 min),取上清液,酚试剂法测定蛋白浓度后,制成蛋白含量相等的样品。2)SDS-聚丙烯酰胺凝胶电泳。3)转膜。4)杂交:5%脱脂奶粉封闭2 h或过夜,TBST洗膜5 min×3次,滴加兔抗鼠TIMP-1、TGF-β1、PAI-1、MMP-2一抗4℃孵育过夜,TBST洗膜5 min×3次,以相应碱性磷酸酶标记的二抗室温孵育2 h,TBST洗膜5 min×3次。5)显色。6)成像分析:于扫描仪上成像,用Scion Corporation分析软件对电泳条带进行灰度值测定。以Mark的吸光度值(A)为100%,与实验各组进行比较和半定量分析。
9 统计学处理 数据资料采用SPSS17.0软件处理。所有数据均以±s表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
结 果
1 各组大鼠心脏形态与功能特点结果分析与假手术组比较,手术组及治疗组心脏质量、左心质量、左心室收缩末期压力、短轴缩短分数、心肌组织胶原容积分数等指标明显增高,而左心室压力最大上升速率(+dP/dtmax)、左心室压力最大下降速率(-dP/ dtmax)等血流动力学指标明显减低(P<0.05),Apelin-13与缬沙坦均具改善高血压大鼠心功能、血流动力学及心肌纤维的作用(P<0.05),且Apelin-13部分指标优于缬沙坦(P<0.05),见表1。
2 HE染色各组心肌细胞形态比较 假手术组心肌细胞形态、细胞质、间质及横/纵纹均正常,肌纤维排列整齐,细胞质丰富均匀,期间很少见红细胞。而模型组心肌排列紊乱,肌丝变粗,波浪样改变,细胞水肿,横/纵纹不清.坏死心肌周围有不同程度的炎症细胞浸润和间质水肿,肌丝间可见大量红细胞,有新毛细血管形成。缬沙坦组与Apelin组心肌病变较模型组轻微,且Apelin组优于缬沙坦组。见图1。
3 Massion染色各组大鼠心肌胶原含量比较Masson染色时胶原纤维呈蓝色,心肌肌纤维呈红色,细胞核染成橘红色,可见假手术组中有少量胶原纤维,而模型组可见大量胶原纤维,缬沙坦组与Apelin组可见胶原纤维,但明显少于模型组,并且Apelin组的胶原纤维明显少于缬沙坦组。见图2。
4 各组大鼠心肌组织中蛋白TIPM-1、TGF-β1、PAI-1、MMP-2表达与Mark的比值 假手术组与手术组TIPM-1、TGF-β1、PAI-1、MMP-2差异有统计学意义(P<0.05),缬沙坦组和Apelin组与模型组差异均有统计学意义(P<0.05),且Apelin组与缬沙坦组差异有统计学意义(P<0.05)。见图3、图4。
5 各组大鼠血浆中血管紧张素Ⅱ、Ang(1-7)水平比较 假手术组与手术组血管紧张素Ⅱ、Ang(1-7)差异有统计学意义(P<00.05),缬沙坦组和Apelin组与模型组差异均有统计学意义(P<0.05),但Apelin组与缬沙坦组无统计学差异(P>0.05)。见表2。
表1 各组大鼠心脏形态学与功能学特点Tab. 1 Cardiac morphology and function in rats from different groups (±s)

表1 各组大鼠心脏形态学与功能学特点Tab. 1 Cardiac morphology and function in rats from different groups (±s)
aP<0.05, vs AAC;bP<0.05, vs AAC;cP<0.05, vs AAC;dP<0.05, vs VST; LVW: left ventricular weight; FS: fractional shortening; LVEDD: left ventricular end-diastolic diameter; P/dtmax: Left ventricular pressure change rate
?

表2 大鼠血浆血管紧张素Ⅱ、Ang(1-7)水平比较Tab. 2 Comparison of serum Ang Ⅱand Ang (1-7) levels

图 1 大鼠心肌组织HE染色 (×400)Fig. 1 Hematoxylin-eosin staining of myocardial tissue in sham group (A), AAC group (B),VST group (C) and Apelin group (D) (×400)

图 2 大鼠心肌组织Masson染色结果(×400)Fig. 2 Masson staining of myocardial tissue in sham group (A), AAC group (B), VST group (C) and Apelin group (D) (×400)

图 3 大鼠心肌组织中蛋白TIPM-1、 TGF-β1、 PAI-1、 MMP-2表达与Mark的比值Fig.3 Protein expression of TIPM-1, TGF-β1, PAI-1, MMP-2 and Mark ratio P<0.05, vs AAC,P<0.05, vs AAC,P<0.05, vs AAC ,P<0.05, vs VST
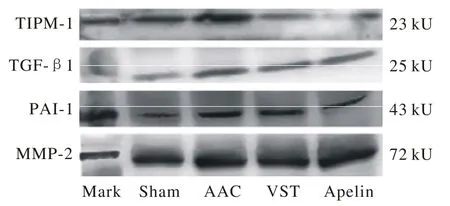
图 4 Western-blotting法检测大鼠心肌组织中TIPM-1、TGF-β1、PAI-1、MMP-2蛋白的表达Fig. 4 Western-blotting showing electrophoretic bands of TIPM-1, TGF-β1, PAI-1, MMP-2 in myocardial tissue of rats
讨 论
高血压可引起持续性压力超负荷,致使心肌代偿性肥厚,但心肌数量并不增加,主要以心肌纤维增多为主,而心肌纤维化导致心肌顺应性变差,舒缩功能降低,心脏舒张末压增高,导致的心脏结构和功能改变[4]。目前对高血压左心室重构的病理改变进行了较深入地研究,认为高血压左心室重构的病理改变主要有LVH和心肌纤维化。然而,心肌的纤维化必然导致心脏的舒缩功能降低,最终导致不可逆的心力衰竭[5]。
导致HHD患者心肌纤维化的机制很多,目前研究较多的与MF相关的神经内分泌系统主要包括RAS及交感神经系统,研究认为,神经内分泌系统的激活,使心肌成纤维细胞过度增殖,以及基质金属蛋白酶与组织抑制因子平衡失调[6],合成细胞外基质增加,导致胶原合成代谢和降解代谢失衡是MF不断进展的内在机制之一,而RAS的过度激活也与MF关系密切,RAS系统中的主要效应因子AngⅡ是心肌胶原网络重塑的重要因子[7],AngⅡ也会刺激心肌成纤维细胞中的TGF-β1分泌增多。AngⅡ通过TGF-β1促进心肌细胞增殖、分化以及细胞外基质沉积的作用[8-9],多项实验表明,TGF-β1 Smads信号通路亦是介导高血压MF的重要通路,TGF-β1过表达可诱导高血压大鼠中血管平滑肌细胞的增殖,且随着心脏功能的不断恶化,TGF-β1的mRNA表达逐渐增加,说明高血压大鼠的心室重构与TGF-β1 Smad通路有关。对盐敏感型高血压大鼠的研究也发现,TGF-β1在主动脉中的mRNA表达水平明显高于对照组[10]。上述资料说明AngⅡ、TGF-β1在高血压所致心力衰竭的发病机制中发挥着重要作用。本实验通过腹主动脉结扎致大鼠血压增高,持续的高血压导致心肌左心室重量增加、心肌细胞肥大、血管周围纤维化和间质纤维化,左心室收缩末期压力、左心室舒展末期压力、左心室压力最大上升速率、左心室压力最大下降速率等心脏功能学指标明显下降。上述指标证明了高血压心脏病存在明显的心肌纤维化,且心肌纤维化越重,心功能越差,我们可以推断,高血压可以导致心肌纤维化,而心肌纤维化又是高血压心力衰竭的病理表现之一。
Apelin/APJ在血管及心脏结构中的相关细胞存在特定表达,并且APJ在一些平滑肌细胞中也有表达[11],并与AngⅡ有31%的同源性,但与AngⅡ的病理生理作用却是截然相反的[12]。大量实验证明,Apelin/APJ具有降低血压、改善心脏功能、保护心肌损伤、预防心肌自噬[13]、促进新生血管生成、调节水盐及脂肪代谢等重要作用。Ashenaqar等[14]通过研究自发性高血压大鼠肾上腺内基因的表达,发现有128个高血压相关基因表达下调,其中含有调控Apelin表达的相关基因,间接说明Apelin参与高血压的形成过程。Naiafipour等[15]在给两肾一夹大鼠静脉注射Apelin后出现了明显的收缩压和舒张压降低,Apelin降动脉压的效果优于降舒张压,并且对高血压大鼠的降压效果优于正常组[16]。Tatemoto等[17]给予大鼠一定浓度Apelin后,大鼠的平均动脉压呈剂量依赖性下降。Japp等[18]发现Apelin可以降低心肌耗氧量、增加心肌收缩力,降低血压,但不引起心肌肥厚[19]。外源性应用Apelin-13治疗后测量心脏各部分重量及与体质量比值、心脏超声及血流动力学,证明Apelin能较好改善心脏功能。通过HE及Masson染色证明了Apelin能较好改善心肌纤维化及预防心室重构。ELISA测量血清中AngⅡAAC组明显高于假手术组和治疗组,而Ang(1-7)则相反,AngⅡ越高心功能越差,初步考虑AngⅡ可以使心功能恶化,Ang(1-7)可以改善心功能。ELISA及Western证明了Apelin-13是通过抑制AngⅡ的表达、减少TGF-β1及PAI-1的表达、加强MMP-2的表达,而改善心肌纤维化及预防心室重构。但Wesrern结果证明缬沙坦和Apelin有差异,而ELISA测定AngⅡ、Ang(1-7)的表达无差异。说明Apelin抑制纤维化的作用不仅是通过本实验证明的机制,还有其他机制,这有待于进一步研究证明。
综上所述,外源性Apelin-13具有降低血压、心率、预防心肌纤维化和改善心功能的作用。Apelin改善心功能的作用可能是通过抑制肾素-血管紧张素-醛固酮系统、降低AngⅡ及减少TGF-β1及PAI-1的表达、加强MMP-2的表达,而抑制心肌纤维化实现的;而心肌纤维越重,心功能则越差,Apelin可以降低收缩压,抑制心肌纤维化,延缓高血压心力衰竭的发生。因此,Apelin也许会为高血压及高血压心脏病的预防提供新的思路。
1 葛均波,徐永健,霍勇,等.内科学[M]. 8版.北京:人民卫生出版社,2013:258-271.
2 Barnes G, Japp AG, Newby DE. Translational promise of the apelin--APJ system[J]. Heart, 2010, 96(13): 1011-1016.
3 Galanth C, Hus-Citharel A, Li B, et al. Apelin in the control of body fluid homeostasis and cardiovascular functions[J]. Curr Pharm Des, 2012, 18(6): 789-798.
4 Santos M, Shah AM. Alterations in cardiac structure and function in hypertension[J]. Curr Hypertens Rep, 2014, 16(5): 428.
5 Quercioli A, Mach F, Montecucco F. Novel treatment strategy with direct renin inhibition against heart failure[J]. Panminerva Med,2010, 52(1):41-51.
6 Leask A. Potential therapeutic targets for cardiac fibrosis: TGFbeta,angiotensin, endothelin, CCN2, and PDGF, partners in fibroblast activation[J]. Circ Res, 2010, 106(11): 1675-1680.
7 陈剑,周瑞莉.血管紧张素Ⅱ及转化生长因子α在糖尿病心肌病发病机制中的作用[J].岭南心血管病杂志,2012,18(3):246-248.
8 褚燕,谭明旗.转化生长因子-β及其Smad信号转导通路在肺纤维化中的作用[J].中国医药指南,2013,11(3):52-53.
9 Maya L, Villarreal FJ. Diagnostic approaches for diabetic cardiomyopathy and myocardial fibrosis[J]. J Mol Cell Cardiol,2010, 48(3): 524-529.
10 Jing L, Zhang JZ, Zhao L, et al. High-expression of transforming growth factor beta1 and phosphorylation of extracellular signalregulated protein kinase in vascular smooth muscle cells from aorta and renal arterioles of spontaneous hypertension rats[J]. Clin Exp Hypertens, 2007, 29(2): 107-117.
11 Thomas MC, Pickering RJ, Tsorotes D, et al. Genetic ace2 deficiency accentuates vascular inflammation and atherosclerosis in the ApoE knockout mouse[J]. Circ Res, 2010, 107(7): 888-897.
12 Oudit GY, Crackower MA, Backx PH, et al. The role of ACE2 in cardiovascular physiology[J]. Trends Cardiovasc Med, 2003, 13(3):93-101.
13 焦慧,张志,马清华,等.Apelin-13对葡萄糖剥夺乳鼠心肌细胞自噬的影响及机制[J].解放军医学院学报,2013,34(2):167-171.
14 Ashenagar MS, Tabuchi M, Kinoshita K, et al. Gene expression in the adrenal glands of three spontaneously hypertensive rat substrains[J]. Mol Med Rep, 2011, 3(2): 213-222.
15 Najafipour H, Soltani Hekmat A, Nekooian AA, et al. Apelin receptor expression in ischemic and non- ischemic kidneys and cardiovascular responses to apelin in chronic two-kidney-one-clip hypertension in rats[J]. Regul Pept, 2012, 178(1/3): 43-50.
16 柏丹娜,高延,李红梅,等.Apelin-13对自发性高血压大鼠的降压调节作用的研究[J].心脏杂志,2010,22(4):514-516.
17 Tatemoto K, Takayama K, Zou MX, et al. The novel peptide apelin lowers blood pressure via a nitric oxide-dependent mechanism[J]. Regul Pept, 2001, 99(2/3): 87-92.
18 Japp AG, Cruden NL, Barnes G, et al. Acute cardiovascular effects of apelin in humans: potential role in patients with chronic heart failure[J]. Circulation, 2010, 121(16):1818-1827.
19 Koguchi W, Kobayashi N, Takeshima H, et al. Cardioprotective effect of apelin-13 on cardiac performance and remodeling in endstage heart failure[J]. Circ J, 2012, 76(1): 137-144.
Effect of apelin-13 on myocardial fibrosis in hypertensive rats and its underlying mechanism
TAO Yang1, ZHANG Zhi1, WANG Yingying2
1Department of Cardiology, The Third Affiliated Hospital of Liaoning Medical university, Jinzhou 121001, Liaoning Province, China;2Department of Cardiology, The First Affiliated Hospital of Liaoning Medical university, Jinzhou 121001, Liaoning Province, China
ZHANG Zhi. Email: ningcheng631@163.com
ObjectiveTo study the effect of apelin-13 on myocardial fibrosis in hypertensive rats and its underlying mechanism.MethodsForty male Sprague Dawley (SD) rats aged 8 weeks were randomly divided into AAC group (n=32) and sham operation group (n=8). After modeling the survival, the rats were randomly divided into three groups: apelin-13 group (n=8), valsartan VST group (n=8) and model group (n=8). The effect of apelin-13 on their cardiac function status and hemodynamical indexes were tested. ELISA kit was used to measure the concentration of AngⅡand Ang (1-7) in blood; Expression level of signaling pathways related protein TGF-β1, TIMP, PAI-1 and MMP-2 were detected by Western-blotting; Morphology of collagen in myocardial tissue was observed by HE and Masson staining, collagen volume fraction (CVF) in left ventricular interstitial tissue was measured by image analysis.ResultsThe cardiac function of AAC group decreased significantly compared with the sham operation group, apelin-13 group and VST group (P<0.05), and VST group was lower than apelin-13 group. Compared with the drug treatment group, the serum levels of Ang-(1-7) in ACC group decreased while the serum levels of Ang (Ⅱ) increased (P<0.05), and no statistically significant difference was found between apelin-13 group and VST group (P>0.05). The CVF in left ventricular interstitial tissue, and the TGF-β1, TIMP, PAI-1 protein expression levels were significantly higher whereas the MMP-2 expression level was significantly lower in apelin-13 group, VST group and ACC group than in sham operation group (P<0.05), and both drug treatment groups were significantly lower than AAC group with apelin-13 group lower than VST group (P<0.05).ConclusionApelin-13 can improve myocardial fibrosis in hypertensive rats by inhibiting the renin - angiotensin - aldosterone system, thereby inhibiting the expression of TGF-β1, PAI-1, TIMP-1 and improving the expression of MMP-2.
apelin-13; hypertension; abdominal aortic stenosis; myocardial fibrosis; rats
R 544.1
A
2095-5227(2015)03-0267-06
10.3969/j.issn.2095-5227.2015.03.018
时间:2014-12-10 08:55
http://www.cnki.net/kcms/detail/11.3275.R.20141210.0855.002.html
2014-09-15
辽宁省科学技术计划项目(2012225019)
Supported by the Science and Technology Program of Liaoning Province(2012225019)
陶阳,男,在读硕士。研究方向:心肌损伤与修复。Email: 540028653@qq.com
张志,男,博士,主任医师,主任。Email: ningcheng631@163.com

