细叶水团花种子萌发特性及扦插繁殖
郭玮龙, 岳春雷, 胡国伟,苏 燕,柴晓娟,金水虎
细叶水团花种子萌发特性及扦插繁殖
郭玮龙1, 岳春雷2, 胡国伟3,苏 燕1,柴晓娟1,金水虎1
(1.浙江农林大学 林业与生物技术学院,浙江 临安 311300;2.浙江省林业科学研究院,浙江 杭州310023;3.浙江森禾种业股份有限公司,浙江 杭州310007)
为了探索细叶水团花Adina rubella的繁殖方法,采用正交试验设计,研究温度、赤霉素(GA3)质量浓度及处理时间对种子萌发的效果,以及扦插基质、ABT生根粉质量浓度及其处理时间对扦插枝条成活率的影响。结果显示:①GA3质量浓度对细叶水团花种子萌发影响最大,其次为温度,处理时间影响最小;最佳处理组合为,15~20℃下,在300 mg·L-1GA3溶液中浸泡60 min,萌发率达75.6%。②基质对细叶水团花枝条扦插成活率影响最大,其次为枝条浸泡时间和ABT质量浓度;最佳处理组合为扦插基质为泥炭∶泥沙(体积比)=1∶1, ABT质量浓度为50 mg· L-1,浸泡时间为60 min,成活率达(91.0±0.7)%。表5参19
园艺学;细叶水团花;种子萌发;扦插繁殖;赤霉素
细叶水团花Adina rubella又名木本水杨梅,为茜草科Rubiaceae水团花属Adina(又称水杨梅属)落叶灌木,多生于溪边、河旁、沙滩等湿润环境,喜光,不怕水渍,较耐寒。它分布于中国安徽、江苏、浙江、江西、湖南、四川、福建、台湾、广东、广西等地,朝鲜也有分布[1-3]。细叶水团花全株可入药,具清热解毒、散瘀止痛之效[4-5]。临床证明其根具良好的抗肿瘤活性,尤其是对消化道肿瘤如胃癌、胰腺癌、肠癌等效果显著[6-7]。且细叶水团花根系发达,树形清秀、花果美丽,作为本地乡土植物,生态适应性强,移栽成活率高,生长快,易管护,能在较短时间内达到固岸护坡绿化美化的效果,适合应用于河道绿化和生态恢复建设。预实验发现,自然条件下细叶水团花的种子萌发率低于16%,扦插枝条的成活率低于30%。本试验采用正交试验设计,研究温度、赤霉素(GA3)质量浓度及处理时间对种子萌发的效果,以及扦插基质、ABT生根粉质量浓度及处理时间对扦插成活率的影响。研究结果可为细叶水团花的繁殖体系的构建及其进一步开发利用提供理论依据。
1 材料与方法
1.1 试验材料
细叶水团花种子于2012年10月下旬采自在浙江省临安市清凉峰镇顺溪村。该地区属于浙江省清凉峰国家级自然保护区,地处亚热带;土壤为花岗岩风化的红黄壤,质地为砂土。种子带回实验室,风干去杂后,常规储藏。2013年3月上旬在同地采集扦插用1年生枝。
1.2 试验方法
1.2.1 种子萌发试验 种子千粒质量测定:随机取100粒饱满种子,利用电子天平称量,重复5次,计算千粒质量。对常温干藏保存的种子进行GA3的不同质量浓度、不同处理时间及不同培养温度的3因素3水平L9(34)正交试验(表1),研究它们对种子萌发的影响,因素与水平设计见表1。该试验共设9个处理,重复3次·处理-1。随机选30粒种子·处理-1,置于垫有2层滤纸的培养皿内,均匀散布,用蒸馏水润湿滤纸后,加盖置于光照14 h·d-1,光强1 500~2 000 lx,湿度75%的相应温度设置的培养箱内进行种子萌发试验。每天观察记录,直至连续7 d不再有种子萌发为止。参照《国际种子检验规程》(1996)[8],根据胚根长度(至少达到种子长度的一半)确定发芽标准。统计发芽率和发芽势:发芽率(%)=种子发芽总数/供试种子数×100;发芽势(%)=发芽高峰期发芽的种子数/供试种子数×100。
1.2.2 扦插繁殖试验 2013年3月7日,将采集的无病虫害发生、长势良好的细叶水团花半木质化保湿枝条,剪取扦插穗条。长度约为10 cm,含2~4个茎节,上切口水平,下切口呈45°,切口光滑,为防止插穗伤口受细菌感染,剪下的穗条立刻放入净水中保持新鲜,然后用消毒溶液处理,并置于阴凉处备用。以扦插基质、ABT质量浓度、处理时间为影响因素,设置3因素3水平L9(34)正交试验(表1),随机选插条25根·处理-1,3次重复。扦插后立刻浇透水,用竹片搭建塑料拱棚,并在拱棚上盖上遮阳网,做好后续日常管理,喷洒质量浓度0.5%的多菌灵1次·周-1,并根据插床内温湿度情况适当通风。

表1 种子萌发与扦插正交实验设计的因素与水平Table 1 Factors and levels for orthogonal test
1.3 数据处理
对于上述属于二项分布的实验数据,根据方差分析基本要求,采用反正弦数据转化(Arcsinp1/2)[9],并利用SPSS 19.0软件进行数据处理。
2 结果与分析
2.1 种子形态与千粒质量
细叶水团花种子长卵状楔形,长为1.2~1.8 mm,宽约0.5 mm;经测定,种子千粒质量为2.852 g。
2.2 种子萌发特性
9个正交处理组合的细叶水团花种子发芽率的极差分析结果如表2。细叶水团花种子处理A,B和C因素的极差分别为38.15,5.56,12.24,即对细叶水团花种子萌发影响的大小依次为:GA3质量浓度(A)>温度(C)>浸泡时间(B),表明GA3质量浓度对细叶水团花种子萌发的影响最大,温度对细叶水团花种子萌发有影响,GA3浸泡时间对种子发芽率的影响最小。3因素的k值表明:种子萌发的最佳组合为A3B2C1,萌发率达(75.6±1.1)%。
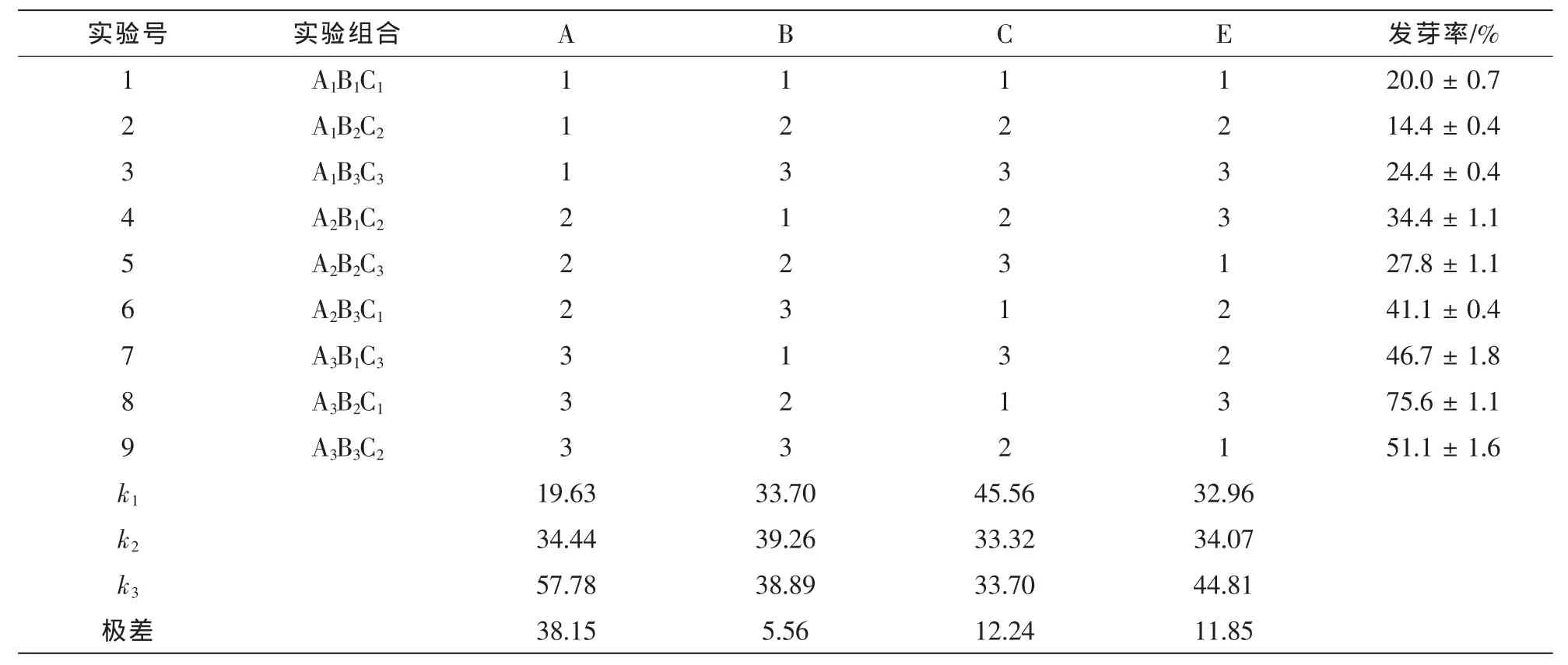
表2 正交试验处理下的种子发芽率Table 2 The results of seed germination
各因素方差分析及多重比较结果表明(表3):GA3质量浓度(A)对细叶水团花种子发芽率和发芽势的F值分别为67.523,15.089,差异极显著;种子浸泡时间(B)F值分别为0.989,0.083,差异不显著;温度对发芽率的F值为6.379,差异显著,但发芽势F值为3.319,差异不显著。表明GA3质量浓度各水平处理差异极显著;温度对种子发芽率有显著影响,其中,C2和C3之间无显著差异,与C1之间差异达显著水平;最佳组合为A3B2C1。

表3 各实验因素对发芽率和发芽势的方差分析及多重比较Table 3 Statistical analysis and multiple comparison of experimental factors for germinating percentage and germinating potential
2.3 细叶水团花扦插繁殖
扦插管理90 d后统计的成活率及不同处理的插条成活率极差分析结果见表4。细叶水团花扦插枝条的基质、插条浸泡ABT试剂的质量浓度、扦插枝条的浸泡时间的成活率极差R分别为28.22,14.66,21.78,即扦插基质(A)>扦插枝条的浸泡时间(C)>ABT质量浓度(B),表明扦插基质是影响细叶水团花扦插枝条存活的首要因素,其次是扦插枝条的浸泡时间,ABT试剂质量浓度对细叶水团花扦插枝条成活率的影响较小。各因素的k1,k2和k3数值表明:细叶水团花扦插枝条存活的最佳组合为A2B1C2,存活率高达(91.0±0.7)%。各因素的方差分析及多重比较结果显示(表5):基质、ABT质量浓度、浸泡时间对细叶水团花插条成活率的方差分析F值分别为10.312,5.283,3.572,即基质各水平对成活率影响极显著,浸泡时间和ABT质量浓度各水平处理对成活率的影响显著。不同扦插基质各处理之间差异显著;不同ABT质量浓度处理间差异也不同,处理B2和B3之间差异不显著,均与处理B1之间差异达到显著水平;浸泡时间C2与C1,C3之间差异显著,C1与C3处理之间则差异不显著;结合成活率极差分析结果显示,扦插试验最佳组合为A2B1C2。
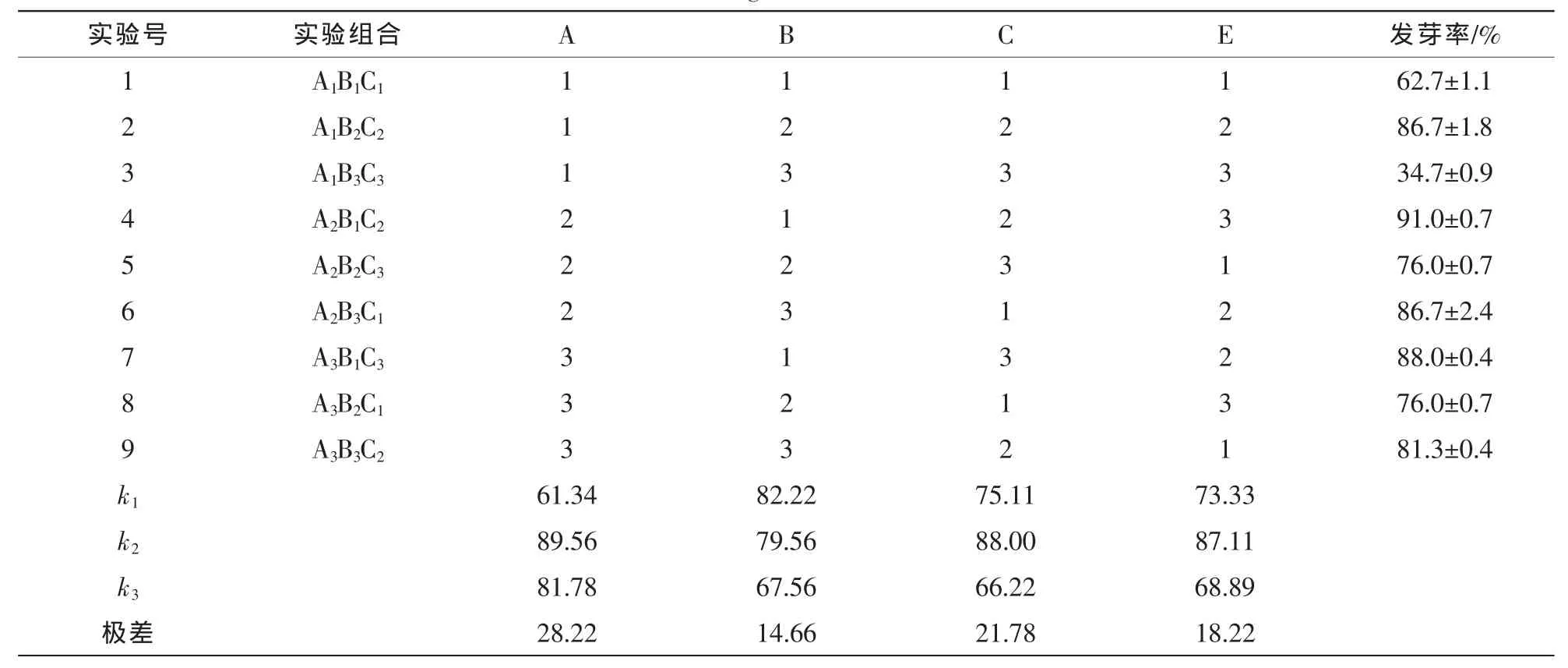
表4 正交试验处理下的扦插成活率Table 4 Results of orthogonal test of branch survival rate
3 讨论
种子萌发特性是种子播种成活最重要的指标。本试验中,细叶水团花种子的初始萌发率低于16%,这可能与种子存在休眠有关。造成种子休眠的原因很多,如含水量、成熟度或者脱落酸等抑制物质[10-11]。吴君等[12]对白花树Styrax tonkinensis种子的生物学特性研究发现,GA3通常能打破休眠和促进种子萌发,但当质量浓度过高时,也会抑制种子的发芽势和发芽率。结果表明:GA3的不同质量浓度处理对种子萌发率的影响较大,随着GA3质量浓度的升高,种子萌发率也有所提高,当GA3质量浓度为300 mg·L-1时,种子萌发率达到最高为75.6%。
温度对细叶水团花种子的萌发率有较大影响,结果显示15~20℃为最适温度范围,这可能与细叶水团花本身对环境的适应性有关;而GA3浸泡时间则对细叶水团花种子的萌发率影响较小,其中60 min对种子萌发的影响最好,适宜的浸泡时间有利于种子的正常萌发,这与刘建强等[13]对厚藤Ipomoea pescaprae种子萌发特性的研究结果相符。
选取1年生枝适当处理后进行扦插育苗,为细叶水团花的无性繁殖开辟了一条有效的途径。根据相关文献,茜草科Rubiaceae植物多数是较难生根树种[14],试验中细叶水团花插条成活率为34.7%~91.0%,造成成活率差异的原因,除了其自身的生物学特性,也与各试验处理有较大关系。适宜的基质是扦插育苗成功的关键环节之一[15],试验中,泥炭∶泥沙(体积比)=1∶1处理的成活率最高,这与该基质的保水透气性密切相关[16],同时也接近其自然生境的土壤特性。适宜的激素处理能有效提高插条的成活率[17]。研究显示,不同处理质量浓度及处理时间对扦插成活率的影响因植物种类和其插条性质而不同[18]。细叶水团花插条在ABT质量浓度为50 mg·L-1时存活率达到最高;而60 min的浸泡时间对插条的成活率促进效果最佳。试验结果也基本与陈圣贤对水团花Adina pilulifera的扦插繁殖技术研究相符[19]。如何调整ABT的处理浓度及其浸泡处理时间以进一步提高细叶水团花插条的存活率,有待进一步研究。
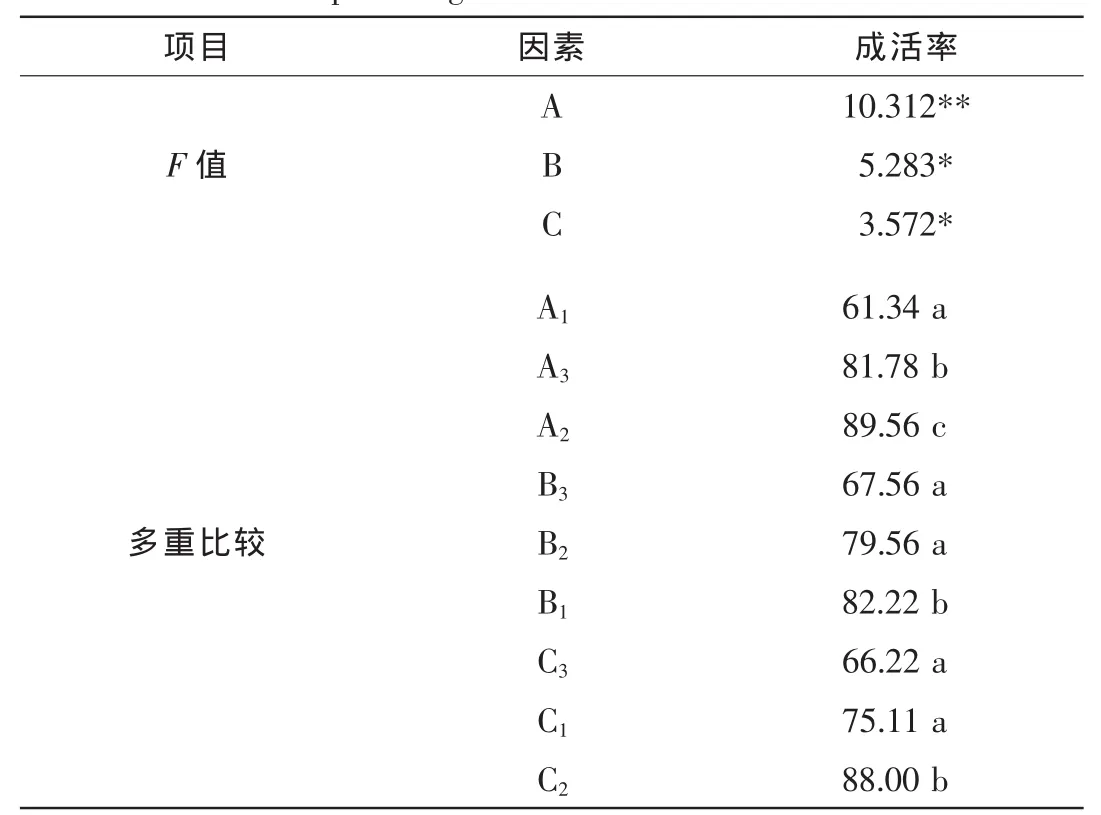
表5 各实验因素对成活率的方差分析及多重比较Table 5 Statistical analysis and multiple comparisons of experimental factors for percentage of success
[1] 罗献瑞.中国植物志:第71卷第1分册[M].北京:科学出版社,1999:274-2761.
[2] 郑朝宗.浙江植物志:第6卷[M].浙江:浙江科学技术出版社,1993:93-97.
[3] 中国科学院植物研究所.中国高等植物图鉴:第4册[M].北京:科学出版社, 1975:186.
[4] 徐祥浩,吴翰.中国水团花亚族植物的整理[J].华南农学院学报,1981,2(4):39.XU Xianghao,WU Han,A review of the subtribe adininae in China[J].J South China Agric Coll,1981,2(4):39.
[5] 俞秀媛,陈重明,张涵庆.中国茜草科抗癌植物资源[J].中药材,1988,11(5):18.YU Xiuyuan,CHEN Chongming,ZHANG Hanqing.The Chinese anti-cancer plant resources-Rubiaceae [J].J Chin Med Mater,1988,11(5):18.
[6] 李郁仁,中医肿瘤学[M].北京:科学技术出版社,1997:72-73.
[7] 郭玉瑜,祝凌云,林绥.水团花属水杨梅的研究进展[J].海峡药学,2008,20(5):1-3.GUO Yuyu,ZHU Lingyun,LIN Sui.Progress of Adina rubella Hance[J].Strait Pharm J,2008,20(5):1-3.
[8] 国际种子检验协会.国际种子检验规程[M].北京:中国农业出版社,1999.
[9] 盖鈞镒.试验统计方法[M].北京:中国农业出版社,1999.
[10] 李雪华,刘志民,蒋德明,等.7种蒿属植物种子重量形状及萌发特性的比较研究[J].生态学杂志,2004,23(5):57-60.LI Xuehua,LIU Zhimin,JIANG Deming,et al.Acomparative study on seed weight,shape and germination characteristics of 7 Artemisia species[J].Chin J Ecol,2004,23(5):57-60.
[11] 马春晖,韩建国,孙洁峰,等.结缕草种子发育过程中生理生化变化的研究[J].草业学报,2009,18(6):174-179.MA Chunhui,HAN Jianguo,SUN Jiefeng,et al.A study on the changes of physiology and biochemistry during zoysiagrass seed development[J].Actaprata Cult Sin,2009,18(6):174-179.
[12] 吴君,李因刚,罗修宝,等.白花树种子生物学特性[J].浙江农林大学学报,2014,31(1):9-13.WU Jun,LI Yingang,LUO Xiubao,et al.Seed biological characteristics of Styrax tonkinensis[J].J Zhejiang A&F Univ,2014,31(1):9-13.
[13] 刘建强,胡军飞,欧丹燕,等.厚藤种子萌发特性[J].浙江农林大学学报,2011,28(1):153-157.LIU Jianqiang,HU Junfei,OU Danyan,et al.Seed germination of Ipomoea pes-caprae(L.)Sweet[J].J Zhejiang A &F Univ,2011,28(1):153-157.
[14] 陈存及,陈伙法.阔叶树栽培[M].北京:中国林业出版社,2000:323-326.
[15] 陈存及,刘春霞.光皮桦扦插繁殖试验研究[J].福建林学院学报,2002,22(2):101-104.CHEN Cunji,LIU Chunxia.Study on the experiment of cutting propagation for Betula luminifera Winkl[J].J Fujian Coll For,2002,22(2):101-104.
[16] 钟泰林,石柏林,钱奇霞,等.几种草本花卉繁育试验[J].浙江林学院学报,2003,20(1):108-110.ZHONG Tailin,SHI Bailin,QIAN Qixia,et al.Cultivation experiments on several kinds of herbaceous flowers[J].J Zhejiang For Coll,2003,20(1):108-110.
[17] 王述贵,何燕梅,考安都,等.油茶扦插繁殖技术研究[J].中国农学通报,2012,28(19):65-69.WANG Shugui,HE Yanmei,KAO Andu,et al.Adventitious rooting formation in cuttings of Camellia oleifera[J]. Chin Agric Sci Bull,2012,28(19):65-69.
[18] 刘晓捷.峨眉含笑扦插繁殖研究[J].北方园艺,2013(5):63-65.LIU Xiaojie.Study on cutting propagataion of Michelia wilsonii[J].Northern Hortic,2013(5):63-65.
[19] 陈圣贤.水团花扦插繁殖试验[J].林业调查规划,2005,30(4):95-97.CHEN Shengxian.Experiment on cuttage breeding of Adina pilulifera(Lam)Franch.ex Drake[J].For Inventory Plann,2005,30(4):95-97.
Seed germination and cuttage of Adina rubella
GUO Weilong1,YUE Chunlei2,HU Guowei3,SU Yan1,CHAI Xiaojuan1,JIN Shuihu1
(1.School of Forestry and Biotechnology,Zhejiang A&F University,Lin’an 311300,Zhejiang,China;2.Zhejiang Forestry Academy,Hangzhou 310023,Zhejiang,China;3.Zhejiang Senhe Seed Company Limited,Hangzhou 310007, Zhejiang,China)
To explore reproduction methods of Adina rubella,an experiment with an orthogonal design was conducted to determine the effects on seed germination with treatments of concentration of gibberellic acid(GA3)(A1:100 mg·L-1,A2:200 mg·L-1,and A3:300 mg·L-1),treatment times (B1:30 min,B2:60 min,and B3: 90 min),and temperature (C1:15-20℃,C2:20-25℃,and C3:25-30℃).Then,survival rate of cuttings was tested with treatments of cutting medium (A1:peat,A2:peat:sediment=1:1,and A3:sediment),concentration of ABT(B1:50 mg·L-1,B2:100 mg·L-1,and B3:200 mg·L-1)and treatment time(C1:30 min,C2: 60 min,and C3:90 min).Results on seed germination showed that(1)GA3concentration had the largest effect followed by temperature,and then treatment time.The optimal treatment was GA3of A3,time of B1,and temperature of C1 with a germination rate of 75.6%.(2)For survival rate of cuttings,cutting medium had the greatest effect with the effects of immersion time and ABT concentration following.For this the optimal treatment was cutting medium-A2,ABT concentration-B1,and time-C1 with a germination rate of 91.0%.[Ch,5 tab.19 ref.]
horticulture;Adina rubella;seed germination;cuttage;GA3
S604
A
2095-0756(2015)02-0319-05
浙 江 农 林 大 学 学 报,2015,32(2):319-323
Journal of Zhejiang A&F University
10.11833/j.issn.2095-0756.2015.02.022
2014-06-09;
2014-07-04
浙江省科技计划项目(2011C22015)
郭玮龙,从事植物分类与开发应用研究。E-mail:767107182@qq.com。通信作者:金水虎,副教授,从事植物分类与资源利用等研究。E-mail:jsh501@163.com

