短短芽孢杆菌几丁质酶的分离纯化及酶学性质
苏明慧,胡雪芹,顾东华,张洪斌,褚小龙
(合肥工业大学医学工程学院,安徽 合肥 230009)
短短芽孢杆菌几丁质酶的分离纯化及酶学性质
苏明慧,胡雪芹*,顾东华,张洪斌,褚小龙
(合肥工业大学医学工程学院,安徽 合肥 230009)
探讨来源于短短芽孢杆菌FM4B的几丁质酶(chitinase)分离纯化过程及其性质。菌株FM4B摇瓶发酵液经过离心、乙醇分级沉淀及葡聚糖凝胶G-100层析纯化,用变性聚丙烯酰胺凝胶电泳确定其分子质量。结果获得几丁质酶纯品,酶的纯化倍数为7.19,酶活回收率为30.6%,分子质量为66 kD;酶活力在pH 5.0~9.0和80 ℃以下稳定,最适pH值为6.0,最适温度为50 ℃;Cu2+、Hg2+、Pb2+、Co2+以及Zn2+对该酶有强烈的抑制作用,Mg2+和Ca2+对该酶的活力具有一定的促进作用;该几丁质酶对多种霉菌有显著的抑菌效果。菌株FM4B分泌的几丁质酶稳定性好,且对多种霉菌抑制效果明显,具有较高的潜在利用价值。
短短芽孢杆菌;几丁质酶;纯化;性质;抑菌
几丁质(chitin)是由N-乙酰-D-氨基葡萄糖通过β-1,4糖苷键聚合而成的直链型大分子多糖,广泛存在于自然界中,其含量仅次于纤维素,它还是地球上除蛋白质外数量最大的天然含氮有机化合物[1-2],降解几丁质获得的多种生理活性的几丁寡糖,已被应用于医药、食品、农业、环保和保健等领域[3-7];大多数真菌和许多昆虫含有几丁质,而高等动植物不含几丁质,几丁质还可以作为选择性高的杀菌杀虫剂作用靶点,但几丁质难以降解,酶法是目前降解几丁质最环保高效、最有前途的方法。自1905年Benecke首次发现能够降解几丁质的贝内克氏菌(Beneckea chitinovora)后[8],人们相继发现许多细菌、放线菌、真菌都可以产生几丁质酶,在病毒、植物、动物中也发现了几丁质酶[9],其中芽孢杆菌是一类重要的几丁质酶制剂生产菌。几丁质酶(chitinase,EC3.3.1.14)[10]是一种专一性降解几丁质的酶类,可将几丁质完全水解为几丁单糖或几丁寡糖,应用前景十分广泛。
在前期的研究中,笔者分离得到一株高产几丁质酶的菌株,经鉴定为短短芽孢杆菌[11],本实验对该菌产生的几丁质酶进行分离纯化以及酶学性质研究,为其在食品和医药生产上的应用奠定基础。
1 材料与方法
1.1 材料与试剂
短短芽孢杆菌FM4B,由本实验室筛选所得[12]。种子培养基:牛肉膏0.5 g、蛋白胨1.0 g、NaCl 0.5 g,蒸馏水100 mL,pH 7.2。发酵培养基[13]:葡萄糖6.1 g/L、蔗糖31.3 g/L、蛋白胨23.1 g/L、K2HPO40.825 g/L、MgSO4·7H2O 0.5 g/L。
1%胶体几丁质、1%壳聚糖、5×蛋白电泳缓冲液、2×Loading Buffer、考马斯亮蓝染色液/脱色液(醋酸-乙醇脱色液)、丙烯酰胺贮液(丙烯酰胺质量分数30%,N,N-亚甲双丙烯酰胺质量分数3%)、浓缩胶缓冲液(1 mol/L Tris-HCl,pH 6.8)和分离胶缓冲液(1.5 mol/L Tris-HCl,pH 8.8) 合肥工业大学医学工程实验室配制;标准蛋白质Marker SM0661 生工生物工程(上海)股份有限公司;无水乙醇为分析纯、葡萄糖、牛肉膏、蛋白胨、氯化钠为生化试剂 中国医药集团(上海)化学试剂厂。
1.2 仪器与设备
HQ45B恒温摇床 中国科学院武汉科学仪器厂;LDZM立式压力蒸汽灭菌锅 上海申安医疗器械厂;HC-3018R高速冷冻离心机 科大创新有限责任公司;HH-1恒温水浴锅 江苏金坛晶玻实验仪器厂;T6紫外分光光度计 新世纪北京普析通用仪器有限责任公司;W-1调节万用电炉 南通市长江光学仪器有限公司;CA-920-2超净工作台 上海净化设备厂。
1.3 方法
1.3.1 几丁质酶粗酶液的制备
将短短芽孢杆菌FM4B菌株,按照50 mL培养基6%的接种量,30 ℃、200 r/min培养21 h制备种子液,种子液以5%的接种量接入50 mL发酵培养基中,28 ℃、180 r/min培养15 h,将发酵液在4 ℃、8 000 r/min的条件下离心15 min,收集上清液,即为粗酶液。
1.3.2 几丁质酶的纯化
将粗酶液在4 ℃条件下分级醇沉,加入乙醇,使乙醇的终体积分数达到45%,4 ℃冰箱静置过夜,第2天取出,0.45 μm微孔滤膜过滤3 遍,去沉淀留上清,上清加入乙醇,使乙醇的终体积分数达到65%,搅拌2 h,6 000 r/min离心10 min,沉淀用水溶解上葡聚糖G-100凝胶柱,以蒸馏水进行洗脱,流速0.5 mL/min,洗脱4 个体积,检测并收集有酶活性的馏分。
1.3.3 几丁质酶酶活力的测定
参考Dai Dehui等[14]的方法测定酶活力,在此基础上进行相应合理的修改:取1 mL处理后的发酵液与1 mL 1%的胶体几丁质-磷酸缓冲液于45 ℃水浴1 h,然后沸水浴煮沸40 min,终止反应后,加入2 mL 3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS),煮沸10 min,定容到10 mL,离心,上清液于540 nm波长处测定OD值。酶促反应的产物几丁质寡糖会和DNS发生氧化还原反应,在煮沸情况下显棕红色,在波长540 nm波长处检测酶活力[15]。在上述条件下,每分钟催化生成1 μg氨基葡萄糖时所用酶量定义为1 个酶活力单位(U)。酶活回收率是纯酶活力与总酶活力的相对百分比。
1.3.4 几丁质酶分子质量的测定
用聚丙烯酰胺凝胶电泳测定蛋白质分子质量。浓缩胶为6%,分离胶为12%,电泳后用考马斯亮蓝R-250染色。
1.3.5 最适pH值和酸碱稳定性的分析
在50 ℃条件下测定几丁质纯酶在pH 2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0时的酶活性,确定几丁质酶的最适pH值。将酶液用0.2 mol/L的不同pH值(2.0~12.0)的缓冲溶液(醋酸-醋酸钠缓冲液pH 2.0~6.0,磷酸盐缓冲液pH 7.0~8.0,甘氨酸-氢氧化钠缓冲液pH 9.0~12.0)进行适当稀释,30 ℃处理1 h后,在50 ℃、pH 6.0条件下测定剩余酶活力,考察酶的酸碱稳定性。
1.3.6 最适温度和热稳定性的分析
在pH 6.0条件下测定20~100 ℃的酶活力,确定酶的最适温度。将适当稀释的酶液在不同温度(20、30、40、50、60、70、80、90、100 ℃)条件下分别处理30 min和1 h后,在50 ℃、pH 6.0条件下测定剩余酶活力,考察酶的热稳定性。
1.3.7 部分金属离子对几丁质酶酶活性的影响
在反应体系中分别加入浓度均为1.0 mmol/L的金属离子(Co2+、Ca2+、Zn2+、Mg2+、Pb2+、Cu2+、Hg2+)测定酶活力,以未加入金属离子的酶液做对照,观察金属离子对酶活力的影响。
1.3.8 几丁质酶抗霉菌能力检测
采用杯碟法,指示菌为霉菌(西瓜枯萎病菌、番茄枯萎病菌、黄瓜枯萎病菌、棘孢青霉及哈茨木霉、根霉和灰霉)。300 μL指示菌孢子悬液(105CFU/mL)与20 mL PDA培养基混合摇匀后制作混菌平板,在混菌平板上放置牛津杯并加入100 μL质量浓度为200 μg/mL几丁质酶粗酶液,30 ℃培养,根据抑菌圈大小考察几丁质酶的抑菌能力。
2 结果与分析
2.1 几丁质酶的分离纯化
取2 L发酵液高速冷冻离心浓缩,取45%~65%醇沉物复溶后为3 mL,上Sephadex G-100的层析柱(1 cm×70 cm),洗脱曲线见图1,蛋白质含量和酶活性最高的部分均为5~13 管。纯化前后电泳图谱见图2,纯化后得到单一蛋白条带,由标准蛋白可知该酶分子质量约为66 kD。酶比活力由60.7 U/mg提高到436.8 U/mg,纯化7.19 倍,酶活回收率30.6%(表1)。
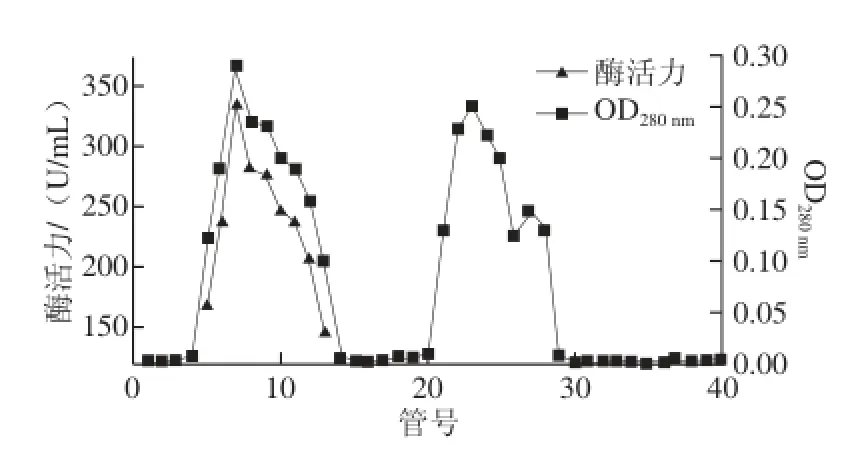
图1 几丁质酶的Sephadex G-100馏分色谱图Fig.1 Sephadex G-100 gel-fi ltration chromatography of chitinase
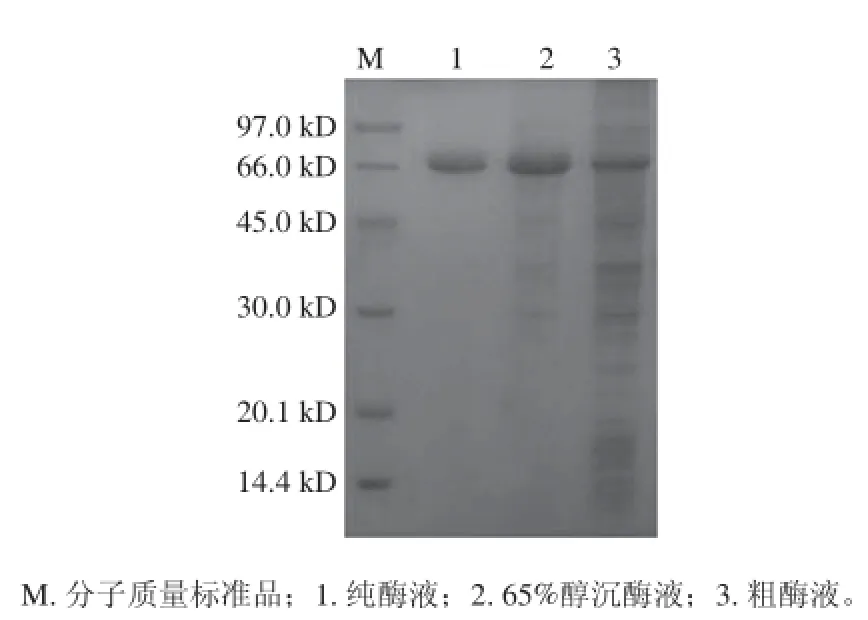
图2 几丁质酶的SDS-PAGE分析Fig.2 SDS-PAGE analysis of chitinase

表1 几丁质酶的纯化结果Table 1 Purifi cation of chitinase from Brevibacillus breevviiss
2.2 pH值和温度对几丁质酶酶活力的影响
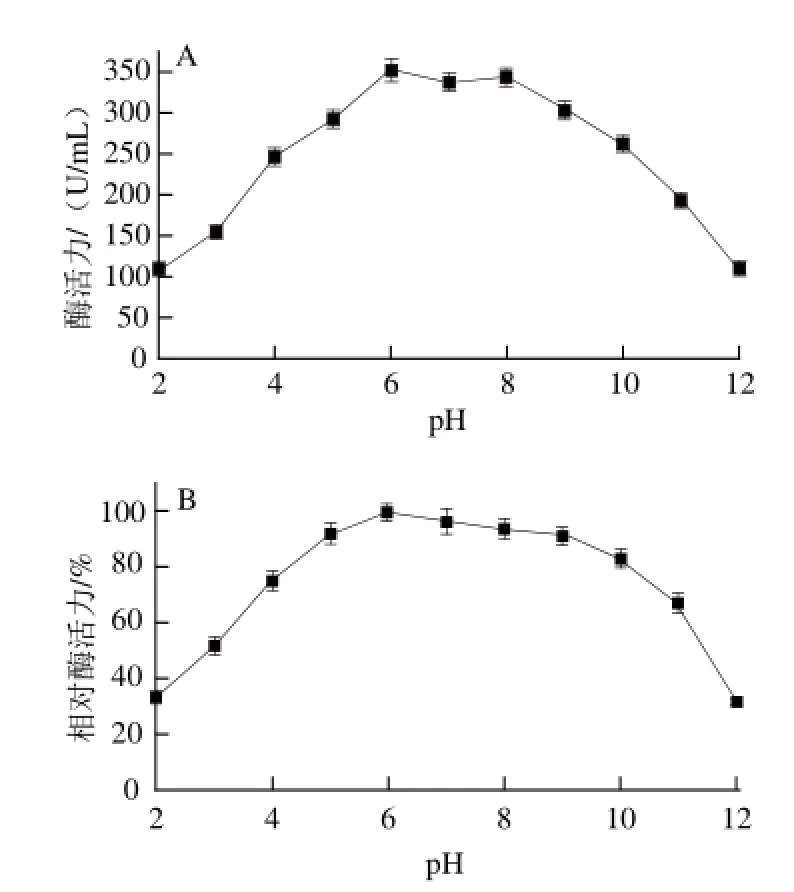
图3 几丁质酶的最适pH值(A)和pH值稳定性(B)Fig.3 Optimal pH (A) and pH stability (B) of chitinase
pH值对几丁质酶酶活性的影响结果(图3)表明,该酶在pH 6.0时活性最大;在pH 5.0~9.0之间较稳定,催化活力无明显变化,而几丁质酶在pH 4.0以下或pH 10.0以上,其稳定性迅速下降。温度对几丁质酶酶活性的影响结果(图4)表明,该酶的最适温度为50 ℃,在70 ℃以下,酶活力损失不明显;在80 ℃条件下保温1 h相对酶活力残留50%,保温0.5 h酶活力仅损失20%,高于80 ℃后酶稳定性降低。
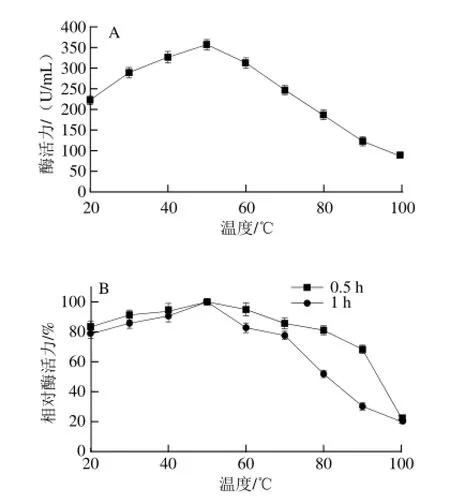
图4 几丁质酶的最适温度(A)和热稳定性(B)Fig.4 Optimal temperature (A) and thermostability (B) of chitinase
2.3 不同金属离子对几丁质酶酶活力的影响
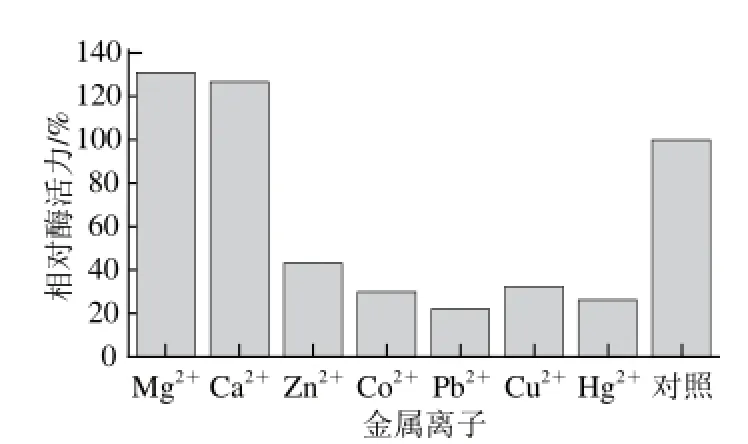
图5 不同金属离子对几丁质酶酶活力的影响Fig.5 Effects of different metal ions on the activity of chitinase
由图5可知,Mg2+、Ca2+对短短芽孢杆菌FM4B分泌的几丁质酶酶活力有一定的促进作用。而Cu2+、Zn2+、Co2+、Pb2+和Hg2+对其有较强的抑制作用,1.0 mmol/L的Cu2+、Zn2+、Co2+、Pb2+和Hg2+均使其相对酶活力降到40%以下。
2.4 几丁质酶抗霉菌检测结果
从短短芽孢杆菌FM4B发酵液分离的几丁质酶对不同指示菌(西瓜枯萎病菌、黄瓜枯萎病菌、番茄枯萎病菌、棘孢青霉、哈茨木霉、根霉和灰霉)有明显的抑菌作用(表2),且随着酶液质量浓度的增加,抑菌效果增大(以西瓜枯萎病菌为例,图6)。该几丁质酶对作物的枯萎病病原菌以及引起果蔬采后贮藏腐烂的病原真菌抑制作用明显,在生物杀菌和果蔬采后贮藏病害的生物防治中具有应用开发前景[16-18]。

表2 几丁质酶对不同拮抗真菌的抑菌效果Table 2 Inhibitory effect of chitinase on different antagonistic fungi
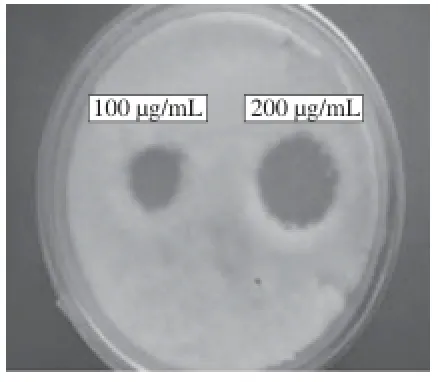
图6 不同质量浓度的几丁质酶对西瓜枯萎病菌的抑菌效果Fig.6 Inhibitory effect of chitinase on fusarium wilt of watermelon
3 讨 论
本实验从短短芽孢杆菌FM4B发酵上清液中得到几丁质酶,分级醇沉后只经过一步葡聚糖凝胶层析就可以达到电泳纯,纯化活力收率较高。文献[19-21]报道中微生物来源的几丁质酶分子质量差异很大,一般来说,放线菌几丁质酶分子质量大多在30 kD左右、细菌几丁质酶多为60~110 kD、真菌所产酶分子质量变化较大。本实验纯化得到的酶分子质量为66 kD,与报道相符。
本实验得到的几丁质酶纯品的最适pH值为6.0,在pH 5.0~9.0之间都可以稳定存在,由此可见该酶的pH值稳定范围较宽,酸碱耐受性很强,适于工业生产。该酶的最适温度为50 ℃,在80 ℃保温30 min仍有80%的相对酶活力,保温1 h相对酶活力仍有50%。可见该酶的热稳定性良好,在工业中可以适用不同的灭菌条件,温度高可防止杂菌的生长,因此该几丁质酶有很高的应用价值。
Cu2+、Zn2+、Co2+、Pb2+和Hg2+对该酶有较强的抑制作用,Mg2+、Ca2+对该酶酶活力有一定的促进作用,由此可见在催化水解几丁质时可以添加Mg2+、Ca2+来提高酶活力。在抗菌方面,虽然在理论上几丁质酶可作用于任意一类细胞壁含几丁质成分的真菌,但研究发现,不同来源的几丁质酶对不同真菌的抑制能力不同,几丁质酶抑菌作用具有选择性。如真菌来源的几丁质酶一般不能抑制真菌的生长[19,22-23],不同细菌来源的几丁质酶抑菌谱也有较大的区别,这种选择机制目前尚不清楚,推测可能与几丁质酶类型、真菌细胞壁结构、几丁质所占比例、几丁质暴露差异,或真菌体内调节因子等特性有关。本实验涉及的几丁质酶对多种霉菌有较强抑制效果,对作物的枯萎病病原菌以及引起果蔬采后贮藏腐烂的主要病原菌根霉菌和灰霉菌的抑制效果显著。综上所述,短短芽孢杆菌分泌的几丁质酶在作物枯萎病以及果蔬采后贮藏病害的生物防治中具有很大的应用开发前景,为开发生物杀菌及新型果蔬采后贮藏病害的生物防治途径提供参考,有进一步研究的价值。
[1] 李春霞, 佟永薇, 侯世洁. 微生物几丁质酶的研究进展[J]. 食品研究与开发, 2008, 29(8): 155-157.
[2] COTTRELL M T, MOORE J A, KRICHMAN D L, et al. Chitinases from uncultured marine microorganisms[J]. Applied and Environmental Microbiology, 1999, 65(6): 2553-2557.
[3] 李丽, 杨雪松, 刘红全. 微生物几丁质酶的特性及其应用的研究进展[J]. 广西民族大学学报: 自然科学版, 2011, 17(1): 92-96.
[4] 薛惠琴, 孙国荣, 杭怡琼. 浅谈虾仁生产废弃物的开发利用[J]. 上海畜牧兽医通讯, 2009(2): 105.
[5] JAYAKUMAR R, PRABAHARAN M, SUDHEESH KUMAR P T, et al. Biomaterials based on chitin and chitosan in wound dressing applications[J]. Biotechnology Advance, 2011, 29(3): 322-337.
[6] RINAUDO M. Chitin and chitosan: properties and applications[J]. Progress in Polymer Science, 2006, 31(7): 603-632.
[7] 刘和众, 刘东辉. 几丁质在农业上的应用[J]. 应用技术, 2001(3): 11-13.
[8] 孙菽蔚, 王子峰, 岳海东, 等. 一株海洋几丁质酶产生菌的筛选及其产酶条件的初步研究[J]. 海洋科学, 2007, 31(5): 10-16.
[9] HIRAMATSU S, FUJIE M, USANFI S, et al. Two catalytic domains of Chlorella virus CVR2 chitinase[J]. Journal of Bioscience and Bioengineering, 2000, 89(3): 252-257.
[10] 蒋红彬, 张瀛, 蒋千里, 等. 几丁质酶的研究概况[J]. 山东科学, 2000, 13(4): 41-45.
[11] 胡雪芹, 芮广虎, 周雪梅, 等. 生防菌FM4B的鉴定及抗菌物质的性质研究[J]. 上海交通大学学报: 农业科学版, 2011, 29(1): 75-80.
[12] 苏晓飞. 西瓜枯萎病拮抗菌株筛选及其活性物质的研究[D]. 合肥:合肥工业大学, 2010.
[13] 芮广虎. 短短芽孢杆菌FM4B的抗真菌活性物质性质和拮抗机理的研究[D]. 合肥: 合肥工业大学, 2012.
[14] DAI Dehui, HU Weilian, HUANG Guangrong, et al. Purifi cation and characterization of a novel extracellular chitinase from thermophilic Bacillus sp. Hu1[J]. African Journal of Biotechnology, 2011, 10(13): 2476-2485.
[15] 张拥军, 鲜乔. 芽孢杆菌几丁质酶高酶活菌株的筛选及其酶活的测定[J]. 中国食品学报, 2009, 9(3): 135-138.
[16] IPPOLITO A, EL-GHAOUTH A, WILSON C L, et al. Control of postharvest decay of apple fruit by Aureobasidium pullulans and induction of defense responses[J]. Postharvest Biology and Technology, 2000, 19: 265-272.
[17] 童志丹, 易有金, 柏连阳, 等. 几丁质酶对果蔬采后病害生物防治的研究进展[J]. 安徽农业科学, 2010, 38(19): 10242-10243.
[18] 阎瑞香, 张娜, 关文强, 等. 重组几丁质酶对不同果蔬病原真菌的抑菌效果研究[J]. 华北农学报, 2014, 29(4): 155-159.
[19] KOPPARAPU N K, ZHOU Peng, ZHANG Sheng, et al. Purifi cation and characterization of a novel chitinase gene from Paecilomyces thermophila expressed in Escherichia coli[J]. Carbohydrate Research, 2012, 347: 155-160.
[20] SONGSIRIRITTHIGUL C, LAPBOONRUENG S, PECHSRICHUANG P, et al. Expression and characterization of Bacillus licheniformis chitinase(ChiA), suitable for bioconversion of chitin waste[J]. Bioresource Technology, 2010, 101: 4096-4103.
[21] 蔡荟梅, 刘斌, 蔡敬民, 等. 金龟子绿僵菌(Metarhizium anisopliae Ma83)几丁质酶的纯化及性质[J]. 中国粮油学报, 2010, 25(4): 56-60.
[22] HOELL I A, KLEMSDAL S S, VAAJE-KOLSTAD G, et al. Overexpression and characterization of a novel chitinase from Trichoderma atroviride strain P1[J]. Biochimica et Biophysica Acta, 2005, 1748(2): 180-190.
[23] KOPPARAPU N K, LIU Zhuqing, YAN Qiaojuan, et al. A novel thermostable chitinase (PJC) from pomegranate (Punica granatum) juice[J]. Food Chemistry, 2011, 127(4): 1569-1575.
Purification and Characterization of Chitinase from the Fermentation Broth of Brevibacillus brevis FM4B
SU Minghui, HU Xueqin*, GU Donghua, ZHANG Hongbin, CHU Xiaolong
(School of Medical Engineering, Hefei University of Technology, Hefei 230009, China)
In the present study, the purification and characterization of a chitinase from the fermentation broth of Brevibacillus brevis FM4B was investigated by centrifugation, ethanol precipitation and Sephadex G-100 chromatography. Sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDS-PAGE) was used to determine its molecular weight. Purifi ed chitinase with a purifi cation factor of 7.19 and a recovery rate of 30.6% was obtained. The molecular weight of the purifi ed chitinase was approximately 66 kD. It had an optimum reaction temperature and pH of 50 ℃ and 6.0, respectively. The enzyme also showed good stability in the pH range of 5.0-9.0. Its activity could be inhibited by Cu2+, Hg2+, Pb2+, Co2+and Zn2+, but slightly activated by Mg2+and Ca2+. In addition, the chitinase had obvious inhibitory effect on different fungi. The chitinase, possessing high thermal stability, good pH adaptability and signifi cant antifungal effect, has great potential for practical applications.
Brevibacillus brevis; chitinase; purification; characterization; antibacterial activity
Q814
A
1002-6630(2015)19-0176-04
10.7506/spkx1002-6630-201519031
2014-10-31
安徽省自主创新专项(合肥工业大学2013秋实计划)(2013AKKG0391);省级大学生创新项目(2015cxcys094)
苏明慧(1989-),女,硕士研究生,研究方向为生物制药与酶工程。E-mail:790283130@qq.com
*通信作者:胡雪芹(1976-),女,副教授,硕士,研究方向为生物制药与酶工程。E-mail:85365206@qq.com

