自然乳酸发酵 猪肉蛋白质降解与血管紧张素转化酶抑制肽的分离纯化
丁 苗,李成龙,刘淑贞,周才琼
(西南大学食品科学学院,重庆市特色食品工程技术研究中心,重庆 400715)
自然乳酸发酵 猪肉蛋白质降解与血管紧张素转化酶抑制肽的分离纯化
丁 苗,李成龙,刘淑贞,周才琼*
(西南大学食品科学学院,重庆市特色食品工程技术研究中心,重庆 400715)
对猪肉发酵过程中蛋白质及其降解产物进行分析。结果表明:猪肉在发酵过程中蛋白氮含量随发酵时间延长呈下降趋势,非蛋白氮和氨态氮含量随发酵时间的延长而增加,多肽氮含量呈先升高后降低趋势,在发酵20 d时达最大值(0.227%);发酵20 d酸肉多肽具有最强的体外血管紧张素转化酶(angiotensin I-converting enzyme,ACE)抑制活性,ACE抑制率达74.35%,IC50为2.75 mg/mL;采用超滤、D101型大孔树脂、葡聚糖凝胶对发酵20 d的酸肉多肽进行分离纯化,分离得到的F3组分有较强的ACE抑制活性,IC50为0.90 mg/mL,肽含量为86.5 4%,氨基酸组成分析显示水解后增加最多的氨基酸是脯氨酸(7.08 倍)和酪氨酸(3.26 倍),谷氨酸、组氨酸、天冬氨酸、苯丙氨酸和丙氨酸占全部肽中氨基酸总量的49.09%,构成肽的疏水性氨基酸、芳香族氨基酸和支链氨基酸分别占39.35%、10.69%和13.65%;反相高效液相色谱显示F3组分主要由9 个峰组成,有待进一步的纯化。
猪肉;乳酸发酵;蛋白质降解;血管紧张素转化酶抑制肽;分离纯化
高血压是一种严重危害人类健康的疾病,在世界范围内约有45%心血管疾病的发生和死亡与之相关[1]。血管紧张素转化酶(angiotensin I-converting enzyme,ACE)是调节肾素-血管紧张素系统(renin-angiotensin system, RAS)和激肽释放酶-激肽系统(kallikrein-kinin system,KKS)的关键酶,能作用于血管紧张素I和缓激肽,产生血管收缩活性,引起血压升高[2]。抑制ACE活性对降低血压有积极的影响,长期服用合成的降血压药物如卡托普利、依那普利等通常伴随有干咳、味觉干扰、皮疹、器官障碍等副作用[3],食源性ACE抑制肽因其天然来源、无副作用、更为安全而受到青睐。目前研究者已经从植物蛋白[4]、动物蛋白[5]、藻类蛋白[6]等的酶解产物和奶酪[7]、腐乳[8]等发酵制品中分离得到了各种不同结构的ACE抑制肽。
猪肉是我国居民食用广泛的肉类食品,有研究表明,来自香肠的植物乳杆菌分泌的蛋白酶和氨肽酶可以水解肌浆蛋白和肌原纤维蛋白,产生肽和氨基酸[9];猪骨骼肌蛋白经蛋白酶水解后会有多种具有不同ACE抑制活性的肽片段被释放[10],Escudero等[11]从发酵肉制品西班牙干腌火腿中分离出了具有体外ACE抑制活性的肽,能够显著降低自发性高血压大鼠的收缩压。中国传统酸肉是以新鲜猪肉为原料,加入米粉、盐等,在自然状态下利用微生物进行厌氧发酵而成的一类乳酸菌发酵肉制品,主要存在于重庆、贵州、湖南、广西等地[12]。目前关于其功能性成分研究少见报道,叶春等[13]对酸肉中的肽进行了提取,研究了其抗氧化活性,结果表明酸肉肽对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、羟自由基、亚硝酸盐有良好的清除能力。本研究拟对酸肉发酵过程中蛋白质降解及ACE抑制肽的形成进行研究,采用现代分离纯化技术对发酵酸肉中的ACE抑制肽进行分离纯化,为酸肉制品的开发提供有关功能化学的研究数据。
1 材料与方法
1.1 材料与试剂
食盐、粳米、新鲜猪后腿瘦肉,购自重庆市北碚区天生路永辉超市。
酸肉制作:取新鲜猪后腿瘦肉,洗净并沥干水分,切成薄块(3 cm×5 cm×1 cm)、加入食盐(5%)和炒至金黄的粳米磨成的细粉(10%)、揉制装坛、水密封,于10~20 ℃条件下发酵。
硼酸、四硼酸钠、乙酸乙酯、氢氧化钠、乙醇、D101型大孔树脂、考马斯亮蓝G-250(均为分析纯) 成都市科龙化工试剂厂;牛血清白蛋白(生化试剂) 北京奥博星生物技术有责任限公司;卡托普利片 山西云鹏制药有限公司;马尿酸、Gly-Gly-Tyr-Arg四肽标准品、马尿酰-组氨酰-亮氨酸(Hip-His-Leu,HHL) 美国Sigma公司;氧化型谷胱甘肽、透析袋 北京索莱宝公司;Sephadex G-50 美国Pharmacia公司。
1.2 仪器与设备
KjelFlex K-360全自动凯氏定氮仪 瑞士Büchi公司;DZF-6020真空干燥箱 上海齐欣科学仪器有限公司;Avanti J-30I贝克曼冷冻离心机 美国贝克曼库尔特公司;ALPHA1-4LSC真空冷冻干燥机 德国Christ公司;LC-20A高效液相色谱仪、UV-2450紫外分光光度计 日本岛津公司;1-15PK冷冻离心机 德国Sigma公司;RE-52A真空旋转蒸发仪 上海亚荣生化仪器厂;MSC050超滤杯(配30、10 kD超滤膜) 上海摩速科学器材有限公司;FSH-2型可调高速匀浆器 江苏大地自动化仪器厂;HL-2恒流泵、DBS-100电脑全自动部分收集器 上海沪西分析仪器厂;日立L-8800型全自动氨基酸分析仪 日本Hitach仪器公司。
1.3 方法
1.3.1 发酵酸肉中粗肽的提取
按照Escuderoa等[14]的方法进行,取不同发酵时间的酸肉,剔除可见的脂肪和筋膜,用生理盐水洗去脂肪,切碎后称取50 g放入三角瓶中,加入200 mL 0.01 mol/L 的HCl溶液,高速均浆4 次(22 000 r/min,每次10 s,间隔10 s),然后置于4 ℃冷冻离心机中10 000 r/min离心20 min,取上清液过滤,加入3 倍体积40%的乙醇以脱去蛋白质,4 ℃条件下放置20 h,再次4 ℃、10 000 r/min离心20 min,取上清液在旋转蒸发仪中浓缩后经真空冷冻干燥制成粗肽粉,于-20 ℃条件下保存备用。

1.3.2 血管紧张素转化酶的粗提及验证
参照吴琼英等[15]的方法,将从市场上购买的新鲜猪肺放置于冰箱中于4 ℃条件下约12 h,充分冷却,然后用4 ℃预冷的质量分数0.9%的NaCl溶液冲洗干净,除去脂肪及大血管,切成小块。称取100 g猪肺组织加入500 mL事先4 ℃预冷的pH 8.3、0.1 mol/L硼酸盐缓冲液(含0.3 mol/L NaCl)中,高速组织捣碎机均浆2 min,将浆液置于冰箱中冷藏5 h,使浸提物充分溶解,于4 ℃、10 000 r/min条件下离心10 min,取上清液;在冰浴条件下以边加边搅拌的方式缓慢向上清液中加入固体硫酸铵至35%饱和度,在冰箱中4 ℃静置5 h,然后于4 ℃、10 000 r/min条件下离心10 min,取上清液;再向上清液中加入固体硫酸铵至55%饱和度,放置在冰箱中4 ℃静置过夜,于4 ℃、10 000 r/min离心10 min,弃去上清液,收集沉淀以4 ℃预冷的pH 8.3、0.1 mol/L硼酸盐缓冲液溶解,然后将溶解液装入截留分子质量为8 000~14 000 D的透析袋中,用硼酸盐缓冲液作透析液,4 ℃透析24 h,透析期间更换4 次透析液,以质量分数10%的BaCl2为检测液,直至透析液中无存在,取透析后的ACE粗酶液,经真空冷冻干燥制成酶粉后于-20 ℃条件下保存备用。
ACE的验证:在ACE样品中加入血管紧张素转换酶抑制剂卡托普利(captopril),计算马尿酸生成量的变化。
酶活力单位定义为在37 ℃的条件下,催化生成1 μmol马尿酸所需的酶量为1 个酶活力单位(U/mg solid);比活力定义为每毫克蛋白质所具有的酶活力(U/mg pro)。
1.3.3 酸肉肽ACE抑制活性的测定
采用Cushman等[16]的方法,对照组以同体积硼酸盐缓冲溶液代替抑制剂,空白组为在反应前加入250 μL 1.0 mol/L的HCl溶液终止反应,其他操作与实验组完全相同。
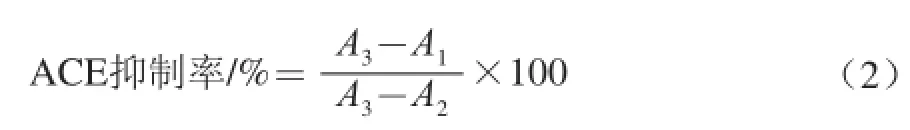
式中:A1为反应中ACE和样品同时存在时的吸光度;A2为ACE和HHL空白反应(在反应前就加入250 μL 1.0 mol/L的HCl溶液终止反应)的吸光度;A3为以同体积硼酸盐缓冲溶液代替样品时对照组的吸光度。
半抑制浓度(IC50)测定:称取一定质量样品配成不同质量浓度的溶液,按照ACE抑制活性体外测定方法测定其抑制活性,采用SPSS软件的概率系统(Probit)分析获得其IC50值。
1.3.4 酸肉中ACE抑制肽的分离纯化
取经冷冻干燥后的不同发酵时段酸肉粗肽粉末溶于纯水,配成质量浓度为10 mg/mL的溶液,分别测定其ACE抑制率,对具有最高ACE抑制率的酸肉肽进行分离纯化。
1.3.4.1 超滤
将粗肽粉溶于纯水配成质量浓度为50 mg/mL的溶液,经过孔径为10 μm的微孔滤膜过滤以除去杂质,然后注入超滤杯中,使其先通过截留分子质量为30 kD超滤膜,获得两种不同分子质量的组分,然后将分子质量<30 kD的组分通过10 kD超滤膜再进行分离,操作压力0.2 MPa,操作温度为室温。分别收集各分离液,获得3 种不同分子质量的组分:Ⅰ(M>30 kD)、Ⅱ(10 kD<M<30 kD)、Ⅲ(M<10 kD)。将超滤后的各组分溶液预冻后经真空冷冻干燥制成粉末,-20 ℃条件下保存备用,分别测定其体外ACE抑制活性。
1.3.4.2 大孔树脂吸附脱盐[17]
采用湿法上柱方法将处理好的D101型大孔树脂装入规格为2.5 cm×50 cm的玻璃层析柱,在室温条件下将具有最高抑制活性的超滤组分缓慢上样,恒流泵控制流速为0.5 mL/min,上样质量浓度10 mg/mL,上样量30 mL。上样结束后分别用25%、50%、75%、90%的乙醇溶液以2.0 mL/min的流速进行洗脱,每个试管收集5 mL,用紫外分光光度计于220 nm波长处检测收集液的吸光度,以A220 nm=0.05为透过点,当A220 nm≤0.05时停止洗脱,收集各试管中的溶液,旋转蒸发浓缩后真空冷冻干燥,获得4 种洗脱组分,分别测定各组分的ACE抑制率。
1.3.4.3 葡聚糖凝胶层析
称取Sephadex G-50凝胶干粉放入烧杯中,加入适量超纯水,室温条件下充分溶胀24 h后装入凝胶层析柱(2.6 cm×30 cm),使用超纯水平衡3 h。称取一定量多肽样品溶于超纯水,配成质量浓度为50 mg/mL溶液,经0.45 μm微孔滤膜过滤后取3 mL溶液上柱,以超纯水为洗脱液,恒流泵控制洗脱流速为0.8 mL/min,洗脱组分分管收集,每管收集5 min,检测波长214 n m,重复上样,对相应管号的洗脱组分进行合并,经旋转蒸发仪浓缩后冷冻干燥,分别测定各组分峰的ACE抑制率。
1.3.4.4 反相高效液相色谱分离
将Sephadex G-50凝胶层析分离得到的高活性组分,经过冷冻干燥后用超纯水配成10 mg/mL溶液,利用反相高效液相色谱(reversed-phase high performance liquid chromatography,RP-HPLC)分离酸肉ACE抑制肽。色谱条件:Kromasil C18色谱柱(4.6 mm×250 mm,5 μm);进样量:10 μL;流速:0.8 mL/min;检测波长:214 nm;柱温:35 ℃;流动相:A液为超纯水,B液为乙腈;流动相A和B事先用0.45 μm的滤膜过滤,洗脱条件如下:0~5 min,10% B;5~10 min,10%~30% B;10~15 min,30%~60% B;15~20 min,60%~30% B;20~25 min,30%~10% B;25~30 min,10%~0% B。
1.3.5 氨基酸组成分析
根据GB/T 5009.124-2003《食品中氨基酸的测定》测定氨基酸组成。
1.3.6 理化分析
蛋白质含量测定:考马斯亮蓝法[18];蛋白氮含量测定:GB 5009.5-2010《食品中蛋白质的测定》中的凯氏定氮法;多肽氮含量测定:常量双缩脲法,以氧化型谷胱甘肽绘制标准曲线[19];氨基酸态氮含量测定:茚三酮比色法,以甘氨酸标准液绘制标准曲线[19];肽含量测定:双缩脲法,以Gly-Gly-Tyr-Arg四肽标准品绘制标准曲线[20];NaCl含量测定:GB/T 12457-2008《食品中氯化钠的测定》;非蛋白氮含量测定:按照Caieri等[21]的方法,采用凯氏定氮法测定。
2 结果与分析
2.1 酸肉发酵过程中蛋白质及其降解产物分析
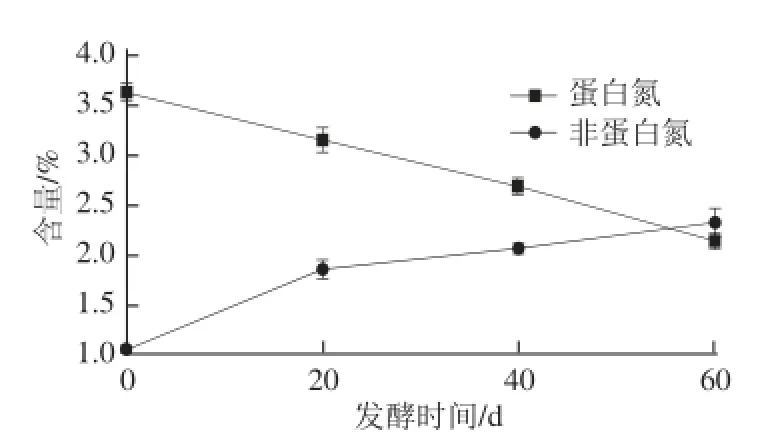
图1 酸肉发酵过程中蛋白氮、非蛋白氮含量变化Fig.1 Changes in protein nitrogen and non-protein nitrogen contents during sour meat fermentation
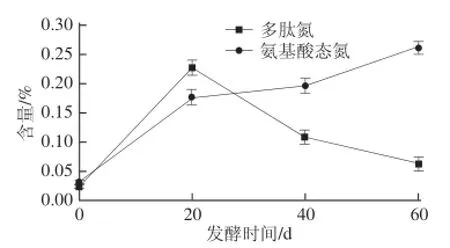
图2 酸肉发酵过程中多肽氮、氨基酸态氮含量变化Fig.2 Changes in peptide nitrogen and amino acid nitrogen contents during sour meat fermentation
由图1可知,酸肉中蛋白氮含量随发酵时间延长呈下降趋势,由发酵0 d的3.64%下降到发酵60 d的2.135%,下降了41.35%,在发酵前期(<20 d)、中期(20~40 d)和后期(40~60 d)分别下降了13.46%、14.44%、20.78%;非蛋白氮含量随发酵时间延长逐渐增加,由发酵0 d的1.064%增加到发酵60 d的2.31%。由图2可知,多肽氮含量在发酵过程中呈先增后降的趋势,在发酵20 d时达最大值(0.227%),增加了0.207%;氨基酸态氮含量呈增加趋势,发酵后期增加迅速,发酵60 d时含量达最高为0.262%,是发酵0 d时的7.99 倍。结果表明,发酵过程中非蛋白氮的持续增加主要源于氨基酸肽氮的增加,这与酸肉特有风味形成有关。
2.2 不同发酵时间发酵酸肉中ACE抑制肽粗肽的提取结果
2.2.1 ACE粗提及验证结果
采用猪肺作为ACE提取材料,经测定提取的ACE活力为0.509 4 U/mg solid,比活力为7.848 U/mg pro。与未加ACE抑制剂卡托普利的实验组相比,卡托普利组产生的马尿酸的量明显减少,质量浓度为6.25 mg/mL的卡托普利药片对ACE抑制率达69.65%,表明从猪肺中提取的物质确实是ACE(表1)。
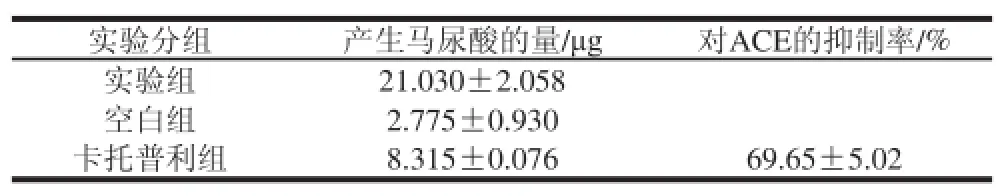
表1 ACE的粗提及验证结果Table 1 Extraction and verifi cation of crude ACE
2.2.2 ACE抑制肽粗肽的提取结果

表2 酸肉粗肽得率及ACE抑制率的IICC5500Table 2 Yield of crude peptide from sour meat and its IC50 for ACE inhibition
由表2可知,发酵20 d酸肉ACE抑制肽粗肽提取率最高,达1.630%。将提取的多肽分别配成质量浓度为10 mg/mL的溶液,测定其体外ACE抑制率,结果见图3。发酵0 d粗肽抑制率仅1.40%,发酵20 d和40 d的酸肉粗肽ACE抑制率分别为74.35%和64.10%,均表现出较高的体外ACE抑制活性,显著高于发酵60 d酸肉粗肽41.61%的抑制率(P<0.05)。4 种粗肽ACE抑制率的IC50以发酵20 d酸肉最低为2.75 mg/mL,低于发酵40 d和发酵60 d酸肉粗肽(表2)。

图3 不同发酵时间酸肉粗肽的ACE抑制率Fig.3 ACE inhibitory rates of peptide derived from sour meat with different fermentation times
对不同发酵时段多肽氮含量变化与粗肽得率和ACE抑制率的IC50进行相关性分析,多肽氮含量变化与粗肽得率之间存在极显著正相关(P<0.01),与ACE抑制率的IC50为负相关(P>0.05)。
2.3 自然乳酸发酵酸肉中ACE抑制肽的分离纯化结果
2.3.1 超滤结果
将从发酵20 d酸肉中提取的粗肽通过超滤得到3 种不同分子质量范围的超滤组分,分别配成质量浓度为2 mg/mL溶液,测定各组分ACE抑制率,结果见表3。超滤组分Ⅰ、Ⅱ、Ⅲ的ACE抑制率分别为25.80%、34.72%、53.22%,相比较超滤原液43.92%的ACE抑制率,分子质量<10 kD的超滤组分Ⅲ的ACE抑制活性最强,比超滤原液提高了21.17%,IC50也由超滤前的2.75 mg/mL降到2.19 mg/mL,表明猪肉发酵中产生的ACE抑制肽主要是分子质量<10 kD的一些肽类。

表3 不同超滤组分的ACE抑制率及IC50Table 3 ACE inhibitory rates and IC5500of different ultrafi ltration components
取适量超滤组分Ⅲ进行紫外全波长扫描,结果见图4,超滤组分Ⅲ在220 nm波长附近(217 nm)有最大吸收峰,符合多肽肽键的特征吸收;在248.4 nm波长处也有吸收峰,推测超滤组分Ⅲ可能含有苯丙氨酸(Phe)和色氨酸(Trp)。
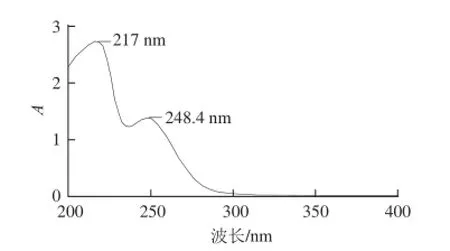
图4 分子质量<10 kD超滤组分的紫外吸收光谱Fig.4 Ultraviolet absorbance spectra of the fractions with molecular weights less than 10 kD
2.3.2 D101型大孔树脂吸附脱盐结果
由于酸肉在制作时加入了一定量的食盐,而过多的NaCl会影响ACE的活性,进一步实验分别采用25%、50%、75%、90%的乙醇对超滤后分子质量<10 kD的组分进行洗脱,收集洗脱后的各流出液,测定ACE抑制率,结果见表4。25%乙醇洗脱后的组分较洗脱前组分ACE抑制率有所降低,50%、75%、90%乙醇洗脱组分的ACE抑制率均比洗脱前高,但是50%乙醇洗脱组分的ACE抑制活性升高不明显,与洗脱前组分无显著差异(P>0.05),75%、90%乙醇洗脱组分的ACE抑制活性升高明显,4 种不同体积分数乙醇洗脱后组分的ACE抑制率之间存在显著性差异(P<0.05)。其中75%乙醇洗脱组分的体外ACE抑制率达68.14%,是4 种不同体积分数乙醇洗脱组分中最高的,比洗脱前升高了28.03%,脱氯率为74.14%,IC50由脱盐前的2.19 mg/mL降为1.40 mg/mL。洗脱后ACE抑制活性升高与氯离子浓度的降低有关,可能还与不同体积分数乙醇洗脱后组分的疏水值变化有关。

表4 不同体积分数乙醇洗脱组分的ACE抑制率Table 4 ACE inhibitory rates of fractions eluted by different volume fractions of ethanol
2.3.3 葡聚糖凝胶层析结果
将D101型大孔树脂吸附,75%乙醇洗脱组分采用Sephadex G-50凝胶层析进行进一步分离纯化,结果如图5所示。75%乙醇洗脱组分经过Sephadex G-50凝胶层析后又分为4 个组分,依次命名为F1、F2、F3、F4,分别测定其体外ACE抑制活性及肽含量,结果如表5所示,F1组分的ACE抑制率最低,F3组分的ACE抑制率最高,达59.18%,IC50由D101型大孔树脂吸附,75%乙醇洗脱后的1.40 mg/mL降为0.90 mg/mL,肽含量为86.54%,表明F3组分的主要成分是肽类物质。
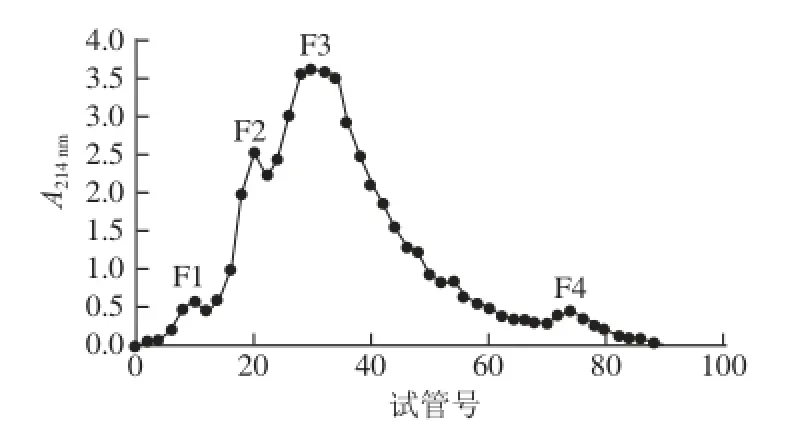
图5 Sephadex G-50层析分离结果Fig.5 Sephadex G-50 chromatography

表5 Sephadex G-50分离组分的ACE抑制率及肽含量Table 5 Peptide content and ACE inhibitory rate of each fraction separated by Sephadex G-50 chromatography
2.3.4 反相高效液相色谱分离结果
将经过葡聚糖凝胶层析得到的F3组分配成质量浓度为10 mg/mL的溶液,采用RP-HPLC进行分离,结果如图6所示。F3组分经分离后,出现9 个洗脱峰,表明经Sephadex G-50凝胶层析得到的F3组分不是很纯。
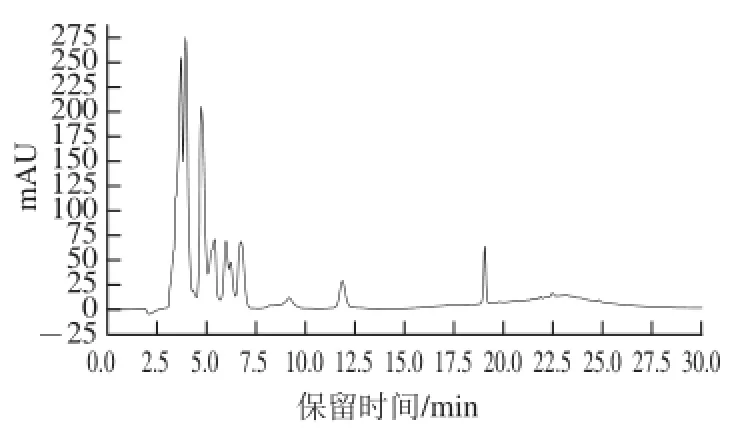
图6 RP-HPLC分离F3组分图谱Fig.6 RP-HPLC profi le of fraction F3
2.3.5 氨基酸组成分析
对F3组分中游离氨基酸和水解后的氨基酸组成进行测定,结果如表6所示。F3组分中游离氨基酸和水解后的氨基酸均有17 种,富含7 种必需氨基酸。水解后的各氨基酸含量和氨基酸总量均比未经水解的要高很多,这表明F3的主要成分是肽。由表6可知,水解后的氨基酸总量是水解前氨基酸总量的4.2 倍,表明分离纯化的F3主要是10 kD以下的肽,有少量游离氨基酸,其中,相比水解前含量增加最多的为谷氨酸、组氨酸、天冬氨酸、苯丙氨酸和丙氨酸,分别占总肽氨基酸比例为15.29%、11.34%、8.11%、7.46%和6.89%,共占全部肽氨基酸总量的49.09%。谷氨酸能促进脑细胞呼吸,利于脑组织中氨的排除,这会对血压造成一定的影响[22];从氨基酸增加比例看,组氨酸、赖氨酸和半胱氨酸含量分别增加了17.68、14.87和11.45 倍;疏水性氨基酸、芳香族氨基酸和支链氨基酸总量比水解前分别增加了1.92、2.24和1.79 倍,其中增加最多的氨基酸分别是脯氨酸(7.08 倍)和酪氨酸(3.26 倍)。构成肽的疏水性氨基酸、芳香族氨基酸和支链氨基酸的量分别占氨基酸总量的39.35%、10.69%和13.65%,这符合ACE抑制肽一般具有疏水性氨基酸、芳香族氨基酸和支链氨基酸含量较高及亮氨酸、脯氨酸含量高的结构特点[23-24]。
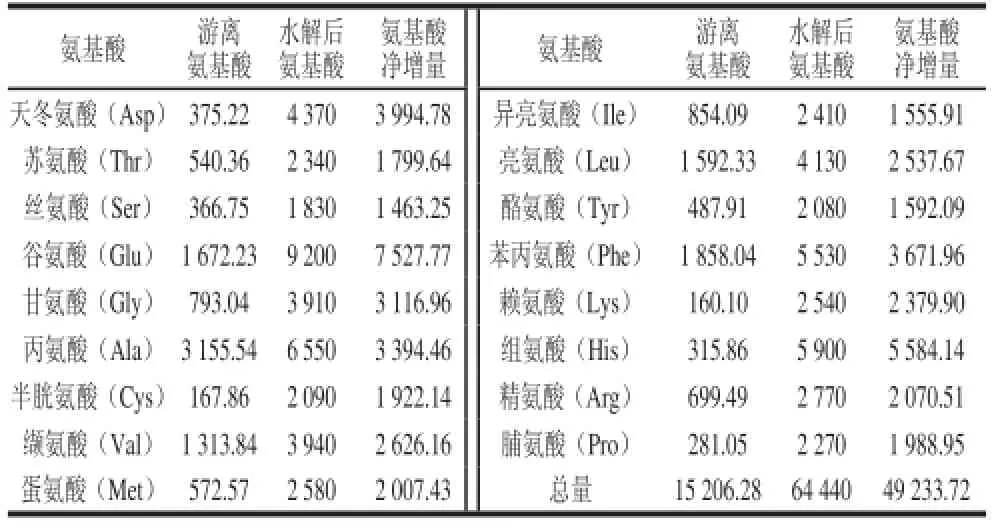
表6 F3组分的氨基酸组成与含量分析Table 6 Analysis of amino acid composition and contents in fraction F3 mg/100 g
3 结论与讨论
肉制品在发酵过程中在微生物胞外蛋白酶和肌肉中存在的内源蛋白酶如组织蛋白酶、钙激活中性蛋白酶等作用下发生水解,产生多肽和寡肽以及游离氨基酸等[25]。先前的研究显示酸肉在发酵过程中蛋白质发生了降解,其中肌原纤维蛋白和肌浆蛋白含量在发酵前期(<20 d)迅速降低,在发酵中后期(20~60 d)下降趋缓[26];此外,酸肉发酵过程中有大量乳酸菌生长,其中在发酵前中期乳酸菌数量多于发酵后期,乳杆菌属和片球菌属作为优势菌株贯穿整个发酵过程[27]。乳酸菌可通过其产生的胞外蛋白酶水解食品中的蛋白质,产生具有ACE抑制活性的肽片段,乳酸菌发酵食品被认为可能具有潜在的降血压活性[28]。Castellano等[29]分别用弯曲乳杆菌CRL705和乳杆菌CRL1862发酵猪肉肌浆蛋白和肌原纤维蛋白,发现这两种乳酸菌均能发酵肌浆蛋白产生ACE抑制肽,从中分离出的氨基酸序列为Phe-Ile-Ser-Asn-His-Ala-Tyr的肽具有较强的ACE抑制活性。
王宇[28]的研究表明ACE抑制活性高的乳酸菌的共同特点是生长性能良好、产酸能力和蛋白水解能力都很强。而酸肉在发酵的前中期乳酸菌处于优势地位,生长繁殖活跃,能更多分泌胞外蛋白酶,本研究以自然乳酸发酵猪肉不同发酵时段ACE抑制活性为评价标准,结果显示发酵20 d的酸肉粗肽体外ACE抑制活性强于发酵40 d 和60 d的酸肉粗肽,IC50为2.75 mg/mL,进一步采用超滤、大孔树脂、葡聚糖凝胶层析等对发酵20 d酸肉ACE抑制肽粗肽进行分离纯化,得到具有较强的ACE抑制活性,分子质量低于10 kD的F3组分,其肽含量为86.54%, IC50为0.90 mg/mL,主要由9 个峰组成,经对F3组分氨基酸组成进行分析,发现其主要由Glu、Phe、His、Asp和Ala组成,占全部肽氨基酸总量的49.09%,含较多的疏水性氨基酸、芳香族氨基酸和支链氨基酸,符合ACE抑制肽的一般结构特点,进一步的实验拟进行深入研究,确定ACE抑制肽的结构和组成。
[1] EZZATI M, VANDER H S, LAWES C M, et al. Rethinking the “diseases of affl uence” paradigm: global patterns of nutritional risks in relation to economic development[J]. PLoS Medicine, 2005, 2(5): e133. doi: 10.1371/journal.pmed.0020133.
[2] 孙红娜. 茶树菇降血压活性肽的提取分离研究[D]. 南宁: 广西大学, 2008.
[3] LIU Xin, ZHANG Miansong, JIA Airong, et al. Purification and characterization of angiotensin I converting enzyme inhibitory peptides from jellyfi sh Rhopilema esculentum[J]. Food Research International, 2013, 50(1): 339-343.
[4] QU Wenjuan, MA Haile, PAN Zhongli, et al. Preparation and antihypertensive activity of peptides from Porphyra yezoensis[J]. Food Chemistry, 2010, 123(1): 14-20.
[5] CHEN Jiwang, WANG Yimei, ZHONG Qixin, et al. Purifi cation and characterization of a novel angiotensin-I converting enzyme (ACE) inhibitory peptide derived from enzymatic hydrolysate of grass carp protein[J]. Peptides, 2012, 33(1): 52-58.
[6] SHEIH I C, FANG T J, WU T K. Isolation and characterisation of a novel angiotensin I-converting enzyme (ACE) inhibitory peptide from the algae protein waste[J]. Food Chemistry, 2009, 115(1): 279-284.
[7] GÓMEZ-RUIZ J Á, TABORDA G, AMIGO L, et al. Identifi cation of ACE-inhibitory peptides in different Spanish cheeses by tandem mass spectrometry[J]. European Food Research and Technology, 2006, 223(5): 595-601.
[8] KUBA M, TANAKA K, TAWATA S, et al. Angiotensin I-converting enzyme inhibitory peptides isolated from tofuyo fermented soybean food[J]. Bioscience, Biotechnology, and Biochemistry, 2003, 67(6): 1278-1283.
[9] FADDA S, SANZ Y, VIGNOLO G, et al. Characterization of muscle sarcoplasmic and myofibrillar protein hydrolysis caused by Lactobacillus plantarum[J]. Applied and Environmental Microbiology, 1999, 65(8): 3540-3546.
[10] ARIHARA K, NAKASHIMA Y, MUKAI T, et al. Peptide inhibitors for angiotensin I-converting enzyme from enzymatic hydrolysates of porcine skeletal muscle proteins[J]. Meat Science, 2001, 57(3): 319-324.
[11] ESCUDERO E, ARISTOY M C, NISHIMURA H, et al. Antihypertensive effect and antioxidant activity of peptide fractions extracted from Spanish dry-cured ham[J]. Meat Science, 2012, 91(3): 306-311.
[12] 李宗军. 侗族发酵酸肉(Nanx wudl)的微生物菌系及其挥发性风味组分研究[D]. 南京: 南京农业大学, 2002.
[13] 叶春, 马顺强, 张倩, 等. 酸肉肽抗氧化活性的研究[J]. 食品科学, 2010, 31(7): 94-97.
[14] ESCUDERO E, MORA L, FRASER P D, et al. Purification and identification of antihypertensive peptides in Spanish dry-cured ham[J]. Journal of Proteomics, 2013, 78: 499-507.
[15] 吴琼英, 马海乐, 崔恒林, 等. 猪肺血管紧张素转化酶的提取纯化及其性质研究[J]. 食品科学, 2004, 25(9): 71-74.
[16] CUSHMAN D W, CHEUNG H S. Spectrophotometric assay and properties of the angiotensin-converting enzyme of rabbit lung[J]. Biochemical Pharmacology, 1971, 20(7): 1637-1648.
[17] CHEN Jiwang, LIU Shanshan, YE Ran, et al. Angiotensin-I converting enzyme (ACE) inhibitory tripeptides from rice protein hydrolysate: purifi cation and characterization[J]. Journal of Functional Foods, 2013, 5(4): 1684-1692.
[18] 强伟, 王洪伦, 周昌范, 等. 考马斯亮蓝G-250染色法测定柠条锦鸡儿种子中可溶性蛋白含量[J]. 氨基酸和生物资源, 2011, 33(3): 74-76.
[19] 大连轻工业学院. 食品分析[M]. 北京: 中国轻工业出版社, 1998: 214-235.
[20] 鲁伟, 任国谱, 宋俊梅. 蛋白水解液中多肽含量的测定方法[J]. 食品科学, 2005, 26(7): 169-170.
[21] CARERI M, MANGIA A, BARBIERI G, et al. Sensory property relationships to chemical data of italian-type dry-cured ham[J]. Journal of Food Science, 1993, 58(5): 968-972.
[22] 曾可斌, 胡长林, 陈阳美. 谷氨酸对原代培养海马神经元的兴奋特性[J]. 中国应用生理学杂志, 2005, 21(4): 381-383.
[23] JUNG W K, MENDIS E, JE J Y, et al. Angiotensin I-converting enzyme inhibitory peptide from yellowfi n sole (Limanda aspera) frame protein and its antihypertensive effect in spontaneously hypertensive rats[J]. Food Chemistry, 2006, 94(1): 26-32.
[24] RUIZ J A G, RAMOS I. Angiotensin converting enzyme-inhibitory activity of peptides isolated from Manchego cheese. Stability under simulated gastrointestinal digestion[J]. International Dairy Journal, 2004, 14(12): 1075-1080.
[25] MORA L, SENTANDREU M A, KOISTINEN K M, et al. Naturally generated small peptides derived from myofi brillar proteins in Serrano dry-cured ham[J]. Journal of Agricultural and Food Chemistry, 2009, 57(8): 3228-3234.
[26] 周才琼, 陈东华, 杜木英. 酸肉发酵中蛋白质降解及影响因素的研究[J]. 食品科学, 2009, 30(7): 127-130.
[27] 周才琼, 李艳芳, 杜木英. 渝黔地区传统酸肉发酵过程中微生物区系研究[J]. 食品工业科技, 2010, 31(4): 171-175.
[28] 王宇. 乳酸菌发酵乳抑制血管紧张素转化酶活性的研究[D]. 无锡:江南大学, 2008.
[29] CASTELLANO P, ARISTOY M C, SENTANDREU M Á, et al. Peptides with angiotensin I converting enzyme (ACE) inhibitory activity generated from porcine skeletal muscle proteins by the action of meat-borne Lactobacillus[J]. Journal of Proteomics, 2013, 89: 183-190.
Protein Degradation and Purifi cation of ACE Inhibitory Peptides from Pork Naturally Fermented by Lactic Acid Bacteria
DING Miao, LI Chenglong, LIU Shuzhen, ZHOU Caiqiong*
(Chongqing Engineering Research Center of Regional Food, College of Food Science, Southwest University, Chongqing 400715, China)
The contents of protein and its degradation products were analyzed during the natural fermentation of pork by lactic acid bacteria. The results indicated that with the extension of fermentation time, the content of protein nitrogen decreased, non-protein nitrogen and amino acid nitrogen increased, and peptide nitrogen showed a downward trend after an initial increase to the maximum level (226.5 mg/100 g) during fermentation for approximately 20 days. Peptides derived from sour meat fermentation for 20 days exhibited the highest ACE inhibitory activity in vitro. ACE inhibitory rate was 74.35%, with an IC50value of 2.75 mg/mL. Ultrafi ltration and D101 macroporous resin and gel fi ltration chromatography were carried out sequentially for the purification of ACE inhibitory peptides. Fraction F3 had a strong ACE inhibitory activity with IC50value of 0.90 mg/mL, and the content of peptides was 86.54%. Amino acid composition analysis showed that most signifi cantly increased levels of amino acids after hydrolysis were observed for proline (7.08-fold) and tyrosine (3.26-fold), and glutamic acid, histidine, aspartic acid, phenylalanine and alanine together accounted for 49.09% of the total amino acids in peptides. Hydrophobic amino acids, aromatic amino acids and branched-chain amino acids in peptides accounted for 39.35%, 10.69% and 13.65%, respectively. RP-HPLC showed that F3 was mainly composed of nine peaks thus needing further purifi cation.
pork; lactic acid fermentation; protein degradation; ACE inhibitory peptide; separation and purifi cation
TS201
A
1002-6630(2015)19-0204-07
10.7506/spkx1002-6630-201519037
2014-11-30
重庆市特色食品工程技术研究中心能力提升项目(cstc2014pt-gc8001)
丁苗(1988-),男,硕士研究生,研究方向为食品化学与营养学。E-mail:dsky1213@163.com
*通信作者:周才琼(1964-),女,教授,博士,研究方向为食品营养化学。E-mail:zhoucaiqiong@swu.edu.cn

