腺苷对人胃癌MGC-803细胞增殖与凋亡的影响
高文强, 刘 坤, 周 艳, 刘寒旸, 汤黎明
(南京医科大学附属常州第二人民医院 胃肠外科, 江苏 常州, 213164)
腺苷对人胃癌MGC-803细胞增殖与凋亡的影响
高文强, 刘坤, 周艳, 刘寒旸, 汤黎明
(南京医科大学附属常州第二人民医院 胃肠外科, 江苏 常州, 213164)
摘要:目的观察腺苷(adenosine)对人胃癌MGC-803细胞的增殖、凋亡的影响。方法CCK-8法检测不同浓度腺苷(0.01~10 mmol/L)对胃癌MGC-803细胞增殖的影响。流式细胞仪检测腺苷(0.25、0.5、1 mmol/L)对细胞凋亡的影响。Western blot检测腺苷处理后细胞内凋亡相关蛋白和内质网应激相关蛋白的表达量。结果腺苷能抑制胃癌MGC-803细胞的活力,并且呈现浓度和时间依赖性(P<0.05)。腺苷(0.25、0.5、1 mmol/L)处理24 h后,细胞的总凋亡率显著升高(P<0.01)。腺苷可以引起凋亡相关蛋白Caspase-3活化片段的蛋白表达量上调(P<0.01)。腺苷能诱导内质网应激(ERS)相关蛋白Caspase-4活化片段、p-JNK、CHOP、GRP78的表达量上调(P<0.05)。结论腺苷可以抑制胃癌MGC-803细胞的增殖,并且促进凋亡,而内质网应激可能参与了腺苷引起的凋亡。
关键词:胃癌; 腺苷; 增殖; 凋亡; 内质网应激
胃癌是常见的恶性肿瘤之一,根据GLOBOCAN 2012的统计,全世界每年新发胃癌约95.1万例,其发病率目前在全球范围内居第5位,每年因胃癌死亡约72.3万例,其死亡率在全球范围内位居第3位[1-2]。在中国,大部分胃癌病例在确诊时已是进展期,手术治疗难以达到治愈,常常需要配合系统性化疗[3]。虽然目前化疗药物种类繁多,但是探索新的抗癌药物一直是治疗肿瘤的研究方向。腺苷是三磷酸腺苷ATP经过内源性核苷酸酶催化的代谢产物[4]。正常情况下,腺苷的浓度维持在极低的水平,可以通过转运体转运到细胞内或者直接作用于细胞膜表面的腺苷受体来调节细胞的生理功能[5]。高浓度的胞外腺苷能诱导肺癌[6]、肝癌[7]、卵巢癌[8]、乳腺癌[9]等多种肿瘤细胞的凋亡。本研究探讨腺苷对于胃癌的作用和机制,现报告如下。
1材料与方法
1.1材料
人胃癌MGC-803细胞株(中科院细胞库);腺苷(A4036,Sigma公司,美国); CCK-8细胞计数试剂盒(同仁化学研究所,日本);RPMI-1640培养基和胎牛血清(Gibco公司,美国);Annexin V PE凋亡检测试剂盒(Affymetrix公司,美国);cleaved Caspase-3、Caspase-4、cleaved Caspase-4、JNK、p-JNK、CHOP和GRP78一抗(Cell Signaling公司,美国);Tubulin一抗、HRP标记的羊抗鼠二抗和HRP标记的羊抗兔二抗(南京诺唯赞公司);蛋白提取试剂盒、BCA蛋白测定试剂盒和ECL显影试剂盒(上海碧云天公司)。
1.2方法
1.2.1细胞培养:MGC-803细胞培养于RPMI-1640培养基,含有10%胎牛血清和1%双抗,于37℃饱和湿度、5%二氧化碳培养箱中培养。每隔2~3 d换液,传代细胞使用0.25%胰酶-EDTA消化液消化2 min。
1.2.2CCK-8试验检测细胞活力:取对数生长期的MGC-803细胞制成混悬液,分别以5×104个/mL细胞密度接种96孔细胞培养板,每孔接种100 μL混悬液,样本孔四周用PBS填充。每隔24 h检测1次,连续监测3 d,每次各组5个孔分别加入10 μL CCK-8试剂,培养1 h 后使用酶标仪(Molecular Devices 公司,美国)测定波长450 nm处的吸光度值,计算实验组/对照组吸光度的比值,取百分数,制作细胞生长曲线,实验重复3次。
1.2.3流式细胞仪检测细胞凋亡:加入不同浓度腺苷处理24 h后,收集各组大约1×105个细胞,用PBS溶液洗涤,离心,加入100 μL缓冲液重悬。细胞悬液加入5 μL Annexin VPE,室温下避光孵育15 min。1×缓冲液洗涤离心1次,加入200 μL缓冲液重悬。细胞悬液加入5 μL 7-AAD, 4 h内流式细胞仪检测,保持样品2~8℃且避光。检测分析早期凋亡(Annexin V PE+, 7-AAD-)和晚期凋亡(Annexin V PE+, 7-AAD+)的所占比率。
1.2.4Western blot:细胞使用RIPA裂解液裂解,45 min后提取总蛋白,BCA法测定蛋白样品含量,加入上样缓冲液后100℃加热5 min。12%的十二烷基磺酸钠-聚丙烯酰胺凝胶(SDS-PAGE)进行电泳分离蛋白,湿转法转膜至PVDF膜。5% BSA室温下封闭1 h, 一抗4℃孵育过夜后PBST洗膜3次,计入HRP标记的二抗孵育1 h, PBST洗膜3次。采用ECL试剂盒显影,凝胶电泳成像系统进行自动摄片分析,蛋白条带的灰度值由ImageJ软件进行分析。
2结果
2.1腺苷对MGC-803细胞增殖能力的影响
CCK-8法检测腺苷对MGC-803细胞增殖能力的影响。每组含有腺苷的细胞与空白对照组的比值表示细胞的增殖能力。浓度为0.5 mmol/L腺苷处理48 h组的细胞增殖能力比空白对照组显著降低(P<0.01)。MGC-803细胞的增殖能力随着腺苷浓度的增加而下降,随着处理时间的延长而下降,呈浓度和时间依赖性。见图1。
与对照组(腺苷0mmol/L)比较,*P<0.05,**P<0.01,***P<0.001,n=3
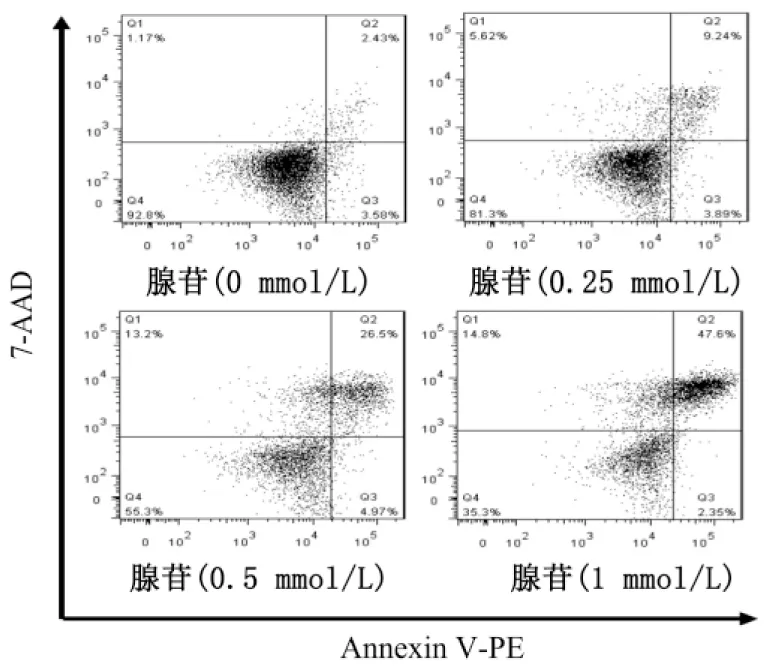
2.2腺苷对MGC-803细胞凋亡的影响
采用流式细胞术检测腺苷对MGC-803细胞凋亡的影响。结果显示MGC-803细胞经过腺苷(0.5 mmol/L)处理后的总凋亡率为(30.59±4.1)%,与空白对照组的总凋亡率(4.44±1.4)%相比,差异具有统计学意义(P<0.01)。相比空白对照组的晚期凋亡率,3组腺苷处理组的晚期凋亡率显著升高(P<0.01)。腺苷处理组的早期凋亡率与空白对照组相比没有变化,差异无统计学意义(P>0.05)。见表1、图2。

表1 MGC-803细胞经过腺苷处理后的凋亡率的变化 %
与对照组(腺苷0 mmol/L)比较, **P<0.01。

图2 腺苷对MGC-803细胞凋亡的影响
2.3腺苷对MGC-803细胞内Caspase-3活化片段的表达量的影响
采用Western blot检测细胞内Caspase-3活化片段的表达量变化。结果显示,在腺苷处理48 h后,浓度为0.25、0.5、1 mmol/L腺苷处理组细胞内的Caspase-3活化片段的蛋白表达量要显著高于空白对照组(P<0.01),并且Caspase-3活化片段的蛋白表达量随着腺苷浓度的增加而升高。在腺苷处理浓度为0.5 mmol/L时,腺苷处理24、48、72 h组细胞内的Caspase-3活化片段的蛋白表达量都显著高于空白对照组(P<0.01),并且Caspase-3活化片段的蛋白表达量随着时间的延长而升高。见图3。
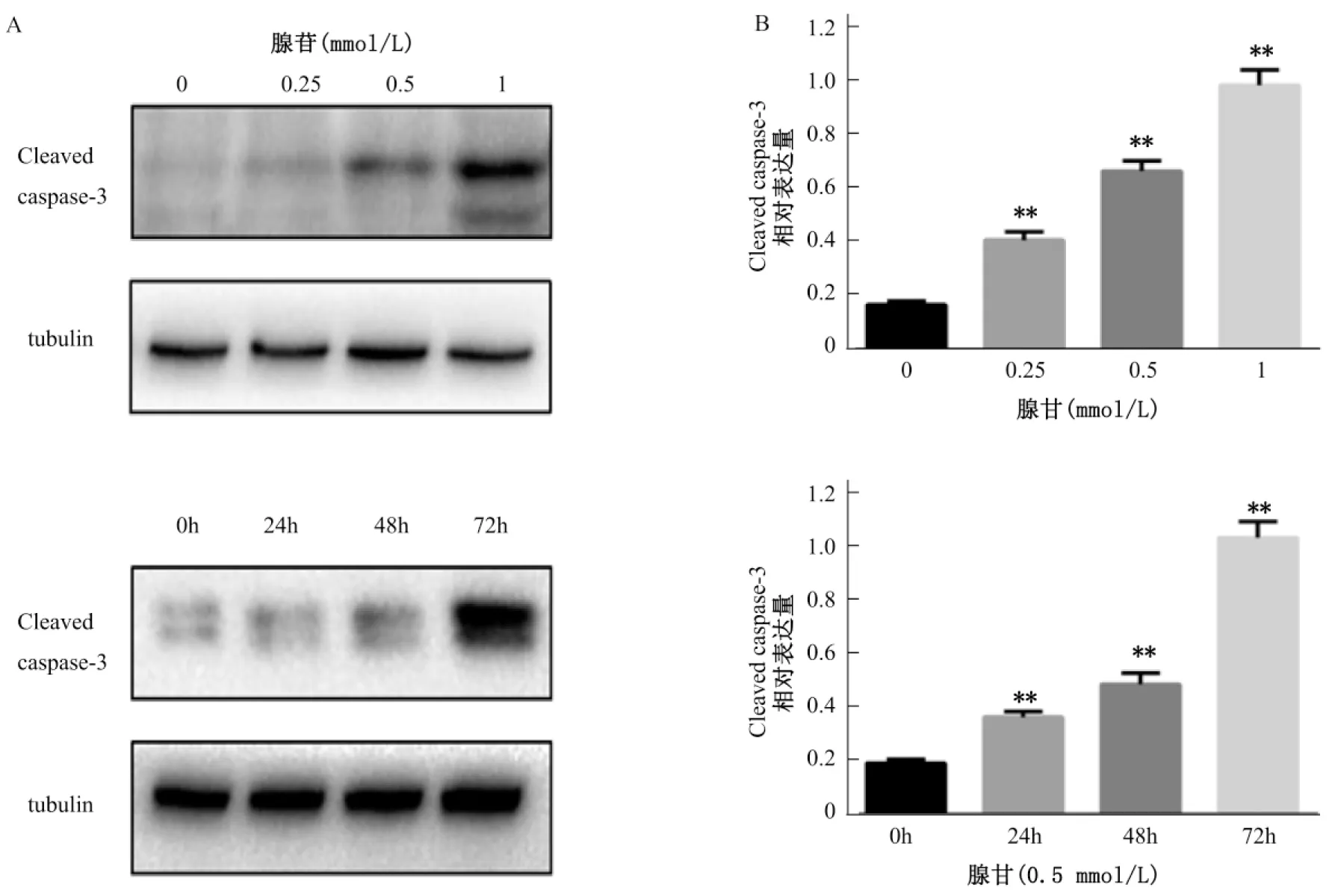
A: Western blot检测Caspase-3活化片段的蛋白表达水平;B: 重复检测样本的量化数据和统计学处理结果(与对照组相比较, **P<0.01, n=3)
2.4腺苷对内质网应激相关蛋白表达的影响
采用Western blot检测细胞内Caspase-4活化片段、p-JNK、CHOP和GRP78的蛋白表达量变化。结果显示,经过浓度为0.25、0.5、1 mmol/L腺苷处理组细胞内的Caspase-4活化片段、p-JNK、CHOP和GRP78的表达量显著高于各自的空白对照组(P<0.05)。随着腺苷浓度的升高,细胞内Caspase-4活化片段、p-JNK、CHOP和GRP78的表达量也随之增加。见图4。
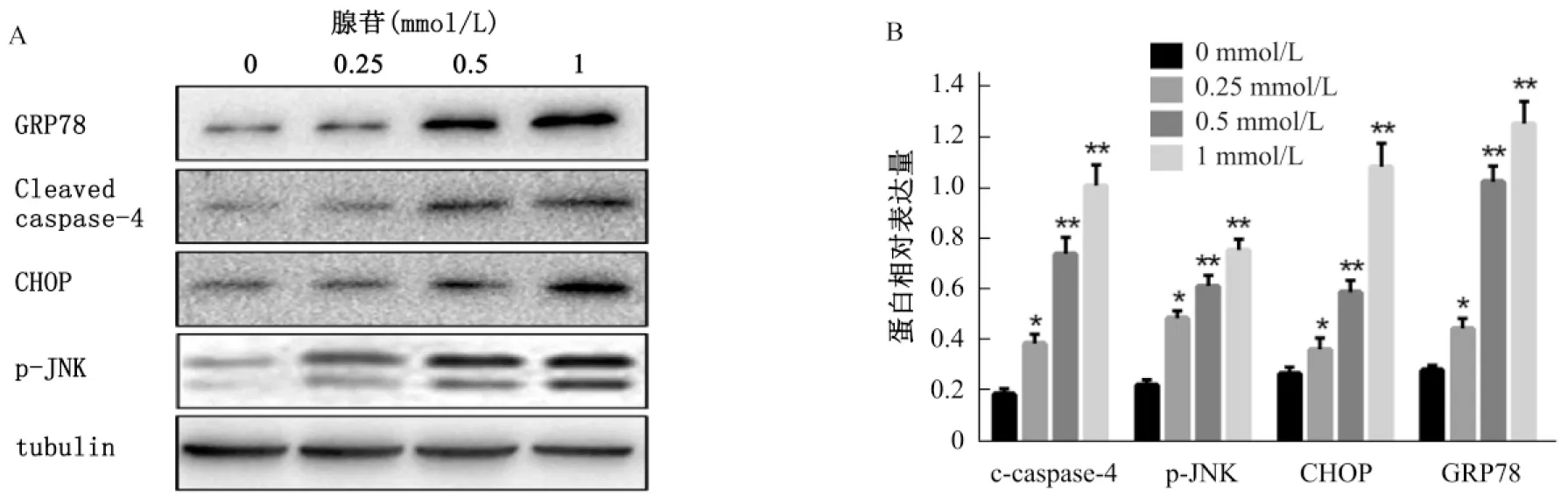
A: Western blot检测的Caspase-4活化片段、p-JNK、CHOP、GRP78的蛋白表达水平;B: 重复检测样本的量化数据和统计学处理结果(与对照组相比较, **P<0.01, n=3)
3讨论
目前,进展期胃癌的术后复发和预后差等问题依然是综合治疗需要攻克的难关,局部或远处复发转移是导致胃癌无法治愈的主要原因。因此,对进展期胃癌进行局部和全身系统性的化疗变得尤为重要。所以在综合治疗模式下,积极探索新型化疗药物和新方案的组合已然是当务之急[10-11]。
本研究观察到腺苷能抑制胃癌细胞MGC-803的生长,并且呈现剂量和时间依赖性。流式细胞仪检测到了腺苷处理24 h过后的MHC-803细胞发生了凋亡。同时还发现,细胞内的Caspase-3活化片段的蛋白表达量显著增加。研究结果表明,腺苷能通过激活Caspase-3诱导凋亡,从而抑制胃癌细胞的增殖。本研究还发现内质网应激相关蛋白Caspase-4活化片段、p-JNK、CHOP、GRP78的蛋白表达水平显著上调。
内质网应激反应与细胞的凋亡关系密切,可以经过多种途径激活凋亡蛋白Caspase-3,进而促进细胞发生凋亡[12]。在细胞的内质网感受到外界的刺激时,就会引起蛋白的错误折叠。为了抵抗蛋白的错误折叠,细胞会上调GRP78蛋白来结合未折叠的蛋白,从而减少错误折叠的蛋白,这种细胞保护机制叫做未折叠蛋白反应(UPR)[13-14]。随着外界刺激的持续,未折叠的蛋白越来越多,细胞的这种保护机制克服不了内质网应激反应时,细胞凋亡就会被激活。在这过程中,未折叠蛋白反应会引起3种蛋白的表达量的上调,即IRE1,PERK和ATF6[15]。作为IRE1,PERK和ATF6的下游蛋白,Caspase-4活化片段、p-JNK和CHOP蛋白的表达量也会被激活上调,最后激活细胞的凋亡蛋白Caspase-3,导致细胞凋亡[16]。
在研究治疗肿瘤的过程中,促进其发生凋亡是一种重要的治疗方法[17]。本研究发现腺苷能通过诱导凋亡来抑制胃癌细胞的增殖,而内质网应激可能参与了腺苷诱导的凋亡。细胞凋亡的机制是复杂的,腺苷作用于胃癌细胞的机制还需要继续进一步研究。
参考文献
[1]Global Burden of Disease Cancer C, Fitzmaurice C, Dicker D, et al.The Global Burden of Cancer 2013[J].JAMA oncology, 2015, 1(4): 505-527.
[2]Ferlay J, Soerjomataram I, Dikshit R, et al.Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J].International journal of cancer Journal international du cancer, 2015, 136(5): E359-386.
[3]Deng W, Wang Q W, Zhang X T, et al.Retrospective analysis of adjuvant chemotherapy for curatively resected gastric cancer[J].World journal of gastroenterology, 2014, 20(12): 3356-3363.
[4]Yu S, Hou D, Chen P, et al.Adenosine induces apoptosis through TNFR1/RIPK1/P38 axis in colon cancer cells[J].Biochemical and biophysical research communications, 2015, 460(3): 759-765.
[5]Fredholm B B.Adenosine—a physiological or pathophysiological agent?[J].Journal of molecular medicine, 2014, 92(3): 201-206.
[6]Yang D, Song J, Wu L, et al.Induction of senescence by adenosine suppressing the growth of lung cancer cells[J].Biochemical and biophysical research communications, 2013, 440(1): 62-67.
[7]Ma Y, Zhang J, Zhang Q, et al.Adenosine induces apoptosis in human liver cancer cells through ROS production and mitochondrial dysfunction[J].Biochemical and biophysical research communications, 2014, 448(1): 8-14.
[8]Shirali S, Aghaei M, Shabani M, et al.Adenosine induces cell cycle arrest and apoptosis via cyclinD1/Cdk4 and Bcl-2/Bax pathways in human ovarian cancer cell line OVCAR-3[J].Tumour biology: the journal of the International Society for Oncodevelopmental Biology and Medicine, 2013, 34(2): 1085-1095.
[9]Tsuchiya A, Kanno T, Saito M, et al.Intracellularly transported adenosine induces apoptosis in [corrected] MCF-7 human breast cancer cells by accumulating AMID in the nucleus[J].Cancer letters, 2012, 321(1): 65-72.
[10]Kim H S, Kim J H, Kim J W, et al.Chemotherapy in Elderly Patients with Gastric Cancer[J].Journal of Cancer, 2016, 7(1): 88-94.
[11]Choi A H, Kim J, Chao J.Perioperative chemotherapy for resectable gastric cancer: MAGIC and beyond[J].World journal of gastroenterology, 2015, 21(24): 7343-7348.
[12]Rao R V, Hermel E, Castro-Obregon S, et al.Coupling endoplasmic reticulum stress to the cell death program.Mechanism of caspase activation[J].The Journal of biological chemistry, 2001, 276(36): 33869-33874.
[13]Szegezdi E, Logue S E, Gorman A M, et al.Mediators of endoplasmic reticulum stress-induced apoptosis[J].EMBO reports, 2006, 7(9): 880-885.
[14]Tabas I, Ron D.Integrating the mechanisms of apoptosis induced by endoplasmic reticulum stress[J].Nature cell biology, 2011, 13(3): 184-190.
[15]Gardner B M, Pincus D, Gotthardt K, et al.Endoplasmic reticulum stress sensing in the unfolded protein response[J].Cold Spring Harbor perspectives in biology, 2013, 5(3): a013169.
[16]Wu L F, Ye Y Q, Huang G Y, et al.Involvement of endoplasmic reticulum stress in adenosine-induced human hepatoma HepG2 cell apoptosis[J].Oncology reports, 2011, 26(1): 73-79.
[17]Goldar S, Khaniani M S, Derakhshan S M, et al.Molecular mechanisms of apoptosis and roles in cancer development and treatment[J].Asian Pacific journal of cancer prevention, 2015, 16(6): 2129-2144.
收稿日期:2015-12-16
中图分类号:R 735.2
文献标志码:A
文章编号:1672-2353(2016)13-044-04
DOI:10.7619/jcmp.201613013
Effects of adenosine on proliferation and apoptosis in human gastric cancer cell line MGC-803
GAO Wenqiang, LIU Kun, ZHOU Yan, LIU Hanyang, TANG Liming
(1.DepartmentofGastrointestinalSurgery,ChangzhouSecondPeople′sHospitalAffiliatedtoNanjingMedicalUniversity,Changzhou,Jiangsu, 213000)
ABSTRACT:ObjectiveTo explore the influence of adenosine on proliferation and apoptosis in human gastric cancer cell line MGC-803.MethodsMGC-803 cells were treated with different concentrations of adenosine (0.01~10 mmol/L), and CCK-8 was used to observe cell proliferation.Flow cytometry (FCM) was used to analyze cells apoptosis after treatment of adenosine.Apoptosis protein Caspase-3 and endoplasmic reticulum stress (ERS) related proteins (casepase-4, p-JNK, CHOP, GRP78) were detected by Western blotting.ResultsAdenosine significantly inhibited the MGC-803 cells viability in a concentration- and time-dependent manner (P<0.05).After treatment with adenosine (0.25, 0.5, 1 mmol/L) for 24 h, total apoptosis rate of cells significantly increased (P<0.01).Expression of cleaved Caspase-3 was significantly up-regulated after treatment with adenosine (P<0.01).ERS related proteins (casepase-4, p-JNK, CHOP, GRP78) were significantly up-regulated in adenosine treated group (P<0.05).ConclusionAdenosine can significantly suppress proliferation and induce apoptosis in MGC-803 cells, while endoplasmic reticulum stress is involved in adenosine-induced apoptosis.
KEYWORDS:gastric carcinoma; adenosine; proliferation; apoptosis; endoplasmic reticulum stress

