耐药肿瘤细胞中ClC-3、P-gp的表达变化及相关性
林嘉麟,施静雯,2,刘学强,余杰,徐彬,2
(1广东药学院生命科学与生物制药学院,广州510006;2广东省生物技术候选药物研究重点实验室)
耐药肿瘤细胞中ClC-3、P-gp的表达变化及相关性
林嘉麟1,施静雯1,2,刘学强1,余杰1,徐彬1,2
(1广东药学院生命科学与生物制药学院,广州510006;2广东省生物技术候选药物研究重点实验室)
目的 观察电压门控氯通道3(ClC-3)、P-糖蛋白(P-gp)在耐药肿瘤细胞中的表达变化,并探讨其相关性。方法 提取人肝癌细胞株BEL-7402及其氟尿嘧啶耐药株BEL-7402/FU、人结肠癌细胞株HCT-8及其紫杉醇耐药株HCT-8/T的总RNA和蛋白,用荧光定量PCR法检测细胞ClC-3和多药耐药基因1(MDR1)mRNA的表达,Western blotting法检测细胞ClC-3和P-gp蛋白的表达,采用线性相关分析ClC-3和P-gp蛋白表达的相关性。结果
耐药细胞BEL-7402/FU和HCT-8/T中ClC-3和P-gp的mRNA和蛋白水平都明显高于相对应的非耐药细胞BEL-7402和HCT-8(P均<0.05),在耐药肿瘤细胞中,ClC-3与P-gp蛋白表达呈正相关(r=0.98,P<0.05)。结论ClC-3、P-gp在耐药肿瘤细胞中呈高表达,二者表达水平呈正相关关系。
肝肿瘤;结肠肿瘤;电压门控氯通道3;P-糖蛋白;肿瘤细胞;耐药性
电压门控氯通道3(ClC-3)普遍存在于哺乳动物细胞中,可能是容积激活性氯通道的通道蛋白或调节者[1],对维持细胞增殖和分化等多种生理功能发挥重要作用。近年来研究发现,在宫颈癌、乳腺癌和膀胱癌组织中ClC-3的表达都远高于正常组织[2,3]。在肿瘤化疗应用过程中,多药耐药是制约化疗成功的主要原因之一。P-糖蛋白(P-gp)是多药
耐药基因1(MDR1)的蛋白产物,同时,P-gp也与容积激活性氯通道密切相关,参与了该通道的调控[4,5]。ClC-3与P-gp之间也可能有密切关系。2014年10月~2015年4月,本研究观察耐药和非耐药肿瘤细胞中ClC-3和P-gp的表达变化,并探讨二者的关系。
1 材料与方法
1.1 材料 人肝癌细胞非耐药株BEL-7402、人结肠癌细胞非耐药株HCT-8(本实验室保存),人肝癌氟尿嘧啶耐药株BEL-7402/FU、人结肠癌紫杉醇耐药株HCT-8/T(南京凯基生物公司),胎牛血清、RPMI1640培养液(美国Gibco公司),总RNA提取试剂TRIzol(美国Invitrogen公司),ClC-3、MDR1、β-actin引物(上海英潍捷基公司),细胞裂解液、BCA蛋白浓度测定试剂盒、小鼠抗人GAPDH单抗、HRP标记的山羊抗兔或山羊抗小鼠二抗(碧云天生物技术研究所),兔抗人ClC-3多抗(英国Abcam公司),兔抗人P-gp多抗(美国GeneTex公司),化学发光试剂和PVDF膜(美国Bio-Rad公司),反转录试剂盒和实时荧光定量PCR试剂盒(广州美津生物技术有限公司)。
1.2细胞培养 BEL-7402、HCT-8、BEL-7402/FU和HCT-8/T均培养于含10%胎牛血清的RPMI 1640培养液,BEL-7402/FU加氟尿嘧啶20 μg/mL,HCT-8/T加入紫杉醇1 μg/mL,于37℃、5%的CO2培养箱中进行常规培养,取对数生长期细胞进行实验。
1.3肿瘤细胞中ClC-3、MDR1 mRNA表达检测采用荧光定量PCR法。收集对数生长期的4种细胞,按TRIzol试剂和反转录试剂盒说明书提取细胞总RNA,并反转录为cDNA。以cDNA为模板,应用荧光定量PCR试剂盒进行扩增。ClC-3上游引物5′-TTGCCTACTATCACCACGAC-3′,下游引物5′-GCATCTCCAACCCATTTACT-3′;MDR1上游引物5′-CAGAGGGGATGGTCAGTGTT-3′,下游引物5′-CGTGGTGGCAAACAATACAG-3′;β-Actin作为内参照,上游引物5′-GATGAGATTGGCATGGCTTT-3′,下游引物5′-CACCTTCACCGTTCCAGTTT-3′。PCR反应体系:THUNDERBIRD SYBR qPCR Mix 10 μL,上下游引物各2 μL,cDNA模板3 μL。反应条件:95℃60 s、95℃15 s、60℃15 s、72℃45 s,共40个循环。应用Bio-Rad MiniOpticonTM System进行数据分析,以2-ΔΔCt公式计算目的基因的相对表达量。
1.4肿瘤细胞中ClC-3、P-gp蛋白表达检测 采用Western blotting法。细胞培养至80%融合时,弃培养上清液,用冰冷的PBS漂洗细胞两次,加入细胞裂解液冰上裂解10 min,离心取上清液,蛋白浓度用BCA法测定,蛋白用10%SDS-PAGE电泳分离,并电转移至PVDF膜。5%脱脂奶粉封闭2 h,分别加入ClC-3和P-gp兔抗人多抗及GADPH小鼠抗人单抗,4℃孵育过夜;TBS洗膜后,加入相应二抗室温孵育2 h;TBS洗膜,加入化学发光试剂,X线胶片曝光、显影和定影;扫描胶片,采用Image J软件分析,以目的条带与内参条带灰度值之比表示ClC-3和P-gp的蛋白相对表达量。
1.5统计学方法 采用SPSS17.0统计软件。计量资料以±s表示,组间比较采用t检验;采用线性相关分析耐药肿瘤细胞中ClC-3与P-gp表达水平的相关性。P<0.05为差异有统计学意义。
2 结果
2.1各类细胞中ClC-3、MDR1 mRNA表达比较
耐药细胞BEL-7402/FU、耐药细胞HCT-8/T中ClC-3、MDR1 mRNA相对表达量均高于相对应的非耐药细胞BEL-7402、非耐药细胞HCT-8(P均<0.05)。见表1。
表1 各类细胞中ClC-3、MDR1 mRNA相对表达量比较(±s)
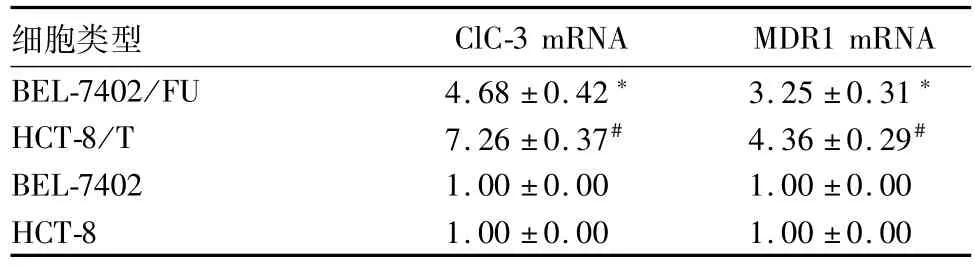
表1 各类细胞中ClC-3、MDR1 mRNA相对表达量比较(±s)
注:与BEL-7402比较,*P<0.05;与HCT-8比较,#P<0.05。
细胞类型ClC-3 mRNAMDR1 mRNA BEL-7402/FU4.68±0.42*3.25±0.31*HCT-8/T7.26±0.37#4.36±0.29#BEL-74021.00±0.001.00±0.00 HCT-81.00±0.001.00±0.00
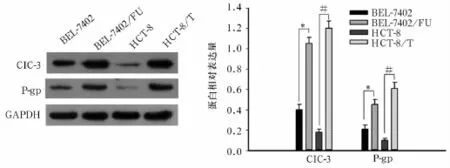
图1 各类细胞中ClC-3、P-gp蛋白表达水平
2.2各类细胞中ClC-3、P-gp蛋白表达比较 耐药细胞BEL-7402/FU、耐药细胞HCT-8/T中ClC-3、P-gp蛋白相对表达量均高于相对应的非耐药细胞BEL-7402、非耐药细胞HCT-8(P均<0.05)。见图1、表2。
表2 各类细胞中ClC-3、P-gp蛋白相对表达量比较(±s)
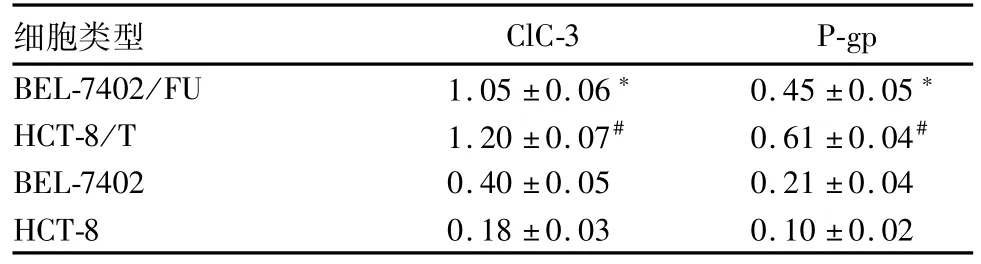
表2 各类细胞中ClC-3、P-gp蛋白相对表达量比较(±s)
注:与BEL-7402比较,*P<0.05;与HCT-8比较,#P<0.05。
细胞类型ClC-3P-gp BEL-7402/FU1.05±0.06*0.45±0.05*HCT-8/T1.20±0.07#0.61±0.04#BEL-74020.40±0.050.21±0.04 HCT-80.18±0.030.10±0.02
2.3耐药肿瘤细胞中ClC-3与P-gp蛋白表达的相关性 在耐药肿瘤细胞中,ClC-3与P-gp蛋白表达呈正相关(r=0.98,P<0.05)。
3 讨论
ClC-3是电压门控性氯离子通道家族的成员,近年来研究发现,其不仅参与细胞增殖、分化和迁移等生理过程,在肿瘤细胞的生命活动中也起着重要作用[6]。研究发现,ClC-3参与了紫杉醇诱导的鼻咽癌细胞CNE-2Z早期凋亡的过程[7]。过表达ClC-3能显著抑制毒胡萝卜内酯诱导的鼠嗜铬细胞瘤PC12细胞凋亡,下调ClC-3的表达则促进细胞凋亡[8]。ClC-3可不依赖于其离子通道属性促进与肿瘤转移相关的细胞膜皱褶形成,在肿瘤转移中扮演关键性的角色[9]。本研究结果显示,肝癌和结肠癌细胞中都表达ClC-3,而且耐药细胞株的表达水平明显高于非耐药细胞株。应用siRNA抑制ClC-3的表达,可抑制人胶质瘤U251细胞自噬而增强顺铂对细胞的毒性[10];相反,当顺铂作用于稳定增加ClC-3表达的宫颈癌细胞HeLa时,对该细胞增殖的抑制作用显著降低[11]。可见,多种组织来源肿瘤的研究结果都显示ClC-3高表达在诱导肿瘤细胞耐药中起重要作用。
目前癌症治疗失败的原因主要在于肿瘤的转移,其次就是肿瘤耐药[12],而多药耐药则是大部分肿瘤细胞对化疗药物产生耐药性的主要机制。P-gp是MDR1编码的胞膜糖蛋白,当药物进入细胞后,同药物分子结合,同时其ATP位点结合ATP后释放能量使药物转移到细胞外,从而使细胞内药物浓度始终维持在低水平,由此获得耐药性[13]。本研究证实,肝癌和结肠癌的耐药细胞株MDR1基因及其表达产物P-gp的表达水平均明显高于非耐药细胞株,故认为高表达P-gp是其产生耐药的原因。耐药细胞同时高表达ClC-3和P-gp,且ClC-3和P-gp的表达呈正相关,说明两者之间可能是一种正向调控,但究竟是ClC-3还是P-gp处于调控的上游,需进行进一步研究。
综上所述,ClC-3在肿瘤细胞耐药中起重要作用,可能与调控P-gp的表达有关,但其确切的调控方式有待于进一步研究探讨。
[1]Yin Z,Tong Y,Zhu H,et al.ClC-3 is required for LPA-activated Cl-current activity and fibroblast-to-myofibroblast differentiation[J].Am J Physiol Cell Physiol,2008,294(2):C535-C542.
[2]Hong S,Bi M,Wang L,et al.CLC-3 channels in cancer[J].Oncol Rep,2015,33(2):507-514.
[3]汪岩,康劲松,王心蕊,等.膀胱移行细胞癌的ClC-3和NF-κB的表达及意义[J].吉林大学学报:医学版,2007,33(1):135-137.
[4]陈丽新,王立伟,Jacob T.MDR1基因在睫状体色素上皮细胞容积激活性氯电流中的作用[J].生理学报,2002,53(1):1-6.
[5]Altenberg GA.The multidrug resistance protein P-glycoprotein and the regulation of chloride channels[J].Leuk Res,2005,29(9):983-984.
[6]Li M,Wu DB,Wang J.Effects of volume-activated chloride channels on the invasion and migration of human endometrial cancer cells[J].Eur J Gynaecol Oncol,2013,34(1):60-64.
[7]Zhang H,Li H,Yang L,et al.The ClC-3 chloride channel associated with microtubules is a target of paclitaxel in its induced-apoptosis[J].Sci Rep,2013(3):2615.
[8]Zhang HN,Zhou JG,Qiu QY,et al.ClC-3 chloride channel prevents apoptosis induced by thapsigargin in PC12 cells[J].Apoptosis,2006,11(3):327-336.
[9]Xu B,Jin X,Min L,et al.Chloride channel-3 promotes tumor metastasis by regulating membrane ruffling and is associated with poor survival[J].Oncotarget,2015,6(4):2434-2450.
[10]Su J,Xu Y,Zhou L,et al.Suppression of chloride channel 3 expression facilitates sensitivity of human glioma U251 cells to cisplatin through concomitant inhibition of Akt and autophagy[J].Anat Rec,2013,296(4):595-603.
[11]王施思,杨清松,施静雯,等.稳定表达ClC-3对宫颈癌细胞顺铂敏感性的影响及其机制[J].肿瘤,2014,34(10):888-893.
[12]Simpson NE,Lambert WM,Watkins R,et al.High levels of Hsp90 cochaperone p23 promote tumor progression and poor prognosis in breast cancer by increasing lymph node metastases and drug resistance[J].Cancer Res,2010,70(21):8446-8456.
[13]Abraham I,El Sayed K,Chen ZS,et al.Current status on marine products with reversal effect on cancer multidrug resistance[J].Mar Drugs,2012,10(10):2312-2321.
ClC-3 and P-gp expression and their correlation in drug-resistant tumor cells
LIN Jialin1,SHI Jingwen,LIU Xueqiang,YU Jie,XU Bin
(1 Guangdong Pharmaceutical University,Guangzhou 510006,China)
Objective To observe the expression changes of voltage-gated chloride channel 3(ClC-3)and P-glycoprotein(P-gp)in drug-resistant tumor cells,and to explore their correlation.Methods Total RNAs and proteins were isolated from human hepatic cancer cell line BEL-7402 and fluorouracil-resistant cell line BEL-7402/FU,human colonic cancer cell line HCT-8 and paclitaxel-resistant cell line HCT-8/T.The expression levels of ClC-3 and multidrug resistance 1(MDR1)mRNAs were assessed by real-time fluorescence quantitative PCR,the expression levels of ClC-3 protein and P-gp were determined by Western blotting.Linear correlational analysis method was used to analyze the correlation of ClC-3 protein and P-gp.Results With regarded to comparison between BEL-7402 and BEL-7402/FU as well as between HCT-8 and HCT-8/T,the expression levels of MDR1 and ClC-3 mRNA and P-gp and ClC-3 protein were significantly higher in drug-resistant cells than non-resistant cells(all P<0.05).ClC-3 protein and P-gp expression levels were positively correlated with each other(r=0.98,P<0.05).Conclusion The ClC-3 and P-gp is highly expressed in drug-resistant tumor cells,and their expression levels are positively correlated.
liver neoplasms;colonic neoplasms;voltage-gated chloride channel 3;P-glycoprotein;tumor cells;drug resistance
10.3969/j.issn.1002-266X.2016.21.005
R73-3
A
1002-266X(2016)21-0013-03
国家自然科学基金资助项目(81101666)。
林嘉麟(1991-),男,硕士,主要研究方向为氯离子通道与肿瘤耐药。E-mail:galuen@sina.com
简介:徐彬(1975-),女,副教授,博士,主要研究方向为离子通道转化医学。E-mail:xubin2003@163.com
(2016-01-14)

