利格列汀对体外高糖诱导后人肾小管上皮细胞E-cadherin、α-SMA表达的影响及机制
孙蔚楠,朱清,阎磊,邵凤民
(河南省人民医院,郑州450003)
利格列汀对体外高糖诱导后人肾小管上皮细胞E-cadherin、α-SMA表达的影响及机制
孙蔚楠,朱清,阎磊,邵凤民
(河南省人民医院,郑州450003)
目的 探讨利格列汀对体外高糖诱导后人肾小管上皮细胞钙黏附蛋白E(E-cadherin)、肌动蛋白α(α-SMA)表达的影响及机制。方法 将体外培养的人肾小管上皮细胞(HK-2细胞)随机分为正常对照组、高糖组、高糖+Wnt4 siRNA组、高糖+β-catenin siRNA组、高糖+利格列汀组,高糖+Wnt4 siRNA组、高糖+β-catenin siRNA组分别转染siRNA沉默Wnt4、β-catenin,12 h后与高糖组、高糖+利格列汀组同时加入D-葡萄糖(葡萄糖终浓度为30 mmol/L),高糖+利格列汀组同时加入利格列汀(终浓度10 μmol/L),继续培养48 h。采用Western blotting法检测各组E-cadherin、α-SMA、Wnt4、β-catenin蛋白表达,倒置显微镜观察细胞形态学改变,测定细胞长与宽比值。结果 与正常对照组比较,高糖组E-cadherin表达下调、α-SMA、Wnt4、β-catenin表达上调(P均<0.05);与高糖组比较,高糖+Wnt4 siRNA组、高糖+β-catenin siRNA组、高糖+利格列汀组E-cadherin表达上调、α-SMA表达下调(P均<0.05)。高糖组细胞由卵圆形伸长呈梭形,高糖+利格列汀组细胞由卵圆形向梭形改变程度减轻。高糖组细胞长/宽较正常对照组、高糖+利格列汀组升高(P均<0.05)。结论 利格列汀可部分抑制体外高糖诱导的人肾小管上皮细胞E-cadherin表达下调、α-SMA表达上调,其机制可能与Wnt4/β-catenin通路有关。
利格列汀;肾小管上皮细胞;钙黏附蛋白E;肌动蛋白α;Wnt4/β-catenin通路
高糖可通过多种途径诱导肾小管上皮细胞-间充质转分化(EMT),并最终导致肾小管间质纤维化(TIF)的发生[1]。利格列汀是目前临床常用的新型降糖药二肽基肽酶(DPP-4)抑制剂之一,具有降糖效果佳、安全性高、适应证广等优点[2,3]。最新研究表明利格列汀具有抑制EMT及TIF的作用[4]。2015年6~11月,本研究探讨利格列汀对体外高糖诱导后肾小管上皮细胞钙黏附蛋白E(E-cadherin)、肌动蛋白α(α-SMA)表达的影响及机制。
1 材料与方法
1.1材料 利格列汀片(欧唐宁,5 mg/片,Boe-
hringer Ingelheim Pharmaceuticals公司),人近端肾小管上皮细胞系(HK-2细胞系,ATCC公司),胎牛血清(FBS,Hyclone公司),DMEM/F12培养液(Invitrogen公司),0.25%胰蛋白酶、D-甘露醇、D-葡萄糖(Sigma公司),Wnt4 siRNA、β-catenin siRNA(北京中杉金桥生物技术有限公司),转染试剂lipofectamineTM2000(Invitrogen公司),E-cadherin多克隆抗体(Abcam公司),a-SMA、Wnt4、β-catenin多克隆抗体(Santa cruz公司),HRP标记山羊抗兔、抗小鼠IgG(中国碧云天公司)。
1.2细胞培养及处理 HK-2细胞复苏后,以含10%FBS的DMEM/F12培养液于37℃、5%CO2条件下培养。细胞长满后,用0.25%胰酶消化,将HK-2细胞以1×105/mL接种于T25培养瓶,按照以下方式分组培养:正常对照组、高糖诱导组、高糖+Wnt4 siRNA组、高糖+β-catenin siRNA组、高糖+利格列汀组。培养方法:DMEM/F12 10%FBS培养细胞生长至约30%亚融合后,改用无血清DMEM/F12培养液;高糖+Wnt4 siRNA组、高糖+ β-catenin siRNA组用lipofectamineTM2000转染siRNA,转染步骤按说明书进行操作,siRNA终浓度为100 nmol/L,将siRNA/lipofectamineTM2000复合物加入T25培养瓶中轻柔摇晃使其混匀,在CO2培养箱中37℃孵育12 h;正常对照组、高糖组、高糖+利格列汀组同步无血清培养12 h;之后各组同时更换DMEM/F12 10%FBS培养液,除正常对照组外均加入D-葡萄糖,使培养液中葡萄糖终浓度为30 mmol/L,高糖+利格列汀组同时加入利格列汀(终浓度10 μmol/L),继续培养48 h。
1.3HK-2细胞形态学观察 各组细胞经PBS洗涤后用倒置显微镜拍照观察细胞形态学改变,每组随机测量100个细胞,测定细胞长与宽的比值,取其平均值。
1.4 细胞中E-cadherin、a-SMA、Wnt4、β-catenin蛋白表达检测 采用Western blotting法。收集各组HK-2细胞,加入适量裂解液,超声破碎仪裂解细胞,12 000 r/min×30 min离心,提取总蛋白,BCA法测定蛋白浓度。取50~100 μg蛋白质上样行聚丙烯酰胺-SDS凝胶电泳,电泳后用电转移仪转移到硝酸纤维素膜上。剪取相应条带,加入相应的一抗4℃过夜,TBST洗膜后加入辣根过氧化物酶标记的二抗室温孵育1~2 h,充分洗涤,应用ECL化学发光试剂显色,X片显影。以β-actin为内参照,应用吸光度值分析软件进行条带分析,用目的蛋白灰度值与内参灰度值的比值代表蛋白相对表达量。
1.5统计学方法 采用SPSS11.0统计软件。计量资料用±s表示,多组比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1各组E-cadherin、α-SMA、Wnt4、β-catenin蛋白表达比较 见表1。
表1 各组E-cadherin、α-SMA、Wnt4、β-catenin蛋白相对表达量比较(±s)
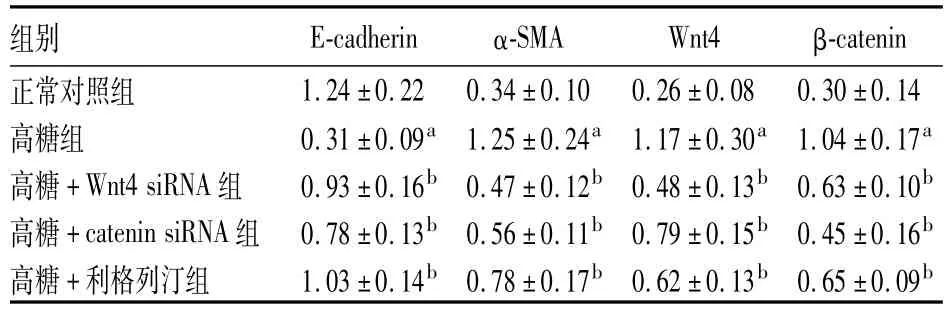
表1 各组E-cadherin、α-SMA、Wnt4、β-catenin蛋白相对表达量比较(±s)
注:与正常对照组比较,aP<0.05;与高糖组比较,bP<0.05。
组别E-cadherinα-SMAWnt4β-catenin正常对照组1.24±0.220.34±0.100.26±0.080.30±0.14高糖组0.31±0.09a1.25±0.24a1.17±0.30a1.04±0.17a高糖+Wnt4 siRNA组0.93±0.16b0.47±0.12b0.48±0.13b0.63±0.10b高糖+catenin siRNA组0.78±0.13b0.56±0.11b0.79±0.15b0.45±0.16b高糖+利格列汀组1.03±0.14b0.78±0.17b0.62±0.13b0.65±0.09b
2.2各组细胞形态学变化 镜下观察见正常对照组HK-2细胞形态为卵圆形;高糖组给予高糖刺激48 h后细胞发生形态学改变,由卵圆形伸长呈梭形;高糖+利格列汀组细胞形态由卵圆形向梭形改变的程度减轻。正常对照组、高糖组、高糖+Wnt4 siRNA组、高糖+β-catenin siRNA组、高糖+利格列汀组细胞长/宽值分别为1.38±0.41、4.47±1.12、2.84±0.72、3.11±0.65、2.62±0.73,高糖组细胞长/宽较正常对照组、高糖+利格列汀组升高(P均<0.05)。
3 讨论
研究表明,在体外可通过高糖诱导肾小管EMT,形态学上表现为肾小管上皮细胞由正常的卵圆形伸长成梭形,分子水平则表现为肾小管上皮细胞标志物如E-cadherin等的下调及间充质标志物α-SMA、Vimentin、Fibronectin等表达增加[5,6]。利格列汀作为DPP-4抑制剂类降糖药的代表药物之一,因其降糖效果佳及多重肾脏保护作用而成为近年来研究的热点。因此,我们通过在体外构建高糖诱导肾小管上皮细胞转分化模型并应用利格列汀干预来进行相关研究。
Wnt/β-catenin信号调节EMT的作用已得到广泛认可。Wnt蛋白属于高度保守的分泌生长因子家族,β-catenin是Wnt家族的核心下游因子。Wnt/βcatenin信号调节EMT的作用已在器官发育和肿瘤转移方面得到多项研究的证实[7],也有研究表明其可能参与了肾间质纤维化的发生[8],然而其在糖尿病肾病肾小管上皮细胞EMT中的作用仍有待进一步研究。近期研究显示,Wnt4及下游β-catenin信号参与介导了甲状旁腺激素诱导的肾小管EMT[9];另有研究表明β-catenin作为细胞骨架蛋白是细胞连接的重要组成部分,与E-cadherin等黏附因子共同参与细胞连接的构建,而病理状态下未磷酸化的β-catenin在胞质及核内异常聚集,并与转录因子TCF/LEF家族成员结合,促使其下游EMT相关基因的表达,促进EMT的发生[10~12]。
本研究在体外建立了高糖诱导的HK-2细胞EMT模型,在高糖诱导下可见HK-2细胞由卵圆形伸长成梭形,上皮标志物E-cadherin表达下调和间充质标志物α-SMA表达上调,以上结果表明HK-2细胞在高糖诱导下由上皮表型向间充质表型转分化。另外,我们发现高糖诱导HK-2细胞Wnt4及β-catenin表达上调,而Wnt4 siRNA/β-catenin siRNA可部分抑制高糖诱导的HK-2细胞表型转化,表现为与高糖诱导组相比,Wnt4 siRNA及β-catenin siRNA干预后E-cadherin表达上调和α-SMA表达下调,结果表明Wnt4/β-catenin可能参与了高糖诱导的EMT发生。
本研究同时观察了利格列汀对高糖诱导下的HK-2细胞表型转化的影响,结果显示利格列汀能够抑制HK-2细胞由卵圆形伸长成梭形,上调E-cadherin的表达并抑制α-SMA表达,表明利格列汀可部分抑制高糖诱导的肾小管EMT。另外,研究结果表明利格列汀干预后可部分减轻高糖诱导下HK-2细胞Wnt4及β-catenin的表达上调。糖尿病肾病TIF及EMT是多种病理因素诱导下的动态复杂过程,而利格列汀的肾脏保护作用亦可能存在着多种机制。然而,该研究结果表明抑制多种病理因素下促EMT信号分子Wnt4和β-catenin的表达增加可能是利格列汀抑制EMT及延缓肾间质纤维化的重要机制之一。
[1]Yung S,Lee CY,Zhang Q,et al.Elevated glucose induction ofthrombospondin-l up-regulates fibronectin synthesis in proximal renal tubular epithelial cells through TGF-beta1 dependent and TGF-beta1 independent pathways[J].Nephrol Dial transplant,2006,21(6):1504-1513.
[2]Forst T,Uhlig-Laske B,Ring A,et al.The oral DPP-4 inhibitor linagliptin significantly lowers HbAlc after 4 weeks of treatment in patients with type 2 diabetes mellitus[J].Diabetes Obes Metab,2011,13(6):542350.
[3]Graefe-Mody U,Friedrieh C,Port A,et al.Renal impairment has no relevant effect on long-term exposure of linagliptin in patients with 2 diabetes mellitus[J].Diabetes Obes Metab,2011,13(10):939-946.
[4]Zeisberg M,Zeisberg EM.Evidence for antifibrotic incretin-independent effects of the DPP-4 inhibitor linagliptin[J].Kidney Int,2015,88(3):429-431.
[5]张飞飞,谭若云,熊明霞,等.高糖通过转化生长因子β1-Smad信号传递途径诱导肾小管上皮细胞转分化[J].中华肾脏病杂志,2008,24(3):174-178.
[6]Lv ZM,Wang Q,Wan Q,et al.The role of the p38 MAPK signaling pathway in high glucose-induced epithelial-mesenchymal transition of cultured human renal tubular epithelial cells[J].PLoS One,2011,6(7):e22806.
[7]Wu Y,Zhou BP.New insights of epithelialmesenchymal transition in cancer metastasis[J].Acta Biochim Biophys Sin,2008,40(7):643-650.
[8]He W,Dai C,Li Y,et al.Wnt/beta-catenin signaling promotes renal interstitial fibrosis[J].J Am Soc Nephrol,2009,20(4):765-776.
[9]Guo Y,Li Z,Ding R,et al.Parathyroid hormone induces epithelial-to-mesenchymal transition via the Wnt/β-catenin signaling pathway in human renal proximal tubular cells[J].Int J Clin Exp Pathol,2014,7(9):5978-5987.
[10]Yoshino J,Monkawa T,Tsuji M,et al.Snail1 is involved in the renal epithelial-mesenchymal transition[J].Biochem Biophys Res Commun,2007,362(1):63-68.
[11]Graham TR,Zhau HE,Odero-Marah VA,et al.Insulin-like growth factor-I-dependent up-regulation of ZEB1 drives epithelialto-mesenchymal transition in human prostate cancer cells[J].Cancer Res,2008,68(7):2479-2488.
[12]Kida Y,Asahina K,Teraoka H,et al.Twist relates to tubular epithelialmesenchymal transition and interstitial fibrogenesis in the obstructed kidney[J].J Histochem Cytochem,2007,55(7):661-673.
10.3969/j.issn.1002-266X.2016.21.012
R977.1
A
1002-266X(2016)21-0033-03
(2016-01-16)

