P27和Stathmin在宫颈癌组织中的表达及其相互关系
马海浓 方来福 刘敏杰.宁波市第二医院妇科,浙江宁波5040;2.宁波市鄞州人民医院病理科,浙江宁波5040;.宁波市鄞州人民医院妇产科,浙江宁波5040
P27和Stathmin在宫颈癌组织中的表达及其相互关系
马海浓1方来福2▲刘敏杰3
1.宁波市第二医院妇科,浙江宁波315040;2.宁波市鄞州人民医院病理科,浙江宁波315040;3.宁波市鄞州人民医院妇产科,浙江宁波315040
目的探讨宫颈癌组织中P27蛋白和Stathmin蛋白的表达及其相互关系。方法应用免疫组织化学方法检测P27蛋白和Stathmin蛋白在40例正常宫颈组织、40例宫颈上皮内瘤变(Cervical Intraepithelial Neoplasia,CIN)组织和60例宫颈癌组织中的表达水平。结果P27蛋白在正常宫颈组织、CIN组织和宫颈癌组织中阳性表达率分别为87.5%、77.5%和50.0%,三组之间差异有统计学意义(χ2=17.732,P<0.05),Stathmin蛋白在正常宫颈组织、CIN组织和宫颈癌组织中阳性表达率分别为17.5%、52.5%和86.7%,三组之间差异有统计学意义(χ2=67.1,P<0.05)。P27和Stathmin蛋白表达与患者的年龄无关(P>0.05),P27和Stathmin蛋白的表达与宫颈癌的组织学分化程度、有无淋巴结转移和临床分期有明显的相关性(P<0.05)。宫颈癌中Stathmin蛋白表达与P27蛋白表达呈负相关(r=-1,P<0.05)。结论P27蛋白和Stathmin蛋白检测可作为宫颈癌诊断中的一组肿瘤标记物,Stathmin蛋白可通过抑制P27蛋白的表达,促进宫颈癌的发生发展。
Stathmin;P27;CIN;宫颈癌;免疫组化
在全球女性肿瘤中宫颈癌发病率占第二位、死亡率占第三位,在欠发达国家其发病率居第一位。2012年新报告的宫颈癌约527 600例,死亡265 700例,占女性新发癌症病例的15%[1]。大部分早期宫颈癌可通过手术切除或放疗达到临床治愈,但比较晚期宫颈癌的临床治疗效果并不太理想。寻找并发现宫颈癌演变过程中相关的肿瘤敏感指标,对阻止宫颈癌癌前病变的继续发展,并在临床早期诊断、治疗和预后判断中都起到十分重要的指导意义。
P27蛋白属于细胞周期蛋白依赖性蛋白激酶抑制因子(CD-KI)家族的成员之一[2],研究显示P27蛋白的低表达与肿瘤的预后不良有关[3-4]。Stathmin是普遍存在于脊椎动物细胞中的一种高度保守的蛋白,大多定位于细胞浆中,该蛋白作为细胞信号转导分子,在细胞的增殖、组织再生、分化及发育中起重要作用,特别在恶性肿瘤的发生、发展及决定表型方面均具有十分重要的作用及意义[2,5]。已有研究表明,Stathmin基因及其表达的产物是恶性肿瘤生物治疗中的一个新热点[6]。
1 资料与方法
1.1一般资料
收集本院2013年1月~2015年7月手术切除宫颈癌及宫颈活检标本共140例,其中宫颈鳞状细胞癌组织60例,按组织学分化程度分为:高分化24例、中分化20例和低分化16例;按FIGO临床分期(2000年版)[7]分为:Ⅰ期31例、Ⅱ期25例和Ⅲ期4例;有淋巴结转移22例和无淋巴结转移38例。宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)组织40例:CINⅢ级组织14例、CINⅡ级组织13例和CINⅠ级组织13例。正常宫颈组织40例。所有宫颈癌患者术前均未接受化疗或放疗,年龄25~67岁,中位年龄50岁,平均(51.0±9.2)岁。所有病例的病理诊断数据均经证实,并附有一份完整的病理资料。
1.2试剂与方法
1.2.1主要仪器和试剂切片机型号:俫卡RM2235,烤片仪型号:上海跃进医疗器械有限公司电热恒温鼓风干燥箱GZX-GF101-1-BS-Ⅱ,孵育箱型号:上海跃进医疗器械有限公司电热恒温鼓风干燥箱PYX-DHS-400-LBS-Ⅱ,热修复仪器型号:富士宝IH-S193A。Stathmin抗体购自英国AbD Serotec公司,Batch NO:110213;免疫组织化学SP法试剂盒和P27抗体购自北京中杉生物技术有限公司,并提供操作步骤,中杉公司P27抗体批号:14620807,中杉公司即用型广谱二抗批号:14G34D08。
1.2.2方法应用免疫组织化学SP法来检测P27和Stathmin蛋白。实验步骤:①用阳离子片捞取3μm石蜡切片65℃烤片过夜;②脱蜡、水化;③用3%H2O2灭活内源性过氧化物酶10 min;④用PBS冲洗3道后EDTA pH=9.0抗原热修复20 min;⑤PBS冲洗3道后羊血清工作液室温下封闭10 min;⑥倾去血清加一抗室温孵育1 h;⑦PBS冲洗3道后即用型广谱二抗室温孵育25 min;⑧PBS冲洗3道后用型DAB显色液显色10 min;⑨苏木素复染、蓝化、梯度酒精脱水、干燥、二甲苯透明和中性树胶封片,具体操作过程严格按照说明进行。阴性对照用PBS代替一抗染色,阳性对照用预实验染色阳性片进行,每个组织蜡块的连续切片做一张HE染色,用于免疫组织化学阳性染色部位的定位分析和对照判定。
1.3结果判断
结果参照许良中等[8]的免疫组织化学染色方法进行判断,随机选择10个400倍视野,采用双盲法综合判断组织切片中染色阳性的细胞着色强度和阳性细胞所占百分比两项参数,在显微镜下半定量判定染色结果。全部组织染色切片都由两位病理诊断医生阅片2次,以确保染色判定结果的一致性。
1.3.1Stathmin蛋白染色(1)Stathmin蛋白染色主要定位于细胞浆上,评分标准如下[9]:肿瘤显色深浅按:a.基本不着色,0分;b.色淡,1分;c.色中,2分;d.色深,3分。(2)阳性细胞百分率:①无着色,0分;②<30%,为1分;③30%~60%,为2分;④>60%,为3分。两者相加得分0~2分为阴性(-);3~4分为阳性(1+);5~6分为强阳性(2+)。
1.3.2P27蛋白染色P27蛋白染色主要定位于细胞核上。评分标准如下[10]:(1)阳性细胞百分率:a.<5%,0分;b.5%~25%,1分;c.25%~50%,2分;d.≥50%,3分。(2)肿瘤显色深浅按:a.基本不着色,0分;b.色淡,1分;c.色中,2分;d.色深,3分。两者相加得分0~2分为阴性(-);3~4分为阳性(1+);5~6分为强阳性(2+)。
1.4统计学处理
采用SPSS 21.0统计学软件进行数据分析,计数资料以百分比(%)表示,采用χ2检验,Spearman等级相关进行相关性分析,采用双侧检验,检验水准为α= 0.05,P<0.05为差异有统计学意义。
2 结果
2.1P27蛋白表达情况
P27蛋白在正常宫颈组织中弱阳性率20.0%(8/40),强阳性率67.5%(27/40);在CIN组织中弱阳性率40.0%(16/40),强阳性率37.5%(15/40);宫颈癌组织中弱阳性率28.3%(17/60),强阳性率21.7%(13/60),三组比较差异有统计学意义(χ2=17.732,P<0.05),而CIN组与正常宫颈组比较,差异无统计学意义(χ2=1.385,P>0.05)。见表1、图1。
2.2P27蛋白与宫颈癌不同临床病理特征的关系
由表2中可见P27蛋白在高分化宫颈癌组织的表达(18/24,75.00%)明显高于中分化癌(9/20,45.00%)和低分化癌(3/16,18.75%)(χ2=15.283,P<0.05);在宫颈癌组织中无淋巴结转移比例(25/38,65.80%)明显高于有淋巴结转移(5/22,22.70%)(χ2=13.079,P<0.05);在Ⅰ期宫颈癌(20/31,64.50%)的表达要明显高于Ⅱ+Ⅲ期宫颈癌(10/29,34.50%)(χ2=11.446,P<0.05);而与宫颈癌患者的年龄无关(χ2=0.341,P>0.05)。

表1 P27蛋白在正常宫颈组织、宫颈上皮内瘤变(CIN)组织和宫颈癌中表达情况[n(%)]
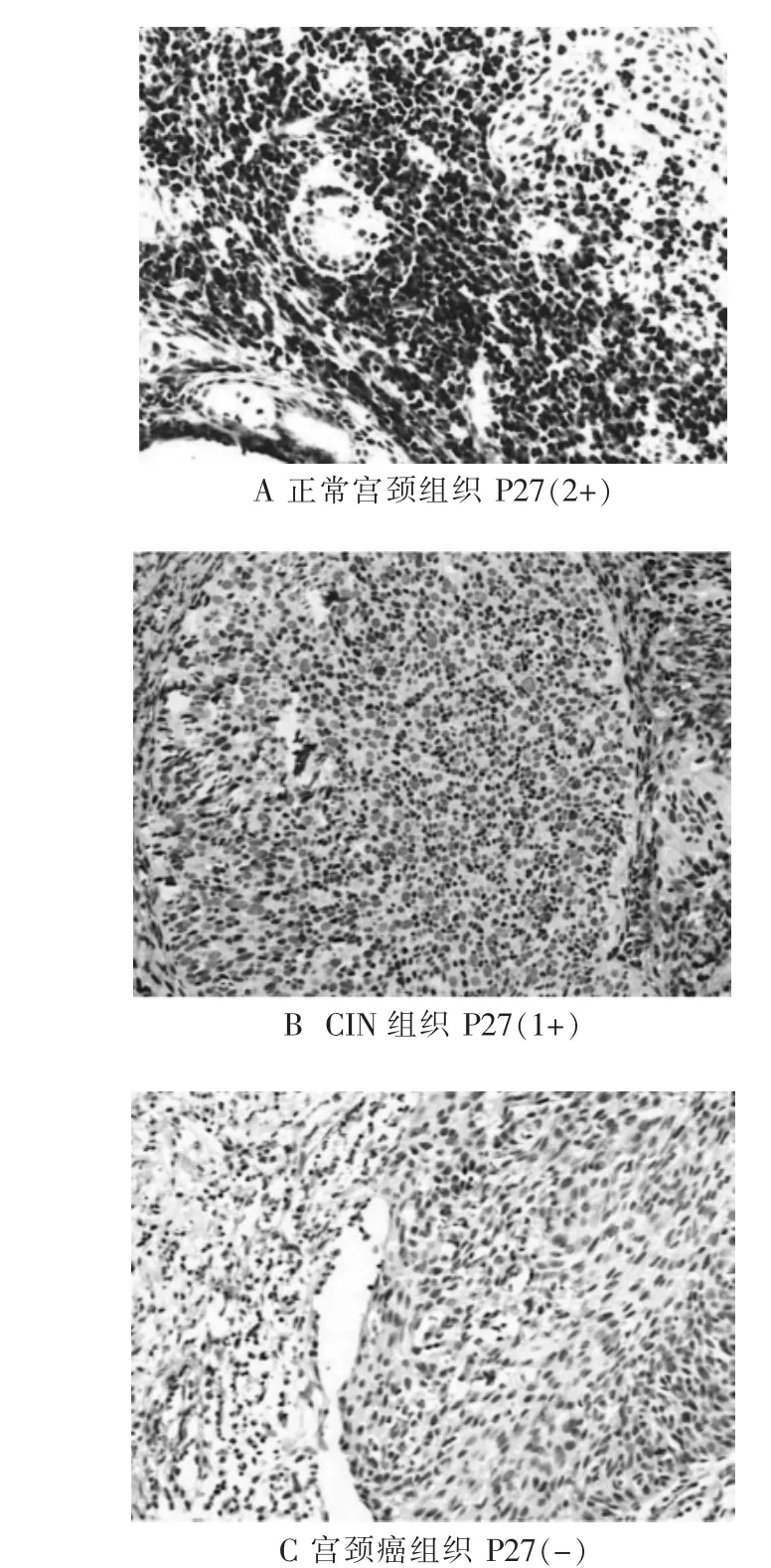
图1 P27蛋白在正常宫颈组织、CIN组织和宫颈癌中表达情况(×100)
2.3Stathmin蛋白表达情况
Stathmin蛋白在宫颈癌组织弱阳性率28.3%(17/60),强阳性率58.3%(35/60);CIN组织中弱阳性率42.5%(17/40),强阳性率10.0%(4/40);正常宫颈组织中弱阳性率17.5%(7/40)。三组比较差异有统计学意义(χ2=67.100,P<0.05),而CIN组与宫颈癌组组织比较,差异也有统计学意义(χ2=26.196,P<0.05)。见表3、图2。
2.4Stathmin蛋白表达与宫颈癌临床病理特征的关系
Stathmin蛋白强阳性比例和强度在低分化宫颈癌组织(15/16,93.8%)中明显高于中分化癌(12/20,60.0%)和高分化癌(8/24,33.3%),差异显著(χ2=15.051,P<0.05);在无淋巴结转移宫颈癌(15/38,39.5%)中的强阳性表达明显低于有淋巴结转移宫颈癌(20/22,90.9%)(χ2=15.490,P<0.05);在Ⅰ期宫颈癌(11/31,35.5%)的强阳性表达明显低于Ⅱ+Ⅲ期宫颈癌(24/29,82.8%)(χ2=14.042,P<0.05);而与宫颈癌患者的年龄无关(χ2=0.500,P>0.05)。见表4。

表2 P27蛋白表达与宫颈癌临床病理特征的关系(n)

表3 Stathmin蛋白在宫颈癌组织中、宫颈上皮内瘤变(CIN)组织和正常宫颈组织中表达情况[n(%)]
表4 Stathmin蛋白表达与宫颈癌临床病理特征的关系

图2 Stathmin蛋白在宫颈癌组织中、CIN组织和正常宫颈组织中表达情况(×100)
2.5P27和Stathmin蛋白在宫颈癌组织中的表达关系
P27与Stathmin蛋白表达呈负相关(r=-1,P<0.05)。见表5。
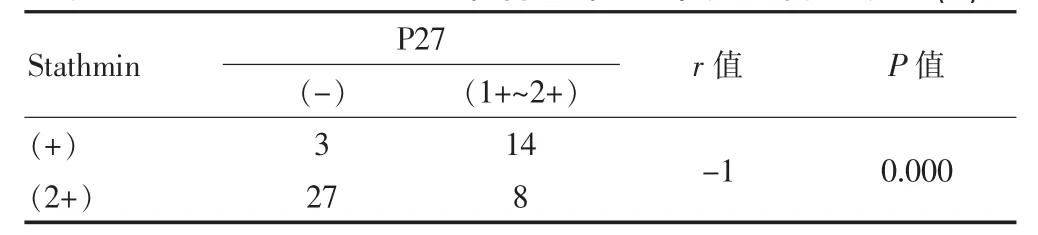
表5 Stathmin和P27蛋白在宫颈癌组织中表达的相互关系(n)
3 讨论
P27蛋白属于细胞周期蛋白依赖性蛋白激酶抑制因子(CD-KI)家族的成员之一,是细胞周期中重要的负性调节因子,在最为关键的G1/S限制点发挥细胞周期调节作用,任何引起P27功能障碍和蛋白表达水平均可能给细胞周期的“制动”机制造成严重损害,导致正常细胞的异常增殖[11,12]。研究发现,P27蛋白在正常宫颈组织中都有较高的表达水平,随着宫颈癌演变发展,在CIN组织和宫颈癌组织中的表达水平明显下降;P27蛋白在宫颈癌组织中的表达水平与肿瘤的不同分化程度、有无淋巴结转移和FIGO分期等临床数据均高度相关(均P<0.05),提示P27蛋白的减少可能直接参与了宫颈癌的发生和演变,高水平表达的P27蛋白对正常宫颈组织的异常增殖起抑制作用,低表达的P27失去了对细胞增殖的抑制作用,从而导致了宫颈癌的发生发展。
人Stathmin蛋白也称原癌基因蛋白18(Oneogene protein18,OP18),由150个氨基酸构成,相对分子质量约为19×103,是广泛存在于细胞浆中的一种高度保守的可溶性磷酸蛋白,在细胞周期的不同阶段通过去磷酸化和磷酸化作用来控制细胞周期,调节细胞微管系统的动力学平衡及细胞的增殖、分化等生物学行为[13,14],有研究显示,在很多不同的人类肿瘤组织中Stathmin蛋白均高表达,如在白血病[15]、乳腺癌[16,17]、前列腺癌[18]、肺癌[19,20]、肝癌[21]和胃癌[22]等恶性肿瘤中均可检测到Stathmin蛋白的高水平表达。本研究发现Stathmin在宫颈癌组织中的表达量明显比CIN组织和正常宫颈组织高(P<0.05)。Stathmin蛋白在宫颈癌组织中的表达水平与肿瘤的不同分化程度、有无淋巴结转移和FIGO分期等临床数据均高度相关(均P<0.05),提示Stathmin蛋白表达水平与宫颈癌的发生发展密切相关,Stathmin蛋白水平越高,肿瘤分化程度越差,越易发生转移。由于Stathmin蛋白对肿瘤的诊断和预后的判断都有一定的价值,将来很有可能成为一个新的宫颈癌治疗的靶基因和肿瘤标志物。
通过研究还发现,P27蛋白和Stathmin蛋白的表达之间呈明显负相关(r=-1,P<0.05)。Baldassarre等[23]研究证实,P27蛋白与Stathmin蛋白结合后,能抑制其微管解离活性及表达,从而降低肉瘤细胞的侵袭和运动等生物学行为。Wang等[24]在肝癌中亦研究发现P27蛋白通过阻止Stathmin蛋白与微管的分离和干扰细胞间期微管的功能来对其发挥负性调节作用,上调肿瘤细胞中的P27蛋白可以抑制Stathmin蛋白的表达,从而促进肿瘤细胞增殖与分裂能力。在宫颈癌演变发展过程中随着P27蛋白表达的降低Stathmin蛋白的表达明显增加,此结果与P27能负性调控Stathmin的观点一致。
综上所述,P27和Stathmin蛋白是宫颈癌演变过程中的一组重要的抑癌基因和癌基因,共同参与了宫颈癌的发生发展,并在其中发挥重要作用。未来P27蛋白和Stathmin蛋白有可能成为一组判断宫颈癌恶性程度及侵袭转移的重要生物学指标,为宫颈癌患者的治疗和和预后判断提供参考依据。
[1]Torre LA,Bray F,SiegelRL,etal.Globalcancerstatistics[J]. CA Cancer J Clin,2015,65(2):87-108.
[2]Rubin CI,Atweh GF.The role ofstathmin in the regulation ofthe cellcycle[J].J Cell Biochem,2004,93(2):242-250.
[3]郭民英.PIk1和p27在甲状腺乳头状癌中的表达及预后意义[J].现代肿瘤医学,2014,22(8):1804-1806.
[4]王在峰,郭蕊.Skp2和P27^kip1蛋白在非霍奇金淋巴瘤组织中的表达及意义[J].中国医药导报,2013,10(10):14-16.
[5]Gigant B,Martin-Barbey C,CarmiPA,et al.The stathmintu-bulin interaction and the regulation of the microtubule assembly[J].Pathol Biol,2003,51(1):33-38.
[6]Martello LA,Verdier-Pinard P,Shen HJ,et al.Elevated levels of microtubule destabilizing factors in a Taxol-resistant/dependent A549 cell line with an alpha-tubu in mutation[J].Cancer Res,2003,63(6):1207-1213.
[7]Pecorelli S.Revised FIGO staging for carcinoma of the vulva,cervix,and endometrium[J].Int J Gynaecol Obstet,2009,105(2):103-104.
[8]Xu LZ,Yang WT.The criteria of the results of immunohistochemicalreaction[J].China Oncology,1996,6(4):229-231.
[9]叶丽华,杜亚丽,姜海燕.Stathmin在宫颈癌中的表达及意义[J].现代妇产科进展,2009,18(12):902-904.
[10]郭伟平,王泽华.p27、cyclin E和HPV16在宫颈癌中的表达及其与预后的关系[J].中国妇幼保健,2005,20(23):3155-3158.
[11]Wei M,Liu B,,Gu Q,et al.Stat6 cooperates with Sp1 in controlling breast cancer cell proliferation by modulating the expression of p21(Cip1/WAF1)and p27(Kip1)[J]. Cell Oncol(Dordr),2013,3(1):79-93.
[12]Hino H,Dai P,Yoshida T,et al.Interaction of Cx43 with Hsc70 regulates G1/S transition through CDK inhibitor p27[J].Sci Rep,2015,5:15365.
[13]Belletti B,Baldassarre G.Stathmin:A protein with many tasks.New biomarker and potential target in cancer[J]. Expert Opin Ther Targets,2011,15:1249-1266.
[14]Holmfeldt P,Sellin ME,Gullberg M.Upregulated Opl8/ stathmin activity causes chromosomal instability through a mechanism that evades the spindle assembly checkpoint[J].Exp Cell Res,2010,316(12):2017-2026.
[15]徐建萍,胡建达,李静,等.Stathmin1在急性白血病中的表达及意义[J].中国实验血液学杂志,2013,21(5):1105-1110.
[16]Xu SG,Yan PJ,Shao ZM.Differential proteomic analysis of ahighlyme tastatic variant of human breast cancer cells using two dimensional differential gelelectrophoresis[J].J Cancer Res Clin Oncol,2010,136(10):1545-1556.
[17]Kuang XY,Chen L,Zhang ZJ,et al.Stathmin and phospho-stathmin protein signature is associated with survival outcomes of breast cancer patients[J].Oncotarget,2015,6(26):22227-22238.
[18]Mistry SJ,Atweh GF.Therapeutic interactions between stathmin inhibition and chemotherapeutic agents in prostate cancer[J].Mol Cancer Ther,2006,5(12):3248-3257.
[19]夏道奎,胡成俊.Stathmin在非小细胞肺癌组织中的表达及意义[J].山东医药,2012,52(3):58-59.
[20]Lin X,Liao Y,Chen X,et al.Regulation of Oncoprotein 18/Stathmin Signaling by ERK Concerns the Resistance to Taxol in Nonsmall Cell Lung Cancer Cells[J].Cancer Biother Radiopharm,2016,31(2):37-43.
[21]Gan L,Guo K,Li Y,et al.Up-regulated expression of stathmin may be associated with hepatocarcinogenesis[J]. Oncol Rep,2010,23(4):1037-1043.
[22]Liu X,Liu H,Liang J,et al.Stathmin is a potential molecular marker and target for the treatment of gastric cancer[J].Int J Clin Exp Med,2015,8(4):6502-6509.
[23]Baldassarre G,Belletti B,Nicoloso M S,etal.p27(Kip1)-stathmin interaction influences sarcoma cell migration and invasion[J].Cancer Cell,2005,7(1):51-63.
[24]Wang XQ,Lui EL,Cai Q,et al.p27Kipl promotes migration of metastatic hepatocel lular carcinoma cells[J].Tomour Biol,2008,29(4):217-223.
Expression of P27 and Stathmin in cervical cancer tissues and their correlations
MA Hainong1FANG Laifu2LIU Minjie3
1.Department of Gynecology,Ningbo Second Hospital,Ningbo 315040,China;2.Department of Pathology,Ningbo Yinzhou People's Hospital,Ningbo 315040,China;3.Department of Gynecology and Obstetrics,Ningbo Yinzhou People's Hospital,Ningbo 315040,China
Objective To investigate the expression of P27 protein and Stathmin protein in cervical cancer tissues and their correlations.Methods Immunohistochemical method was used to detect the expression of P27 protein and Stathmin protein in 40 cases of normal cervical tissues,40 cases of cervical intraepithelial neoplasia(CIN)and 60 cases of cervical cancer tissues.Results The positive expression rates of P27 protein in normal cervical tissues,CIN tissues and cervical cancer tissues were 87.5%,77.5%and 50.0%respectively.There was significant difference among the three groups(χ2=17.732,P<0.05).The positive expression rates of Stathmin protein in normal cervical tissues,CIN tissues and cervical cancer tissues were 17.5%,52.5%and 86.7%respectively.There were significant differences among the three groups(χ2=67.1,P<0.05).The expression of P27 and Stathmin was not correlated with the age of patients(P>0.05). The expression of P27 and Stathmin was significantly correlated with histological differentiation of cervical cancer,lymph node metastasis or not and clinical staging(P<0.05).The expression of Stathmin protein was negatively correlated with the expression of P27 protein in cervical cancer(r=-1,P<0.05).Conclusion Detection of P27 protein and Stathmin protein can be used as a group of tumor markers in the diagnosis of cervical cancer,and Stathmin protein may promote the occurrence and development of cervical cancer by inhibiting the expression of P27 protein.
Stathmin;P27;CIN;Cervical cancer;Immunohistochemistry
R737.33
A
1673-9701(2016)29-0004-05
浙江省宁波市科技局科技惠民计划项目(2015C 50015);浙江省宁波市科技局自然科学基金(2013A610229)▲
(2016-06-21)

