TLR9、MyD88及NF-κB在过敏性紫癜中的表达及意义
王子威 杨丽君
首都医科大学附属北京友谊医院儿科,北京100050
TLR9、MyD88及NF-κB在过敏性紫癜中的表达及意义
王子威杨丽君
首都医科大学附属北京友谊医院儿科,北京100050
目的探讨免疫上游因子TLR9、MyD88、NF-κB及免疫下游细胞因子IL-6、TNF-α在HSP组与正常对照组间的差异及相关性。方法采用实时荧光定量PCR检测HSP患儿外周血单核细胞TLR9、MyD88及NF-κB mRNA表达量,ELISA法检测血浆IL-6、TNF-α水平。结果①HSP患儿外周血单核细胞TLR9、MyD88及NF-κB mRNA表达均显著高于正常对照组;②HSP组血浆IL-6、TNF-α水平较对照组水平显著增高;③HSP组中TLR9与MyD88、TLR9与NF-κB、MyD88与NF-κB、NF-κB与IL-6以及NF-κB与TNF-α均存在线性正相关关系。结论HSP患儿TLR9、MyD88、NF-κB、IL-6、TNF-α水平均较正常儿童显著升高。TLR9-MyD88-NF-κB信号通路参与HSP发病,并在其中起重要作用。
过敏性紫癜;Toll样受体9;髓样分化因子88;核转录因子Kappa-B;白介素6;肿瘤坏死因子α
过敏性紫癜(henoch-schonlein purpura,HSP)是儿童时期最常见的免疫系统疾病,本病以小血管炎症为主要病变,好发于3~10岁儿童,常累及皮肤、胃肠道、关节、肾脏等多个系统,其发病率呈逐年增多趋势,临床上无有效的治疗措施及控制其进展的有力手段,近年来,人们努力寻找HSP发生的上游机制,随着Toll样受体(Toll like receptors,TLRs)等模式识别受体(pattern recognition receptor,PRR)深入研究,人们发现这种形式让机体不但可以发现入侵的病原体,而且能够识别其类型,并通过一系列信号途径活化效应分子,从而控制并清除病原体。目前研究发现由Toll样受体9(Toll like receptor 9,TLR9)-髓系分化因子(myeloid differentiation factors 88,MyD88)-核转录因子Kappa-B(nuclear factor kappa-B,NF-κB)信号通道介导下游细胞因子如血清白介素6(Interleukin 6,IL-6)、肿瘤坏死因子(Tumor necrosis factor,TNF-α)释放发挥免疫应答,因此信号通道TLR9-MyD88-NF-κB在免疫识别、激活、效应过程中发挥关键作用。
1 资料与方法
1.1一般资料
选取2015年3月~2016年3月首都医科大学附属北京友谊医院门诊及住院急性期HSP患儿40例作为研究对象,另选取我院儿童保健科健康体检儿童35例作为正常对照组。研究对象入选标准:①年龄<14岁;②均为初诊初次发病,病程在3 d内且未接受治疗者;③HSP的诊断标准参照诸福棠《实用儿科学》第7版[1];④近1个月内无感染及过敏性疾病史,未使用过激素及免疫抑制剂。对照组:选取同期在本院体检的正常健康儿童。本研究取得入选对象监护人知情同意并获我院医学伦理委员会批准。HSP组男21例,女19例,年龄3~12岁,平均(7.4±2.9)岁,对照组男18例,女17例,年龄3~11岁,平均(7.6±2.7)岁。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2方法
实时荧光定量(real-time quantitative RT-PCR)检测:采集研究对象的组织,采用Trizol抽提法提取总RNA,按照反转录试剂盒(TAKARA公司)说明书合成cDNA。引物的设计使用Oligo 6.0设计软件设计,由上海生物工程有限公司合成,引物序列及扩增长度详见下图。RT-PCR使用TAKARA公司的SybergreenIMix试剂盒,反应条件为:94℃5 min,94℃15 s,58℃15 s,72℃15 s,共35个循环,扩增反应完成后又进行了溶解曲线的制作,确保扩增的特异性。
引物序列如下:
TRL9引物序列:
上游:5’-GGGACCTCGAGTGTGAAGCA-3’199
下游:5’-CTGGAGCTCACAGGGTAGGAA-3’
MyD88引物序列:
上游:5’-GCACATGGGCACATACAGAC-3’239
下游:5’-TGGGTCCTTTCCAGAGTTTG-3’
NF-κB引物序列:
上游:5’-CTGAACCAGGGCATACCTGT-3’197
下游:5’-GAGAAGTCCATGTCCGCAAT-3’
β-actin引物序列:
上游:5’-CACGATGGAGGGGCCGGACTCATC-3’111
下游:5’-TAAAGACCTCTATGCCAACACAGT-3’
血清IL-6、TNF-α由第四军医大学免疫学教研室提供ELISA试剂盒测定。敏感度为100μg/L,酶标仪MicroplateReader为美国Bio-Rad公司产品,在450 nm处读出吸光度(A)值,操作严格按说明书进行。
1.3统计学处理
采用SPSS17.0软件进行统计分析,数据经正态分布检验后,满足正态分布的计量资料以(±s)表示,计量资料组间比较采用t检验,直线相关性分析应用Pearson分析,P<0.05为差异有统计学意义。
2 结果
2.1HSP组与正常对照组血浆IL-6与TNF-α表达水平比较
HSP组血浆IL-6、TNF-α水平较对照组水平显著增高,差异有高度统计学意义(t=5.11、9.26,P<0.01)。见表1。
表1 HSP组与正常对照组血浆IL-6与TNF-α水平比较(±s)
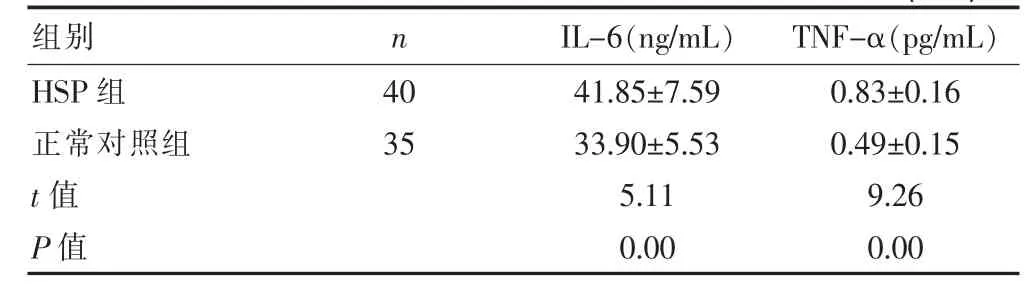
表1 HSP组与正常对照组血浆IL-6与TNF-α水平比较(±s)
组别n IL-6(ng/mL)TNF-α(pg/mL)HSP组正常对照组t值P值40 35 41.85±7.59 33.90±5.53 5.11 0.00 0.83±0.16 0.49±0.15 9.26 0.00
2.2HSP组与正常对照组人外周血单个核细胞(peripheralblood mononuclearcell,PBMC)TLR9、MyD88、NF-κB-mRNA表达量比较
HSP患儿外周血单核细胞TLR9、MyD88及NF-κB mRNA表达均显著高于正常对照组,差异有高度统计学意义(t=5.68、5.42、112.95,P<0.01)。见表2。
表2 HSP组与正常对照组PBMC TLR9、MyD88、NF-κB-mRNA表达量比较(s)
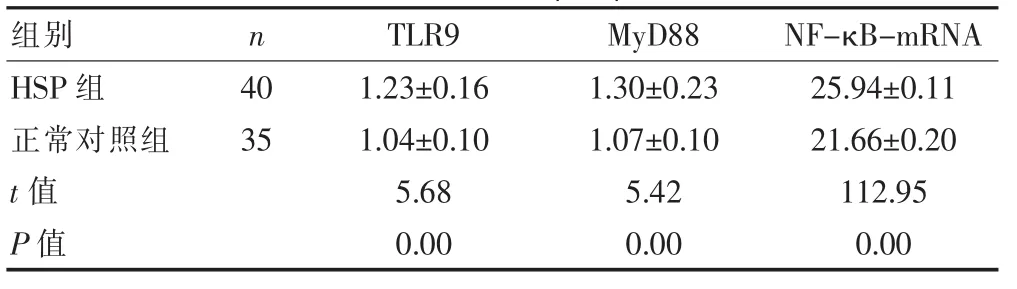
表2 HSP组与正常对照组PBMC TLR9、MyD88、NF-κB-mRNA表达量比较(s)
?
2.3HSP组中TLR9与MyD88,TLR9与NF-κB,MyD88与NF-κB,NF-κB与IL-6以及NF-κB与TNF-α的相关关系
HSP组中TLR9与MyD88,TLR9与NF-κB,MyD88与NF-κB,NF-κB与IL-6以及NF-κB与TNF-α均存在线性正相关关系。TLR9与MyD88呈正相关(r=1.00,P<0.01);TLR9与NF-κB呈正相关(r= 0.98,P<0.01);MyD88与NF-κB呈正相关(r=0.98,P<0.01);NF-κB与IL-6呈正相关(r=0.98,P<0.01);NF-κB与TNF-α呈正相关(r=0.97,P<0.01)。
3 讨论
过敏性紫癜是儿童好发的自身免疫系统疾病,目前发病率逐年上升,发病率约为万分之一[2]。临床上以非血小板减少性皮疹、腹痛、关节痛、血尿和蛋白尿为主要表现,可分为单纯皮肤型、关节型、腹型、肾型、混合型[3]。
Toll样受体是目前研究较多的一种模式识别受体,至少包括13个成员(TRL1-13),其中TRL1-9在人类及小鼠中均有表达,在天然免疫和获得性免疫中都发挥着重要的作用,实现对入侵病原体的早期识别,激活天然免疫,是连接天然免疫和获得性免疫的桥梁[4,5]。TLR9是TLRs家族中的一员,能识别细菌和病毒DNA中非甲基化的胞嘧啶-磷酸-鸟嘌呤基序(CpG-DNA),在微生物、空气传播的细菌、真菌、病毒病原菌感染的先天免疫中起作用。启动炎性应答信号通路,成为近两年HSP研究的热点[6]。TLR9信号通道是MyD88依赖通道[7]。
MyD88通过一系列信号分子如:Toll/IL-1受体同源区(Toll/IL-1 receptorhomologous region,TIR)、白介素1受体相关蛋白激酶(IL-1 Rassociated kinase,IRAK)4、肿瘤坏死因子受体相关因子6(TNFR-associatedfactor 6,TRAF6)、TGF-β激酶(TGF-βactivated kinase 1,TAK1)和TAK1结合蛋白(TAK1 binding protein,TAB),最终激活NF-κB[8],促进下游炎性因子如白介素1(Interleukin 1,IL-1)、白介素6(Interlenkin 6,IL-6)、白介素8(Interleukin 8,IL-8)、白介素12(Interleukin 12,IL-12)和TNF-α等表达。
TLR9-MyD88-NF-κB信号通道激活后能启动下游多种炎症因子的转录和合成[9]。大量研究发现,包括细菌、病毒以及其他病原体的感染与HSP的发病最为密切,机体受到病原微生物感染后,激活上游TLR9-MyD88-NF-κB信号通道后,活化的NF-κB诱导下游多种炎症因子和酶等基因的表达,介导瀑链式炎症反应的形成、发展及恶化。国外Maria E等[10]通过研究63例HSP患儿与50例正常儿童外周血单核细胞,发现在HSP患儿外周血中TLR9 mRNA表达远远高于正常组。Coppo R等[11]研究发现HSP患儿中TLR9基因和蛋白表达较正常组均显著升高,故推测TLR9信号通路介导HAP异常免疫反应。Alper S等[12]发现TLRs通过IL-1和NF-κB途径引起炎症反应。TLR信号通路的上调还与肾脏疾病有关,在国外一项HSP研究中,野生型C57BL/6实验鼠和TLR缺失型实验鼠同时接种同等剂量的脂多糖(lipopolysaccharide,LPS),野生型C57BL/6实验鼠发生严重过敏性紫癜肾炎,表现为肾小球血栓,新月体形成和肾小球巨噬细胞浸润,而TLR缺失型实验鼠却未发生过敏性紫癜肾炎,研究表明TLR信号通路在过敏性紫癜肾炎发生及发展过程中起到重要作用[13]。Hong C等[14]2011~2013年将105名HSP患儿按照24 h尿蛋白量分成3组,A组诊断为HSP,但未见肾脏损伤,B组HSP伴有肾脏损伤,但无大量蛋白尿,C组HSP伴有肾脏损伤,合并大量蛋白尿,同时以35例健康儿童作为健康组,研究发现C组患儿TLR9 mRNA和蛋白表达远远高于对照组,同时比A、B组均高,研究还发现TLR9表达与24 h尿蛋白定量呈线性相关关系。这个结论与Maria E[10]得出在成人中,TLRs表达与蛋白尿的量有很明显的相关性的结论,高度一致。故本研究推测TLR4异常激活与HSPN发生有密切相关。目前越来越多的研究表明TLR信号通路参与了HSP发病的过程[15-18]。因此HSP的发病与TLR9-MyD88-NF-κB信号通道密切相关。TNF-α和IL-6均属于免疫下游细胞因子,研究表明NF-κB是其上游的调控点。
本实验发现HSP组患儿TLR9、MyD88、NF-κB均比正常对照组患儿明显升高,差异有统计学意义,三者间经过统计学分析具有线性正相关关系,说明HSP患儿因内源性或外源性因素机体免疫上游的TLR9、MyD88、NF-κB被激活,同时我们也检测到免疫下游细胞因子IL-6、TNF-α在HSP组比正常对照组明显升高,且与上游的TLR9、MyD88、NF-κB存在线性正相关关系。因此在HSP发病过程中,TLR9-MyD88-NF-κB信号通道作为上游信号受到外界刺激被活化后,继而引起下游炎症介质,包括自由基,细胞因子,前列腺素类和补体级联反应,打破机体的免疫耐受,导致HSP的发病。
因此如果对免疫反应上游的TLR9或MyD88进行干预,是否可减轻HSP症状或进行早期预防,这将是我们下一步研究的重点。
[1]胡亚美,江载芳.诸福棠实用儿科学[M].第7版.北京:人民卫生出版社,2002:689-690.
[2]赵辨.临床皮肤病学[M].南京:江苏科学技术出版社,2010:872-873.
[3]方湘铃,易显文,党西强,等.儿童过敏性紫癜236例临床分析[J].临床儿科杂志,2006,24(1):46-49.
[4]金伯泉.固有免疫中模式识别受体及其信号转导—当代免疫学中最伟大的发现之一[J].细胞与分子免疫学杂志,2006,22(6):1-3.
[5]Takeda K,Akira S.Toll-like receptors in innate immunity[J]. Int Immunol,2005,17(4):1-14.
[6]Kawai T,Akira S.TLR signaling[J].Cell Death Differ,2006,13(5):816-825.
[7]Lucas K,Maes M.Role of the Toll like receptor(TLR)radical cycle in chronic inflammation:Possible treatments targeting the TLR4 pathway[J].Mol Neurobiol,2013,48(12):190-204.
[8]Ohnishi H,Tochio H,Kato Z,et al.Structural basis for the multiple interactions of the MyD88 TIR domain in TLR4 signaling[J].Proc NatlAcad SciUSA,2009,106(25):10260-10265.
[9]李曼丽,甘华.高糖对肾小管上皮细胞Toll样受体4表达及其信号通路的影响[J].重庆医科大学学报,2010,35(6):857-859.
[10]Maria E,Donadio,Elisa L,et al.Toll-like receptors,immunoproteasome and regulatory T cells in children with Henoch-Schönlein purpura and primary IgA nephropathy[J].Pediatr Nephrol,2014,29(10):1545-1551.
[11]Coppo R,Camilla R,Amore A,et al.Toll-like receptor 4 expression is increased in circulating mononuclear cells of patients with immunoglobulin A nephropathy[J].Clin Exp Immunol,2010,159(30):73-81.
[12]Alper S,Sefa K,Salih K,et al.TLR-2 Arg753Gln,TLR-4 Asp299Gly,and TLR-4 Thr399Ile polymorphisms in Henoch Schonlein purpura with and without renal involvement[J].Rheumatol Int,2010,30(12):667-670.
[13]Brown HJ,Sacks SH,Robson MG.Toll-like receptor 2 agonists exacerbate accelerated nephrotoxic nephritis[J]. J Am Soc Nephrol,2006,17(9):1931-1939.
[14]Hong C,Dong SY,Xiu QL,et al.Clinical significance of TLR3 and TLR4 in peripheral blood mononuclear cells from children with Henoch-Schönlein purpura nephritis[J]. Exp Ther Med,2014,32(7):1703-1707.
[15]Mills KH.TLR-dependent T cell activation in autoimmunity[J].Nat Rev Immunol,2011,45(11):807-822.
[16]Urbonaviciute V,Starke C,Pirschel W,et al.Toll-like receptor 2 is required for autoantibody production and developmentofrenal disease in pristane-induced lupus[J]. Arthritis Rheum,2013,65(10):1612-1623.
[17]Miranda HS,Baxter AG.Role of toll-like receptors in multiple sclerosis[J].Am J Clin Exp Immunol,2013,24(2):75-93.
[18]Kirchner M,Sonnenschein A,Schoofs S,et al.Surface expression and genotypes of Toll-like receptors 2 and 4 in patients with juvenile idiopathic arthritis and systemic lupus erythematosus[J].Pediatr Rheumatol Online J,2013,84(11):9.
Expression and significance of TLR9,MyD88 and NF-κB in HSP
WANG Ziwei YANG Lijun
Department of Pediatrics,Beijing Friendship Hospital Affiliated to Beijing Capital University,Beijing 100050,China
Objective To investigate the differences and correlations of immunological upstream factors of TLR9, MyD88,NF-κB and immunological downstream factors of IL-6 and TNF-αin the HSP group and normal control group.Methods The expression of TLR9,MyD88 and NF-κB in peripheral blood mononuclear cells(PBMC)of HSP were detected by real-time PCR.The levels of IL-6 and TNF-αwere measured by ELISA.Results①The expression of TLR9,MyD88 and NF-κB mRNA in peripheral blood mononuclear cells of children with HSP was significantly higher than that of normalcontrols;②The levels of IL-6 and TNF-αin plasma of HSP group were significantly higher than those in the control group;③There was a positive linear correlation between TLR9 and MyD88,TLR9 and NF-κB, MyD88 and NF-κB,NF-κB and IL-6,NF-κB and TNF-αin HSP group.Conclusion The levels of TLR9,MyD88, NF-κB,IL-6 and TNF-αin children with HSP are significantly higher than those in normal children.TLR9-MyD88-NF-κB signal pathways play an important role in the pathogenesis of HSP.
HSP;TLR9;MyD88;NF-κB;IL-6;TNF-α
R554.6
A
1673-9701(2016)29-0009-04
(2016-08-07)

