转染ELF5基因的人卵巢癌干细胞增殖、周期、凋亡及成瘤能力变化
谢肖磊,闫洪超
(1徐州医科大学研究生院,江苏徐州221002;2徐州医科大学附属医院)
转染ELF5基因的人卵巢癌干细胞增殖、周期、凋亡及成瘤能力变化
谢肖磊1,闫洪超2
(1徐州医科大学研究生院,江苏徐州221002;2徐州医科大学附属医院)
目的 观察转染ELF5基因的人卵巢癌干细胞增殖、周期、凋亡及成瘤能力变化。方法 将人卵巢癌干细胞(具有CD133+、CD117+特征的人卵巢癌细胞株HO8910)分为重组质粒组、空质粒组和空白对照组,重组质粒组转染真核细胞表达载体pcDNA3.1-ELF5+EGFP,空质粒组转染空载质粒pcDNA3.1-EGFP,空白对照组不做转染;分别于培养24、48、72、96 h后采用CCK-8法观察细胞增殖能力,于培养48 h后采用流式细胞仪观察细胞周期分布情况、测算细胞凋亡率,于培养48 h后采用Western blotting法检测各组细胞中的p21、Caspase-3蛋白。将重组质粒组、空质粒组和空白对照组细胞分别接种于雌性裸鼠右腋窝皮下制作卵巢癌移植瘤,每组接种5只;待移植瘤形成后取肿瘤组织,测量肿瘤最大直径及质量,测算细胞凋亡率,检测细胞中的p21、Caspase-3蛋白。结果 重组质粒组培养24、48、72、96 h后细胞增殖能力较空质粒组和空白对照组明显下降(P均<0.05)。重组质粒组中阻滞于G0/G1期的细胞比例、细胞凋亡率及细胞中p21、Caspase-3蛋白相对表达量均高于空质粒组和空白对照组(P均<0.05)。重组质粒组移植瘤最大直径和肿瘤质量小于空质粒组、空白对照组(P均<0.05)。重组质粒组移植瘤组织中细胞凋亡率及p21、Caspase-3蛋白相对表达量高于空质粒组和空白对照组(P均<0.05)。结论 转染ELF5基因的人卵巢癌干细胞增殖受抑制、细胞周期阻滞、细胞凋亡增多、成瘤能力减弱,机制可能与p21、Caspase-3蛋白表达上调有关。
卵巢癌;肿瘤干细胞;细胞周期;细胞凋亡;ELF5基因;细胞周期依赖性蛋白激酶抑制因子1A;含半胱氨酸的天冬氨酸蛋白水解酶3
卵巢恶性肿瘤是危害女性健康的妇科恶性肿瘤之一,以卵巢上皮性癌较多见,病死率居妇科恶性肿瘤的首位[1,2]。研究[3~5]显示人卵巢癌的恶性增殖及浸润转移与卵巢癌干细胞密切相关。本课题组前期研究以人卵巢癌细胞株HO8910为对象,筛选出具有“肿瘤干细胞”特性的CD133+、CD117+细胞,发现该细胞体内成瘤能力显著,自我更新和分化能力明显,并具有多药耐药等肿瘤干细胞特征[6]。ELF5是Ets转录因子家族中具有上皮特异性的成员,可调控细胞增殖,参与肿瘤的发病[7,8]。本课题组前期研究[9]表明ELF5 mRNA在卵巢上皮性癌组织中呈低表达,其表达缺失与卵巢上皮性癌的发生、发展有关。为进一步探讨ELF5在卵巢癌发生发展中的作用,本课题组成功构建了含有ELF5基因的真核细胞表达载体pcDNA3.1- ELF5+EGFP,将其体外转染至卵巢癌干细胞[10],观察转染ELF5基因的人卵巢癌干细胞增殖、周期、凋亡及成瘤能力变化,并探讨其可能机制,现报告如下。
1 材料与方法
1.1 细胞、动物与主要材料 人卵巢癌干细胞(紫杉醇培养法筛选出具有CD133+、CD117+特征的人卵巢癌细胞株HO8910)由本课题组保存,接种至含有EGF、bFGF、Noggi及LIF的无血清培养基,在37 ℃、5% CO2、饱和湿度的恒温密闭培养箱内传代培养;鼠龄4~6周的NOD/SCID雌性裸鼠15只,在45%~50%恒湿、25~27 ℃恒温、无特异性病原体的层流环境中饲养,饲料和水等经高压消毒灭菌后供小鼠自由摄入,定期更换垫料;pcDNA3.1-ELF5+EGFP真核细胞表达载体由本课题组构建并保存;CCK-8为日本Dojindo公司产品;Liptapfector脂质体转染试剂购自上海碧云天生物技术有限公司;逆转录试剂盒、引物合成由日本TaKaRa公司提供;细胞周期试剂盒、Annexin V-PE/7-AAD、TUNEL检测试剂盒购自南京凯基生物有限公司;ELF5一抗购自美国Chemicon公司;NOD/SCID雌性裸鼠(鼠龄4~6周)由中国科学院上海实验动物中心提供。
1.2 细胞分组及ELF5基因转染 将人卵巢癌干细胞分为重组质粒组、空质粒组和空白对照组。重组质粒组采用脂质体转染法转染真核细胞表达载体pcDNA3.1-ELF5+EGFP,具体操作步骤按Liptapfector2000脂质体转染试剂盒说明书进行;空质粒组转染空载质粒pcDNA3.1-EGFP;空白对照组不做转染处理。通过倒置荧光显微镜拍照分析,转染48 h时细胞中GFP阳性表达率最高。用G418筛选稳定转染48 h的细胞,进一步扩增培养。采用实时荧光定量PCR法检测各组细胞中的ELF5 mRNA,以β-actin为内参,以2-ΔΔCt表示目的基因相对表达量,重组质粒组细胞中ELF5 mRNA相对表达量为3.11±0.71,高于空质粒组的1.30±0.56和空白对照组的1。
1.3 细胞增殖观察 取三组细胞悬液,以5×104/mL分别接种于96孔板,每组细胞设6个复孔,周围加PBS防蒸发,置于37 ℃、5% CO2环境下分别培养24、48、72、96 h后加入10 μL的CCK-8试剂,另设无细胞空白孔加相同试剂,避光操作,再继续培养1 h后置于酶标仪上,在450 nm波长处测OD值。实验重复3次,取均值,以实验组OD值/空白组OD值表示细胞增殖能力。
1.4 细胞周期分布观察 于培养48 h后收集三组细胞,PBS洗涤、离心后调整细胞浓度为1×106/mL,70%乙醇固定,PBS洗涤后分别加100 μL的RNase A、400 μL的PI染色混匀,最后上流式细胞仪检测,记录激发波长488 nm处红色荧光。实验重复3次,用Modfi T软件分析细胞周期分布情况。
1.5 细胞凋亡率测算 于培养48 h后收集三组细胞,用不含EDTA的胰酶消化处理,经PBS洗涤、离心后收集(1~5)×105个细胞,分别加入Binding Buffer混匀的7-AAD、Annexin V-PE染液(按Annexin V-PE/7-AAD双染试剂盒说明书操作),最后上流式细胞仪测算细胞凋亡率。
1.6 细胞中p21、Caspase-3蛋白检测 于培养48 h后取生长期的三组细胞,置于细胞裂解液(200 μL)中冰上裂解,采用二喹啉甲酸(BCA)法测定蛋白浓度,SDS-PAGE电泳分离蛋白后,进行转膜实验,脱脂奶粉封闭,加入1∶1 000的兔抗人ELF5单克隆抗体一抗,4 ℃过夜,与1∶10 000的羊抗兔二抗室温下反应,加入化学发光试剂,最后进行曝光、显影剂扫描并保存图片,用Image J图像软件进行灰度分析,以空白对照组灰度值为参考,对目的蛋白相对表达量进行标准化。
1.7 细胞成瘤能力观察
1.7.1 卵巢癌裸鼠移植瘤的制作 取“1.2”中所得的三组细胞悬液,按2×104/mL浓度分别接种于裸鼠右腋窝皮下,每组接种5只,每周2次观察肿瘤生长情况。
1.7.2 移植瘤直径及质量测量 各组成瘤后取肿瘤组织,测量肿瘤最大直径及质量。对瘤组织行病理检查以证实其致瘤性。
1.7.3 移植瘤组织中细胞凋亡率测算 取三组移植瘤组织切片,60 ℃烘烤后经二甲苯脱蜡、乙醇水合、1% TritonX-100通透液促渗、3% H2O2甲醛封闭、蛋白酶K孵育等一系列处理,以DNase1孵育,加入TdT酶反应液、Streptavidin-HRP工作液、DAB显色液,重复吸干组织周围水分,苏木素复染,1%盐酸甲醇分化,饱和碳酸锂返蓝,再以梯度酒精脱水、二甲苯透明、中性树胶封片,按TUNEL检测试剂盒说明书操作,镜下计数凋亡细胞并计算细胞凋亡率。
1.7.4 移植瘤组织中p21、Caspase-3蛋白检测 采用Western blotting法,操作参考“1.6”,用Image J图像软件分析结果,并计算目的蛋白相对表达量。
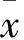
2 结果
2.1 各组细胞增殖能力比较 重组质粒组培养24、48、72、96 h后细胞增殖能力分别为0.88±0.03、1.09±0.04、1.24±0.04、1.37±0.03,空质粒组分别为1.08±0.03、1.27±0.04、1.58±0.04、1.90±0.01,空白对照组分别为1.10±0.06、1.29±0.04、1.53±0.03、1.92±0.02,重组质粒组不同培养时间细胞增殖能力较空质粒组和空白对照组明显下降(P均<0.05)。
2.2 各组细胞周期分布比较 重组质粒组中阻滞于G0/G1期的细胞比例(68.50%±0.50%)高于空质粒组(40.73%±0.35%)及空白对照组(40.87%±0.23%),P均<0.05。
2.3 各组细胞凋亡率比较 重组质粒组细胞凋亡率(39.98%±0.97%)高于空质粒组(19.01%±1.37%)及空白对照组(17.05%±1.45%),P均<0.05。
2.4 各组细胞中p21、Caspase-3蛋白表达比较 重组质粒组、空质粒组及空白对照组中p21蛋白相对表达量分别为10.81±0.67、1.38±0.46、1.13±0.35,Caspase-3蛋白相对表达量分别为7.31±0.54、0.97±0.46、1.08±0.55,重组质粒组细胞中p21、Caspase-3蛋白相对表达量高于空质粒组及空白对照组(P均<0.05)。见图1。

注:A为重组质粒组;B为空质粒组;C为空白对照组。
图 1 各组细胞中p21、Caspase-3蛋白表达比较
2.5 各组移植瘤最大直径及肿瘤质量比较 重组质粒组、空质粒组、空白对照组移植瘤最大直径分别为(8.06±0.54)、(15.17±0.82)、(16.09±0.25)mm,肿瘤质量分别为(0.47±0.26)、(1.08±0.67)、(1.13±0.73)g,重组质粒组移植瘤最大直径和肿瘤质量均小于空质粒组、空白对照组(P均<0.05)。
2.6 各组移植瘤组织细胞凋亡率比较 TUNEL法检测结果显示,重组质粒组、空质粒组、空白对照组移植瘤组织中细胞凋亡率分别为53.26%±0.54%、24.17%±1.82%、22.09%±0.75%,重组质粒组移植瘤组织中细胞凋亡率高于空质粒组和空白对照组(P均<0.05)。见图2。

注:A为重组质粒组;B为空质粒组;C为空白对照组。
图2 三组移植瘤组织中细胞凋亡情况比较
2.7 各组移植瘤组织中p21、Caspase-3蛋白表达比较 重组质粒组、空质粒组及空白对照组移植瘤组织中p21蛋白相对表达量分别为7.41±0.52、1.12±0.63、1.08±0.49,Caspase-3蛋白相对表达量分别为9.71±0.74、1.05±0.76、0.98±0.45,重组质粒组移植瘤组织中p21、Caspase-3蛋白相对表达量高于空质粒组及空白对照组(P均<0.05)。见图3。
3 讨论
卵巢癌因其发病部位隐匿、发病机制复杂,早期诊断困难,治疗效果欠佳,病死率较高,严重威胁妇女健康[11,12]。卵巢癌侵袭转移和术后复发是多数卵巢癌患者死亡的主要原因。不同肿瘤发生转移的机制虽有共性,但亦有特异的信号通路机制[13~15]。因此,研究及阐明卵巢癌侵袭转移的特异性机制,并针对性地设计相应治疗对策,对提高卵巢癌的临床治疗效果和改善患者生存率具有非常重要的意义[16,17]。卵巢癌干细胞理论认为卵巢癌是一种干细胞疾病[3~5]。本课题组前期研究筛选出人卵巢癌干细胞,其体内成瘤能力显著,自我更新和分化能力明显,具有肿瘤干细胞特征[6]。

注:A为重组质粒组;B为空质粒组;C为空白对照组。
图3 各组移植瘤组织中p21、Caspase-3蛋白表达比较
ELF5是Ets转录因子家族中具有上皮特异性的成员,可调控细胞增殖,参与肿瘤的发病[7,8]。ELF5基因位于人11号染色体短臂13~15区,此区域在癌症患者中易发生杂合性丢失。ELF5含有E1、E2两个可识别结构域,一个能够与TTCC核心序列结合的基序和一个参与蛋白间相互作用的E3结构域[18,19]。Yan等[20]研究表明ELF5中的E3结构域富含脯氨酸,具有与蛋白质结合的功能,而E2结构域中S208的磷酸化水平是决定ELF5活性的关键因素之一。ELF5在细胞发育、分化和凋亡过程中扮演关键角色,并可调控细胞增殖,参与肿瘤发病。本课题组前期研究[9]表明ELF5 mRNA在卵巢上皮性癌组织中呈低表达,其表达缺失与卵巢上皮性癌的发生、发展有关。
为进一步从多方面研究ELF5基因干预对人卵巢癌细胞增殖、周期、凋亡及成瘤能力的影响,本课题组将pcDNA3.1- ELF5+EGFP转染人卵巢癌干细胞,同时以转染空载质粒pcDNA3.1-EGFP及未经转染的人卵巢癌干细胞作为对照,细胞体外实验结果显示,重组质粒组培养24、48、72、96 h后细胞增殖能力较空质粒组和空白对照组明显下降,重组质粒组中阻滞于G0/G1期的细胞比例、细胞凋亡率及细胞中p21、Caspase-3蛋白相对表达量均高于空质粒组和空白对照组。上述结果表明ELF5基因可抑制人卵巢癌干细胞增殖,阻滞其细胞周期,诱导细胞凋亡,机制可能与调控p21、Caspase-3蛋白表达有关。同时,本研究还将三组细胞分别接种于裸鼠体内构建人卵巢癌裸鼠皮下移植瘤模型,从体内实验验证ELF5基因对卵巢癌细胞增殖、周期、凋亡及成瘤能力的影响。相关研究结果显示,重组质粒组移植瘤最大直径和肿瘤质量小于空质粒组、空白对照组,重组质粒组移植瘤组织中细胞凋亡率及p21、Caspase-3蛋白相对表达量高于空质粒组和空白对照组。上述结果提示ELF5基因在体内对人卵巢癌干细胞同样有抑制增殖、阻滞细胞周期、促进凋亡的作用,并能够减弱卵巢癌干细胞的成瘤能力。ELF5基因调控凋亡蛋白表达的机制可能与其自身E3结构域有关。因为研究已证实ELF5基因中E3结构域富含脯氨酸,其具有和蛋白质结合的功能,故我们推测ELF5基因可能通过与人卵巢癌干细胞的蛋白质结合并相互作用,上调人卵巢癌干细胞中的细胞周期调控蛋白p21及凋亡调控因子Caspase-3的表达,从而抑制细胞增殖、阻滞细胞周期、促进细胞凋亡,同时减弱人卵巢癌干细胞的成瘤能力。
本研究通过一系列体外及体内实验证实,转染ELF5基因的人卵巢癌干细胞增殖受抑制、细胞周期阻滞、细胞凋亡增多、成瘤能力减弱,ELF5基因对人卵巢癌干细胞增殖、周期及成瘤能力有明显影响,其机制可能与上调p21、Caspase-3蛋白表达有关。本研究结果为ELF5基因用于卵巢癌的基因治疗奠定了实验基础,但相关研究目前尚处于初级阶段,仍需进一步展开探索。
[1] Suh DH, Kim MK, Kim HS, et al. Epigenetic therapies as a promising strategy for overcoming chemoresistance in epithelial ovarian cancer[J]. Cancer Prev, 2013,18(3):227-234.
[2] Muralidhar GG, Barbolina MV. Chemokine Receptors in EpithelialOvarian Cancer[J]. Int J Mol Sci, 2013,15(1):361-376.
[3] Ozakpinar OB, Maurer AM, Ozsavci D. Ovarian stem cells:From basic to clinical applications[J].World J Stem Cells, 2015,7(4):757-768.
[4] Wang X, Li X, Fu X, et al. Eliminating ovarian cancer stem cells: a Potential therapeutic target for ovarian cancer chemoresistance[J]. Curr Protein Pept Sci, 2015,16(4):270-278.
[5] Djordjevic B, Stojanovic S, Conic I, et al. Current approach to epithelial ovarian cancer based on the concept of cancer stem cells[J]. J Buon, 2012,17(4):627-636.
[6] Yan HC, Fang LS, Xu J, et al. The identification of the biological characteristics of human ovarian cancer stem cells[J].Eur Rev Med Pharmacol Sci, 2014,18(17):3497-3503.
[7] Pearton DJ, Broadhurst R, Donnison M, et al. Elf5 regulation in the trophectoderm[J]. Dev Biol, 2011,360(2):343-350.
[8] Lapinskas EJ, Svobodova S, Davis ID, et al. The Ets transcription factor ELF5 functions as a tumor suppressor in the kidney[J]. Twin Res Hum Genet, 2011,14(4):316-322.
[9] 钱卫卫,闫洪超.Elf5mRNA在卵巢上皮性癌组织中的表达及临床意义[J].中国煤炭工业医学杂志,2015,18(12):2009-2012.
[10] 仇影影,谢肖磊,邱玲琳,等.转染Elf5基因的人卵巢癌干细胞增殖、侵袭能力及凋亡变化[J].山东医药,2016,56(19):25-27.
[11] Yanghartwich Y, Soteras MG, Lin ZP, et al. p53 protein aggregation promotes platinum resistance in ovarian cancer[J]. Oncogene, 2014,34(27):3605-3616.
[12] Lawrenson K, Grun B, Lee N, et al. NPPB is a novel candidate biomarker expressed by cancer-associated fibroblasts in epithelial ovarian cancer[J]. Int J Cancer, 2015,136(6):1390-1401.
[13] Wen BL, Brewer MA, Nadiarnykh O, et al. Texture analysis applied to second harmonic generation image data for ovarian cancer classification[J]. J Biomed Opt, 2014,19(9):157-182.
[14] Sharma SK, Wuest M, Wang M, et al. Immuno-PET of epithelial ovarian cancer: harnessing the potential of CA125 for non-invasive imaging[J]. EJNMMI Res, 2014,4(1):60.
[15] Lindenblatt D, Fischer E, Cohrs S, et al. Paclitaxel improved anti-L1CAM lutetium-177 radioimmunotherapy in an ovarian cancer xenograft model[J]. EJNMMI Res, 2014,4(1):54.
[16] Giornelli GH. Management of relapsed ovarian cancer: a review[J]. Springer Plus, 2016,5(1):1197.
[17] Pylvaseerola M, Liakka A, Puistola U, et al. Cancer stem cell properties as factors predictive of chemoresistance in neoadjuvantly-treated patients with ovarian cancer[J]. Anticancer Res, 2016,36(7):3425-3431.
[18] Lee HJ, Gallegoortega D, Ledger A, et al. Progesterone drives mammary secretory differentiation via RankL-mediated induction of Elf5 in luminal progenitor cells[J]. Development, 2013,140(7):1397-1401.
[19] Lapinskas EJ, Svobodova S, Davis ID, et al. The Ets transcription factor ELF5 functions as a tumor suppressor in the kidney[J]. Twin Res Hum Genet, 2011,14(4):316-322.
[20] Yan H, Sun Y. Evaluation of the mechanism of epithelial-mesenchymal transition in human ovarian cancer stem cells transfected with a WW domain-containing oxidoreductase gene[J]. Oncology Letters, 2014,8(1):426-430.
闫洪超(E-mail: 1015058194@qq.com)
10.3969/j.issn.1002-266X.2017.03.009
R737.31
A
1002-266X(2017)03-0032-04
2016-10-18)

