宫颈癌组织中人类黑色素瘤相关抗原A3表达变化及其意义
高新萍,何海鹏,梁义娟,张惠,刘桂玲
(1河北大学附属医院,河北保定0710002;2河北大学)
宫颈癌组织中人类黑色素瘤相关抗原A3表达变化及其意义
高新萍1,何海鹏2,梁义娟1,张惠1,刘桂玲1
(1河北大学附属医院,河北保定0710002;2河北大学)
目的 观察宫颈癌组织中人类黑色素瘤相关抗原A3(MAGE-A3)的表达变化,分析其与肿瘤临床病理参数及预后的关系。方法 收集宫颈癌组织76例、宫颈上皮内瘤变(CIN)组织40例、正常宫颈组织标本25例,采用免疫组化SP法检测MAGE-A3,分析MAGE-A3表达与患者年龄、FIGO分期、组织病理学分级、淋巴结转移及阴道残端癌累及的关系。收集70例宫颈癌患者的术后随访资料,采用Kaplan-Meier生存曲线分析MAGE-A3表达与患者预后的关系。结果 宫颈癌组织、CIN组织、正常宫颈组织中MAGE-A3阳性表达率分别为53.94%、7.50%、0,组间两两相比,P均<0.05。FIGO分期Ⅱa1期宫颈癌组织中MAGE-A3阳性表达率高于Ⅰ期者(P<0.05)。病理分级为G1、G2、G3的宫颈癌组织中MAGE-A3阳性表达率逐渐增高(P均<0.05)。有淋巴结转移的宫颈癌组织中MAGE-A3阳性表达率高于无淋巴结转移者(P<0.05)。MAGE-A3低表达组患者5年生存率为78.1%(25/32),高表达组患者5年生存率为44.7%(17/38),两者相比,P<0.05。结论 宫颈癌组织中MAGE-A3阳性表达率高于CIN组织和正常宫颈组织;MAGE-A3高表达可能与宫颈癌的发生发展及不良预后密切相关。
宫颈癌;宫颈上皮内瘤变;人类黑色素瘤相关抗原A3
子宫颈癌是常见的恶性肿瘤之一,发病趋于年轻化。随着宫颈病变早期筛查的普及,越来越多的宫颈癌得以早发现早治疗,其预后也得到很大改善,但宫颈癌发病机制目前仍不清楚。宫颈上皮内瘤变(CIN)是一组发生于宫颈上皮的癌前病变,与宫颈癌的发生密切相关。随着分子生物学的迅速发展,学者们逐渐认识到宫颈病变的形成和演变是多基因共同作用的复杂进程。人类黑色素瘤相关抗原A3(MAGE-A3)作为MAGE-A基因家族的一员[1],除在睾丸和胚盘组织中表达外,在其他正常组织也有微弱表达。研究[2~7]显示,MAGE-A3在肾癌、膀胱癌、卵巢癌、非小细胞肺癌、黑色素瘤、胃癌等肿瘤组织中高表达,关于MAGE-A3在子宫颈癌中表达的研究尚少。本研究观察了宫颈癌组织中MAGE-A3的表达变化,并分析其与肿瘤临床病理参数及预后的关系。
1 材料与方法
1.1 临床资料 2008年6月~2011年6月河北大学附属医院手术切取并制作的宫颈癌组织标本76例、CIN组织标本40例、正常宫颈组织标本25例。宫颈癌患者年龄30~67岁、中位年龄43岁,FIGO分期Ⅰa~b期52例、Ⅱa期24例,鳞癌60例、腺癌16例,病理分级为高分化(G1)24例、中分化(G2)32例、低分化(G3)20例,无淋巴转移61例、有淋巴转移15例,所有病例均经病理诊断证实,排除患其他恶性肿瘤疾病或急慢性疾病者,患者术前均未进行放化疗;截止到2016年6月,共70例患者获得随访,按月数计算生存时间。CIN患者年龄26~56岁、中位年龄38岁。正常宫颈组织选自良性子宫肌瘤行子宫全切手术标本,患者年龄30~61岁、中位年龄52岁。三组标本来源患者年龄资料具有可比性。本研究方案获医院伦理委员会批准。
1.2 MAGE-A3检测方法 采用免疫组化SP法。将各组石蜡切片经常规脱蜡和水化后,以枸橼酸盐缓冲液(pH 6.0)进行抗原修复13 min,冷却至室温;依次加入过氧化酶阻断液、适量辣根酶标记的链霉卵白素工作液和DAB显色剂,显微镜下观察染色情况;自来水冲洗,苏木素复染,脱水,透明,中性树胶封片;以已知阳性组织作阳性对照,以PBS代替一抗作阴性对照。每张切片在高倍镜(400×)下随机挑选5个视野(每个观察视野范围内的细胞数量≥200个),结合染色强度和阳性细胞百分比综合判定结果。染色强度为不着色计0分,浅黄色计1分,棕黄色计算2分,棕褐色计3分;阳性细胞百分比<5%计0分5%~<25%计1分,25%~<50%计2分,≥50%计3分;将上述两项得分相加,0~2分为蛋白表达阴性,3~4分为弱阳性,5~6分为强阳性,3~6分为蛋白表达阳性;0~2分为低表达,3~6分为高表达。所有切片由两名资深病理科医生双盲阅片。
2 结果
2.1 宫颈癌组织、CIN组织、正常宫颈组织中MAGE-A3表达比较 MAGE-A3蛋白主要表达于细胞质中,少量表达细胞核中,呈浅黄色至棕褐色染色,MAGE-A3蛋白的染色强度随着宫颈病变程度加重而增强。宫颈癌组织、CIN组织、正常宫颈组织中MAGE-A3的阳性表达率分别为53.94%(41/76)、7.5%(3/40)、0(0/25),呈递减趋势,组间两两相比,P均<0.05。见图1。

注:A为正常宫颈组织;B为CIN组织;C、D为宫颈癌组织。
图1 宫颈癌组织、CIN组织、正常宫颈组织中 MAGE-A3的表达
2.2 MAGE-A3表达与宫颈癌临床病理参数的关系 FIGO分期Ⅱa1期宫颈癌组织中MAGE-A3阳性表达率高于Ⅰ期者(P<0.05)。病理分级为G1、G2、G3的宫颈癌组织中MAGE-A3阳性表达率逐渐增高(P均<0.05)。有淋巴结转移的宫颈癌组织中MAGE-A3阳性表达率高于无淋巴结转移者(P<0.05)。详见表1。
2.3 MAGE-A3表达与宫颈癌患者预后的关系 Kaplan-Meier生存分析结果显示,MAGE-A3低表达组患者5年生存率为78.1%(25/32),高表达组患者5年生存率为44.7%(17/38),两者相比,P<0.05。详见图2。
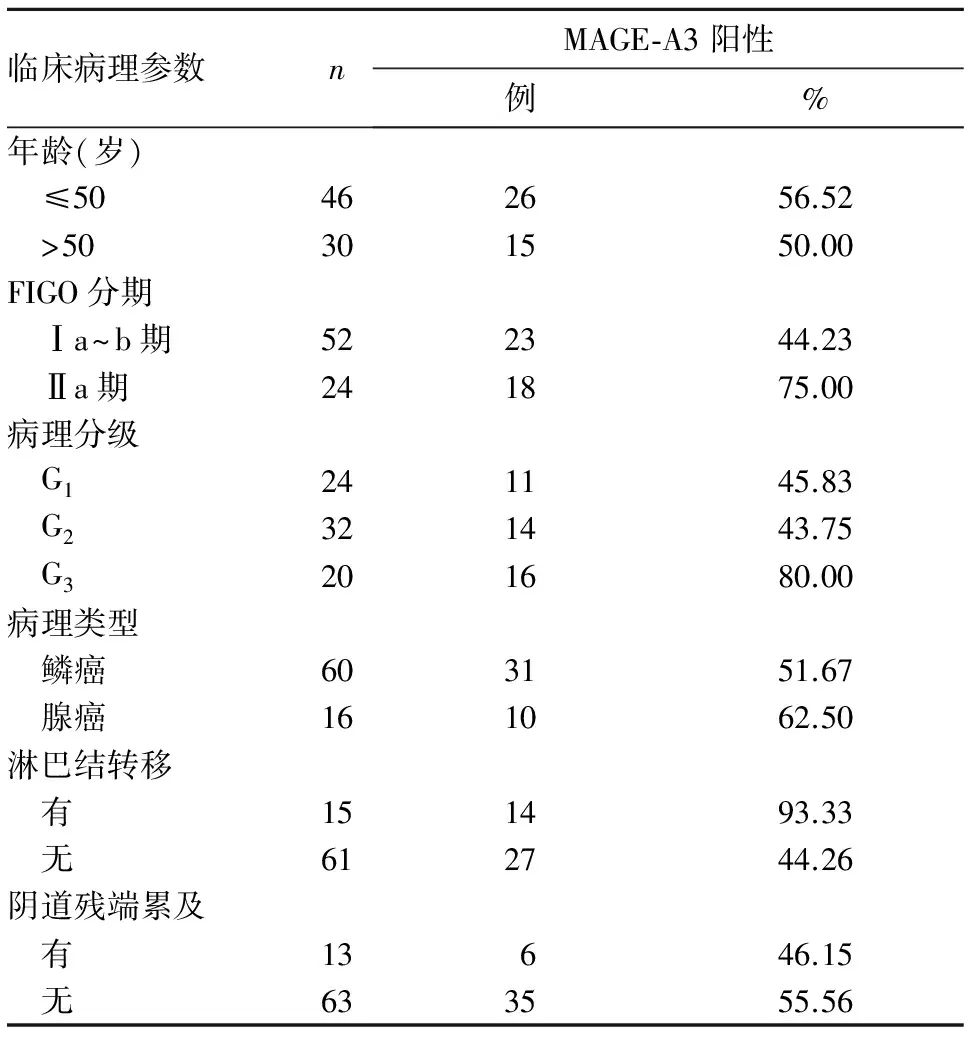
表1 MAGE-A3表达与宫颈癌临床病理参数的关系

图2 MAGE-A3低表达与高表达的宫颈癌患者的生存曲线
3 讨论
自1991年Vander Bruggen等[8]用基因克隆技术在黑色素瘤细胞株中发现MAGE-A1以来,目前已有60多种MAGE抗原相继被发现。MAGE-A3基因与其他A亚家族成员一样位于X染色体的长臂末端即Xq28,有3个外显子,第1、21号外显子很短,第3号外显子很长;有一个开放阅读框(ORF)位于第3个外显子,编码一段长309~319个氨基酸残基的蛋白质。MAGE-A3基因编码的肿瘤抗原MA2-D分子量为48 kD,由314个氨基酸残基组成[9]。MAGE-A3为染色体上固有存在的原癌基因,其在正常细胞(除睾丸及胎盘组织)中均不表达[10],在肿瘤发生发展中所起的作用目前尚未完全明确[11]。MAGE-A3在基因转录和特殊转录因子表达调节中起重要作用,机制涉及多条信号通路。研究[12]发现MAGE-A3能通过与p53结合从而抑制p53的活性,促进黑色素瘤细胞活化。Doyle等[13]发现MAGE的表达能促进KAP1/p53蛋白复合物的形成,从而促进p53脱乙酰作用。
MAGE-A3在多种肿瘤组织中表达。Liu等[14]研究表明MAGE-A3与肿瘤的发生、发展和预后有密切关系,MAGE-A3为成纤维细胞生长因子受体2(FGRF2)信号通路的靶基因,可负调节FGRF2的表达,并通过调节纤维连接蛋白而控制肿瘤的侵袭和转移。Guo等[15]检测结果显示胶质瘤组织中MAGE-A3蛋白阳性表达率为51.3%,而正常脑组织中未检测到MAGE-A3,认为MAGE-A3有望作为神经胶质瘤免疫治疗的理想靶点。杨静等[16]发现低度恶性和高度恶性胶质瘤组织中MAGE-A3的阳性表达率分别为39.1%、70.4%。宫颈癌的侵袭性很强,有盆腔转移的宫颈癌患者术后复发率高达70%[17]。本研究结果显示,宫颈癌组织中MAGE-A3的阳性表达率为53.94%,显著高于CIN组织和正宫颈组织,且MAGE-A3表达与宫颈癌FIGO分期、病理分级和淋巴结转移情况等有关,因此推测,MAGE-A3蛋白在宫颈癌组织中异常高表达,可能参与某些癌基因的激活或抑癌基因沉默,从而导致宫颈癌的发生、发展。
早期宫颈癌患者经治疗后预后较好,但仍有15%~30%的复发率[18],50%的复发患者在治疗后在1年内复发,75%~80%的患者在治疗后2年内复发[19]。现已证实,MAGE-A3的高表达与恶性肿瘤不良预后相关,MAGE-A3是多种恶性肿瘤不良预后的独立预测因子。Yin等[20]认为MAGE-A3可作为肾透明细胞癌潜在的不良预后标志物。本研究结果显示,MAGE-A3高表达者5年生存率低于低表达者,与既往相关研究结果一致,说明MAGE-A3阳性表达率越高提示患者预后越差。
综上所述,宫颈癌组织中MAGE-A3阳性表达率高于CIN组织和正常宫颈组织,MAGE-A3的高表达可能与宫颈癌的发生发展及不良预后密切相关。我们推测MAGE-A3可作为宫颈癌的预后评价指标,并有可能成为宫颈癌的治疗靶点。MAGE-A3在宫颈癌发病中的具体作用机制还有待于进一步研究阐明。
[1] Lueas S, De Smet C, Arden KC, et al. Identification of a new MAGE gene with tumor-specific expression by representational difference analysis[J]. Cancer Res, 1998,58(4):743-752.
[2] Yin B, Liu G, Wang XS, et al. Expression profile of cancer-testis genes in transitional cell carcinoma of the bladder[J]. Urol Oncol, 2012,30(6):886-892.
[3] Esfandiary A, Ghafouri-Fard S. MAGE-A3: an immunogenic target used in clinical practice[J]. Immunotherapy, 2015,7(6):683-704.
[4] Thongprasert S, Yang PC, Lee JS, et al. The prevalence of expression of MAGE-A3 and PRAME tumor antigens in East and South East Asian non-small cell lung cancer patients[J]. Lung Cancer, 2016,101(3):137-144.
[5] Wu YL, An SJ, Chen ZH, et al. Gene expression of MAGE-A3 and PRAME tumor antigens and EGFR mutational status in Chinese non-small cell lung cancer patients[J]. Chin J Cancer Res, 2015,27(3):301-308.
[6] Saiag P, Gutzmer R, Ascierto PA, et al. Prospective assessment of a gene signature potentially predictive of clinical benefit in metastatic melanoma patients following MAGE-A3 immunotherapeutic (PREDICT)[J]. Ann Oncol, 2016,27(10):1947-1953.
[7] Xie C, Subhash VV, Datta A, et al. Melanoma associated antigen (MAGE)-A3 promotes cell proliferation and chemotherapeutic drug resistance in gastric cancer[J]. Cell Oncol (Dordr), 2016,39(2):175-186.
[8] Vander Bruggen P, Traversari C, Chomez P, et al. A gene encoding an antigen recognized by cytolytic T lymphocytes on a human melanoma[J]. Science, 1991,254(5038):1643-1647.
[9] Kocher T, Thater ES, Gudal F, et al. Identification and intracellular location of MAGE-3 gene product[J]. Cancer Res, 1995,55(11):2236-2239.
[10] Akers SN, Odunsi K, Karpf AR. Regulation of cancer germline antigen gene expression:implications for cancer immunotherapy[J]. Future Oncol, 2010,6(5):717-732.
[11] Decoster L, Wauters I, Vansteenkiste JF, et al. Vaccination therapy for non-small-cell lung cancer:review of agents in phase Ⅲ development[J]. Ann Oncol, 2012,23(6):1387-1393.
[12] Yang B, OHerrin SM, Wu J, et al. MEGE-A,mMage-b,and MAGE-C proteins form complexes with KAP1 and suppress P53-dependent apoptosis in MAGE-positive cell line[J].Cancer Res, 2007,67(20):9954-9962.
[13] Doyle JM, Gao J, Wang J, et al. MAGE-RING protein complexes comprise a family of E3 ubiquitin ligases [J]. Mol Cell, 2010,39(6):963-974.
[14] Liu W, Cheng S, Asa SL, et al. The melanoma-associated antigen A3 mediates fibronectin-controlled cancer progression and metastasis[J]. Cancer Res, 2008,68(19):8014-8112.
[15] Guo L, Sang M, Liu Q, et al. The expression and clinical significance of melanoma-associated antigen-A1,-A3 and -A11 in glioma[J]. Oncol Lett, 2013,6(1):55-62.
[16] 杨静,廖红,陈纡,等.MAGE-A1/A3蛋白在胶质瘤的表达及意义[J].现代免疫学,2011,31(5):395-399.
[17] Arbyn M, Castellsagué X, de Sanjosé S, et al. Worldwide burden of cervical cancer in 2008[J]. Ann Oncol, 2011,22(12):2675-2686.
[18] Kim MK, Jo H, Kong HJ, et al. Postoperative nomogram predicting risk of recurrence after radical hysterectomy for early-stage cervical cancer[J]. Int J Gynecol Cancer, 2010,20(9):1581-1586.
[19] 谢幸,苟文丽.妇产科学[M].8版.北京:人民卫生出版社,2013:308.
[20] Yin B, Zeng Y, Wang X, et al. Expression and clinical significance of cancer-testis genes in clear cell renal cell carcinoma[J]. Int J Clin Exp Pathol, 2014,7(7):4112-4119.
河北省政府资助临床医学优秀人才培养和基础课题研究项目(2016361007);河北省医学科学研究重点课题计划项目(20160381)。
梁义娟(E-mail:HHPWL@163.com)
10.3969/j.issn.1002-266X.2017.03.021
R737.33
B
1002-266X(2017)03-0067-03
2016-09-26)

