卵巢子宫内膜异症不孕患者异位内膜组织中FMO3、DMBT1的表达变化及其意义
王秋阳,林伟,王福玲,王雅琦,许伟伟
(1青岛大学医学部,山东青岛266071;2青岛大学附属医院)
卵巢子宫内膜异症不孕患者异位内膜组织中FMO3、DMBT1的表达变化及其意义
王秋阳1,林伟2,王福玲2,王雅琦1,许伟伟1
(1青岛大学医学部,山东青岛266071;2青岛大学附属医院)
目的 观察卵巢子宫内膜异位症(EMs)不孕患者异位内膜组织中的含黄素单氧化酶3(FMO3,在输卵管上皮组织高表达)、脑恶性肿瘤缺失基因(DMBT1,在子宫内膜组织高表达)mRNA及蛋白,并探讨其意义。方法 将卵巢EMs不孕患者的异位内膜组织40例份作为观察组,选取卵巢EMs已育患者的异位内膜组织50例份作为对照组,以正常卵巢组织35例份作为正常组。采用real-time PCR法检测三组FMO3、DMBT1 mRNA,采用Western blotting法检测FMO3、DMBT1蛋白。结果 观察组FMO3 mRNA及蛋白相对表达量高于对照组和正常组(P均<0.05);观察组、对照组DMBT1 mRNA及蛋白相对表达量高于正常组(P均<0.05)。结论 卵巢EMs不孕患者异位内膜组织中FMO3呈高表达,异位内膜组织来源可能为输卵管;输卵管组织来源的异位内膜组织可能与卵巢EMs患者不孕有关。
子宫内膜异位症;卵巢子宫内膜异位症;不孕症;异位子宫内膜;含黄素单氧化酶3;脑恶性肿瘤缺失基因
子宫内膜异位症(EMs)是子宫内膜组织出现在子宫体以外部位的一类疾病[1,2]。EMs可引起痛经、月经不调等症状,且与不孕关系密切[3~5]。有关EMs发病机制存在多种学说,具体发病机制尚未明确。研究[6]表明,EMs病灶组织细胞部分起源于子宫内膜细胞,部分可能源于输卵管上皮细胞。输卵管上皮细胞可能是卵巢EMs潜在的组织细胞来源。关于不同来源的卵巢EMs病灶对患者生育能力的影响是否存在差异尚未见报道。为研究不同来源的卵巢EMs病灶对生育的影响,我们选择在输卵管上皮组织中高度表达、在子宫内膜组织中低表达的含黄素单氧化酶3(FMO3)作为输卵管来源标志物,选择在子宫内膜组织中高表达、在输卵管上皮组织中低表达的脑恶性肿瘤缺失基因(DMBT1)作为子宫内膜来源标志物[6],检测卵巢EMs不孕患者异位内膜组织中的FMO3、DMBT1 mRNA和蛋白,以此观察卵巢EMs不孕患者异位内膜组织的来源,并分析其与患者不孕的关系。
1 资料与方法
1.1 临床资料 研究对象选自2014年5月~2015年5月在青岛大学附属医院手术治疗的女性住院患者。纳入标准:①有正常月经周期及排卵,基础性激素检查正常;②手术治疗前3个月无激素类药物治疗史;③排除子宫腺肌症、子宫先天发育异常、急性盆腔炎、子宫肌瘤、子宫内膜增生症患者及子宫内膜息肉、子宫内粘连等子宫内病变患者及自身免疫性疾病患者。纳入行卵巢巧克力囊肿剥除术的卵巢EMs合并不孕患者50例,年龄25~35(29.4±2.7)岁,不孕年限1~10年,患者同时行宫腔镜与腹腔镜手术,输卵管通畅,术中留取异位内膜40例份作为观察组;行卵巢巧克力囊肿剥除术的卵巢EMs已育患者50例,年龄26~45(30.6±5.4)岁,术中留取异位内膜50例份作为对照组;因一侧卵巢病变而行双侧卵巢切除的患者35例,年龄28~45(32.0±3.2)岁,术中留取正常卵巢组织50例份作为正常组。三组患者年龄、BMI等资料具有可比性。本研究方案经本院医学伦理委员会审批通过,患者均签署知情同意书。
1.2 各组FMO3、DMBT1 mRNA检测 采用real-time PCR法。参照TRIzol说明书提取组织总RNA,逆转录为cDNA用于PCR扩增。基因引物由上海生工生物公司合成。FMO3基因上游引物序列为5′-AATTCGGGCTGTGATATTGC-3′,下游引物序列为5′-TTGAGGAAGGTTCCAAATCG-3′,产物长度20 bp;DMBT1上游引物序列为5′-TGCTCTGTCTGCCAAATCAC-3′,下游引物序列为5′-GTCATTGTCTGCCTGCTTGA-3′,产物长度20 bp;内参GAPDH基因上游引物序列为5′-CGGAGTCAACGGATTTGGTCGTAT-3′,下游引物序列为5′-AGCCTTCTCCATGGTGGTGAAGAC-3′,产物长度24 bp。PCR反应在FTC2000型荧光定量PCR仪上进行,使用2×Sybr Green qPCR Mix试剂盒,按照说明书进行PCR反应,每个标本设3个副孔。以2-ΔΔCt表示目的基因相对表达量[7]。
1.3 各组FMO3、DMBT1蛋白检测 采用Western blotting法。取出各组组织,加细胞裂解液冰上匀浆提取总蛋白,BCA法检测蛋白浓度。每孔加入50 μg总蛋白,10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白质,将蛋白质转移至聚偏氟乙烯(PVDF)膜上。封闭后加入相应一抗FMO3、DMBT1、GAPDH,4 ℃孵育过夜。洗膜后加入二抗,孵育并洗膜,ECL显色液显色。方正扫描仪扫描条带,Quantity One软件对条带进行灰度分析,以FMO3、DMBT1与GAPDH条带的相对吸光度值表示FMO3、DMBT1蛋白的相对表达量。
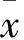
2 结果
2.1 各组FMO3、DMBT1 mRNA相对表达量比较 观察组FMO3 mRNA相对表达量高于对照组和正常组(P均<0.05);观察组、对照组DMBT1 mRNA相对表达量高于正常组(P均<0.05)。详见表1。

表1 各组FMO3、DMBT1 mRNA及蛋白相对表达量比较
注:与正常组相比,*P<0.05;与对照组相比,△P<0.05。
2.2 各组FMO3、DMBT1蛋白相对表达量比较 观察组FMO3蛋白相对表达量高于对照组和正常组(P均<0.05);观察组、对照组DMBT1蛋白相对表达量高于正常组(P均<0.05)。详见表1。
3 讨论
过去对于EMs的研究多基于EMs与在位内膜的关系,从“血逆流学说”到“在位内膜决定论”都指出在位内膜是EMs发病的源头[8]。近年来,学者们对卵巢EMs的组织来源有了新的发现。卵巢EMs的异位内膜被证实有一部分来源于输卵管[9]。有学者[10]发现初始内膜异位病灶从输卵管样上皮到内膜样上皮移行,或腺体一半呈输卵管黏膜上皮样、另一半呈宫体内膜上皮样;随后又发现大部分卵巢低级别浆液性癌也起源于输卵管黏膜上皮而非卵巢表面生发上皮,故推测输卵管黏膜上皮参与了卵巢EMs的形成,并最终在细胞和分子水平得到证实。近年研究[6]表明,约60%的卵巢EMs病灶组织有可能起源于输卵管上皮细胞。输卵管上皮细胞是卵巢EMs潜在的组织细胞来源。
现已证实,EMs与不孕关系密切[11,12]。关于卵巢EMs相关性不孕与卵巢异位组织来源的关系目前尚未见报道。本研究分别选择FMO3和DMBT1作为输卵管上皮组织和子宫内膜组织的标志物。FMO3是一种重要的肝微粒体酶,参与体内大量药物、外源性物质和某些化学物质的氧化代谢。DMBT1属于SRCR超家族,在许多恶性肿瘤组织中常表达缺失或下调[13,14],被认为是候选的抑癌基因。本研究结果显示,DMBT1在卵巢EMs患者的异位病灶组织中均呈高表达,FMO3仅在卵巢EMs不孕患者的异位病灶组织中高表达,提示DMBT1可能在卵巢EMs发病中发挥着重要作用,但与卵巢EMs相关性不孕无关,而FMO3可能与卵巢EMs相关性不孕有关。我们推测,子宫内膜为绝大部分卵巢EMs病灶组织的来源,但子宫内膜来源的卵巢EMs可能并不增加不孕发生率;而输卵管组织来源的卵巢EMs患者不孕发生率可能增高,输卵管组织可能与卵巢EMs相关性不孕存在一定关联,具体机制尚不明确。
输卵管组织来源的卵巢EMs导致不孕与以下因素有关:①异位的输卵管组织可能引起盆腔解剖结构改变,引起不孕;②异位的输卵管组织可能引起卵泡液微环境改变,后者影响卵母细胞质量及后续的受精和胚胎发育[15];③T、B淋巴细胞及NK细胞的免疫功能变化可能与输卵管组织的生长与种植有关,输卵管来源的异位病灶组织有可能引起免疫细胞异常活化及腹腔微环境改变;④子宫内膜容受性降低等[16]。输卵管来源的卵巢异位内膜组织有可能由生殖干细胞分化而来,这些细胞中HOX基因可能表达缺失,而HOX参与调控苗勒管向生殖器官发育,对维持子宫内膜容受性也有重要作用[16]。
总之,本研究发现,多数卵巢EMs患者的异位内膜组织来源为子宫内膜,而卵巢EMs不孕患者异位内膜组织来源为输卵管,输卵管组织可能在卵巢EMs不孕发生中发挥一定作用。在以后的研究中,我们有必要从其他角度或应用其他方法进一步对上述结论进行验证。
[1] 李雷,冷金花.子宫内膜异位症及其治疗对女性生育影响的研究进展[J].中国实用妇科与产科杂志, 2013,29(5):393-396.
[2] 于玲,田永杰.子宫内膜异位症发病相关因素的临床研究[J].山东大学学报(医学版),2013,51(2):79-83.
[3] Houshdaran S, Nezhat CR, Vo KC, et al. Aberrant endometrial DNA methylome and associated gene expression in endometriosis[J]. Biol Reprod, 2016,95(5):1-16.
[4] Opoien HK, Fedorcsak P, Omland AK, et al. In vitro fertilization is a successful treatment in endometriosis-associated infertility[J]. Fertil Steril, 2012,97(4):912-918.
[5] Ozkan S, Murk W, Arici A. Endometriosis and infertility: epidemiology and evidence-based treatments[J]. Ann N Y Acad Sci, 2008,1127(10):92-100.
[6] Yuan Z, Wang L, Wang Y, et al. Tubal origin of ovarian endometriosis[J]. Mod Pathol, 2014,27(8):1154-1162.
[7] Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method[J]. Methods, 2001,25(4):402-408.
[8] 仝佳丽.子宫内膜异位症的在位内膜病变研究进展[J].现代妇产科进展,2010,19(6):465-467.
[9] 魏利,吴凯彦,王轶英.卵巢子宫内膜异位症的输卵管起源及其临床意义[J].实用妇产科杂志,2015,31(11):811-812.
[10] Chen C, Li J, Yao G, et al. Tubal origin of ovarian low-grade serous carcinoma[J]. Am J Clin Exp Obstet Gynecol, 2013,24(11):1488-1499.
[11] Buyalos RP, Agarwal SK. Endometriosis-associated infertility[J]. Curr Opin Obstete Gynecol, 2000,12(5):377-381.
[12] Augoulea A, Alexandrou A, Creatsa M, et al. Pathogenesis of endometriosis: the role of genetics, inflammation and oxidative stress[J]. Arch Gynecol Obstet, 2012,286(1):99-103.
[13] Helmke BM, Renner M, Poustka A, et al. DMBT1 expression distinguishes anorectal from cutaneous melanoma[J]. Histopathology, 2009,54(2):233-240.
[14] Mollenhauer J, Helmke B, Medina D, et al. Carcinogen inducibility in vivo and down-regulation of DMBT1 during breast carcinogenesis[J]. Genes Chromosomes Cancer, 2004,39(3):185-194.
[15]Ambekar AS, Nirujogi RS, Srikanth SM, et al. Proteomic analysis of human follicular fluid: A new perspective towards understanding folliculogenesis[J]. J Proteomics, 2013,87(13):68-77.
[16] 宋亚丽,全松.子宫内膜异位症患者内膜容受性及“种植窗”的特点[J].生殖与避孕,2016,34(7):590-594.
王福玲(E-mail: wang.fl2007@163.com)
10.3969/j.issn.1002-266X.2017.03.017
R711.71;R711.6
B
1002-266X(2017)03-0056-03
2016-09-21)

