树皮藻岩藻聚糖硫酸酯的纯化及其化学结构研究
姜龙,宋悦凡,罗宣,武龙,丛海花,汪秋宽
(大连海洋大学食品科学与工程学院,国家海藻加工技术研发分中心,辽宁省水产品加工及综合利用重点开放实验室,辽宁大连116023)
树皮藻岩藻聚糖硫酸酯的纯化及其化学结构研究
姜龙,宋悦凡,罗宣,武龙,丛海花,汪秋宽
(大连海洋大学食品科学与工程学院,国家海藻加工技术研发分中心,辽宁省水产品加工及综合利用重点开放实验室,辽宁大连116023)
为研究树皮藻Ecklonia maxima岩藻聚糖硫酸酯的单糖组成及其化学结构,以产自南非的树皮藻为原料测定其基本成分,采用DEAE-Sepharose Fast Flow阴离子层析柱对树皮藻岩藻聚糖硫酸酯粗品进行分离纯化,通过柱前衍生高效液相色谱法、红外光谱法和核磁共振波谱法测定单糖组成和化学结构。结果表明:树皮藻干基中基本营养成分分别为灰分18.59%、蛋白质9.16%、脂肪0.74%;对树皮藻岩藻聚糖硫酸酯粗品进行纯化得到4个组分,分别命名为SPF1、SPF2、SPF3、SPF4,收集冻干各组分,检测各组分得率分别为18.19%、24.02%、5.61%、4.23%,硫酸根含量分别为12.07%、5.44%、15.58%、19.30%; 4个组分主要由岩藻糖、半乳糖、鼠李糖、甘露糖和葡萄糖醛酸组成,还含有少量的葡萄糖和木糖,其中SPF3、SPF4主要由岩藻糖和半乳糖组成,岩藻糖含量分别为70.92%和86.20%,4个组分的红外光谱显示出典型的多糖吸收峰,SPF1、SPF2在13C核磁共振谱177×10-6附近均出现糖醛酸C6信号峰,SPF3、SPF4 在18×10-6附近均出现信号峰,为α-L-吡喃岩藻糖C6信号峰。
树皮藻;岩藻聚糖硫酸酯;单糖组成;结构分析
岩藻聚糖硫酸酯 (fucoidan)是存在于褐藻细胞间及海参等棘皮动物体壁中的大分子硫酸化多糖,其基本结构由L-岩藻糖和硫酸基团组成,还含有半乳糖、鼠李糖、葡萄糖、木糖和糖醛酸等,这导致其化学结构较为复杂[1]。有研究表明,岩藻聚糖硫酸酯具有抗氧化[2]、抗肿瘤[3]、抗炎[4]、降血脂[5]等多种生物活性。提取自不同种类褐藻的岩藻聚糖硫酸酯在结构组成、生物活性方面存在较大差异,有报道表明,其生物活性与其纯度、化学结构、岩藻糖含量、硫酸根含量及取代位置有一定关联性[6]。曲桂艳[7]研究表明,源自泡叶藻的岩藻聚糖硫酸酯纯化组分相对于粗提物显示出了更高的对胰岛素受体信号因子PTP1B抑制活性,且随着岩藻糖含量的增大活性显著升高。王景峰[8]研究表明,萱藻岩藻多糖在高剂量下各组分均具有抗凝血活性,且硫酸根含量高的组分效果更好。因此,对不同种类褐藻的岩藻聚糖硫酸酯分离纯化后进行结构分析是建立构效关系所必需的。
树皮藻Ecklonia maxima隶属于褐藻门Phaeophyta、海带目Laminariales、翅藻科Alariaceae、昆布属Ecklonia[9],树皮藻原生长于南非及智利海岸,中国进口此藻种作为褐藻胶生产原料,其外层质地较硬,呈灰褐色树皮样,在生产加工及活性物质提取上存在一定困难。目前,国外关于树皮藻的研究主要集中在其养殖分布、多酚提取和生物活性等方面[10],对其岩藻聚糖硫酸酯组成及结构分析较少,国内对树皮藻的研究甚少。本试验中,以树皮藻为原料对其岩藻聚糖硫酸酯粗品进行分离纯化,并对各分离组分的单糖组成、化学结构进行研究,以期为寻找褐藻综合加工利用的新原料提供依据。
1 材料与方法
1.1 材料
样品树皮藻干品产自南非海岸,树皮藻岩藻聚糖硫酸酯由国家海藻加工技术研发分中心提供,岩藻糖、鼠李糖、木糖、半乳糖等单糖标准品购自美国Sigma公司,DEAE-Sepharose Fast Flow为Pharmacia进口分装,其余试剂均为国产分析纯。
主要仪器有ODK-159型全自动凯氏定氮仪(北京盛科有限责任公司)、1260型高效液相色谱仪 (美国Agilent公司)、EPOCH-2型酶标仪 (美国伯腾仪器有限公司)、ScientZ-30D型真空冷冻干燥机 (宁波新芝生物科技有限公司)、Nicolet-470型红外光谱仪 (美国Nicolet公司)。
1.2 方法
1.2.1 树皮藻基本成分的测定 取树皮藻干品适量,粉碎成粉末状。使用快速水分测定仪测定样品中水分含量,采用灼烧法、凯氏定氮法、索氏抽提法分别测定样品中灰分、粗蛋白质、粗脂肪含量。
1.2.2 岩藻聚糖硫酸酯的分离纯化 称取0.2 g样品溶于20 mL 0.02 mol/L的磷酸盐缓冲液 (pH 7.4)中,通过DEAE-Sepharose Fast Flow填装的阴离子交换柱 (300 mm×26 mm)进行分离纯化,具体过程同文献[13]。
1.2.3 单糖组成分析 分别称取10 mg干燥恒重的岩藻糖、半乳糖、木糖、鼠李糖、葡萄糖、甘露糖、葡萄糖醛酸、半乳糖醛酸标准品,溶解并定容至10 mL。称取待测样品20 mg溶于1.5 mL超纯水中,室温下溶解过夜,加入1.5 mL 8 mol/L三氟乙酸 (TFA)溶液,混匀,于烘箱 (105℃)中水解6 h,冷却至室温,以4 mol/L NaOH溶液将水解液调至中性,离心,取上清液避光保存备用。
将样品水解液单糖衍生化后,终止反应,再加入三氯甲烷,震荡混匀,静置后去除有机相,反复萃取多次,剩余水相通过0.45 μm水系膜进行高效液相色谱分析。色谱柱为Agilent ZORBAX Eclipse XDB C-18(5 μm,4.6 mm×250 mm),柱温30℃,流动相A为15%乙腈+50 mmol/L磷酸盐缓冲液(pH 6.0),流动相B为40%乙腈+50 mmol/L磷酸盐缓冲液 (pH 6.0),梯度为0 min 100%A→50 min 50%A,流速为1 mL/min,检测波长为250 nm,进样体积为20 μL。
1.2.4 傅里叶红外光谱 (FTIR)分析 称取2 mg待测样品,加入适量干燥溴化钾粉末反复研磨均匀,压制成透明均匀的薄片,扫描4000~400 cm-1范围内的吸收光谱。
1.2.513C核磁共振波谱分析 将待测样品在氘水中溶解过夜、冻干,再溶解于氘水中制成浓度为20 mg/mL的样液,利用Bruker AVANCEⅢ型核磁共振分析仪在工作频率为500 MHz、温度为25℃条件下进行13C核磁共振分析。
2 结果与分析
2.1 树皮藻基本成分
经测定,树皮藻样品水分含量为11.56%± 0.06%,其他基本成分含量按干基计算,灰分含量为 18.59% ±0.07%,蛋白质含量为 9.16% ± 0.28%,脂肪含量为0.74%±0.02%。
2.2 岩藻聚糖硫酸酯的分离纯化
如图1所示,树皮藻岩藻聚糖硫酸酯粗品经过梯度洗脱得到4个组分,分别命名为SPF1、SPF2、SPF3、SPF4,其中SPF1为流出峰,SPF2~SPF4为盐度梯度洗脱峰。从表1可见:各组分中总糖、硫酸根含量和纯度均为SPF4最高,SPF2最低。
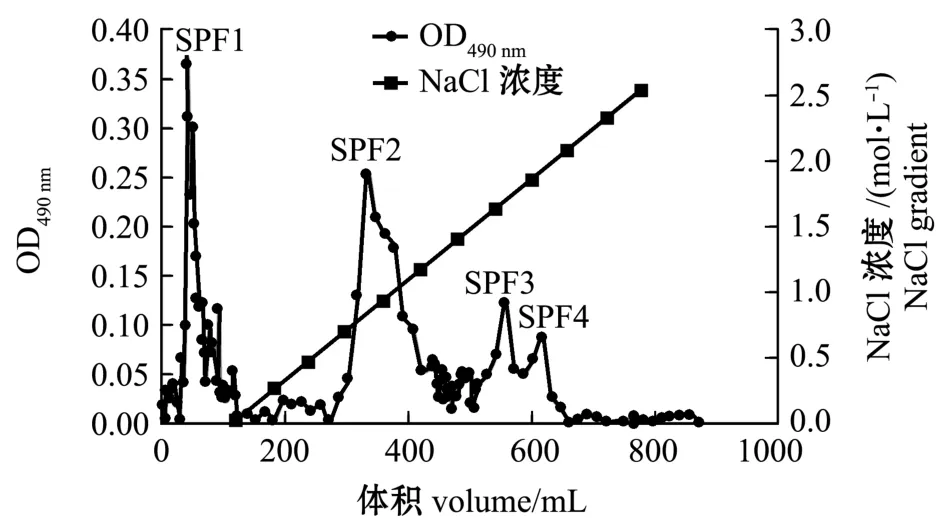
图1 岩藻聚糖硫酸酯梯度洗脱曲线Fig.1 Grade elution curve of fucoidan
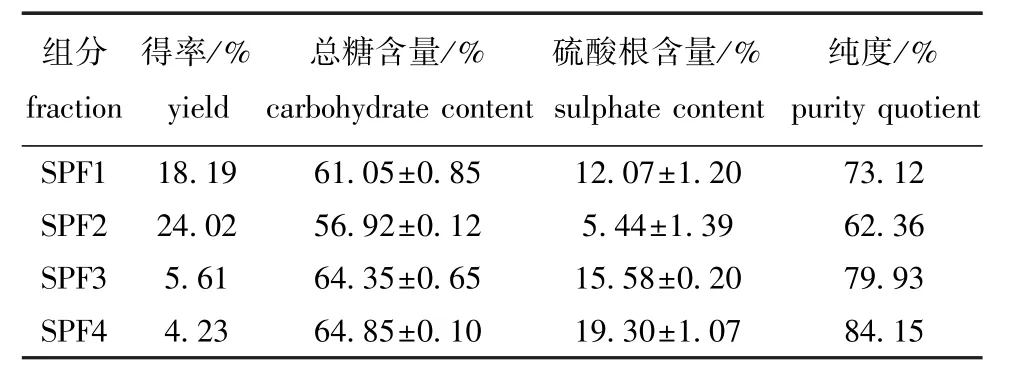
表1 各组分总糖及硫酸根含量Tab.1 Carbohydrate and sulphate contents of the purified fractions
2.3 单糖组成分析
树皮藻岩藻聚糖硫酸酯各纯化组分的液相色谱分析结果如图2和表2所示,通过比对图3中各单糖标准品的出峰时间和峰面积,确定4个组分的单糖构成及相对含量,SPF2中含量最高的是鼠李糖,其次是木糖、葡萄糖醛酸、甘露糖和岩藻糖,还含有少量的半乳糖和葡萄糖,且在甘露糖出峰位置附近出现两个相邻峰,可能是由于组分中存在甘露糖的同分异构体或甘露糖醛酸,因此这一组分的构成相对复杂。SPF1、SPF3和SPF4中含量最多的单糖均为岩藻糖,其中SPF4中比例最高,为86.21%, 而SPF2中仅含有15.34%的岩藻糖,4个组分间的单糖组成及含量有明显区别。
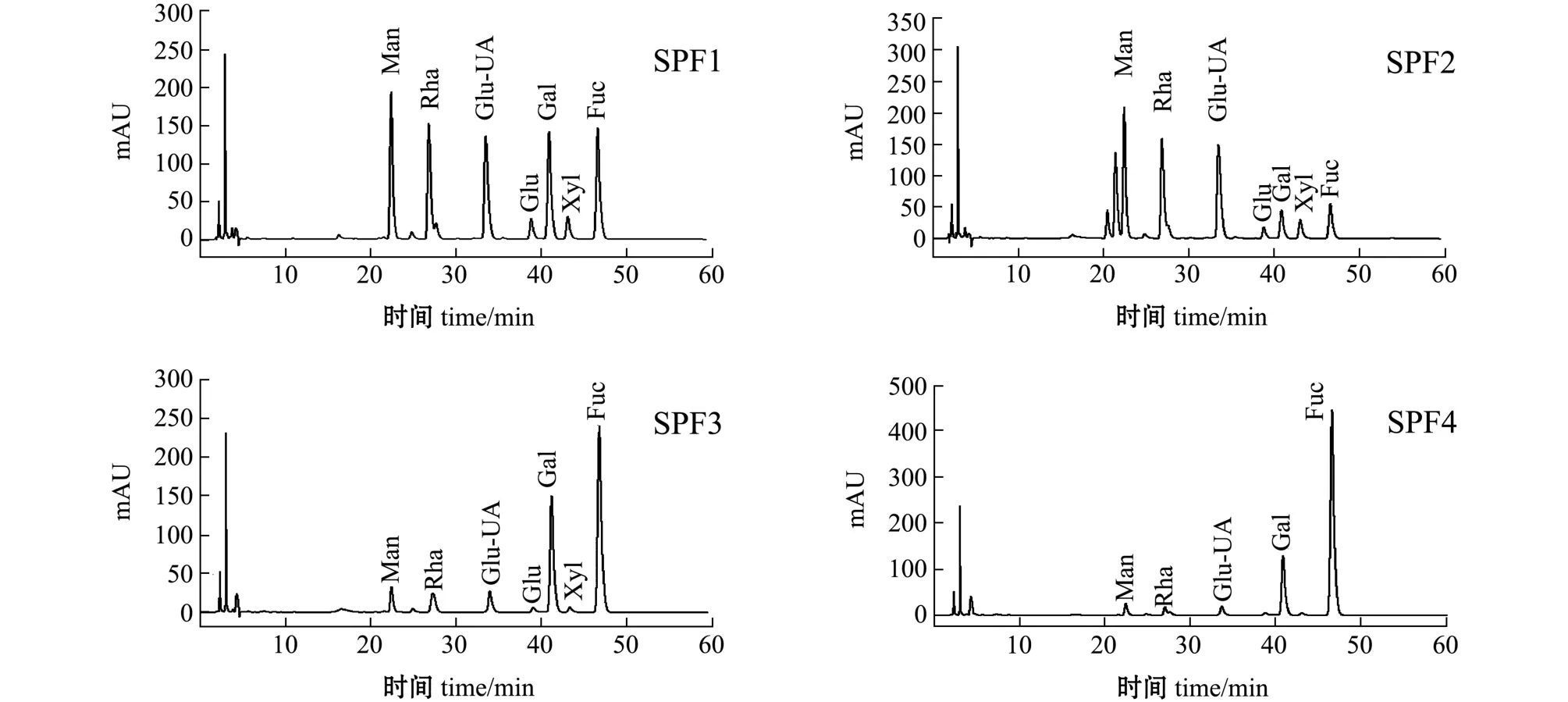
图2 SPF1~SPF4的高效液相色谱图Fig.2 The HPLC of SPF1-SPF4
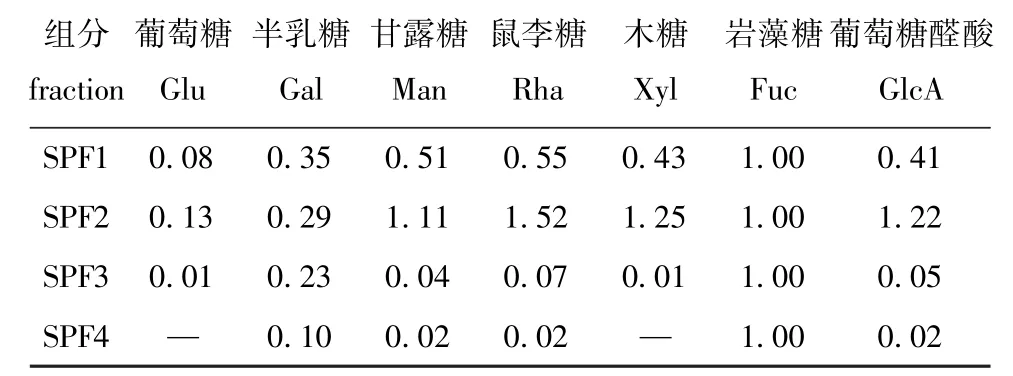
表2 各组分单糖含量 (单糖摩尔比)Tab.2 Content of monosaccharide in each fraction(monosaccharide mole ratio)
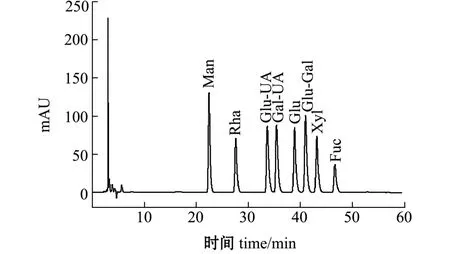
图3 标准单糖高效液相色谱图Fig.3 The HPLC of mixed standard monosaccharides
2.4 红外光谱分析
从图4可见:4个组分均显示出典型多糖结构吸收谱带,在3600~3200 cm-1范围内均出现强吸收峰 (3435、3389、3438、3467 cm-1),这是多糖结构中共有的O-H键伸缩振动,且各组分在3000~2800 cm-1范围出现C-H伸缩振动吸收峰(2937、2926、2921、2944 cm-1);SPF1、SPF3、SPF4在1260~1250 cm-1内有强吸收峰,为S=O伸缩振动,符合硫酸根测定结果,这3个组分中含有较多硫酸基团,SPF2在这一范围的吸收峰较弱,这与该组分硫酸根含量 (5.44%)较低相对应;各组分在1075~1030 cm-1范围内的吸收峰对应的是C-O-C或C-O-H伸缩振动。此外,SPF1和SPF2在1420~1410 cm-1范围内出现较强的C-H变角振动吸收峰,在1630 cm-1附近有较强的C=O伸缩振动峰,结合单糖组成分析结果,应归因于这两个组分含有的葡萄糖醛酸。SPF1、SPF2分别在820、822 cm-1处有赤道配位的C-O-S伸缩振动吸收峰,SPF3、SPF4分别在855、848 cm-1处有较强的轴向配位C-O-S伸缩振动吸收峰。
2.5 核磁共振碳谱分析
从图5可见,SPF1~SPF4在高场区18×10-6附近均出现信号峰,这是岩藻糖C6或鼠李糖C6的特征信号峰,SPF4在18.5×10-6处信号峰相对强度高于其他3个组分,这与单糖组成及红外光谱所得的结果一致,SPF4中含有更多的岩藻糖。半乳糖C6的特征信号峰出现在 (62~63)×10-6之间,且各组分在 (67~83)×10-6内均出现复杂信号峰, (67~76)×10-6范围内可能是未被取代的C2~C5信号峰,在 (76~83)×10-6内的信号峰与C2~C5位的硫酸根取代有关。SPF1、SPF2在(177.5~178.5)×10-6范围内均存在一个信号峰(177.9×10-6、177.8×10-6处),但在高场区23×10-6附近未见信号峰,可以推测是葡萄糖醛酸C6的信号峰,SPF1~SPF4在101×10-6附近的信号峰对应异头碳C1[13]。
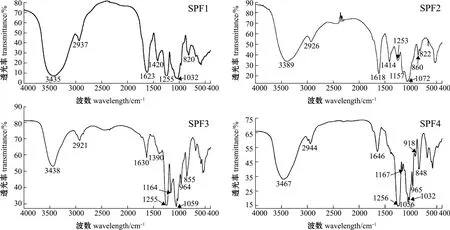
图4 SPF1~SPF4红外光谱图Fig.4 The IR spectra of SPF1-SPF4

图5 SPF1~SPF413C核磁共振谱图Fig.513C NMR spectra of SPF1-SPF4
3 讨论
3.1 岩藻聚糖硫酸脂的单糖组成
目前,已经有多种褐藻中岩藻聚糖硫酸酯结构的相关报道,不同种类褐藻提取的岩藻聚糖硫酸酯单糖组成差异较大。徐杰等[14]发现,羊栖菜岩藻聚糖硫酸酯主要由岩藻糖、半乳糖、甘露糖和葡萄糖组成,经Q-Sepharose Fast Flow纯化得到3个组分F1、F2、F3,其中F3的岩藻糖含量最高,为70.5%;刘承颖等[15]利用DEAE-C52纯化半叶马尾藻岩藻聚糖硫酸酯得到F1和F2两个组分,主要由岩藻糖和糖醛酸组成;吴元峰等[16]研究了裙带菜岩藻聚糖硫酸酯,经DEAE-Sepharose Fast Flow柱层析纯化得到5个组分F1~F5,其中F1、F4、F5主要由岩藻糖和半乳糖组成,F2、F3中含有鼠李糖、岩藻糖、甘露糖,还含有少量木糖和葡萄糖。同种褐藻以不同方法提取的岩藻聚糖硫酸酯,因其在提取过程中硫酸根的保留程度不同以及褐藻胶杂质含量的差异等,对岩藻聚糖硫酸酯的结构分析也产生了影响。张淑平等[17]研究了乙醇沉淀法和电解质沉淀法对所提取的海带岩藻聚糖硫酸酯中总糖、硫酸根含量等的影响,发现使用乙醇沉淀法提取物中各项指标均高于后者。何云海等[18]利用复合酶解法提取裙带菜孢子叶中岩藻聚糖硫酸酯,结果表明,该方法较传统水煮法所得粗提物中硫酸根含量更高。本研究中采用复合酶解-乙醇沉淀法提取树皮藻岩藻聚糖硫酸酯,利用DEAE-Sepharose Fast Flow柱层析纯化得到4个组分 SPF1~SPF4,盐度梯度洗脱组分SPF2、SPF3和SPF4中岩藻糖含量逐渐升高,而SPF2中单糖组成复杂,除岩藻糖外还含有较多的鼠李糖、木糖、葡萄糖醛酸和甘露糖,这与吴元峰等[16]的研究结果相似。
3.2 岩藻聚糖硫酸酯的化学结构
关于树皮藻岩藻聚糖硫酸酯结构的研究较少, Zhang等[19]对树皮藻等4种褐藻岩藻聚糖硫酸酯粗提物进行了液相色谱分析,结果表明,树皮藻岩藻聚糖硫酸酯粗提物中有38%的岩藻糖和41%的半乳糖以及少量的葡萄糖、甘露糖和木糖,但并未对粗提物进行纯化。而本研究中,SPF2组分中检测到了较多的鼠李糖含量,这可能是由于树皮藻的生长环境和采摘季节不同造成的;SPF3、SPF4单糖组成中岩藻糖含量均在70%以上,但这2个组分的得率较低,分别为5.61%和4.23%。
刘舒[20]通过红外光谱分析了3种褐藻中岩藻聚糖硫酸酯的结构,其中多肋藻的3个纯化组分CF1~CF3分别在821、818、817 cm-1处有吸收峰,表明这3个组分的硫酸基团连接在岩藻糖的C4位上。张文清等[21]研究发现,海带岩藻聚糖硫酸酯TC1在848 cm-1处有吸收峰,是连接在岩藻糖C2 或C3位上硫酸基团的吸收峰。本研究中,通过红外光谱分析表明,SPF1在820 cm-1的吸收峰表明硫酸基团连接在岩藻糖的C2或C3位上,SPF2、SPF3、SPF4分别在860、855、848 cm-1的吸收峰表明其硫酸基团主要连接在岩藻糖的C4位上。
核磁共振碳谱是解析复杂碳水化合物的有效方法,本研究中结合单糖组成分析结果,SPF1、SPF2在18×10-6附近出现的信号峰应归因于组分中的鼠李糖和岩藻糖,且SPF2在此处的信号峰主要来源于鼠李糖C6;(96~106)×10-6是多种异头碳C1的信号区间,雷松藻岩藻聚糖硫酸酯的13C核磁分析表明,在101.3×10-6、104.3×10-6处分别是α-D-甘露糖的C1信号峰和β-D-葡萄糖醛酸的C1信号峰[22];Cong等[23]研究表明,羊栖菜岩藻聚糖硫酸酯结构中的β-D-半乳糖的C1信号峰出现在103.5×10-6处,而α-D-甘露糖、β-D-葡萄糖醛酸的C1信号峰分别出现在 (99.9~100.3)× 10-6、 (102.7~103.0) ×10-6区间;Bilan等[24]通过二维核磁共振波谱确认了墨角藻纯化后的第4个组分 (岩藻糖含量95%以上)结构中α-L-岩藻糖C1信号峰出现在 (98.0~101.2)×10-6区间。可见,在不同研究结果中,同种异头碳C1的出峰位置不完全相同。王展等[25]也在研究中指出,多种异头碳会出现重叠或相邻峰,且同种单糖在多糖结构中的位置不同会造成C1化学信号的迁移。本研究中,组分SPF1和SPF2均含有较多的甘露糖、葡萄糖醛酸、半乳糖和鼠李糖,而这2个组分在(96~106)×10-6区间信号峰比较集中,没有明显区分开强度较大的信号峰,因此,难以判断该信号区域内相邻近的信号峰分别对应的单糖残基类型, 而SPF3和SPF4中岩藻糖为主要组成单糖,仅含有少量的半乳糖,可以确定在101×10-6和18×10-6处分别为α-L-吡喃岩藻糖的C1和C6信号峰。
[1] 薛长湖,陈磊,李兆杰,等.岩藻聚糖硫酸酯体外抗氧化特性的研究[J].青岛海洋大学学报:自然科学版,2000,30(4):583-588.
[2] Kang M C,Kim S Y,Kim E A,et al.Antioxidant activity of polysaccharide purified from Acanthopanax koreanum Nakai stems in vitro and in vivo zebrafish model[J].Carbohydrate Polymers, 2015,127:38-46.
[3] Rabanal M,Ponce N M A,Navarro D A,et al.The system of fucoidans from the brown seaweed Dictyota dichotoma:chemical analysis and antiviral activity[J].Carbohydrate Polymers,2014, 101:804-811.
[4] Lee S H,Ko C I,Jee Y,et al.Anti-inflammatory effect of fucoidan extracted from Ecklonia cava in zebrafish model[J].Carbohydrate Polymers,2013,92(1):84-89.
[5] 李鸶鸶,汪秋宽,何云海,等.多肋藻岩藻聚糖硫酸酯的提取及其降血脂作用研究[J].大连海洋大学学报,2013,28(1):94-98.
[6] Rengasamy K R R,Aderogba M A,Amoo S O,et al.Potential antiradical and alpha-glucosidase inhibitors from Ecklonia maxima (Osbeck)Papenfuss[J].Food Chemistry,2013,141(2):1412-1415.
[7] 曲桂燕.五种褐藻岩藻聚糖硫酸酯提取纯化及其功能活性的比较研究[D].青岛:中国海洋大学,2013.
[8] 王景峰.萱藻岩藻聚糖硫酸酯的制备及其抗血栓活性的研究[D].青岛:中国海洋大学,2013.
[9] Rothman M D,Mattio L,Wernberg T,et al.A molecular investigation of the genus Ecklonia(Phaeophyceae,Laminariales)with special focus on the Southern Hemisphere[J].Journal of Phycology, 2015,51(2):236-246.
[10] Mwangi H M,Van Der Westhuizen J,Marnewick J,et al.Isolation,identification and radical scavenging activity of phlorotannin derivatives from brown algae,Ecklonia maxima:an experimental and theoretical study[J].Free Radicals and Antioxidants,2013, 3(S1):S1-S10.
[11] 刘红英,薛长湖,李兆杰,等.海带岩藻聚糖硫酸酯测定方法的研究[J].青岛海洋大学学报:自然科学版,2002,32(2): 236-240.
[12] 张惠芬,李宝才,范家恒,等.盐酸水解—硫酸钡重量法测定硫酸酯化多糖硫酸基含量方法考察[J].食品科学,2002,23 (5):107-111.
[13] 张海霞,汪秋宽,何云海,等.马尾藻褐藻多糖硫酸酯的分离纯化及结构研究[J].大连海洋大学学报,2016,31(5):559-562.
[14] 徐杰,李八方,薛长湖,等.羊栖菜岩藻聚糖硫酸酯的提取纯化和化学组成研究[J].中国海洋大学学报:自然科学版, 2006,36(2):269-272.
[15] 刘承颖,王维民.半叶马尾藻中岩藻聚糖硫酸酯的提取纯化及抗氧化研究[J].食品研究与开发,2008,29(11):71-75.
[16] 吴元锋,李亚飞,刘士旺,等.裙带菜中褐藻糖胶的提取纯化及其组成的研究[J].农业工程学报,2008,24(6):273-276.
[17] 张淑平,王金歌,施利毅.不同提取方法所得褐藻糖胶的理化性质比较[J].应用化学,2007,24(12):1448-1451.
[18] 何云海,汪秋宽,刘红丹.用复合酶酶解提取海带岩藻聚糖硫酸酯的工艺研究[J].大连水产学院学报,2006,21(1):55-58.
[19] Zhang Z Q,Till S,Knappe S,et al.Screening of complex fucoidans from four brown algae species as procoagulant agents[J]. Carbohydrate Polymers,2015,115:677-685.
[20] 刘舒.三种褐藻中岩藻聚糖硫酸酯的纯化及结构分析[D].大连:大连海洋大学,2013.
[21] 张文清,左萍萍,徐辰,等.海带中岩藻多糖的分离纯化与结构分析[J].食品科学,2012,33(1):68-71.
[22] 纪明侯.海藻化学[M].北京:科学出版社,2004:322.
[23] Cong Q F,Chen H J,Liao W F,et al.Structural characterization and effect on anti-angiogenic activity of a fucoidan from Sargassum fusiforme[J].Carbohydrate Polymers,2016,136:899-907.
[24] Bilan M I,Grachev A A,Ustuzhanina N E,et al.Structure of a fucoidan from the brown seaweed Fucus evanescens C.Ag.[J].Carbohydrate Research,2002,337(8):719-730.
[25] 王展,方积年.高场核磁共振波谱在多糖结构研究中的应用[J].分析化学,2000,28(2):240-247.
Purification and chemical structure of fucoidan extracted from brown seaweed Ecklonia maxima
JIANG Long,SONG Yue-fan,LUO Xuan,WU Long,CONG Hai-hua,WANG Qiu-kuan
(College of Food Science and Engineering,National Research and Development Branch Center for Seaweed Processing,Key Laboratory of Fishery Product Processing and Utilization of Liaoning Province,Dalian Ocean University,Dalian 116023,China)
The basic components were determined in brown seaweed Ecklonia maxima from South Africa and then crude fucoidan was subjected to a DEAE column chromatography,with four fractions named as SPF1,SPF2, SPF3,and SPF4.It was found that the seaweed had ash content of 18.59%,protein content of 9.16%,and fat content of 0.74%on the dry basis.The four fractions were collected and freezing dried,and then the yield,carbohydrate content and sulphate content were measured.The results showed that the yield and sulphate content were shown to be 18.19%and 12.07%in SPF1,24.02%and 5.44%in SPF2,5.61%and 15.58%in SPF3,and 4.23%and 19.30%in SPF4.The monosaccharide compositions and structural features of each fraction were analyzed by HPLC,FTIR,and NMR spectroscopy.The monosaccharides SPF1-SPF4 was primarily composed of fucose,galactose,rhamnose,mannose,and glucuronic acid,with small amount of glucose and xylose,in which fucose(70.92%)and galactose(86.20%)were the main constituents in SPF3 and SPF4.The IR spectra of the four fractions showed the typical absorption bands of polysaccharides,with signal peak of glucuronic acid C6 in SPF1 and SPF2 in the vicinity of 177×10-6in13C NMR spectroscopy.The 18×10-6regions of SPF3 and SPF4 were assigned to C6 of α-L-fucopyranose.
Ecklonia maxima;fucoidan;monosaccharide composition;structure analysis
TS254.1
A
10.16535/j.cnki.dlhyxb.2017.01.013
2095-1388(2017)01-0073-06
2016-12-02
国家自然科学基金资助项目 (31471610);国家海洋公益性行业科研专项 (201405040)
姜龙 (1990—),男,硕士研究生。E-mail:562589336@qq.com
汪秋宽 (1962—),女,教授。E-mail:wqk320@dlou.edu.cn

