自体DC/CIK细胞免疫治疗对EGFR基因突变阴性的晚期肺腺癌患者外周血微转移指标的影响
陆华东 马志红 刘志聪 邱国琴 华锋 崔恩海 王斌
●论 著
自体DC/CIK细胞免疫治疗对EGFR基因突变阴性的晚期肺腺癌患者外周血微转移指标的影响
陆华东 马志红 刘志聪 邱国琴 华锋 崔恩海 王斌
目的 探讨自体DC/CIK细胞免疫治疗对表皮生长因子受体(EGFR)基因突变阴性的晚期肺腺癌患者外周血微转移指标的影响。方法 选择EGFR基因突变阴性的晚期肺腺癌患者120例,按随机数字表法分为治疗组和对照组各60例。治疗组进行DC/CIK细胞免疫治疗,对照组仅进行定期随访。采用RT-PCR法检测两组治疗前、治疗1个月和治疗3个月的外周血微转移指标(CEA mRNA、MK mRNA和Lunx mRNA),同时观察两组患者的肿瘤无进展生存时间(PFS)。 结果 治疗组治疗1个月和3个月后3种指标的表达量均明显低于对照组,差异均有统计学意义(均P<0.05)。同时两组在治疗1个月和3个月后3种指标的表达量均较治疗前明显上升,差异均有统计学意义(均P<0.05)。此外,治疗3个月后,对照组有38例患者CEA mRNA达到了108copies/ml以上,有32例患者MK mRNA达到了109copies/ml以上,有35例患者Lunx mRNA达到了109copies/ml。治疗组和对照组肿瘤的中位PFS分别是3.10和2.52个月,差异有统计学意义(P<0.05)。 结论 自体DC/CIK细胞免疫治疗在EGFR基因突变阴性的晚期肺腺癌患者的维持治疗中达到了初步的疗效,一定程度上延长了生存时间。
肺腺癌 DC/CIK 微转移指标 癌胚抗原mRNA 中期因子mRNA 肺癌特异性X蛋白mRNA 维持治疗
近年来肺癌在全球范围内的发病率和死亡率呈上升趋势,已成为恶性肿瘤死亡的首要原因[1]。其中非小细胞肺癌(NSCLC)约占肺癌的80%[2-3],NSCLC主要包括肺腺癌和肺鳞状细胞癌,肺腺癌相对于其他类型发病率较高[4]。肺癌传统的治疗模式有外科手术治疗、放化疗及这些治疗方式的结合。目前,细胞治疗药物和靶向药物在对完成4~6周期的一线含铂方案治疗后且疾病达稳定或以上(部分缓解、完全缓解)的肺腺癌患者进行后续的维持治疗中已经取得了不错的疗效[5]。但是在临床工作中,一方面大多数患者很难耐受这些治疗后引起的毒性反应;另一方面对于表皮生长因子受体(epithelial growth factor receptor,EGFR)基因突变阴性的晚期肺腺癌患者,这些治疗方案并不能取得相应的疗效[6-7]。因此,本研究采用树突状细胞(dendritic,DC)/细胞因子诱导的杀伤细胞(cytokine-induced killer cell,CIK)细胞免疫治疗对一线化疗达稳定以上的EGFR基因突变阴性的晚期肺腺癌患者进行维持治疗,观察患者肿瘤的无进展生存时间(progression free survival,PFS),同时监测治疗前后外周血中微转移指标,包括癌胚抗原(carcinoembryonic antigen,CEA)mRNA、中期因子(midkine,MK)mRNA、肺癌特异性X蛋白(Lunx)mRNA,以评价DC/ CIK细胞免疫治疗在维持治疗中的作用。
1 对象和方法
1.1 对象 选取2014年8月至2016年3月在本院经病理(包括经皮肺穿刺活检病理、纤维支气管镜活检及术后病理)和基因检测后确诊为EGFR基因突变阴性的晚期肺腺癌患者120例,按随机数字表法分为治疗组和对照组各60例。治疗组男18例,女42例;年龄28~65(45.69±4.89)岁;病程4.5~14.6(6.89±0.98)个月;疾病分期:Ⅲb期23例,Ⅳ期37例。对照组男21例,女39例;年龄31~67(44.91±5.03)岁;病程3.2~11.4(6.63±1.09)个月;疾病分期:Ⅲb期22例,Ⅳ期38例。两组患者性别、年龄、病程和疾病分期比较差异均无统计学意义(均P>0.05)。本研究获得医院伦理委员会批准和患者知情同意。
1.2 方法 治疗组在化疗结束14d后实施DC/CIK细胞免疫治疗;对照组定期随访,随时监测,直至病情出现进展。
1.2.1 DC/CIK细胞的制备 抽取120例肺腺癌患者外周静脉血100ml,3 000r/min离心10min,分离单个核细胞。使用0.9%氯化钠溶液对分离出来的单个核细胞连续洗涤3次。随后对单个核细胞分别进行DC和CIK培养。培养当日先用含有各种细胞因子的培养基培养DC,换液时间为半天;用无血清生长培养基培养CIK,平均每2~3d更换1次培养基。培养7d后,收集CIK和DC,按1∶10比例联合共同培养。培养第11天,检测其细菌、真菌等微生物的培养情况,各项指标均合格后,收集共培养的DC/CIK细胞。使用无菌0.9%氯化钠溶液对共培养的DC/CIK细胞进行连续洗涤3次,然后分装成5袋,每袋加入约5%的人血清白蛋白。患者每天回输1袋,规定6d为1个疗程,连续治疗2个疗程。通常是第1次治疗时间为半个月,治疗1个月后再进行第2次治疗,再隔1个月进行第3次治疗。每一阶段结束治疗后,抽取所有患者静脉血5ml,对其外周血微转移指标的表达进行检测。DC/CIK细胞的制备及治疗流程图见表1。

表1 DC/CIK细胞的制备及治疗流程图
1.2.2 RT-PCR法检测外周血中微转移指标 应用RT-PCR法对外周血中微转移指标进行检测,RNA提取完全按照Trizol总RNA提取试剂盒说明书 (北京天根生化科技有限公司)进行实验操作。按照引物设计原则对3种指标进行引物设计。CEA mRNA,正向:5′-TAGCTACTTACTACTTACTACTCCT-3′,反向:5′-CTTTTGTCCCGGCACATCGGGC-3′,探针:5′-TGTATCGGGACGTGCACAAAGACAG-3′;MK mRNA,正向:5′-CATCACACGCACCCCAGTT-3′,反向:5′-ATTGCGGCGTGGGTTTC-3′,探针:5′-CTTGCAGTCGGCTCCAAACTCCTTCTT-3′;Lunx mRNA,正向:5′-AAGTCTGTTGAGGCTGGCTG-3′,反向:5′-GCCAAGTCCATCAAGCAGAG-3′,探针:5′-FAM-CCTCAACAGACTTGCACCGACCA-TAMRA-3′。以上引物均由上海生工生物工程公司合成。
1.2.3 观察患者肿瘤的PFS PFS指患者从入组开始至复发或死亡的时间,或至因疾病进展而停药的时间。
1.3 统计学处理 采用SPSS 18.0统计软件。计量资料以表示,组间比较采用独立样本t检验,组内比较采用配对t检验;计数资料组间比较采用χ2检验。
2 结果
2.1 两组患者治疗前后外周血微转移指标检测结果比较 治疗组治疗1个月和3个月后3种指标的表达量均明显低于对照组,差异均有统计学意义(均P<0.05)。同时两组在治疗1个月和3个月后3种指标的表达量均较治疗前明显上升,差异均有统计学意义(均P<0.05),见表2和图1。治疗3个月后,对照组有38例患者CEA mRNA达到了108copies/ml以上,有32例患者MK mRNA达到了109copies/ml以上,有35例患者Lunx mRNA达到了109copies/ml。
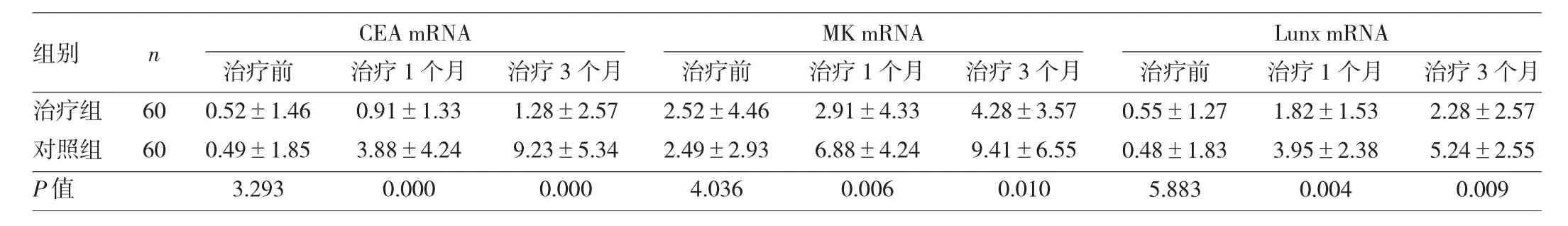
表2 两组治疗前后外周血微转移指标检测结果比较(copies/ml)

图1 两组患者治疗前后外周血微转移指标的表达结果
2.2 两组患者肿瘤的PFS比较 两组患者肿瘤的中位PFS分别是3.10和2.52个月,95%CI分别是2.89~3.51和2.37~2.69个月,两组比较差异有统计学意义(P<0.05),见图2。

图2 两组患者肿瘤的PFS比较
3 讨论
近年来随着环境恶化、压力的增加,恶性肿瘤的发病率呈逐年上升趋势,对人类的健康造成了极大的危害。肺癌位居恶性肿瘤发病率首位,晚期肺腺癌已经成为肺癌的常见病理类型,对其诊断治疗的研究已经引起了极大的关注。目前临床上对于一线化疗结束后达到稳定的肺腺癌患者,通过测定外周血或组织中EGFR基因突变与否来决定下一步治疗。对于EGFR基因存在突变的患者,一般建议口服TKI靶向药物[8]。TKI药物不良反应较小,服用方便,尤其对EGFR基因突变的肺腺癌患者疗效满意[9]。这种药物不是以杀死肿瘤细胞为目的,主要是以细胞内特异性或高表达的或肿瘤细胞膜上的分子作为靶点,阻止其生长或诱导其凋亡,同时降低了对正常细胞的杀死作用。但是对这种靶向药物的应用存在一些局限,尤其当病情发生进展后可选择的治疗措施减少,通常产生许多不良反应并且不能彻底清除肿瘤细胞[10]。另外,TKI药物对EGFR基因无突变的肺腺癌晚期患者的治疗效果不佳。目前对EGFR基因突变阴性的晚期肺腺癌患者,在放化疗结束后达到稳定,下一步如何维持治疗成为难题。
维持治疗是指在初始治疗获得成功控制后,有助于阻滞肿瘤发生与发展的相关措施,主要有疫苗、抗体以及药物等[11],是指在一线治疗后给予巩固治疗或序贯治疗以维持疗效,以期延长生存时间和提高生活质量的目的[12]。目前临床应用的多种维持治疗方案存在许多弊端,比如患者会出现不耐受,免疫排斥以及长久的使用会出现耐药等[13]。DC/CIK是一种新型的免疫生物治疗方法,这种方法是利用自体免疫细胞进行简单处理后回输患者体内,克服了既往疗法的很多缺点[14]。已经有研究报道,DC/CIK细胞治疗在别的疾病的维持治疗中可以有明显的效果,延长了患者的生存时间,改善了生活质量[15-17],但是尚未见文献报道此方法在EGFR基因突变阴性的晚期肺腺癌患者中进行维持治疗的效果。
本研究主要是针对入组一线化疗后病情达到稳定控制后的EGFR基因突变阴性的晚期肺腺癌患者,采集患者外周静脉血,体外制备成DC/CIK细胞,定期回输给患者,采用RT-PCR法检测外周血中CEA mRNA、MK mRNA、Lunx mRNA这些微转移指标的表达情况,观察治疗前后患者外周血中微转移变化情况。通过本课题的研究,笔者发现治疗组治疗1个月和3个月后3种指标的表达量均明显低于对照组,差异均有统计学意义。治疗组和对照组肿瘤的中位PFS分别是 3.10和2.52个月,差异有统计学意义。经过DC/CIK细胞免疫治疗后,尽管一些患者最终仍会面临一些病情的变化,但是此方法已经初步达到了延长生存时间,改善生活质量的效果,为EGFR基因突变阴性的晚期肺腺癌患者维持治疗提供了新的治疗方案。后续笔者将会进一步优化方法,比如结合其他一些血液指标,更快速地反映病情的变化,更及时地采取免疫治疗;另外,加大样本量,进一步探索此方法的有效性和安全性,期望能够达到更大的临床疗效。
因此本研究得出自体DC/CIK细胞治疗方法在EGFR基因突变阴性的晚期肺腺癌患者维持治疗过程中达到了初步的疗效,一定程度上改善了生存质量,为临床治疗此类患者提供了新思路。
[1]Jermal A,Bray F,Center M M,et al.GloBal cancer statistics[J]. CACancer J Clin,2015,65(2):87.doi:10.3322/caac 21262.
[2]顾勤花,沈琦斌,李冬,等.血清midkine检测在非小细胞肺癌辅助诊断及预后评估中的价值[J].浙江医学,2016,38(7):469-471.
[3]Dorantes-Heredia R,Ruiz-Morales J M,Cano-García F.Histopathological transformation to small-cell lung carcinoma in nonsmall cell lung carcinoma tumors[J].Transl Lung Cancer Res, 2016,5(4):401-412.doi:10.21037/tlcr.2016.07.10.
[4]Wang Y,Zhao H,Gao X,et al.Identification of a three-miRNA signature as a blood-borne diagnostic marker for early diagnosis oflung adenocarcinoma[J].Oncotarget,2016,7(18):26070-26086. doi:10.18632/oncotarget.8429.
[5]Cappuzzo F,Ciuleanu T,Stelmakh L,et al.Erlotinib as maintenance treatment in advanced non-small-cell lung cancer:a multicentre,randomised,placebo-controlled phase 3 study[J]. Lancet Oncol,2010,11(6):521-529.doi:10.1016/S1470-2045 (10)70112-1.
[6]Jain A,Lim C,Gan E M,et al.Impact of smoking and brain metastasis on outcomes of advanced EGFR mutation lung adenocarcinoma patients treated with first line epidermal growth factor receptor tyrosine kinase inhibitors[J].PLoS One,2015,10(5): e0123587.doi:10.1371/journal.pone.0123587.eCollection 2015.
[7]Yu J Y,Yu S F,Wang S H,et al.Clinical outcomes of EGFR-TKI treatment and genetic heterogeneity in lung adenocarcinoma patients with EGFR mutations on exons 19 and 21[J].Chin J Cancer,2016,35:30.doi:10.1186/s40880-016-0086-2.
[8]Li H,Wang Y,Su F,et al.Monitoring of cyclooxygenase-2 levels can predict EGFR mutations and the efficacy of EGFR-TKI in patients with lung adenocarcinoma[J].Int J Clin Exp Pathol,2015,8 (5):5577-5583.
[9]Qiao X,Zhang Y,Wang J,et al.Subsequent treatment of epidermal growth factor receptor-tyrosine kinase inhibitor failure in patients with advanced lung adenocarcinoma[J].Thorac Cancer, 2015,6(6):678-686.doi:10.1111/1759-7714.12236.
[10]Irwin M E,Johnson B P,Manshouri R,et al.A NOX2/Egr-1/Fyn pathway delineates new targets for TKI-resistant malignancies [J].Oncotarget,2015,6(27):23631-23646.
[11]Gerber D E,Schiller J H.Maintenance Chemotherapy for Advanced Non-Small-Cell Lung Cancer:New Life for an Old Idea [J].J Clin Oncol,2013,31(8):1009-1020.doi:10.1200/JCO.2012. 43.7459.
[12]刘晓晴.晚期NSCLC维持治疗质疑与问题解析[J].中国肺癌杂志, 2014,17(4):289-293.
[13]Schmiegelow K,Nielsen S N,Frandsen T L,et al.Mercaptopurine/Methotrexate Maintenance Therapy of Childhood Acute Lymphoblastic Leukemia:Clinical Facts and Fiction[J].J Pediatr Hematol Oncol,2014,36(7):503-517.doi:10.1097/MPH.0000-000000000206.
[14]郭伟伟,刘莉,吴德华.DC-CIK细胞免疫治疗联合TACE术治疗原发性肝癌[J].南方医科大学学报,2014,34(5):674-678.
[15]Zheng Y W,Li R M,Zhang X W,et al.Current Adoptive Immunotherapy in Non-Small Cell Lung Cancer and Potential Influence of Therapy Outcome[J].Cancer Investigation,2013,31 (3):197-205.doi:10.3109/07357907.2013.775294.
[16]Yuan Y Y,Niu L Z,Mu F,et al.Therapeutic outcomes of combining cryotherapy,chemotherapy and DC-CIK immunotherapy in the treatment of metastatic non-small cell lung cancer[J]. Cryobiology,2013,67(2):235-240.doi:10.1016/j.cryobiol.2013. 08.001.
[17]刘光艺,李洋,陈振海,等.DC-CIK细胞联合全身静脉化疗治疗晚期结直肠癌伴弥漫性肝转移临床疗效分析[J].重庆医科大学学报, 2014,39(3):368-373.
DC/CIK immunotherapy for patients with advanced lung cancer with negative EGFRgene mutation
LU Huadong,MA Zhihong,LIU Zhicong,et al.Department of Respiratory Medicine and Intensive Care Unit,Huzhou Central Hospital,Huzhou 313003, China
Objective To evaluate the clinical effect of DC/CIK immunotherapy in treatment of advanced lung adenocarcinoma patients with negative epidermal growth factor receptor(EGFR)gene mutation. Methods One hundred and twenty advanced lung cancer patients with negative EGFR gene mutation were randomly divided into two groups with 60 cases in each group.Patients in treatment group received DC/CIK immunotherapy and those in control group were followed up only.Real-time PCR was used to examine the expression of CEA mRNA,MK mRNA and Lunx mRNA.Progression free survival(PFS)was used to monitor the change of clinical state after treatment with DC/CIK.And the results were analyzed statistically. Results The expression levels of CEA mRNA,MK mRNA and Lunx mRNA in treatment group were lower than those in control group 1 and 3 months after treatment(all P<0.05).After 3 months,in control group there were 38 cases with CEA mRNA>108copies/ml,32 cases with MK mRNA>109copies/ml and 35 cases with Lunx mRNA>109copies/ml.In treatment group there was significant difference in CEA mRNA and MK mRNA expression before and after DC/CIK treatment(all P<0.05).The progression-free survival in treatment and control groups was 3.10 months and 2.52 months,respectively(P<0.05). Conclusion DC/CIK immunotherapy can improve the quality of life and may be used as a maintenance treatment for patients with advanced lung adenocarcinoma.
Lung adenocarcinoma Dendritic cells-cytokine-induced killer cells Micrometastases Carcinoembryonic antigen mRNA Midkine mRNA Lung specific Xprotein mRNA Maintenance therapy
2016-12-25)
(本文编辑:陈丽)
10.12056/j.issn.1006-2785.2017.39.7.2016-2188
浙江省医药卫生平台计划(2015DTA016)
313003 湖州市中心医院呼吸与危重症学科(陆华东、刘志聪、邱国琴、华锋、崔恩海、王斌),中心实验室(马志红)
王斌,E-mail:3414169736@qq.com

