NOD蛋白与免疫应答
沈雪莹 方传雷 刘志华
(中国科学院生物物理研究所,中科院感染与免疫重点实验室,北京100101)
·专家述评·
NOD蛋白与免疫应答
沈雪莹 方传雷 刘志华
(中国科学院生物物理研究所,中科院感染与免疫重点实验室,北京100101)
NOD蛋白包括NOD1和NOD2,两者识别细菌肽聚糖的片段,诱导促炎和抗菌反应。在本篇综述中,我们介绍近年来NOD蛋白的研究进展,包括激活的方式,信号途径的调节,在细胞中的定位以及在免疫防御过程中发挥的作用。洞悉NOD蛋白诱导的信号通路有助于了解相关疾病的致病机理,为疾病的治疗提供新的视角。
NOD蛋白;胞内定位;生理功能

沈雪莹(1992年-),2015年毕业于厦门大学生物科学专业,同年就读于中国科学院大学,并推荐免试进入中国科学院生物物理研究所,目前就读研究生二年级,师从刘志华研究员,主要从事肠道菌与宿主之间相互作用的研究。

方传雷(1991年-),2014年毕业于东北林业大学生命科学专业,2015年考入中国科学院大学,并于生物物理研究所攻读硕士学位,师从刘志华研究员,主要从事肠道共生菌与宿主肥胖研究。

刘志华(1976年-),现任中国科学院生物物理研究所研究员,博士生导师。同时就职于中科院生物大分子科教融合卓越中心。1999年毕业于北京大学生命科学学院,2006年毕业于美国哈佛大学,2006~2011年在美国国立卫生院进行博士后研究,主要从事肠道共生菌与宿主健康的关系研究。
固有免疫系统作为宿主防御机制之一,在识别和清除感染机体病原菌的过程中发挥重要作用。固有免疫应答的实现依赖于体内蛋白对保守的微生物相关分子模式的识别作用。 含有核苷酸结合寡聚域(Nucleotide-binding oligomerization domain,NOD)的NOD1和NOD2同属NOD样蛋白,是一类胞内模式识别受体蛋白。 NOD1和NOD2蛋白具有同源性并且其信号通路高度相似,本综述将NOD1和NOD2蛋白统称为NOD蛋白。NOD1可识别的最小单元为gamma-D-glutamyl-meso-diaminopimelic acid(iE-DAP),iE-DAP常见于革兰氏阴性菌的肽聚糖中,在某些革兰氏阳性菌中也有存在,例如李斯特菌和芽孢杆菌;NOD2可识别的最小单元为胞壁酸酰二肽(Muramyldipeptide,MDP),MDP广泛存在于细菌肽聚糖中。活化的NOD1和NOD2可以进一步诱导NF-κB和MAPK依赖的基因转录,从而启动促炎和抗菌应答。
2001年研究发现NOD2是与克罗恩病相关的基因[1,2],目前也是较受关注的克罗恩病易感基因之一。NOD1和NOD2蛋白在维持肠道稳态过程中的作用吸引了众多学者的关注。十余年来,关于NOD蛋白的研究已有了突破性进展,其中包括NOD蛋白相关的信号通路研究、在细菌感染过程中发挥的作用以及维持组织稳态和疾病相关的研究。在这篇综述中,我们主要对领域内关于NOD蛋白的一些前沿研究进展进行总结并提示目前的研究还没有阐明的问题。
1 NOD蛋白的生物学
1.1NOD蛋白的结构 NOD1和NOD2蛋白主要由三部分构成,即:羧基末端连串的富含亮氨酸的重复单元(LRRs)、中间核苷酸结合功能域(NBD)以及氨基末端细胞凋亡蛋白酶募集结构域(CARD)。NOD1蛋白氨基末端由单个CARD功能域组成;NOD2蛋白氨基末端由串联的CARD功能域组成。有研究表明NOD蛋白的LRR功能域行使配体感应的功能,即:NOD2对MDP的识别;NOD1对iE-DAP的识别[3,4]。并且,NOD蛋白对其配体的识别引发其构象的改变,促使NBD介导的NOD蛋白自身寡聚化。
对NOD信号通路的研究发现了NOD1或NOD2的寡聚化促进其招募下游接头蛋白RIP2,并通过 CARD-CARD结构域相互作用形成大的蛋白复合物[5-8]。尽管NOD信号通路模型的结构基础被研究了多年,然而其潜在的分子模式仍未被证实,如NBD功能域的ATP结合以及水解区的作用、NOD1或NOD2结合各自配体的方式。
1.2NOD蛋白配体进入宿主细胞的方式 NOD蛋白作为胞内受体,目前认为存在以下几种其配体进入细胞的方式:①胞内病原菌感染,比如弗氏志贺菌的感染,这种胞内病原菌能引起NOD蛋白信号通路的活化[9]。②胞外菌通过分泌系统将细菌肽聚糖传递到宿主细胞中。有研究表明,幽门螺旋菌的分泌系统以及革兰氏阴性菌外膜囊泡可以将细菌肽聚糖传递到宿主细胞中[10-12]。③在上皮细胞中,细菌肽聚糖也可以通过内吞作用进入宿主细胞[13,14]。④寡肽转运子,如PEPT1和SLC15A4,可以有效地携带肽聚糖片段进入宿主细胞胞质中[14,15]。⑤间隙连接能够介导感染细胞周围的正常细胞内NOD1信号通路的活化[16]。另外,最近的研究表明,在小肠远端区域,纳米颗粒能够诱捕环境中的肽聚糖或口服来源的蛋白抗原,利用上皮M细胞进入派尔氏集合淋巴小结,将肽聚糖转运到肠道组织中的免疫细胞中,进而维持肠道免疫稳态[17]。
这些进入胞质的途径表明NOD1和NOD2蛋白可能感应胞外细菌释放的配体,包括肠道共生菌的成分。尽管从传统意义上讲,NOD蛋白涉及侵入到胞质的细菌检测,然而最近的研究进展拓宽了NOD1和NOD2所检测的范围,这暗示NOD蛋白在免疫应答中发挥着更广泛的作用。
2 NOD蛋白的表达与胞内定位
NOD1蛋白在造血来源或非造血来源的细胞中均有表达;而NOD2蛋白的表达具有一定的限制性,其主要在髓系来源以及淋巴来源的细胞中表达。研究表明,在胃肠道中,NOD2蛋白在肠道上皮细胞以及潘式细胞中均有表达,并且NOD2的表达受多种刺激调控[18,19]。目前的文献强调NOD2蛋白在TNF、IFN-γ、1,25-dihydroxyvitamin D3以及丁酸盐处理的上皮细胞中表达上调,并且增加对MDP的应答[20-23]。NOD1和NOD2的表达在造血细胞来源的细胞中被调控,比如脂多糖(LPS)、Ⅰ型IFN以及TNF均会增加巨噬细胞内NOD1和NOD2的表达[24,25]。除此之外,NOD蛋白的降解也被严密调控。有研究表明巨噬细胞经过MDP刺激后引发细胞内依赖蛋白酶体途径的NOD2和RIP2蛋白的降解[26,27]。
NOD1和NOD2属于胞质蛋白,缺少跨膜功能域。有意思的是,有研究报道NOD1和NOD2均可被招募到质膜上,从而使NOD1和NOD2位于在细菌侵入宿主细胞的入口处[28]。近期研究发现NOD1和NOD2蛋白被招募到S.flexneri侵入的质膜位点上,招募ATG16L1到质膜,促进S.flexneri进入自噬小体中并清除[29]。含有支架蛋白FERM和PDZ功能域的蛋白2(FRMPD2)蛋白定位在上皮细胞的基底外侧膜上。有研究表明FRMPD2蛋白为NOD2和ERBIN蛋白提供关键的联系,从而形成复合体结构[30]。NOD1被报道同紧密连接相关蛋白RHO鸟嘌呤核苷酸交换因子2(ARHGEF2)相互作用,促进病原菌感染时信号通路的活化[31]。有研究表明NOD2定位到质膜上也与其驱使NF-κB活化的能力相关[18,29]。 Irving等[32]证明NOD1在检测革兰氏阴性菌胞外囊泡包裹的肽聚糖时,可以迁移到早期胞内体上,并与RIP2相互作用来活化细胞自噬以及炎症应答。Nakamura等[33]的研究表明NOD2和RIP2募集到内体膜(Endosome)上,并与SLC15A3/A4形成复合体来感应病原菌来源的MDP。在肠道共生菌影响小肠隐窝中潘氏细胞胞内溶菌酶分选的研究中,Zhang等[34]证明NOD2和LRRK2募集Rab2a到潘氏细胞的致密核心囊泡(DCV)表面上,并且三者在DCV上影响潘氏细胞中溶菌酶的分选过程。尽管NOD蛋白定位到膜结构上使NOD蛋白信号通路活化,但是这个领域仍需要未来的工作去完全理解这个过程。
3 NOD信号通路与调节
NOD2基因的功能丧失型突变和功能获得型突变都会引起疾病发生。功能丧失型突变影响了NOD2介导的肽聚糖识别过程,这一突变与克罗恩病相关[35];在NOD2的NBD段发生功能获得型突变与自身炎症性疾病相关,如Blau综合征、早发型结节病[36,37]。越来越多的研究证实了疾病过程中NOD蛋白的表达变化,因此了解NOD蛋白的信号通路和调节机制十分重要。
3.1NOD蛋白的激活 NOD1和NOD2蛋白在结构上具有一个相同的NOD组件,由NBD、WH、HD1和HD2组成。由ADP介导的NBD与WH之间相互作用使NOD蛋白具有稳定的紧密构象,同时NOD蛋白的构成元件之一LRRs起到封闭这些结构域的作用,导致胞浆中的NOD1和NOD2蛋白以自我抑制的单体形式存在[38]。通常认为与相应肽聚糖配体结合后,NOD1和NOD2蛋白的构象发生变化,从而促进激活,然而这种看法目前还缺乏实验证据。Keestragounder等[39]发现内质网应激诱发的促炎应答过程由依赖NOD1/NOD2,且易受TUDCA/KIRA6影响的信号通路调节。其中TUDCA是内质网应激抑制剂,KIRA6是IRE1α激酶抑制剂,IRE1α参与这一过程中NOD蛋白诱导的NF-κB信号通路。这一信号通路区别于细菌肽聚糖片段诱导的不受TUDCA/KIRA6影响的信号通路。这一研究结果提示我们,除了经典的感应细菌来源的配体而被激活的NOD蛋白通路,NOD蛋白可能由其他形式激活并发挥功能。
3.2NOD信号通路过程 NOD1和NOD2一旦活化,通过同型CARD之间相互作用招募RIPK2(Receptor-interacting serine/threonine-protein kinase 2),活化RIPK2。活化的RIPK2招募并激活TAK1激酶,TAK1激酶(TGFβ-activated kinase 1)进而激活IKK复合物和MAPK途径。IKK调节NF-κB抑制剂IkBα的磷酸化,导致IkBα聚泛素随后降解,使NF-κB能够入核作为转录因子影响下游靶基因的表达[40]。NOD信号同时也激活MAPK,包括ERK1、ERK2、JNK和p38。RIPK2在整体NOD信号通路中扮演重要角色,有研究表明RIPK2缺陷型小鼠不会对NOD配体产生应答[41]。
另外,NOD蛋白也能够激活其他的信号途径,但目前的研究并没有完全阐明其中机制。已有研究发现感应细菌来源的配体激活的NOD蛋白招募RIPK2,活化的RIPK2结合TRAF3蛋白。TRAF3蛋白继而激活TBK1和IKKε,促进IRF3和IRF7的磷酸化而被激活。活化的IRF3和IRF7形成二聚体入核,诱导Ⅰ型IFN基因的表达[42-44]。
3.3NOD信号通路的调节 在NOD介导的NF-κB信号通路中,蛋白翻译后的泛素化修饰影响了很多环节。例如,RIPK2的泛素化修饰促进TAK1的招募[45]。已有研究证实了一些可以结合并催化RIPK2泛素化从而调控NOD信号通路的E3连接酶,包括cIP1(cellular inhibitor of apoptosis 1)、cIP2、ITCH和Pellino3[46-48]。类似于NOD2突变的影响,已证实在NOD信号通路过程中发挥作用的E3连接酶突变影响正常的NOD信号通路并与克罗恩病相关,例如XIAP(X-linked inhibitor of apoptosis protein)的突变[49,50]。NOD信号通路的调节对维持细胞稳态从而抑制过度或不足的免疫应答的过程十分重要。目前的研究已经证实了一些影响NOD信号通路的正调控物和负调控物。
A20是第一个被证实可以负调控NOD介导的NF-κB信号通路的泛素蛋白酶。Hitotsumatsu等[51]研究表明A20敲除会导致RIPK2泛素化水平提高,增强NF-κB信号。除此之外,过表达A20的细胞内NOD2活性被抑制,而且呈现A20剂量依赖性。有趣的是,A20的激活需要NOD2的活化,这暗示着NOD2和A20是某负反馈环的一部分[52]。A20减弱NF-κB信号通路的机制是A20自身的调节作用。A20蛋白的N端可以去除C端的泛素化,并在RIPK2的K48位加入泛素链,两者共同作用切断了NOD2介导的NF-κB信号途径。A20的单核苷酸突变与几种慢性炎症疾病相关,例如类风湿性关节炎、牛皮癣、系统性红斑狼疮[53]。多方面独立的研究证实了A20是克罗恩病的易感基因[54,55]。与健康的样本相比,克罗恩患者的活组织切片检查结果显示着较低或缺失表达的A20蛋白[56]。此外,研究显示A20缺陷型小鼠对DSS诱导的结肠炎更加敏感并对TNF-α的应答反应更强[57,58]。综上所述,缺乏A20调节的NOD2活性可能导致机体对共生菌的过度应答并引发机体无法掌控的炎症反应。
Zurek等[27]研究证实了一种E3连接酶TRIM27(Tripartite motif containing 27)可以通过影响蛋白泛素化来负调控NOD信号通路。TRIM27与NOD2蛋白以高亲和力相互作用,使NOD2上的第48位赖氨酸(K48)泛素连接,最后介导NOD2进入蛋白酶体而被降解。MDP能够增强TRIM27与NOD2之间的相互作用,这也许能够解释MDP耐受的现象。MDP耐受表现为,MDP预处理的人细胞和小鼠细胞在MDP的再次刺激下诱导的NOD2活性降低[59,60]。对克罗恩患者的结肠切片检查显示,与健康样本相比,TRIM27的表达水平升高,这一结果告诉我们上调TRIM27会减弱NOD2活性导致肠道稳态受损。
环指蛋白34(RNF34)和PSMA7(20S proteas-ome subunit alpha 7)被认为是新发现的具有负调控NOD1信号通路的调控蛋白。体外实验已证明NOD1的活性与RNF34和PSMA7的水平相关。普遍认为这一调控机制是RNF34和PSMA7通过泛素-蛋白酶体途径,将K48位泛素化的NOD1蛋白靶向到蛋白酶体并通过蛋白水解的作用被降解。抑制实验的结果也支持了这种解释,实验显示RNF34和PSMA7对NOD1蛋白活性的抑制作用通过抑制剂的作用被明显减弱。但是,RNF34和PSMA7蛋白与慢性炎症疾病的联系还需要进一步的研究[61,62]。
构成NOD1蛋白的CARD元件与泛素之间的相互作用的机制已经通过核磁共振和X射线结晶的手段阐明[63,64]。此外,NOD2蛋白的CARD突变导致NOD2不能被有效泛素化进行降解而提高了下游CXCL8的分泌。
Erbin作为能与NOD2蛋白特异性结合的蛋白,无论在体内还是体外都能够负调控NOD2蛋白的活性。Erbin过表达会降低MDP诱导的NOD2信号并呈现剂量依赖性[65,66]。因此推测Erbin调控的潜在分子机制是通过改变MDP的敏感性实现对NOD2蛋白的调控。然而Erbin蛋白在疾病模型中的表达情况还需要进一步检测。
另一种调控NOD2信号的蛋白CARD8(Caspase recruitment domain-containing protein 8)能够与NOD2蛋白共定位。研究显示CARD8能够抑制NOD2对细菌的作用以及MDP诱导的NF-κB促炎信号。活检分析显示克罗恩患者的结肠黏膜相比健康样本表达更高的CARD8[67]。通过对CARD8的一种特定的突变形式的研究更加证实了CARD8与克罗恩病的联系。除了与克罗恩病之间的联系,已有研究表明CARD8与其他NLR相关疾病的关系,包括动脉粥样硬化。在动脉粥样硬化患者的斑块中检测到更高的CARD8信使RNA的表达[68]。
对比负调控NOD信号的发现,迄今为止已有的研究只证实了较少的正调控NOD信号的调控物。凋亡蛋白BID(BH3-interacting domain death agonist)是通过siRNA筛选手段被证实的正调控NOD信号的蛋白,它能够连接到活化的RIPK2促进IKK复合物的招募。缺乏BID的表达会抑制NOD2诱导的NF-κB和ERK1、ERK2的活化,但并不影响JNK和p38的活化。这一有趣的研究结果暗示我们NOD信号中复合物具有多种形式[69]。需要指出的是,也有研究表明BID缺陷型小鼠表现出正常的依赖NOD蛋白的应答[70,71]。另外有报道揭示了LRRK2能够促进NOD2激活的RIP2的磷酸化,进而促进了NOD-RIP2信号通路诱导的炎性因子的表达[72]。
早期的研究表明细胞骨架相关分子会影响NOD信号。经过细胞松弛素D作用的巨噬细胞会增强对NOD蛋白配体的应答[73]。同时NOD2的激活会被细胞骨架调控蛋白RAC1和PAK3BP抑制,敲低RAC1或PAK3BP蛋白的表达都会增强MDP诱导的NOD2激活。此外,RHO亚家族GTP酶的活化结构(RAC1、CDC42、RHOA)在缺乏肽聚糖感应的时候能够显著激活NOD1蛋白依赖的NF-κB信号。类似地,在没有NOD蛋白配体感应的情况下,调节RHOA活化的ARHGEF2蛋白的激活也能够增强NOD信号[31,74]。但是目前这些研究的深层含义并不清楚,因为这些结果暗示着在没有细菌刺激的情况下,细胞骨架正常改变导致的GTP酶的激活会诱发炎症,这是目前无法理解的。
已有研究结果显示促炎因子可能调控NOD蛋白的表达。IFN-γ能够通过增加细胞核干扰素调控因子1(Nuclear interferon regulatory factor 1)间接地提高NOD1的RNA和蛋白表达水平,并呈现时间剂量依赖性。而其他细胞因子(包括TNF-α和IL-1β)并不会影响NOD1的水平,因此IFN-γ对NOD1表达的提高是特异的[75]。早前的研究表明TNF-α可以通过IkBα磷酸化降解途径,增强NF-κB信号[76]。基于这个结果,有研究证实TNF-α处理过的肠道上皮细胞内,NOD2的RNA水平提高[23]。不同于对NOD1蛋白的影响,IFN-γ并不能上调NOD2蛋白的表达,但是IFN-γ与TNF-α之间具有协同作用,IFN-γ可以增强TNF-α诱导的NOD2表达水平的提高[77]。
除了通过蛋白调控NOD通路的方式外,饮食同样在NOD信号通路的调控过程中发挥作用。短链脂肪酸丁酸盐是肠道内食物纤维厌氧发酵的副产物,丁酸盐在维持肠道免疫的过程中发挥作用。Candido等[78]发现丁酸盐能够提高NOD2蛋白的表达并呈现剂量依赖性。Leung等[21]发现丁酸盐能够通过NOD2启动子H3和H4的乙酰化促进NOD2转录。值得注意的是,炎症性肠病患者服用丁酸盐后肠道炎症减轻,对此解释可能是丁酸盐帮助重建了正常的NOD2针对共生菌的应答[79]。
目前的研究已经证实了很多调控NOD信号途径的方式以及调控蛋白。整个调控环节的失衡会导致机体稳态的失衡,在细菌侵袭时会表现出不恰当的应答而引发NOD蛋白相关的疾病发生。例如,正调控蛋白的高表达以及负调控蛋白的低表达都会间接引发过度的炎症反应。而且从本综述中可以了解到有些调控只针对NOD1信号,有些调控只针对NOD2信号,也有些调控对NOD1和NOD2信号通路均有影响,很好的区分不同调控带来的影响差别也是很重要的环节。因此熟悉能够调控NOD信号通路的物质与NOD1/NOD2的联系为我们寻找一个新的治疗NOD信号受损导致的相关疾病的靶点奠定了基础。
4 NOD蛋白在免疫方面的功能
在NOD信号通路与调节的章节中,我们了解到NOD蛋白参与的几种信号途径:依赖NOD蛋白的NF-κB途径、MAPK途径、IRF途径。活化的NOD蛋白最终会激活不同的转录因子调控不同基因的表达。例如,NF-κB可以诱导促炎因子,生长因子,刺激免疫细胞的效应因子的表达[80-82]。MAPK途径激活的AP1调控细胞增殖分化与凋亡的相关蛋白[83,84]。IRF途径诱导的Ⅰ型IFN作为连接固有免疫和适应性免疫的桥梁,可以激活DC细胞和NK细胞,同时在效应T/B细胞的发育过程中发挥作用。总的来说,活化的NOD蛋白在免疫应答中发挥重要的作用。因此在这一部分我们着重了解NOD蛋白与免疫系统之间的联系。
4.1NOD1与免疫 NOD1蛋白的表达很广泛,例如上皮细胞、基质细胞、内皮细胞都有NOD1的表达[6,85]。
4.1.1NOD1与固有免疫 在体内肠道上皮细胞NOD1激活的信号途径能够诱导趋化因子的生成并招募急性的炎性细胞[86]。弗氏志贺菌和幽门螺杆菌感染模型会通过Ⅳ型分泌系统促进上皮细胞中依赖NOD1的NF-κB信号途径[9,87]。除此之外,Watanabe等[88]发现幽门螺杆菌可以通过NOD1诱导Ⅰ型IFN的生成。已有研究证明,NOD1敲除小鼠对艰难梭菌更加易感,表现为艰难梭菌的清除能力减弱,共生菌的易位升高并且招募到感染位置的中性粒细胞减少[89]。Jiao等[90]发现NOD1招募中性粒细胞的能力不仅局限于肠道,当牙周遭受病生菌(Pathobiont)聚集的时候,中性粒细胞被招募到受损位置,这一过程中NOD1蛋白发挥重要作用。Frutuoso等[91]也在噬肺军团杆菌感染情况下,发现NOD1敲除小鼠募集中性粒细胞的能力变弱。
4.1.2NOD1与适应性免疫 肠道淋巴组织产生成群活性的分泌IgA的B细胞,肠道淋巴组织包括派尔集合淋巴结 (Peyer′s patches),肠系膜淋巴结和大量孤立淋巴滤泡(ILFs)[92,93]。Bouskra等[94]发现革兰氏阴性菌来源的肽聚糖通过肠上皮细胞中NOD1受体感应途径诱导Cryptopatches(CPs)形成ILFs。但是成熟的ILFs还依赖于TLR感应细菌诱导的途径来完成。研究证实了通过NOD1依赖的配体识别过程建立的肠道共生菌与免疫系统之间的关系。ILFs的形成在肠道免疫系统的发育进而维持肠道稳态的过程中发挥重要作用。因此有趣的猜想是,给予NOD1配体或能够高水平分泌NOD1配体的革兰氏阴性益生菌也许可以使处于疾病状态的肠道重建肠道稳态状态。
幽门螺杆菌感染通过NOD1蛋白不仅能诱导Ⅰ型IFN的生成,慢性的幽门螺杆菌感染还能激发胃黏膜中Th1细胞的免疫应答。Th1细胞通过IFN-γ介导作用发挥宿主防御功能,因为在IFN-γ缺陷型小鼠中幽门螺杆菌不能被机体清除[95]。尽管已阐明幽门螺杆菌感染患者的胃黏膜中适应性Th1细胞的应答发挥着重要作用,但是固有免疫应答引发的Th1细胞应答的机制还很模糊。
已有研究证实NOD1或NOD2的单独激活均能够明显的导致Th2细胞依赖的适应性免疫应答。同时在TLR兴奋剂的共刺激条件下会促进Th1、Th2和Th17细胞的免疫应答[96,97]。Fritz等[96]发现抗辐射的非造血细胞能启动NOD1调控的Th2细胞免疫应答,然而这一调控途径的机制还需要更多的研究。Magalhaes[97]和Wei[98]等发现NOD1和NOD2激活会诱导OX40配体产生,促进Th2型的免疫应答。Geddes等[99]人发现在早期肠道柠檬酸杆菌感染和鼠伤寒沙门氏菌感染中,NOD1蛋白和NOD2蛋白可以激活IL-6依赖的Th17细胞的黏膜免疫应答。
4.2NOD2与免疫 不同于NOD1、NOD2的表达限定在特定的细胞中,例如造血细胞以及肠道内的潘氏细胞和干细胞[19,100,101]。
4.2.1NOD2与固有免疫 目前许多研究结果证明体内NOD2蛋白在宿主防御的过程中发挥作用。例如,肺炎双球菌的感染通过NOD2识别作用可以诱导CCL2的生成进而促进炎性巨噬细胞的募集,对肺部病原菌的清除发挥作用[102]。Kim等[103]发现柠檬酸杆菌感染过程中,结肠基质细胞内 NOD2 调控趋化因子的产生,募集CCL2依赖的炎性单核细胞向感染部位的聚集, 炎性单核细胞分泌 IL-12诱导适应性免疫应答来清除病原菌。因此, NOD2 介导的炎性单核细胞的募集对柠檬酸杆菌的清除发挥重要作用。Hruz等[104]在金黄色葡萄球菌皮肤感染过程中发现NOD2不仅能够识别进入细胞质的细菌也能检测到通常停留在细胞外的细菌,而这种识别方式可以区别肠道共生菌与合成穿孔毒素的病原菌。穿孔毒素促进了细胞外细菌细胞壁有效成分进入细胞质激活NOD2信号。研究认为NOD2启动的固有免疫应答可以激活caspase1信号并进一步生成IL-1,caspase1和IL-1可以放大NOD2信号,作为IL-1的下游调控物质IL-6的生成进一步激活具有杀伤能力的中性粒细胞达到清除病原菌的目的。因此IL-1,IL-6以及穿孔毒素在这个NOD2依赖的防御途径中发挥重要作用[104]。
NOD2作为宿主细胞内重要的模式识别受体,通过识别病原菌或共生菌的模式分子参与固有免疫应答。有研究表明,NOD2缺陷型小鼠对TNBS诱导的肠炎模型异常敏感,但是其潜在的机制还不是很清楚。研究报道肺结核疫苗诱导的单核细胞发挥的宿主防御功能也需要NOD2的作用,而且由NOD2诱导的单核细胞在继发的非真菌感染过程中也发挥作用[105]。这一结果启示我们NOD2在调控固有免疫的适应性特征中发挥作用。
4.2.2NOD2与适应性免疫 NOD2作为重要的胞质模式分子识别受体,通过感应微生物产物以及危险信号来调控宿主免疫[106]。NOD2主要识别肠道共生菌或病原菌产生的MDP肽聚糖片段,从而诱导转录因子NF-κB以及MAPK的活化[8,107,108]。在小肠中,NOD2通过调控潘式细胞中抗菌肽的表达、分拣和释放来控制正常的共生菌和病原菌[34,109]。
Kim等[103]发现NOD2缺陷型小鼠的肠道对柠檬酸杆菌清除的能力是受损的。柠檬酸杆菌感染小鼠的病理模型模拟了人类受到大肠杆菌感染的病理过程[110]。在NOD2缺陷型小鼠肠道中,趋化因子CCL2的减少、炎症单核细胞数量的减少以及Th1细胞应答的减少发生在细菌负荷增加前。结肠基质细胞通过依赖NOD2的方式产生CCL2来应答柠檬酸杆菌的感染。不像定居的巨噬细胞和DCs,在柠檬酸杆菌侵染的小鼠结肠中,炎症型单核细胞以及CD11b+吞噬细胞能产生大量的IL-12,从而诱导Th1细胞免疫应答以及该病原菌的清除[111-113]。Ramanan等[114]发现NOD2 通过限制普通拟杆菌在肠道内的病理性扩张,抑制小肠内炎症。 研究发现,NOD2 缺陷型小鼠的小肠上皮表型异常而且上皮内淋巴细胞 IFN-γ表达上升,这些肠道异常的表型依赖于 NOD2 缺陷型小鼠肠道普通拟杆菌的扩张。
Jiang等[115]发现NOD2信号在维持肠道上皮内淋巴细胞的平衡过程中发挥作用,且这一调控过程依赖于NOD2蛋白对肠道菌的识别以及IL-15的生成。这是之前没有被人意识到的NOD2的新功能。研究表明,NOD2缺陷型小鼠的肠道内缺乏上皮内淋巴细胞,而且仅有的上皮内淋巴细胞增殖减弱,凋亡水平上升。但同时在胸腺、脾脏、肝脏中的淋巴结仍表现正常。他们的研究也显示了NOD2缺陷型小鼠抗原提呈细胞的IL-15的表达受损。Jiang等的研究表明NOD2信号通路通过对肠道共生菌的识别来调控肠道内APCs细胞IL-15的表达,从而影响肠道上皮内淋巴细胞的稳态和生存。而NOD2蛋白的缺失引起IELs细胞的缺失,这可能损害了固有免疫,并且加重了NOD2缺陷型小鼠和患克罗恩病患者对黏膜破坏的高敏感性。
Costa[116]报道了 NOD2 活化可以导致Ⅰ型糖尿病的发生,研究发现链脲霉素诱导Ⅰ型糖尿病的过程中,肠道菌组成发生改变, 肠道共生菌转位到胰腺淋巴结中激活髓样细胞内NOD2活性,诱发了Th1和Th17细胞的活化而导致Ⅰ型糖尿病早期的发生。这一研究结果可能为早期Ⅰ型糖尿病的介入治疗提供新的具有可能性的靶点。
5 总结与展望
NOD1和NOD2蛋白作为宿主细胞内模式识别受体,感应病原菌或肠道共生菌高度保守的肽聚糖分子。这些肽聚糖分子通过吞噬作用、内吞作用、胞内体膜转运子、细菌分泌系统、细菌的外膜囊泡以及磷酸钙纳米颗粒等方式进入宿主细胞。NOD1和NOD2的活化会诱导促炎抗菌反应,进而发挥免疫应答作用。生化分析以及遗传筛选已经揭示了调控NOD1和NOD2信号通路的复杂机制。若干实验证据表明NOD2和NOD1蛋白分别通过调控固有免疫类细胞的稳态以及募集、适应性免疫应答的起始以及肠道淋巴组织发生来影响对克罗恩疾病的敏感性(图1)。尽管我们对NOD1和NOD2蛋白的了解不断完善,但依然存在一些关键性问题有待阐明,如:NOD1和NOD2蛋白被细菌肽聚糖活化更精确的机制;NOD蛋白促进抗病毒免疫应答的机制;NOD1-NOD2-ATG16L1轴对克罗恩疾病的影响;以及NOD配体在Th2疫苗佐剂发展中的应用等。
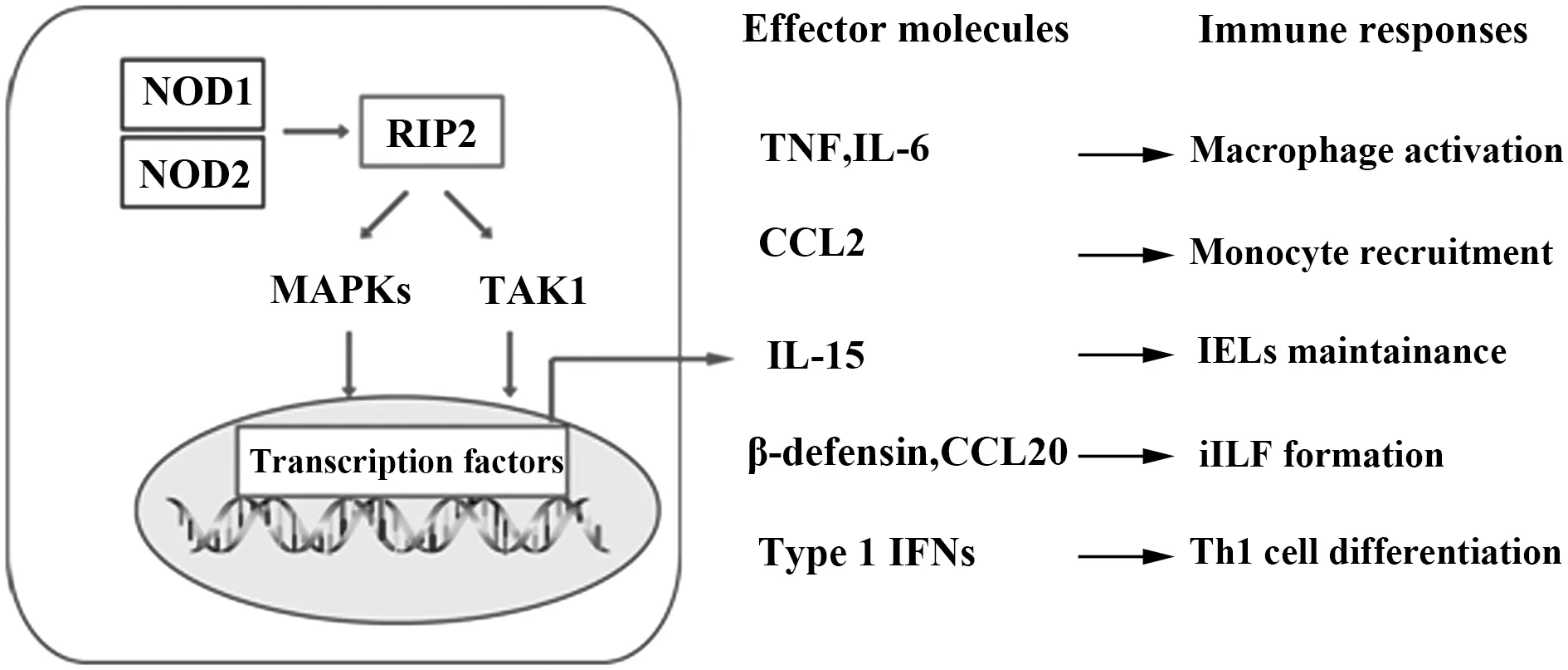
图1 NOD蛋白的生理功能示意图Fig.1 Schematic of NOD protein physiological functionNote:NOD1 and NOD2 recognize bacterial PGNs which enter cells. The NOD proteins self-oligomerize and recruit RIP2.RIP2 activates TAK1 and MAPKs,then activate transcription factors and influence the expression of downstream target genes.
若干实验组正在尝试发展能够调节NOD蛋白信号通路的小分子,用它们来影响病原菌清除和炎症[117-119]。目前,通过活性小分子的文库的筛选来鉴定出对NOD1和NOD2蛋白信号通路发挥作用的成分[120-122]。尽管这些小分子调控NOD1和NOD2信号通路的机制有待证明,但它们直接影响NOD蛋白的稳定性、配体识别以及ATP结合与水解活性具有可能性。
一些研究已经尝试鉴定出NOD1和NOD2蛋白的免疫刺激分子,这些分子可以作为疫苗佐剂或者抗菌成分去应用。这个领域早期的研究是对肽聚糖核心成分进行化学修饰来增强或减弱NOD1和NOD2活性[120,121]。也有研究表明NOD1和NOD2也参与调控结肠炎有关的癌症。在结肠炎关联的肿瘤病理模型中,NOD1、NOD2以及RIP2的敲除会加剧小鼠体内肿瘤的发生,这暗示NOD1和NOD2信号通路可能在肠道外的肿瘤发育中发挥作用[125,126]。
总之,这些研究支持将NOD1和NOD2信号通路的调节作为治疗手段来治疗炎症性疾病或癌症。然而,我们需要更深入的研究来评估这一治疗手段可能带来的影响。
[1] Hugot JP,Chamaillard M,Zouali H,etal.Association of NOD2 leucine-rich repeat variants with susceptibility to Crohn′s disease[J].Nature,2001,411(6837):599-603.
[2] Ogura Y,Bonen DK,Inohara N,etal.A frameshift mutation in NOD2 associated with susceptibility to Crohn′s disease[J].Nature,2001,411(6837):603-606.
[3] Girardin SE,Jéhanno M,Menginlecreulx D,etal.Identification of the critical residues involved in peptidoglycan detection by Nod1[J].J Biol Chem,2005,280(46):38648-38656.
[4] Tanabe T,Chamaillard M,Ogura Y,etal.Regulatory regions and critical residues of NOD2 involved in muramyl dipeptide recognition[J].Embo J,2004,23(7):1587-1597.
[5] Chin AI,Dempsey PW,Bruhn K,etal.Involvement of receptor-interacting protein 2 in innate and adaptive immune responses[J].Nature,2002,416(4):190-194.
[6] Inohara N,Koseki T,del Peso L,etal.Nod1,an Apaf-1-like activator of caspase-9 and nuclear factor-κB[J].J Biol Chem,1999,274(21):14560-14567.
[7] Ogura Y,Inohara N,Benito A,etal.Nod2,a Nod1/Apaf-1 family member that is restricted to monocytes and activates NF-κB[J].J Biol Chem,2001,276(7):4812-4818.
[8] Park JH,Kim YG,Mcdonald C,etal.RICK/RIP2 mediates innate immune responses induced through Nod1 and Nod2 but not TLRs[J].J Immunol,2007,178(4):2380-2386.
[9] Girardin SE,Tournebize R,Mavris M,etal.CARD4/Nod1 mediates NF-κB and JNK activation by invasive Shigella flexneri[J].EMBO Reports,2001,2(8):736-742.
[10] Viala J,Chaput C,Boneca IG,etal.Nod1 responds to peptidoglycan delivered by the Helicobacter pylori cag pathogenicity island[J].Nature Immunol,2004,5(11):1166-1174.
[11] Bielig H,Rompikuntal PK,Dongre M,etal.NOD-Like receptor activation by outer membrane vesicles from vibrio cholerae Non-O1 Non-O139 strains is modulated by the quorum-sensing regulator HapR[J].Infect Immunity,2011,79(4):1418-1427.
[12] Kaparakis M,Turnbull L,Carneiro L,etal.Bacterial membrane vesicles deliver peptidoglycan to NOD1 in epithelial cells[J].Cell Microbiol,2010,12(3):372-385.
[13] Marina-Garcia N,Franchi L,Kim YG,etal.Clathrin-and dynamindependent endocytic pathway regulates muramyl dipeptide internalization and NOD2 activation[J].J Immunol,2009,182:4321-4327.
[14] Lee J,Tattoli I,Wojtal KA,etal.pH-dependent internalization of muramyl peptides from early endosomes enables Nod1 and Nod2 signaling[J].J Biol Chem,2009,284(35):23818-23829.
[15] Vavricka SR,Musch MW,Chang JE,etal.hPepT1 transports muramyl dipeptide,activating NF-kappaB and stimulating IL-8 secretion in human colonic CaCO2/bbe cells[J].Gastroenterology,2004,127(5):1401-1409.
[16] Kasper CA,Sorg I,Schmutz C,etal.Cell-cell propagation of NF-κB transcription factor and MAP kinase activation amplifies innate immunity against bacterial infection[J].Immunity,2010,33(5):804-816.
[17] Powell JJ,Thomasmckay E,Thoree V,etal.An endogenous nano mineral chaperones luminal antigen and peptidoglycan to intestinal immune cells[J].Nat Nanotechnol,2015,10(4):331-333.
[18] Barnich N,Aguirre JE,Reinecker HC,etal.Membrane recruitment of NOD2 in intestinal epithelial cells is essential for nuclear factor-kappaB activation in muramyl dipeptide recognition[J].J Cell Biol,2005,170(1):21-26.
[19] Ogura Y,Lala S,Xin W,etal.Expression of NOD2 in Paneth cells:a possible link to Crohn′s ileitis[J].Gut,2003,52(11):1591-1597.
[20] Wang TT,Dabbas B,Laperriere D,etal.Direct and indirect induction by 1,25-dihydroxyvita min D3 of the NOD2/CARD15-defensin beta2 innate immune pathway defective in Crohn disease[J].J Biol Chem,2010,285(4):2227-2231.
[21] Leung CH,Lam W,Ma DL,etal.Butyrate mediates nucleotide-binding and oligomerisation domain (NOD) 2-dependent mucosal immune responses against peptidoglycan[J].Eur J Immunol,2009,39(12):3529-3537.
[22] Rosenstiel P,Fantini M,Bräutigam K,etal.TNF-α and IFNγ regulate the expression of the NOD2 (CARD15) gene in human intestinal epithelial cells[J].Gastroenterology,2003,124(4):1001-1009.
[23] Gutierrez O,Pipaon C,Inohara N,etal.Induction of Nod2 in myelomonocytic and intestinal epithelial cells via nuclear factor-kappa B activation[J].J Biol Chem,2002,277(44):41701-41705.
[24] Kim YG,Park JH,Reimer T,etal.Viral infection augments Nod1/2 signaling to potentiate lethality associated with secondary bacterial infections[J].Cell Host Microbe,2011,9(6):496-507.
[25] Takahashi Y,Isuzugawa K,Murase Y,etal.Up-regulation of NOD1 and NOD2 through TLR4 and TNF-alpha in LPS-treated murine macrophages[J].J Veterinary Med Sci,2006,68(5):471-8.
[26] Lee KH,Biswas A,Liu YJ,etal.Proteasomal degradation of Nod2 protein mediates tolerance to bacterial cell wall components[J].J Biol Chem,2012,287(47):39800-39811.
[27] Zurek B,Schoultz I,Neerincx A,etal.TRIM27 negatively regulates NOD2 by ubiquitination and proteasomal degradation[J].PLoS One,2012,7(7):e41255.
[28] Philpott DJ,Girardin SE.Nod-like receptors:sentinels at host membranes[J].Current Opin Immunol,2010,22(4):428-434.
[29] Travassos LH,Carneiro LA,Ramjeet M,etal.Nod1 and Nod2 direct autophagy by recruiting ATG16L1 to the plasma membrane at the site of bacterial entry[J].Nature Immunol,2010,11(11):55-62.
[30] Lipinski S,Grabe N,Jacobs G,etal.RNAi screening identifies mediators of NOD2 signaling:implications for spatial specificity of MDP recognition[J].Proc Natl Acad Sci,2012,109(52):21426-21431.
[31] Fukazawa A,Alonso C,Kurachi K,etal.GEF-H1 Mediated Control of NOD1 Dependent NF-κB Activation by Shigella Effectors[J].Plos Pathogens,2008,4(11):e1000228.
[32] Irving AT,Mimuro H,Kufer TA,etal.The immune receptor NOD1 and kinase RIP2 interact with bacterial peptidoglycan on early endosomes to promote autophagy and inflammatory signaling[J].Cell Host Microbe,2014,15(5):623-635.
[33] Nakamura N,Lill JR,Phung Q,etal.Endosomes are specialized platforms for bacterial sensing and NOD2 signalling[J].Nature,2014,509(7499):240-244.
[34] Zhang Q,Pan Y,Yan R,etal.Commensal bacteria direct selective cargo sorting to promote symbiosis[J].Nat Immunol,2015,16(9):918-926.
[35] Philpott DJ,Sorbara MT,Robertson SJ,etal.NOD proteins:regulators of inflammation in health and disease[J].Nat Rev Immunol,2013,14(1):9-23.
[36] Franchi L,Warner N,Viani K,etal.Function of Nod-like receptors in microbial recognition and host defense[J].Immunological Rev,2009,227(1):106-128.
[37] Caso F,Costa L,Rigante D,etal.Caveats and truths in genetic,clinical,autoimmune and autoinflammatory issues in Blau syndrome and early onset sarcoidosis[J].Autoimmunity Rev,2014,13(12):1220-1229.
[38] Hu Z,Yan C,Liu P,etal.Crystal structure of NLRC4 reveals its autoinhibition mechanism[J].Science,2013,341(6142):172-175.
[39] Keestragounder AM,Byndloss MX,Seyffert N,etal.NOD1 and NOD2 signalling links ER stress with inflammation[J].Nature,2016,532(7599):394-397.
[40] Yang Y,Yin C,Pandey A,etal.NOD2 pathway activation by MDP or Mycobacterium tuberculosis infection involves the stable polyubiquitination of Rip2[J].J Biol Chem,2007,282(50):36223-36229.
[41] Magalhaes JG,Lee J,Geddes K,etal.Essential role of Rip2 in the modulation of innate and adaptive immunity triggered by Nod1 and Nod2 ligands[J].Eur J Immunol,2011,41(5):1445-1455.
[42] Correa RG,Milutinovic S,Reed JC.Roles of NOD1 (NLRC1) and NOD2 (NLRC2) in innate immunity and inflammatory diseases[J].Bioscience Reports,2012,32(6):597-608.
[43] Mccartney SA,Colonna M.Viral sensors:diversity in pathogen recognition[J].Immunological Rev,2009,227(1):87-94.
[44] Takeuchi O,Akira S.Innate immunity to virus infection[J].Immunological Rev,2009,227(1):75-86.
[45] Hasegawa M,Fujimoto Y,Lucas PC,etal.A critical role of RICK/RIP2 polyubiquitination in Nod-induced NF-κB activation[J].Embo J,2008,27(2):373-383.
[46] Bertrand MJ,Doiron KK.Cellular inhibitors of apoptosis cIAP1 and cIAP2 are required for innate immunity signaling by the pattern recognition receptors NOD1 and NOD2[J].Immunity,2009,30(6):789-801.
[47] Tao M,Scacheri PC,Marinis JM,etal.ITCH K63-ubiquitinates the NOD2 binding protein,RIP2,to influence inflammatory signaling pathways[J].Curr Biol,2009,19(15):1255-1263.
[48] Yang S,Wang B,Humphries F,etal.Pellino3 ubiquitinates RIP2 and mediates Nod2-induced signaling and protective effects in colitis[J].Nat Immunol,2013,14(9):927-936.
[49] Damgaard RB,Fiil BK,Speckmann C,etal.Disease-causing mutations in the XIAP BIR2 domain impair NOD2-dependent immune signaling[J].Embo Mol Med,2013,5(8):1278-1295.
[50] Zeissig Y,Petersen BS,Milutinovic S,etal.XIAP variants in male Crohn′s disease[J].Gut,2015,64(1):66-76.
[51] Hitotsumatsu O,Ahmad RC,Tavares R,etal.The ubiquitin-editing enzyme A20 restricts nucleotide-binding oligomerization domain containing 2-triggered signals[J].Immunity,2008,28(3):381-390.
[52] Billmann-Born S,Till A,Arlt A,etal.Genome-wide expression profiling identifies an impairment of negative feedback signals in the Crohn′s disease-associated NOD2 variant L1007fsinsC[J].J Immunol,2011,186(7):4027-4038.
[53] Musone SL,Taylor KE,Nititham J,etal.Sequencing of TNFAIP3 and association of variants with multiple autoimmune diseases[J].Genes Immun,2011,12(3):176-182.
[54] Barmada MM,Brant SR,Nicolae DL,etal.A genome scan in 260 inflammatory bowel disease-affected relative pairs[J].Inflamm Bowel Dis,2004,10(5):513-520.
[55] Burton PR,Clayton DG,Cardon LR,etal.Genome-wide association study of 14,000 cases of seven common diseases and 3,000 shared controls[J].Nature,2007,447(7145):661-678.
[56] Nasser MS.Signature biomarkers in Crohn′s disease:toward a molecular classification[J].Mucosal Immunol,2008,1(1):399-411.
[57] Vereecke L,Sze M,Guire CM,etal.Enterocyte-specific A20 deficiency sensitizes to tumor necrosis factor-induced toxicity and experimental colitis[J].J Exp Med,2010,207(7):1513-1523.
[58] Lee EG,Boone DL,Chai S,etal.Failure to regulate TNF-induced NF-kappaB and cell death responses in A20-deficient mice[J].Science,2000,289(5488):2350-2354.
[59] Hedl M,Li J,Cho JH,etal.Chronic stimulation of NOD2 mediates tolerance to bacterial products[J].Proc Natl Acad Sci,2008,104(49):19440-19445.
[60] Kim Y,Park JS,Fukase K,etal.Cross-tolerization between Nod1 and Nod2 signaling results in reduced refractoriness to bacterial infection in Nod2-deficient macrophages[J].J Immunol,2008,181(6):4340-4346.
[61] Zhang R,Zhao J,Song Y,etal.The E3 ligase RNF34 is a novel negative regulator of the NOD1 pathway[J].Cell Physiol Biochem,2014,33(6):1954-1962.
[62] Yang L,Tang Z,Zhang H,etal.PSMA7 directly interacts with NOD1 and regulates its function[J].Cell Phy Biochem,2013,31(6):952-959.
[63] Ver Heul AM,Fowler CA,Ramaswamy S,etal.Ubiquitin regulates caspase recruitment domain-mediated signaling by nucleotide-binding oligomerization domain-containing proteins NOD1 and NOD2[J].J Biol Chem,2013,288(10):6890-6902.
[64] Ver Heul AM,Gakhar L,Piper RC,etal.Crystal structure of a complex of NOD1 CARD and ubiquitin[J].PLoS One,2014,9(8):e104017.
[65] McDonald C,Chen FF,Ollendorff V,etal.A role for erbin in the regulation of Nod2-dependent NF-κB signaling[J].J Biol Chem,2005,280(48):40301-40309.
[66] Kufer TA,Kremmer E,Banks DJ,etal.Role for erbin in bacterial activation of Nod2[J].Infect Immunity,2006,74(6):3115-3124.
[67] Von KO,Lipinski S,Till A,etal.Caspase recruitment domain-containing protein 8 (CARD8) negatively regulates NOD2-mediated signaling[J].J Biol Chem,2010,285(26):19921.
[68] Paramel GV,Folkersen L,Strawbridge RJ,etal.CARD8 gene encoding a protein of innate immunity is expressed in human atherosclerosis and associated with markers of inflammation[J].Clin Science,2013,125(8):401-407.
[69] Yeretssian G,Correa RG,Doiron K,etal.Non-apoptotic role of BID in inflammation and innate immunity[J].Nature,2011,474(7349):96-99.
[70] Nachbur U,Vince JE,O′Reilly LA,etal.Is BID required for NOD signalling?[J].Nature,2012,488:E4-E6.
[71] Yeretssian G,Correa RG,Doiron K,etal.Yeretssianetal.reply[J].Nature,2012,488,E6-E8.
[72] Yan R,Liu Z.LRRK2 enhances Nod1/2-mediated inflammatory cytokine production by promoting Rip2 phosphorylation[J].Protein Cell,2017,8(1):55-66.
[73] Magalhaes JG,Philpott DJ,Nahori MA,etal.Murine Nod1 but not its human orthologue mediates innate immune detection of tracheal cytotoxin[J].EMBO Rep,2005,6:1201-1207.
[74] Zhao Y,Alonso C,Ballester L,etal.Control of NOD2 and Rip2-dependent innate immune activation by GEF-H1[J].Inflamm Bowel Dis,2012,18:603-612.
[75] Hisamatsu T,Suzuki M,Podolsky DK.Interferon-γ augments CARD4/NOD1 gene and protein expression through interferon regulatory factor-1 in intestinal epithelial cells[J].J Biol Chem,2003,278(35):32962-32968.
[76] Beg AA,Finco TS,Nantermet PV,etal.Tumor necrosis factor and interleukin-1 lead to phosphorylation and loss of I kappa B alpha:a mechanism for NF-kappa B activation[J].Mol Cell Biol,1993,13(6):3301-3310.
[77] Rosenstiel P,Fantini M,Bräutigam K,etal.TNF-alpha and IFN-gamma regulate the expression of the NOD2 (CARD15) gene in human intestinal epithelial cells[J].Gastroenterology,2003,124(4):1001-1009.
[78] Candido EP,Reeves R,Davie JR.Sodium butyrate inhibits histone deacetylation in cultured cells[J].Cell,1978,14(1):105-113.
[79] Scheppach W,Sommer H,Kirchner T,etal.Effect of butyrate enemas on the colonic mucosa in distal ulcerative colitis[J].Gastroenterology,1992,103(1):51-56.
[80] Burns KA,Martinon F.Inflammatory diseases:is ubiquitinated NEMO at the Hub?[J].Current Biol,2004,14(24):1040-1042.
[81] Rahighi S,Ikeda F,Kawasaki M,etal.Specific recognition of linear ubiquitin chains by NEMO is important for NF-κB activation[J].Cell,2009,136(6):1098-1109.
[82] Jiang X,Chen ZJ.The role of ubiquitylation in immune defence and pathogen evasion[J].Nat Rev Immunol,2012,12(1):35-48.
[83] Karin M.The regulation of AP-1 activity by mitogen-activated protein kinases[J].J Biol Chem,1995,270:16483-16486.
[84] Kobayashi KS,Chamaillard M,Ogura Y,etal.Nod2-dependent regulation of innate and adaptive immunity in the intestinal tract[J].Science,2005,307(5710):731-734.
[85] Park JH,Kim YG,Shaw M,etal.Nod1/RICK and TLR signaling regulate chemokine and antimicrobial innate immune responses in mesothelial cells[J].J Immunol,2007,179(1):514-521.
[86] Masumoto J,Yang K,Varambally S,etal.Nod1 acts as an intracellular receptor to stimulate chemokine production and neutrophil recruitment in vivo[J].J Exp Med,2006,203(1):203-213.
[87] Allison CC,Kufer TA,Kremmer E,etal.Helicobacter pylori induces MAPK phosphorylation and AP-1 activation via a NOD1-dependent mechanism[J].J Immunol,2009,183(12):8099-8109.
[88] Watanabe T,Asano N,Fichtner-Feigl S,etal.NOD1 contributes to mouse host defense against Helicobacter pylori via induction of type I IFN and activation of the ISGF3 signaling pathway[J].J Clin Invest,2010,120(5):1645-1662.
[89] Hasegawa M,Yamazaki T,Kamada N,etal.Nucleotide-binding oligomerization domain 1 mediates recognition of Clostridium difficile and induces neutrophil recruitment and protection against the pathogen[J].J Immunol,2011,186(8):4872-4880.
[90] Jiao Y,Darzi Y,Tawaratsumida K,etal.Induction of bone loss by pathobiont-mediated Nod1 signaling in the oral cavity[J].Cell Host Microbe,2013,13(5):595-601.
[91] Frutuoso MS,Hori JI,Pereira MS,etal.The pattern recognition receptors Nod1 and Nod2 account for neutrophil recruitment to the lungs of mice infected with Legionella pneumophila[J].Microbes Infect,2010,12(11):819-827.
[92] Hamada H,Hiroi T,Nishiyama Y,etal.Identification of multiple isolated lymphoid follicles on the antimesenteric wall of the mouse small intestine[J].J Immunol,2002,168(1):57-64.
[93] Tsuji M,Suzuki K,Kitamura H,etal.Requirement for lymphoid tissue-inducer cells in isolated follicle formation and T cell-independent immunoglobulin A generation in the gut[J].Immunity,2008,29(2):261-271.
[94] Bouskra D,Brézillon C,Bérard M,etal.Lymphoid tissue genesis induced by commensals through NOD1 regulates intestinal homeostasis[J].Nature,2008,456(7221):507-510.
[95] Watanabe T,Asano N,Kitani A,etal.NOD1-mediated mucosal host defense against helicobacter pylori[J].Intern J Inflammation,2010,2010(1):476482.
[96] Fritz JH,Le BL,Sellge G,etal.Nod1-mediated innate immune recognition of peptidoglycan contributes to the onset of adaptive immunity[J].Immunity,2007,26(4):445-459.
[97] Magalhaes JG,Philpott DJ.Nucleotide oligomerization domain-containing proteins instruct T cell helper type 2 immunity through stromal activation[J].Proc Natl Acad Sci U S A,2011,108(36):14896-14901.
[98] Wei D,Mehta AK,Magalhaes JG,etal.Innate signals from Nod2 block respiratory tolerance and program Th2 driven allergic inflammation[J].J Allergy Clin Immunol,2010,126(6):1284-1293.
[99] Geddes K,Rubino SJ,Magalhaes JG,etal.Identification of an innate T helper type 17 response to intestinal bacterial pathogens[J].Nat Med,2011,17(7):837-844.
[100] Barnich N,Hisamatsu T,Aguirre JE,etal.GRIM-19 interacts with nucleotide oligomerization domain 2 and serves as downstream effector of anti-bacterial function in intestinal epithelial cells[J].J Biol Chem,2005,280(19):19021-19026.
[101] Nigro G,Rossi R,Commere PH,etal.The cytosolic bacterial peptidoglycan sensor Nod2 affords stem cell protection and links microbes to gut epithelial regeneration[J].Cell Host Microbe,2014,15(6):792-798.
[102] Davis KM,Nakamura S,Weiser JN.Nod2 sensing of lysozyme-digested peptidoglycan promotes macrophage recruitment and clearance of S.pneumoniae colonization in mice[J].J Clin Invest,2011,121(9):3666-3676.
[103] Kim YG,Kamada N,Shaw M,etal.The Nod2 sensor promotes intestinal pathogen eradication via the chemokine CCL2-dependent recruitment of inflammatory monocytes[J].Immunity,2011,34(5):769-780.
[104] Hruz P,Zinkernagel AS,Jenikova G,etal.NOD2 contributes to cutaneous defense against Staphylococcus aureus through alpha-toxin-dependent innate immune activation[J].Proc Natl Acad Sci U S A,2009,106(31):12873-12878.
[105] Kleinnijenhuis J,Quintin J,Preijers F,etal.Bacille Calmette-Guérin induces NOD2-dependent nonspecific protection from reinfection via epigenetic reprogramming of monocytes[J].Proc Natl Acad Sci U S A,2012,109(43):17537-17542.
[106] Shaw MH,Reimer T,Kim YG,etal.NOD-like receptors (NLRs):bona fide intracellular microbial sensors[J].Curr Opini Immunol,2008,20(4):377-382.
[107] Kobayashi K,Inohara N,Hernandez LD,etal.RICK/Rip2/CARDIAK mediates signalling for receptors of the innate and adaptive immune systems[J].Nature,2002,416(6877):194-199.
[108] Biswas A,Liu YJ,Hao L,etal.Induction and rescue of Nod2-dependent Th1-driven granulomatous inflammation of the ileum[J].Proc Natl Acad Sci U S A,2010,107(33):14739-14744.
[109] Denning TL,Wang YC,Patel SR,etal.Lamina propria macrophages and dendritic cells differentially induce regulatory and interleukin 17-producing T cell responses[J].Nature Immunol,2007,8(10):1086-1094.
[110] Bry L,Brenner MB.Critical role of T cell-dependent serum antibody,but not the gut-associated lymphoid tissue,for surviving acute mucosal infection with Citrobacter rodentium,an attaching and effacing pathogen[J].J Immunol,2004,172(1):433-441.
[111] Maaser C,Housley MP,Iimura M,etal.Clearance of citrobacter rodentium requires b cells but not secretory immunoglobulin A (IgA) or IgM antibodies[J].Infec Immunity,2004,72(6):3315-3324.
[112] Simmons CP,Clare S,Ghaemmaghami M,etal.Central role for B lymphocytes and CD4+T cells in immunity to infection by the attaching and effacing pathogen Citrobacter rodentium[J].Infect Immunity,2003,71(9):5077-5086.
[113] Mebius RE.Organogenesis of lymphoid tissues[J].Nat Rev Immunol,2003,3(4):292-303.
[114] Ramanan D,Tang MS,Bowcutt R,etal.Bacterial sensor Nod2 prevents inflammation of the small intestine by restricting the expansion of the commensal Bacteroides vulgatus[J].Immunity,2014,41(2):311-324.
[115] Jiang W,Wang X,Zeng B,etal.Recognition of gut microbiota by NOD2 is essential for the homeostasis of intestinal intraepithelial lymphocytes[J].J Exp Med,2013,210(11):2465-2476.
[116] Costa FRC,Franozo MCS,Oliveira GGD,etal.Gut microbiota translocation to the pancreatic lymph nodes triggers NOD2 activation and contributes to T1D onset[J].J Exp Med,2016,213(7):1223-1239.
[117] Geddes K,Magalhães JG,Girardin SE.Unleashing the therapeutic potential of NOD-like receptors[J].Dressnature Rev Drug Discovery,2009,8(6):465-479.
[118] Ziga Jakopin.Nucleotide-binding oligomerization domain (NOD) inhibitors:a rational approach toward inhibition of NOD signaling pathway[J].J Med Chem,2014,57(16):6897-6918.
[119] Maisonneuve C,Bertholet S,Philpott DJ,etal.Unleashing the potential of NOD-and Toll-like agonists as vaccine adjuvants[J].Proc Natl Acad Sci U S A,2014,111(34):12294-12299.
[120] Khan PM,Correa RG,Divlianska DB,etal.Identification of inhibitors of NOD1-induced nuclear factor-κB activation[J].Acs Medicinal Chemistry Letters,2011,2(10):780-785.
[121] Rickard DJ,Sehon CA,Kasparcova V,etal.Identification of benzimidazole diamides as selective inhibitors of the nucleotide-binding oligomerization domain 2 (NOD2) signaling pathway[J].PLoS One,2013,8(8):e69619.
[122] Correa RG,Khan PM,Askari N,etal.Discovery and characterization of 2-aminobenzimidazole derivatives as selective NOD1 inhibitors[J].Chem Biol,2011,18(7):825-832.
[123] Agnihotri G,Ukani R,Malladi SS,etal.Structure-activity relationships in nucleotide oligomerization domain 1 (Nod1) agonistic g-glutamyldia minopimelic acid derivatives[J].J Med Chem,2011,54:1490-1510.
[124] Rubino SJ,Magalhaes JG,Philpott D,etal.Identification of a synthetic muramyl peptide derivative with enhanced Nod2 stimulatory capacity[J].Innate Immunity,2013,19(5):493-503.
[125] Chen GY,Shaw MH,Redondo G,etal.The innate immune receptor Nod1 protects the intestine from inflammation-induced tumorigenesis[J].Cancer Res,2008,68(24):10060-10067.
[126] Couturiermaillard A,Secher T,Rehman A,etal.NOD2-mediated dysbiosis predisposes mice to transmissible colitis and colorectal cancer[J].J Clin Invest,2013,123(2):700-711.
[收稿2017-01-11]
(编辑 倪 鹏)
NODproteinsandimmuneresponse
SHENXue-Ying,FANGChuan-Lei,LIUZhi-Hua.CASKeyLaboratoryofInfectionandImmunity,InstituteofBiophysics,ChineseAcademyofSciences,Beijing100101,China
The NOD protein family include NOD1 and NOD2,both of which recognize intracellular bacterial peptidoglycan,induce inflammation and promote host defense.In this review article,we summarize the research progress on NOD family,including signaling and regulation.We will also discuss their cellular localization and the role in host defense.Understanding on their physiological function will help shed light on pathogenesis on related diseases.
NOD protein;Cellular localization;Physiological function
10.3969/j.issn.1000-484X.2017.06.001
R392.1
A
1000-484X(2017)06-0801-10

