子痫前期患者外周血CD8+CD25+FoxP3+调节T细胞的变化及意义①
于建秀 汪洪友 钱 雷 陈 玮 孙海玲
(滨海县人民医院检验科,盐城224500)
子痫前期患者外周血CD8+CD25+FoxP3+调节T细胞的变化及意义①
于建秀 汪洪友②钱 雷 陈 玮 孙海玲③
(滨海县人民医院检验科,盐城224500)
目的:探讨外周血CD8+CD25+FoxP3+调节T细胞(Treg)在子痫前期(PE)疾病过程中的作用。方法:研究对象包括子痫前期孕晚期患者46例,其中轻度子痫24例(MPE组),重度子痫22例(SPE组),并选择24例与患者孕龄匹配的健康孕妇作为对照组(HP组)。流式细胞仪检测分析外周血CD8+CD25+FoxP3+Treg比例;Luminex200检测血清IL-6、 IL-17A、IL-10、IL-1β、IL-33和TGF-β1浓度。分离10例健康对照者单个核细胞(PBMCs),IL-33刺激培养后检测CD8+CD25+FoxP3+Treg比例的变化。结果:MPE和SPE组CD8+CD25+FoxP3+Treg比例分别为[0.32(0.19-0.63)%]、[0.13(0.02-0.41)%],两组均低于HP组[0.48(0.21-0.96)%],三组差异有统计学意义(P<0.05)。与HP组相比,MPE组和SPE组血清IL-6、IL-17A浓度均升高,且SPE组患者血清IL-6、IL-17A浓度升高更明显,差异有统计学意义(P<0.05);IL-10、IL-1β和IL-33浓度在HP、MPE及SPE三组间差异无统计学意义(P>0.05);与HP对照者相比,MPE和SPE组血清TGF-β浓度均升高,差异有统计学意义(P<0.05);但MPE和SPE组之间差异无统计学意义(P>0.05)。PE患者CD8+CD25+FoxP3+Treg比例与血清IL-17A负相关(r=-0.338,P=0.021),与IL-33正相关(r=0.548,P=0.001)。PBMCs用IL-33刺激5 d后,与空白对照组相比,CD8+CD25+FoxP3+Treg比例显著增高(P<0.05)。结论:子痫前期患者外周血CD8+CD25+FoxP3+Treg细胞比例降低可能在其疾病过程中发挥重要作用。
子痫前期;CD8+CD25+FoxP3+Treg;IL-17;IL-33
子痫前期(Preeclampsia,PE)指孕妇妊娠前血压正常,妊娠后出现高血压和蛋白尿等临床症状,发病率约5%~10%,是孕产妇及胎儿发病和死亡的主要原因之一[1]。研究表明子痫前期等病理妊娠的发生与母体免疫系统对胎儿的免疫耐受异常有关,导致母胎界面免疫损伤和母体系统性炎症反应[2]。FoxP3+调节性T细胞(Treg)是维持免疫耐受的主要效应细胞,可抑制其他免疫细胞的增生、活化和效应功能,抑制炎症反应,具有保持免疫内环境稳定的功能[3,4]。较多研究表明CD4+FoxP3+Treg细胞参与子痫前期的发生发展[1,3],但CD8+FoxP3+Treg在PE疾病过程中的作用缺乏研究。本次研究通过检测PE患者外周血CD8+CD25+FoxP3+Treg细胞比例,并分析其与血清细胞因子相关性,探讨其在PE疾病过程中的作用。
1 材料与方法
1.1实验材料
1.1.1研究对象 选取2015年9月~2016年3月在滨海县人民医院诊断为子痫前期的孕晚期患者共46例,其中轻度子痫(MPE)24例,重度子痫(SPE) 22例,并选择孕龄匹配的健康孕妇24例作为对照组。PE诊断标准及分类参照第八版《妇产科学》[5]。排除标准为:使用免疫抑制药物或患有免疫系统疾病。各组均无近期感染史,无胎膜破裂或双胎。本研究通过医院伦理委员会批准 (伦研2015-03),获得受试者书面知情同意。各组受试者年龄及孕龄差异均无统计学意义(P>0.05)。临床特征见表1。
1.1.2仪器及试剂 异硫氰酸荧光素(FITC)鼠抗人-CD3单克隆抗体(mAb)、叶绿素蛋白偶联物(PerCP-cy5.5)鼠抗人-CD8 mAb、别藻青蛋白(APC)鼠抗人-CD25 mAb、藻红蛋白(PE)鼠抗人-FoxP3 mAb及同型对照、红细胞裂解液均购自美国BD公司;血清细胞因子IL-6、 IL-17A、IL-10、IL-1β、IL-33和TGF-β1购自美国Bio-Rad公司;cDNA反转录试剂盒购自Applied Biosystems;Trizol购自Invitrogen公司;Ficoll-HyPaque分离液购自上海恒信试剂有限公司;尿微量白蛋白采用BNProSpec特定蛋白分析仪及配套试剂检测。流式细胞仪购自BD公司;Luminex200流式荧光检测分析仪购自Luminex公司。

表1 研究对象临床资料
Note:1)P<0.05 MPE and SPE versus HP;2)P<0.05 MPE versus SPE.
1.2方法
1.2.1流式细胞仪检测外周血CD8+CD25+FoxP3+Treg细胞比例 取100 μl肝素抗凝静脉血,分别加入10 μl FITC鼠抗人-CD3 mAb、10 μl PerCP-cy5.5鼠抗人-CD8 mAb、10 μl APC-鼠抗人CD25 mAb及同型对照,室温避光孵育30 min。红细胞裂解液破坏红细胞后,1 ml磷酸盐缓冲液(PBS)洗涤,离心弃上清。每管加入250 μl 1×Fix/Perm buffer 涡旋约3 s,避光孵育40 min,加入300 μl 1×Perm/wash buffer洗涤,离心弃上清。100 μl Perm/wash buffer 重悬细胞,加10 μl PE-Foxp3 mAb,室温避光孵育40 min。洗涤离心,弃上清。400 μl PBS重悬细胞,立即上机检测。以淋巴细胞(图1A)设门,分选出CD3+CD8+T细胞(图1B),检测CD8+CD25+T细胞(图1)及CD8+CD25+FoxP3+Treg细胞(图1D)。
1.2.2RNA提取及RT-PCR检测:用Ficoll-Hypaque密度梯度离心法制备外周血单个核细胞(PBMCs),使用Trizol试剂提取总RNA。采用 cDNA反转录试剂盒进行 cDNA合成,利用QuantiTect SYBR Green PCR试剂盒进行扩增。引物序列设计如下:FoxP3,sense:5′-TGAGAAGGACAGGGAGCCAA-3′,antisense:5′-GAGAAGCTGAGTGCC-ATGCA-3′;β-actin sense:5′-TGGCACCCAGCACA-ATGAA-3′,antisense:5′-CTAAGTCATAGTCCGCCTA-GAAGCA-3′。热循环条件如下:95°C 1 min,95°C 40个循环 15 s,60°C 1 min。根据2-ΔΔCt值计算样本中FoxP3 mRNA 相对表达水平。

图1 CD8+CD25+FoxP3+Treg细胞检测Fig.1 Detection of CD8+CD25+FoxP3+Treg cellsNote:A.Lymphocyte were gated based on FSC and SSC (R1);B.Plots showing CD8+ lymphocyte (R2) on gated CD3+ lymphocytes;C.Plots showing CD25 expression on gated CD8+ lymphocytes (R5);D.Plots showing FoxP3 expression on gated CD8+CD25+ lymphocytes (R7).
1.2.3Luminex液相芯片检测血清细胞因子浓度 收集外周血2 ml,1 500 r/min离心5 min,收集血浆,立即储存于-80℃冰箱。按试剂说明书检测TGF-β、IL-10、IL-17A、IL-1β、IL-33、和IL-6浓度,每个标本检测2次,取均值。
1.2.4IL-33诱导CD8+CD25+FoxP3+Treg细胞增殖 收集10位健康对照者外周血4 ml,通过Ficoll-HyPaque 密度梯度离心法制备PBMCs。细胞用RPMI1640完全培养液(100 U/L青霉素,链霉素100 U/L和10%小牛血清)重悬,然后分别接种于24孔培养板中,细胞浓度为1×106cells/ml。然后加入终浓度为10 ng/ml重组IL-33,混匀,37℃ 5%CO2孵育5 d。最后收集细胞,流式细胞仪测定CD8+CD25+FoxP3+Treg细胞频率,PCR检测FoxP3 mRNA水平。
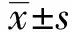

表2 外周血CD8+CD25+FoxP3+Treg比例及PBMCs FoxP3 mRNA水平比较
Note:1)P<0.05,MPE and SPE versus HP;2)P<0.05,MPE vers-us SPE.
2 结果
2.1PE患者外周血CD8+CD25+FoxP3+Treg细胞频率检测 与HP组相比,MPE及SPE患者外周血CD8+CD25+FoxP3+Treg细胞比例均显著降低,但SPE组降低更明显,差异具有统计学意义(P<0.05),见表2。
2.2Real-time PCR检测外周血单个核细胞FoxP3 mRNA 与HP组对比,MPE及SPE组PBMCs FoxP3 mRNA表达水平均降低,但SPE 组降低更明显,差异具有统计学意义(P<0.05),见表2。PE组CD8+CD25+FoxP3+Treg比例与PBMCs FoxP3 mRNA表达水平呈正相关(t=0.779,P<0.05),见图2。
2.3PE患者外周血细胞因子浓度检测 与HP组相比,MPE组和SPE组血清IL-6、IL-17A浓度均升高,但SPE组升高更明显,差异有统计学意义(P<0.05)。与HP组相比,MPE和SPE组血清TGF-β浓度均升高,差异有统计学意义(P<0.05);但MPE和SPE组之间差异无统计学意义(P>0.05)。三组血清IL-10、IL-33及IL-1β浓度差异无统计学意义(P>0.05),见表3。
2.4PE患者CD8+CD25+FoxP3+Treg细胞比例与血清细胞因子相关性分析 PE患者CD8+CD25+FoxP3+Treg细胞比例与血清IL-33浓度呈正相关(r=0.548,P=0.001);与IL-17A呈负相关(r=-0.338,P=0.021);与IL-6 (r=0.019,P=0.896)、IL-10(r=0.201,P=0.181)、IL-1β(r=0.103,P=0.496)及TGF-β (r=0.196,P=0.192)浓度不相关。
2.5IL-33诱导CD8+CD25+FoxP3+Treg增殖 与空白对照组相比,IL-33刺激5 d后,PBMCs中CD8+CD25+FoxP3+Treg比例和FoxP3mRNA表达水平显著增高,具有统计学意义(P<0.05),见表4。

图2 PE患者CD8+CD25+FoxP3+Treg比例与PBMCs FoxP3 mRNA相关性Fig.2 Correlations between percentage of CD8+CD25+FoxP3+Treg and FoxP3 mRNA expression in PBMCs from PE patients

表3 血清细胞因子浓度比较
Note:1)P<0.05,MPE and SPE versus HP;2)P<0.05,MPE versus SPE.

表4 IL-33诱导CD8+CD25+FoxP3+Treg增殖
Note:1)P<0.05,IL-33 group versus control group.
3 讨论
子痫前期的发病机制与母体对胎儿不能产生足够的免疫耐受有关,胎儿对母体是一种同种半异体移植物,导致母体系统性炎症反应,引起高血压和蛋白尿[2]。FoxP3+调节性T细胞可根据细胞表面CD4、CD8分为CD4+FoxP3+Treg和CD8+FoxP3+Treg。较多研究证实子痫前期的发生发展与CD4+Tregs数量减少和抑制功能下降有关[3,6]。CD8+CD25+FoxP3+Treg与CD4+CD25+FoxP3+Treg有相似的表型、功能和作用机制,能够通过细胞表面高表达的膜结合型TGF-β和细胞毒性T淋巴细胞相关抗原4 (CTLA-4)介导的接触依赖性方式,或者通过分泌IL-10、 TGF-β 等细胞因子,发挥非特异性免疫抑制功能[7]。
本研究表明,与正常妊娠组相比,PE患者外周血CD8+CD25+FoxP3+Treg细胞比例显著降低。叉头状蛋白转录因子Foxp3是Treg细胞关键转录因子,FoxP3表达对Tregs细胞发育和抑制功能的发挥起着关键作用。过继表达FoxP3的CD4+T细胞对自身免疫等疾病的防治有显著疗效[8]。本研究证实,与正常妊娠者相比,子痫前期患者外周血单个核细胞FoxP3mRNA水平明显减少,其他研究者也有相似的报道[9]。本次研究还证实PE患者PBMCs FoxP3mRNA表达水平与CD8+CD25+FoxP3+Treg比例呈正相关。
调节T细胞合成和分泌高浓度的抑炎性细胞因子IL-10和TGF-β等,从而发挥非特异性免疫抑制功能。正常妊娠时,母胎界面高浓度的IL-10能产生同种异体免疫耐受作用,从而抑制母体对胎儿产生免疫排斥[10]。Weel等[11]将胎盘组织经匀浆处理,发现与正常妊娠者相比,PE患者胎盘组织IL-10浓度显著降低,且晚发型PE患者TNF-α/IL-10比例显著低于早发型PE患者,提示PE患者胎盘组织存在炎症损伤。 本研究发现检测PE患者外周血IL-10浓度与正常对照组无差异,与CD8+CD25+FoxP3+Treg也不存在相关性,可能的原因是IL-10可由CD4+Treg、CD8+Treg、绒毛滋养层细胞等多种免疫细胞产生。
与CD4+Th细胞相似,CD8+T细胞分为Tc1、Tc2、Tc9、Tc17和CD8+Treg。CD8+初始T细胞朝着不同亚群分化的方向取决于抗原性质和强度、协同刺激分子和细胞因子。TGF-β 能诱使CD8+初始T细胞向CD8+Treg细胞分化,但在IL-6和TGF-β同时存在时则可分化为Tc17,在TGF-β和IL-4存在的条件下分化为Tc9[12]。Feizollahzadeh等[13]研究表明,子痫前期患者存在TGF-β1基因多肽性,而且血清TGF-β浓度明显升高。本次研究也证实,PE受试者血清TGF-β的表达显著高于健康妊娠组。
PE患者血清TGF-β水平显著升高,但CD8+Treg显著降低,其机制可能是受患者体内高浓度IL-6影响。Luppi等[14]也证实,与正常孕妇相比,PE患者的单核细胞可分泌高浓度IL-6。Pasare等[15]发现,IL-6/高浓度IL-6抑制CD4+CD25+Treg 细胞的免疫抑制作用,其机制可能是IL-6/高浓度IL-6能诱导CD4+Treg 前体细胞朝着Th17细胞分化[6,16],Santner-Nanan等[17]证实,PE患者体内 Th17细胞比例明显增加,而CD4+Treg细胞比例明显降低。本次研究也证实,子痫前期患者外周血IL-6和IL-17升高,与Darmochwal-Kolarz等[18]研究结果一致。本次研究还证实,CD8+CD25+FoxP3+Treg比例与IL-17呈负相关,提示IL-6可能诱导CD4+Treg、CD8+Treg分别向Th17细胞和Tc17细胞分化。也提示Th17/Treg 细胞是一对相关的T淋巴细胞亚群,共同参与维持体内免疫功能动态平衡。
IL-33是IL-1家族的新成员,是一种多功能蛋白[19]。ST2是IL-33细胞膜受体,IL-33促进Treg细胞表达ST2,并增强其免疫抑制功能[20]。本次研究发现PE患者外周血中 IL-33水平与正常孕妇相比差异无显著性,与Granne 等研究结果一致[21],同时还发现PE患者IL-33浓度与CD8+CD25+FoxP3+Treg比例呈正相关。通过体外实验证实,IL-33在体外能诱导CD8+CD25+FoxP3+Treg增殖。Matta等[20,22]研究发现,IL-33可以促进树突状细胞分泌IL-2,导致CD4+FoxP3+Treg细胞增殖;还发现IL-33可以在体内外增加CD4+Treg的抑制功能。在本次研究中,PE患者外周血CD8+CD25+FoxP3+Treg显著降低,而IL-33浓度正常,其机制可能是PE患者体内sST2显著增加[19]。sST2是ST2的可溶性变体,可作为 IL-33的诱饵受体从而抑制IL-33的功能。
综上所述,本次研究表明,与健康妊娠者相比,PE患者外周血CD8+CD25+FoxP3+Treg细胞比例显著降低,其相应FoxP3mRNA表达水平也降低,血清IL-6和IL-17浓度显著升高。PE患者CD8+CD25+FoxP3+Treg细胞比例与外周血IL-33浓度呈正相关,与IL-17浓度呈负相关,通过体外实验证实,IL-33可诱导外周血CD8+CD25+FoxP3+Treg+增殖。这些结果表明CD8+CD25+FoxP3+Treg细胞比例减少及相应FoxP3mRNA转录水平表达降低,减弱Treg免疫抑制功能,在子痫前期的发病机制中可能发挥一定的作用。为此,推测通过对PE患者CD8+Treg细胞分化及功能调控免疫平衡正常化,为探索子痫前期发病机制及治疗提供新的思路及治疗可能的新途径。
[1] Ahn H,Park J,Gilman-Sachs A,etal.Immunologic characteristics of preeclampsia,a comprehensive review[J].Am J Reprod Immunol,2011,65(4):377-394.
[2] Faas MM,de Vos P.Maternal monocytes in pregnancy and preeclampsia in humans and in rats[J].J Reprod Immunol,2017,119:91-97.
[3] Rahimzadeh M,Norouzian M,Arabpour F,etal.Regulatory T-cells and preeclampsia:an overview of literature[J].Exp Rev Clin Immunol,2016,12(2):209-227.
[4] Ohkura N,Kitagawa Y,Sakaguchi S.Development and mainten-ance of regulatory T cells[J].Immunity,2013,38(3):414-423.
[5] 谢 辛,苟文丽.妇产科学[M].第8版.北京:人民卫生出版社,2013:64-71.
[6] Lamarca B,Cornelius D,Wallace K.Elucidating immune mechanisms causing hypertension during pregnancy[J].Physiology,2013,28(4):225-233.
[7] Hori S.The Foxp3 interactome:a network perspective of Treg cells[J].Nat Immunol,2012,13(10):943-945.
[8] Steinborn A,Haensch G,Mahnke K,etal.Distinct subsets of regulatory T cells during pregnancy:is the imbalance of these subsets involved in the pathogenesis of preeclampsia[J].Clin Immunol,2008,129:401-412.
[9] Prins JR,Boelens HM,Heimweg J,etal.Preeclampsia is associated with lower percentages of regulatory T cells in maternal blood[J].Hypertens Pregnancy,2009,28(3):300-311.
[10] Lai Z,Kalkunte S,Sharma S.A critical role of interleukin-10 in modulating hypoxia-inducedpreeclampsia-like disease in mice[J].Hypertension,2011,57(3):505-514.
[11] Weel IC,Baergen RN,Romao-Veiga M,etal.Association between placental lesions,cytokines and angiogenic factors in pregnant women with preeclampsia[J].PLoS One,2016,11(6):e0157584.
[12] Mittrücker HW,Visekruna A,Huber M.Heterogeneity in the differentiation and function of CD8+T cells[J].Arch Immunol Ther Exp (Warsz),2014,62(6):449-582.
[13] Feizollahzadeh S,Taheripanah R,Khani M,etal.Promoter region polymorphisms in the transforming growth factor beta-1 (TGFβ1) gene and serum TGFβ1 concentration in preeclamptic and control Iranian women[J].Reprod Immunol,2012,94(2):216-221.
[14] Luppi P,DeLoia JA.Monocytes of preeclamptic women spontaneously synthesize pro-inflammatory cytokines[J].Clin Immunol,2006,118(2):268-275.
[15] Pasare C,Medzhitov R.Toll pathwaydependent blockade of CD4+CD25+T cell-mediated suppression by dendritic cells[J].Science,2003,299(5609):1033-1036.
[16] Afzali B,Mitchell P,Lechler R,etal.Translational mini-review series on Th17 IL-17-producing CD4+T cells in healthy pregnancy but not in preeclampsia[J].J Immunol,2009,183(11):7023-7030.
[17] Santner-Nanan B,Peek MJ,Khanam R,etal.Systemic increase in the ratio between FoxP3+and IL-17-producing CD4+T cells in healthy pregnancy but not in preeclampsia[J].J Immunol,2009,183(11):7023-7030.
[18] Darmochwal-Kolarz D,Kludka-Sternik M,Tabarkiewicz J,etal.The predominance of Th17 lymphocytes and decreased number and function of Treg cells in preeclampsia[J].J Reprod Immunol,2012,93(2):75-81.
[19] Stampalija T,Chaiworapongsa T,Romero R,etal.Maternal plasma concentrations of sST2 and angiogenic/anti-angiogenic factors in preeclampsia[J].Matern Fetal Neonatal Med,2013,26(14):1359-1370.
[20] Matta BM,Turnquist HR.Expansion of regulatory T cells in vitro and in vivo by IL-33[J].Methods Mol Biol,2016,1371:29-41.
[21] Granne I,Southcombe JH,Snider JV,etal.ST2 and IL-33 in Pregnancy and Pre-Eclampsia[J].PLoS One,2011,6(9):e24463.
[22] Matta BM,Lott JM,Mathews LR,etal.IL-33 is an unconventional alarmin that stimulates IL-2 secretion by dendritic cells to selectively expand IL-33R/ST2+regulatory T cells[J].J Immunol,2014,193(8):4010-4020.
[收稿2016-11-10 修回2016-12-10]
(编辑 许四平)
ChangeandsignificanceofCD8+CD25+FoxP3+regulatorTcellsinperipheralbloodofpatientswithpre-eclampsia
YUJian-Xiu,WANGHong-You,QIANLei,CHENWei,SUNHai-Ling.DepartmentofLaboratoryMedicine,BinhaiCountryPeople′sHospital,Yancheng224500,China
Objective:To explore the role of CD8+CD25+FoxP3+regulator T cells(Treg) in the pathogenesis of pre-eclampsia (PE) in peripheral blood.Methods:This study included 24 gestational-age-matched healthy pregnant women and 46 pregnant women diagnosed with mild PE (MPE,n=24) or severe PE (SPE,n=22) during the third trimester of gestation.An 3 ml sample of peripheral blood was drawn from each subject and anti-coagulated with heparin sodium.The percentage of CD8+CD25+FoxP3+Treg cells was detected by flow cytometry.The cytokines IL-6,IL-17A,IL-10,IL-1,IL-33 and TGF-β1 were detected using Luminex200.Peripheral blood mononuclear cells (PBMCs) were isolated from healthy controls and treated with IL-33,the percentages of CD8+CD25+FoxP3+Treg cell were measured by flow cytometric detection.Results:Compared to that of healthy pregnant controls [0.48(0.21-0.96)%],MPE patients [0.32(0.19-0.63)%] and SPE patients [0.13(0.02-0.41)%] had lower percentages of CD8+CD25+FoxP3+Treg cells (P<0.05).Compared to HP controls,higher levels of IL-6 and IL-17A were found in MPE and SPE patients(P<0.05) and even higher in SPE patients.The levels of IL-10,IL-1β and IL-33 were similar in all three groups (P>0.05).Compared to HP controls,the levels of TGF-β1 was significantly increased in SPE and MPE patients(P<0.05),but no significant differences were found between these two groups (P>0.05).The percentage of CD8+CD25+FoxP3+Treg cells showed a negative correlation with the serum concentrations of IL-17A (r=-0.338,P=0.338),and a positive correlation with the serum concentrations of IL-33 (r=0.548,P=0.548).After PBMCs were treated with IL-33 for five days,the percentages of CD8+CD25+FoxP3+Treg were significantly higher than those of the controls(P<0.05).Conclusion:These findings suggested that the reduced CD8+CD25+FoxP3+Treg cells may play a role in the pathogenesis of pre-eclampsia.
Pre-eclampsia;CD8+CD25+FoxP3+Treg;IL-17;IL-33
10.3969/j.issn.1000-484X.2017.06.019
①本文为盐城医学科技发展项目(YK2015065)。
②滨海县人民医院妇产科,盐城224500。
③通讯作者,E-mail:qianleiyc@163.com。
于建秀(1984年-),女,硕士,主管技师,主要从事免疫学方面的研究。
R392
A
1000-484X(2017)06-0900-05

