磷酸酶PP2CB抑制RNA病毒VSV或SeV介导的天然免疫应答①
周庆卿 张赟恺 陈 祥 刘星光
(第二军医大学免疫学研究所暨医学免疫学国家重点实验室,上海200433)
磷酸酶PP2CB抑制RNA病毒VSV或SeV介导的天然免疫应答①
周庆卿 张赟恺②陈 祥 刘星光
(第二军医大学免疫学研究所暨医学免疫学国家重点实验室,上海200433)
目的:研究蛋白磷酸酶PP2CB在抗RNA病毒天然免疫应答中的调控作用及其机制。方法:在小鼠腹腔巨噬细胞中转染PP2CB的特异siRNA,干扰其表达后通过Q-PCR和ELISA观察RNA病毒诱导的Ⅰ型干扰素的产生变化、病毒在细胞内的复制变化,Western blot检测TBK1和IRF3的磷酸化水平的改变。结果:VSV感染诱导巨噬细胞中PP2CB的表达发生显著改变。过表达PP2CB抑制HEK293细胞中IFN-β的转录活化。干扰PP2CB表达显著升高RNA病毒VSV或SeV诱导的Ⅰ型干扰素的mRNA和蛋白表达水平,并抑制VSV复制。此外,RNA病毒诱导PP2CB和TBK1结合。干扰PP2CB的表达能够增强TBK1和IRF3的磷酸化。结论:RNA病毒VSV或SeV使蛋白磷酸酶PP2CB能够结合TBK1并抑制其磷酸化,下调Ⅰ型干扰素信号通路的活化,从而负向调控RNA病毒VSV或SeV诱导的Ⅰ型干扰素的产生。
蛋白磷酸酶PP2CB;天然免疫;Ⅰ型干扰素;巨噬细胞
当病毒等病原体入侵机体时,天然免疫应答是机体免疫系统识别和清除病原体的一系列生理性防御机制中最早出现的。天然免疫系统通过模式识别受体(Pattern recognition receptors,PRRs)特异性识别相应病原体相关分子模式(Pathogen-associated molecular patterns,PAMPs)触发天然免疫应答[1]。受到病毒感染后,PRRs特异性识别病毒表面特定的分子结构,使下游信号通路活化,诱导巨噬细胞等天然免疫细胞产生大量的炎性细胞因子和Ⅰ型干扰素(Interferon,IFN),从而启动抗病毒天然免疫应答[2,3]。维甲酸诱导的基因Ⅰ样受体[Retinoid acid-inducible geneⅠ(RIG-Ⅰ)-like receptors,RLRs]是一类能够识别胞浆内病毒RNA的重要PRRs,包括RIG-Ⅰ(Retinoid acid-inducible geneⅠ)和MDA5(Melanoma differentiation-associated gene5)。其中,RIG-Ⅰ主要识别短链dsRNA和5′ppp RNA,例如水泡口炎病毒(Vesicular stomatitis virus,VSV)和仙台病毒(Sendai virus,SeV)等;MDA5则主要识别长链dsRNA[4,5]。RIG-Ⅰ或MDA5识别相应病毒RNA后,招募接头分子IPS-1(Interferon-β promoter stimulator 1),继而激活TBK1(TANK-binding kinase 1),使IRF3(Interfe-ron regulatory factor 3)或IRF7磷酸化并促进其核转位,最终诱导IFN-α和IFN-β大量产生,发挥抗病毒作用[6,7]。Ⅰ型IFN具有干扰病毒感染和复制的功能[8]。它能够激活大量干扰素刺激基因(Interferon stimulated genes,ISGs),诱导其转录表达,共同发挥对病毒复制的抑制作用,增强细胞抵抗病毒感染的能力,诱导受病毒感染的细胞凋亡,刺激造血系统中各种细胞的更新与增殖以及激活适应性免疫[9]。然而,天然免疫系统的过度激活会产生过量的干扰素,对机体组织、细胞造成损伤,甚至导致自身免疫疾病等严重不良后果[10]。而Ⅰ型IFN的产生不足则无法成功干扰病毒的感染与复制。因此,天然免疫系统在各个层面上对Ⅰ型IFN的产生进行精密的调控,包括PRRs对病原体的特异性识别过程、下游信号途径上的接头分子以及有关的酶和转录因子的活化等不同调控层面[11]。
目前研究发现多种信号蛋白参与抗病毒天然免疫应答的调控。近年来,蛋白磷酸酶通过调节免疫信号通路中关键蛋白的磷酸化水平进而调控其免疫应答的新功能受到广泛关注。不少研究已经证实蛋白磷酸酶在造血细胞分化、髓系细胞和淋巴细胞发育增殖以及细胞因子受体信号、B细胞受体(B cell receptor,BCR)、T细胞受体(T cell receptor,TCR)和Fc受体(Fc receptor,FCR)信号活化过程中发挥重要作用[12,13]。在抗病毒反应中,蛋白磷酸酶通过改变其中关键信号分子的磷酸化水平对该蛋白的活性和功能进行调控,使其发生去磷酸化而失活,参与调控天然免疫应答,在抵抗病原体感染过程中扮演重要角色。目前已报道部分蛋白磷酸酶通过不同机制,在抗病毒天然免疫应答中发挥调控作用。PPM1B(Protein phosphatase Mg2+/Mn2+-dependent 1B)直接结合TBK1,并去磷酸化TBK1的Ser172,进而抑制TBK1的激活[14]。酪氨酸磷酸酶SHIP-1能够抑制TBK1的磷酸化,最终抑制TLR3介导的IFN-β的产生[15]。然而,蛋白磷酸酶PP2家族在抗病毒天然免疫应答中的调控作用及机制仍有待研究。蛋白磷酸酶PP2CB(Protein phosphatase 2,catalytic subunit,beta isoform)属于丝/苏氨酸蛋白磷酸酶家族成员,包括一个包含15个HEAT(Huntingtin-elongation-A subunit-TOR)重复序列组成的马蹄状的PP2支架亚基、一个相对保守的催化亚基和多个调节亚基。以前的研究证实PP2CB能够通过使细胞周期蛋白依赖性蛋白激酶(Cyclin-dependent protein kinases,CDKs)去磷酸化,调节细胞周期。它还能调节Sp1和NF-κB等重要转录因子的磷酸化水平从而控制其转录活性,与DNA结合能力和细胞内定位。此外,PP2CB还参与TOR信号、Wnt信号及MAP信号通路,发挥重要的调控作用[16]。然而PP2CB在抗病毒免疫应答中的作用尚不清楚。
本实验在小鼠腹腔巨噬细胞中转染PP2CB的特异siRNA,研究干扰其蛋白表达对RNA病毒VSV或SeV诱导的IFN-β和IFN-α产生的影响,并探索其调控的分子机制。本研究丰富了机体对Ⅰ型IFN表达的内源性调控机制,同时也为发现新的抗病毒药物靶点及新型治疗策略提供理论基础。
1 材料与方法
1.1材料
1.1.1细胞培养与转染 HEK293细胞来自ATCC,用含10%胎牛血清(FCS)的DMEM培养基培养。小鼠腹腔巨噬细胞取自于C57BL/6J小鼠。
1.1.2主要试剂 DMEM培养基和胎牛血清购自PAA Laboratories公司;JetPEI转染试剂和INTERFERin转染试剂购自Polyplus公司;细胞总RNA抽提试剂Trizol和反转录试剂盒ReverTraAce购自ToYoBo公司;IFN-α和IFN-β ELISA试剂盒购自PBL公司;IFN-β报告基因质粒由本实验室自行构建并保存;VSV病毒由第二军医大学微生物教研室潘卫教授惠赠;SeV由中国科学院上海生命科学研究院孙兵教授惠赠。
1.2方法
1.2.1小鼠腹腔巨噬细胞的分离和培养 取制备的3%无菌脱水硫羟乙酸培养基2 ml,注射入6周以上C57小鼠腹腔,3 d后将其颈椎脱臼处死,于75%乙醇中浸泡消毒,后剪开小鼠下腹部皮肤充分暴露腹膜。将不含血清的培养基注射入腹腔并反复冲洗,后离心5 min。弃去离心管中液体,加入10 ml的含10% FCS的DMEM完全培养基,吹打重悬细胞沉淀50次左右,使细胞充分分散混匀后计数铺板。铺板后置于培养箱中培养,2 h后更换含血清培养基,得到腹腔巨噬细胞。
1.2.2RNA干扰 分离小鼠腹腔巨噬细胞的第2天将培养基换成预热过的含10% FCS的DMEM完全培养基。将PP2CB siRNA按最适浓度加入至Opti-MEM培养基中,涡旋震荡10 s,再将INTERFERin按比例加入该混合液体中,同样涡旋震荡10 s,静置10~15 min将混合的转染试剂竖直平均滴加在培养基中。置于37℃、CO2浓度为5%的培养箱中于6 h后用预热的含血清的DMEM培养基换液,干扰时间48 h后进行后续实验操作。靶向PP2CB基因的siRNA的序列是5′-GAGAAGGCUAAGGAAAUUU-3′(siRNA)。对照siRNA的序列是5′-UUCUCCGAACGUGUCACGU-3′(Ctrl)。
1.2.3Western blot 在6孔板中加入冰冷PBS洗细胞2次,吸干液体后加入一定量含蛋白酶抑制剂Cocktail的细胞裂解液,于冰盒上裂解5 min后即可收集蛋白。之后在运用BCA法测定上清中蛋白浓度,随后处理蛋白样品。将蛋白样品进行电泳、转膜,之后将其置于5% BSA中封闭,时间为1 h。加入抗待测蛋白的抗体置于4℃冰箱中孵育过夜。第2天于TBST摇床上洗3次膜,加入相应鼠或兔的HRP标记的二抗,室温孵育1 h,同样的方法洗3次膜后即可用ECL法显影。
1.2.4ELISA 使用特异性siRNA干扰小鼠腹腔巨噬细胞中PP2CB表达48 h后,使用VSV或SeV感染细胞24 h,收集培养上清,离心后即可按照不同说明书使用ELISA试剂盒检测巨噬细胞上清中IFN-β和IFN-α的蛋白水平。
1.2.5RNA提取和实时荧光定量PCR 按照说明书使用细胞总RNA抽提试剂Trizol,根据步骤提取腹腔巨噬细胞total RNA。测定RNA浓度后取1 μg细胞总RNA,使用反转录试剂盒获取cDNA,即可用于实时荧光定量PCR。采用SYBR Green Real-time PCR Master Mix,使用荧光定量仪lightCycler2.0进行实时荧光定量PCR扩增。定量PCR引物序列如下:Pp2cb:Forward:5′-GTCCGCTGTCCTGTACCG-3′;Reverse:5′-GCTTTCGTGATTTCCTCCTCGCAATA-3′。Ifnb1:Forward:5′-ATGAGTGGTGGTTGCAGGC-3′;Reverse:5′-TGACCTTTCAAATGCAGTAGATTCA-3′。Ifna4:Forward:5′-TACTCAGCAGACCTTGAACCT-3′;Reverse:5′-CAGTCTTGGCAGCAAGTTGAC-3′。VSVL:Forward:5′-TCAAACCATCCGAGCCATTC-3′;Rev-erse:5′-TTGGCAAGTATGCTAAGTCA-3′。β-actin:Forward:5′-AGTGTGACGTTGACATCCGT-3′;Reve-rse:5′-GCAGCTCAGTAACAGTCCGC-3′。
1.2.6荧光素酶报告基因 将HEK293细胞铺于96孔板,细胞密度为(1~2)×104/孔,置于37℃、CO2浓度为5%的培养箱培养,12 h后使用JetPEI转染试剂将目的基因质粒、接头分子质粒、IFN-β-Luciferase荧光素酶报告基因质粒、TK质粒共转进HEK293细胞中,转染24 h。之后在每孔中加入40 μl的PLB裂解液后置于摇床上约30 min,吸取25 μl的细胞裂解液,将其转移至96孔的报告基因检测板中,使用双荧光报告基因检测仪Synergy2检测HEK293细胞中荧光素酶活性并计算IFN-β的相对转录活性。
1.2.7免疫沉淀 在小鼠腹腔巨噬细胞中感染VSV病毒6 h后用细胞裂解液裂解收取蛋白,加入一定比例的抗PP2CB抗体和IgG抗体后置于4℃震荡过夜,第2天加入A/G珠子再次4℃震荡4 h。随后用IP buffer洗涤4次,加入蛋白loading buffer后,在沸水中煮8 min,再进行Western blot检测。
1.3统计学处理 两组数据间的比较,采用t检验。P<0.05表示差异有统计学意义。
2 结果
2.1PP2CB的表达在病毒活化的巨噬细胞中发生显著改变 RNA病毒VSV感染巨噬细胞0、4、8、12、24 h,PP2CB表达先升高后降低,提示PP2CB可能参与抗病毒天然免疫应答(图1)。
2.2PP2CB剂量依赖性抑制SeV诱导的IFN-β的转录活化 在HEK293细胞中转染50、100、150 ng的PP2CB表达质粒,转染24 h后发现转染PP2CB质粒能显著抑制IFN-β的转录活性,并且随PP2CB质粒转染剂量的升高,其转录活性显著降低,表明PP2CB剂量依赖性地抑制SeV诱导的IFN-β的转录活化(图2)。
2.3干扰PP2CB的表达能促进RNA病毒诱导的Ⅰ型IFN产生 设计并合成了多对靶向PP2CB的siRNA,并通过实验筛选出能显著沉默小鼠腹腔巨噬细胞中PP2CB表达的一对特异性siRNA,与对照siRNA(Ctrl)相比,其干扰效率达到70%以上(图3)。干扰PP2CB的表达可以显著升高VSV和SeV诱导的IFN-α和IFN-β mRNA的表达水平。而且,干扰PP2CB的表达也能显著促进VSV和SeV诱导的IFN-β和IFN-α蛋白的产生(图4)。
2.4干扰PP2CB的表达抑制巨噬细胞中VSV的复制 在小鼠腹腔巨噬细胞中转染PP2CB特异性siRNA,干扰其表达后,发现VSV的复制率较对照组有显著降低,表明PP2CB通过抑制RNA病毒诱导的Ⅰ型IFN的产生从而促进巨噬细胞中RNA病毒的复制(图5)。
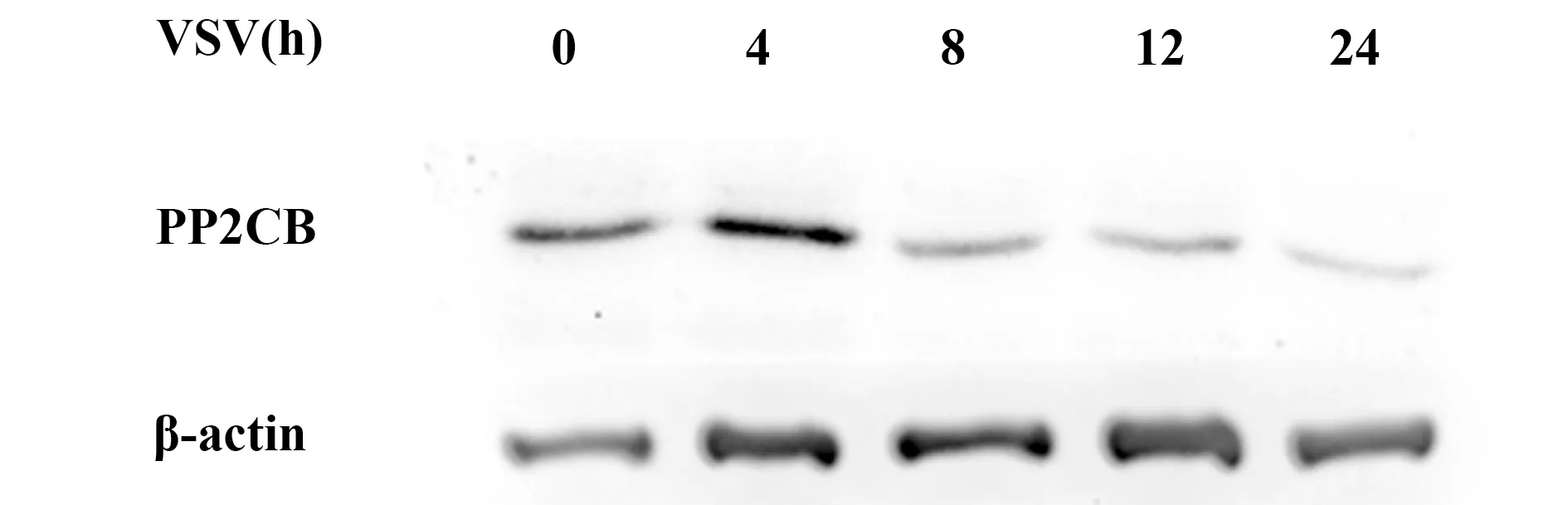
图1 VSV病毒感染可以诱导巨噬细胞中PP2CB 表达发生显著改变Fig.1 Expression change of PP2CB in macrophages infected with VSV
2.5PP2CB能够结合TBK1而调控TBK1依赖的Ⅰ型IFN产生 使用抗PP2CB的抗体进行免疫沉淀实验发现,小鼠腹腔巨噬细胞中蛋白磷酸酶PP2CB能与TBK1相结合,而当RNA病毒VSV感染后其结合增强(图6)。
2.6干扰PP2CB的表达能促进Ⅰ型IFN信号通路的活化 利用特异性siRNA干扰PP2CB的表达能够上调VSV感染诱导的关键信号分子TBK1和IRF3的磷酸化水平,表明干扰PP2CB的表达能促进Ⅰ型IFN信号通路的活化(图7)。
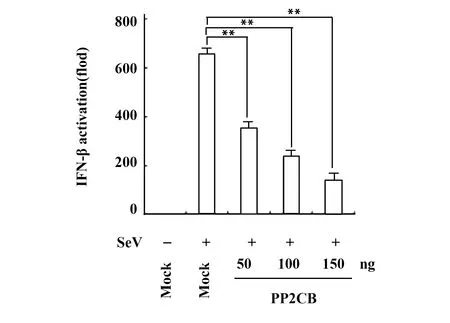
图2 PP2CB剂量依赖性抑制HEK293细胞中SeV诱导的IFN-β转录活化Fig.2 Overexpression of PP2CB dose-dependently inhib-its activation of IFN-β reporter gene induced by SeVNote:Data are the ±s of six samples in one experiment representative of similar results in three independently experiments,**.P<0.01.
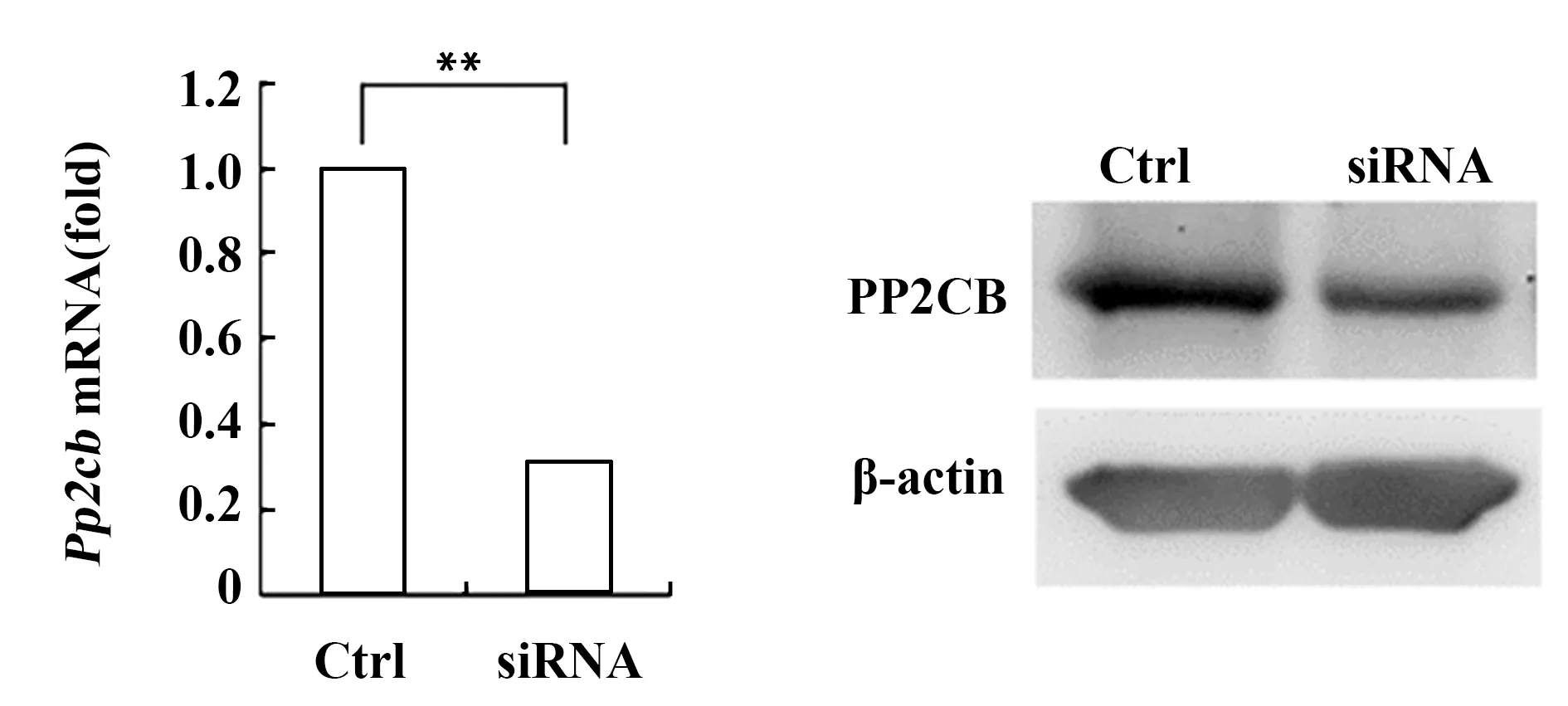
图3 靶向PP2CB特异性siRNA显著降低小鼠腹腔巨噬细胞中PP2CB的表达Fig.3 PP2CB silencing effectively down-regulates expres-sion level of PP2CB in macrophagesNote:Data are the ±s of six samples in one experiment representative of similar results in three independently experiments,**.P<0.01.

图4 干扰PP2CB表达促进VSV和SeV感染诱导的巨噬细胞中IFN-β和IFN-α的产生Fig.4 PP2CB silencing significantly promotes production of IFN-α/β in macrophages infected with VSV and SeVNote:Data are shown as ±s of three independently experiments,**.P<0.01.

图5 干扰PP2CB表达可以抑制VSV病毒的复制Fig.5 PP2CB silencing inhibits VSV replication in macrophagesNote:Data are shown as ±s of three independently experiments,**.P<0.01.
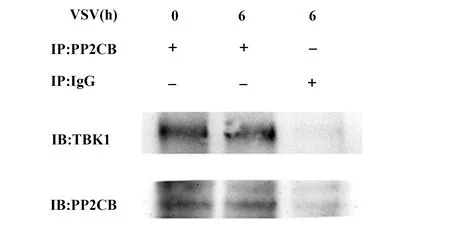
图6 PP2CB可以结合TBK1Fig.6 PP2CB binds TBK1
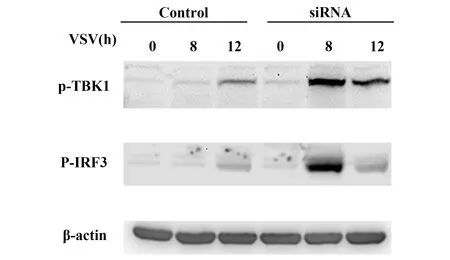
图7 干扰PP2CB表达上调TBK1和IRF3的磷酸化水平Fig.7 PP2CB silencing up-regulates phosphorylation levels of TBK1 and IRF3 in macrophages infected with VSV
3 讨论
病毒触发的天然免疫细胞通过产生Ⅰ型IFN,抑制病毒复制并清除受病毒感染的细胞,防御病毒的播散[17]。近年来,部分蛋白磷酸酶已被发现参与抗病毒天然免疫应答的调控,其中有4个磷酸酶通过作用于TBK1调控Ⅰ型IFN的产生,包括SHP-2、SHIP-1、PPM1B及PP4。它们均通过不同的机制直接或间接与TBK1发生作用,从而负向调控抗病毒反应。酪氨酸磷酸酶SHP-2虽然不与TBK1发生直接作用,但通过发挥其酪氨酸磷酸酶活性,抑制TRIF依赖的Ⅰ型IFN和炎性细胞因子的产生[18];脂类磷酸酶SHIP-1促进TLR3信号通路复合体上TBK1和内涵体的分离进而抑制其磷酸化;只有PP2C家族成员PPM1B和丝/苏氨酸磷酸酶PP4能够与 TBK1发生直接作用使TBK1的Ser172发生去磷酸化,抑制TBK1的激活,随后抑制IRF3的活化,最终下调Ⅰ型IFN和ISGs的表达。然而其他磷酸酶包括蛋白磷酸酶PP2A家族成员PP2CB在抗病毒天然免疫应答中的作用仍不清楚。
本实验的研究结果证实了蛋白磷酸酶PP2CB参与抗RNA病毒天然免疫应答的调控。PP2CB能通过结合关键信号激酶TBK1并下调其磷酸化水平从而抑制TBK1和IRF3通路的活化,抑制Ⅰ型IFN的产生,从而导致细胞内RNA病毒复制的增加,对机体的抗RNA病毒天然免疫应答反应起抑制性调控作用。TBK1 的Ser172磷酸化对其活化非常关键,考虑到PP2CB具有丝/苏氨酸磷酸酶活性,PP2CB可能作用于TBK1的Ser172并使其去磷酸化,从而抑制TBK1激酶的活化及下游IRF3的活化。另外,在病毒入侵机体的过程中,PP2CB和以上几个磷酸酶是否全部发挥负向调控抗病毒天然免疫应答的功能,以及彼此之间是否存在竞争或协同的关系,也需要进一步研究。
在机体抵抗病毒入侵、启动抗病毒反应的过程中,病毒也针对免疫应答的不同环节,试图逃逸免疫应答确保自身的存活。病毒可以通过阻断模式识别受体的识别、阻止宿主基因表达、抑制Ⅰ型IFN信号通路的活化、减少Ⅰ型IFN和ISGs的产生等方法限制和逃逸免疫系统的攻击[19,20]。既然我们的研究证明PP2CB能抑制病毒诱导的Ⅰ型IFN的产生,且PP2CB的表达在RNA病毒感染后先升高后降低,那么病毒便能够利用细胞内PP2CB从而拮抗细胞中Ⅰ型IFN产生信号通路的活化,抑制Ⅰ型IFN和ISGs的表达,帮助病毒逃逸天然免疫应答。我们的研究为病毒免疫逃逸增添了新的假说,也为发现新型重要的抗病毒药物靶点提供新思路。此外,过量的Ⅰ型IFN会对组织细胞造成病理性损伤,以及在某些自身免疫性疾病如类风湿性关节炎的发病中起重要致病作用,既然内源性RNA也能被胞内相应受体所识别从而产生Ⅰ型IFN,所以机体便可以利用PP2CB对Ⅰ型IFN信号通路的抑制作用,避免机体产生过量的Ⅰ型IFN,从而在自身免疫性疾病的发病中起抑制性调控作用。因此PP2CB调节Ⅰ型IFN产生的免疫学功能有助于为慢性炎症或自身免疫性疾病提供新的潜在药物开发和治疗靶点。
[1] Brubaker SW,Bonham KS,Zanoni I,etal.Innate immune pattern recognition:a cell biological perspectve[J].Annu Rev Immunol,2015,33:257-290.
[2] Kumar H,Kawai T,Akira S.Pathogen recognition by the innate immune system[J].Int Rev Immunol,2011,30(1):16-34.
[3] Ng CT,Mendoza JL,Garcia KC,etal.Alpha and beta type 1 interferon signaling:passage for diverse biologic outcomes[J].Cell,2016,164(3):349-352.
[4] Yoneyama M,Onomoto K,Jogi M,etal.Viral RNA detection by RIG-I-like receptors[J].Curr Opin Immunol,2015,32:48-53.
[5] Feng Q,Hato SV,Langereis MA,etal.MDA5 detects the double-stranded RNA replicative form in picorna virus-infected cells[J].Cell Rep,2012,2(5):1187-1196.
[6] Gu M,Zhang T,Lin W,etal.Protein phosphatase PP1 negatively regulates the Toll-like receptor-and RIG-I-like receptor-triggered production of type I interferon by inhibiting IRF3 phosphorylation at Serines 396 and 385 in macrophage[J].Cell Signal,2014,26(12):2930-2939.
[7] Zhao Y,Liang L,Fan Y,etal.PPM1B negatively regulates antiviral response via dephosphorylating TBK1[J].Cell Signal,2012,24(11):2197-2204.
[8] Nan,Nan G,Zhang YJ.Interferon induction by RNA viruses and antagonism by viral pathogens[J].Viruses,2014,6(12):4999-5027.
[9] Li S,Zhu M,Pan R,etal.The tumor suppressor PTEN has a critical role in antiviral innate immunity[J].Nat Immunol,2016,17(3):241-249.
[10] Zhan Z,Cao H,Xie X,etal.Phosphatase PP4 Negatively Regulates Type I IFN Production and Antiviral Innate Immunity by Dephosphorylating and Deactivating TBK1[J].J Immunol,2015,195(8):3849-3857.
[11] Teijaro JR.Type I interferons in viral control and immune regulation[J].Curr Opin Virol,2016,16:31-40.
[12] Bastan R,Eskandari N,Sabzghabaee AM,etal.Serine/Threonine phosphatases:classification,roles and pharmacological regulation[J].Int J Immunopathol Pharmacol,2014,27(4):473-484.
[13] Doody KM,Bourdeau A,Tremblay ML.T-cell protein tyrosine phosphatase is a key regulator in immune cell signaling:lessons from the knockout mouse model and implications in human disease[J].Immunol Rev,2009,228(1):325-341.
[14] Zhao W.Negative regulation of TBK1-mediated antiviral immunity[J].FEBS Lett,2013,587(6):542-548.
[15] Gabhann JN,Higgs R,Brennan K,etal.Absence of SHIP-1 results in constitutive phosphorylation of tank-binding kinase 1 and enhanced TLR3-dependent IFN-beta production[J].J Immunol,2010,184(5):2314-2320.
[16] Zhang W,Yang J,Liu Y,etal.PR55 alpha,a regulatory subunit of PP2A,specifically regulates PP2A-mediated beta-catenin dephosphorylation[J].J Biol Chem,2009,284(34):22649-22656.
[17] Horner SM.Insights into antiviral innate immunity revealed by studying hepatitis C virus[J].Cytokine,2015,74(2):190-197.
[18] An H,Zhao W,Hou J,etal.SHP-2 phosphatase negatively regulates the TRIF adaptor protein-dependent type I interferon and proinflammatory cytokine production[J].Immunity,2006,25(6):919-928.
[19] Beachboard DC,Horner SM.Innate immune evasion strategies of DNA and RNA viruses[J].Curr Opin Microbiol,2016,32:113-119.
[20] Yi Z,Chen J,Kozlowski M,etal.Innate detection of hepatitis B and C virus and viral inhibition of the response[J].Cell Microbiol,2015,17(9):1295-1303.
[收稿2016-09-28 修回2016-11-08]
(编辑 张晓舟)
PhosphatasePP2CBinhibitsinnateimmuneresponsetriggeredbyRNAvirusVSVorSeV
ZHOUQing-Qing,ZHANGYun-Kai,CHENXiang,LIUXing-Guang.NationalKeyLaboratoryofMedicalImmunology&InstituteofImmunology,SecondMilitaryMedicalUniversity,Shanghai200433,China
Objective:To investigate the role of phosphatase PP2CB in the innate immunity against RNA virus and the underlying mechanism.Methods:PP2CB expression in macrophages was silenced with the specific siRNA.The mRNA and protein expression level of type Ⅰ interferon was detected by Q-PCR and ELISA respectively.The phosphorylation level of TBK1 and IRF3 was analyzed by Western blot.Results:RNA virus VSV infection led to the expression change of PP2CB.Overexpression of PP2CB dose-dependently inhibited the activation of IFN-β reporter gene.PP2CB silencing by PP2CB siRNA significantly promoted the production of typeⅠ interferon triggered by RNA virus VSV or SeV,and inhibited the replication of VSV in macrophages.Furthermore,PP2CB bound TBK1 upon RNA virus infection.PP2CB silencing up-regulated the phosphorylation level of TBK1 and IRF3.Conclusion:Upon RNA virus VSV or SeV infection,phosphatase PP2CB binds TBK1 and inhibits its phosphorylation to negatively regulate the activation of the antiviral innate immune signal pathway,which consequently suppresses the production of type Ⅰ interferon triggered by RNA virus VSV or SeV.
Phosphatase PP2CB;Innate immunity;Type Ⅰ interferon;Macrophage
10.3969/j.issn.1000-484X.2017.06.003
①本文受国家自然科学基金优秀青年科学基金(81422021)资助。
②共同第一作者。
周庆卿(1990年-),女,在读硕士,主要从事天然免疫应答调控研究,E-mail:pp123zqq@163.com。
及指导教师:刘星光(1980年-),男,博士,副教授,主要从事天然免疫应答调控研究,E-mail:liuxg80@163.com。
R392.12
A
1000-484X(2017)06-0818-06

