β-胡萝卜素对脂多糖刺激巨噬细胞RAW264.7炎症因子的影响及其机制①
张晓音 张珊珊 吴 旻 吉昱斌 黄羽盛 郑 鑫
(吉林农业大学动物科学技术学院,长春130118)
β-胡萝卜素对脂多糖刺激巨噬细胞RAW264.7炎症因子的影响及其机制①
张晓音 张珊珊 吴 旻 吉昱斌 黄羽盛 郑 鑫
(吉林农业大学动物科学技术学院,长春130118)
目的:探讨β-胡萝卜素对脂多糖(LPS)刺激巨噬细胞RAW264.7炎症因子的影响及其机制。方法:采用5 μg/ml 的LPS刺激巨噬细胞24 h后用不同浓度的β-胡萝卜素(20、40、80、160 μmol/L)处理细胞3 h,MTT法测细胞活性,荧光定量PCR测炎症因子IL-1β、IL-6、TNF-α mRNA相对表达量,ELISA测炎症因子IL-1β、IL-6、TNF-α的分泌量,Western blot测NF-κB p65蛋白相对表达量。5 μg/ml的LPS和不同浓度的NF-κB抑制剂PDTC(1、5、10 μg/ml)共同处理巨噬细胞24 h,Western blot测NF-κB p65蛋白相对表达量,荧光定量PCR、ELISA测炎症因子的表达和分泌。比较LPS+PDTC组和LPS+PDTC+β-胡萝卜素组炎症因子和NF-κB p65蛋白相对表达的变化。结果:与LPS组相比,不同浓度的β-胡萝卜素对LPS刺激的巨噬细胞的细胞活性有提升作用,对炎症因子和NF-κB p65蛋白的表达有抑制作用;抑制NF-κB蛋白的表达可以抑制LPS刺激的巨噬细胞炎症因子的分泌; LPS+PDTC+β-胡萝卜素组对炎症因子的抑制作用比LPS+PDTC组明显,且差异显著(P<0.05),但两组对NF-κB p65蛋白的表达不明显。结论:β-胡萝卜素可以通过抑制NF-κB通路中NF-κB p65蛋白的表达抑制LPS刺激的巨噬细胞炎症因子IL-1β、IL-6、TNF-α的分泌,且此通路不是唯一相关的通路。
β-胡萝卜素;RAW264.7细胞;炎症因子;NF-κB p65蛋白
炎症是由激活的巨噬细胞释放一系列炎症因子所产生的以防御为主的一种免疫反应[1],炎症因子的持续刺激会导致慢性炎症的发生,与风湿性关节炎、哮喘、动脉粥样硬化等疾病的产生密切相关[2,3]。类固醇和非类固醇药物是传统的抗炎药物,被广泛使用,但其对胃肠道、肾脏、中枢神经系统等存在极大的副作用[4],因此,寻求一种新型、高效、毒副作用小的抗炎药物对慢性炎症干预具有重要意义。β-胡萝卜素是具有共轭多烯双键结构的天然色素之一,具有抗氧化、抗癌、促进细胞间隙连接通讯等多种生物活性,在延缓机体衰老、预防疾病、提高机体免疫力等方面中发挥重要作用[5,6],现已被157个国家列入食品添加剂与饲料添加剂名录。关于β-胡萝卜素的研究大多基于其是维生素A的前体,在炎症方面鲜有报道,本试验拟通过细胞炎症模型来研究β-胡萝卜素对炎症反应的作用。
巨噬细胞是参与炎症反应的主要细胞之一,在脂多糖的刺激下,可诱导分泌IL-1β、IL-6、TNF-α等多种炎症因子,进而出现临床炎症反应[7],而分泌的这些炎症因子是检测炎症严重程度的量化指标[8]。所以,本试验以LPS诱导RAW264.7巨噬细胞建立炎症模型,研究β-胡萝卜素对其炎症因子分泌的影响及其作用机制,为β-胡萝卜素的使用以及炎症的治疗提供理论基础。
1 材料与方法
1.1材料
1.1.1细胞株 巨噬细胞RAW264.7购自武汉大学中国细胞典藏中心。
1.1.2主要试剂 β-胡萝卜素(武汉星辰生物);RPMI1640培养基、胎牛血清(美国Gibco公司);LPS、MTT(美国Sigma公司);PDTC(上海碧云天);RNA Lyzol(上海ExCell公司);cDNA逆转录试剂盒(美国Gene Copoeia 公司);Brilliant Ⅱ SYBR Green QPCR Master Mix(美国 Agilent Technologies);引物(上海生工生物);RIPA裂解液(北京Solarbio);ELISA试剂盒(上海朗顿);BCA法蛋白定量试剂盒(上海申能博采);NF-κB抗体、β-actin抗体(美国CST);HRP标记的羊抗鼠/兔抗体(天津三箭);ECL试剂盒(美国Millipore)。
1.1.3主要仪器 高速冷冻离心机(德国Sigma);Thermo酶标仪(上海赛默飞世尔) ;荧光定量PCR仪、凝胶成像仪(美国Bio-Rad)。
1.2方法
1.2.1RAW264.7细胞培养 用含10%胎牛血清的RPMI1640培养基(含青霉素100 U/ml,链霉素100 μg/ml)于5% CO2、37℃ 培养箱中培养,1~2 d换液1次。待细胞生长至80%~90%时,根据不同的试验目的,接种于96孔细胞板或6孔细胞板中继续培养。
1.2.2MTT法检测β-胡萝卜素对RAW264.7细胞活性的影响 取对数生长期的细胞以8×104个/ml的密度接种于96孔细胞板中,每孔100 μl,置于5% CO2、37℃ 培养箱中培养。待细胞贴壁后,加入终浓度为0、20、40、80、160 μmol/L的β-胡萝卜素(DMSO的最终质量分数为0.5%),每组8个复孔,培养3、6、12 h后分别弃去培养液,然后每孔加入0.5 mg/ml的MTT溶液100 μl,培养4 h后终止培养。最后,每孔加入100 μl DMSO,置于摇床上低速震荡10 min,在酶标仪490 nm处测量其吸光值,计算不同浓度的β-胡萝卜素组相对于空白组的细胞活性。
1.2.3荧光定量PCR、ELISA检测β-胡萝卜素、PDTC对LPS刺激RAW264.7细胞炎症因子IL-1β、IL-6、TNF-α的影响 按照1.2.2中接种96孔细胞板的方法以细胞浓度为2×106个/ml接种RAW264.7细胞于6孔细胞板中,每孔2 ml,细胞贴壁后用5 μg/ml的LPS刺激细胞24 h,弃掉培养液后加入20、40、80、160 μmol/L的β-胡萝卜素继续培养3 h,或者5 μg/ml的LPS和1、5、10 μg/ml NF-κB抑制剂PDTC共同处理RAW264.7细胞24 h。①根据RNA Lyzol说明书提取细胞RNA,样品在-80℃保存,并取部分样品测RNA的质量,OD260/OD280在1.8~2.0之间,可用于下一步试验。然后按照cDNA逆转录试剂盒的步骤将RNA转录为cDNA。最后荧光定量PCR,采用20 μl的反应体系,Master Mix 10 μl、上下游引物各0.5 μl、cDNA模板2 μl、染料1 μl 、ddH2O 6 μl,按照95℃ 预变性 5 min,95℃ 变性10 s,60℃ 退火75 s,40个循环进行PCR反应,每次试验均设置18s作为内参。用2-ΔΔCt法计算炎性因子的相对表达量,引物序列表如表1所示[9]。②根据ELISA说明书,3 000 r/min、4℃离心20 min,用无菌管收集细胞上清,严格按照试剂盒步骤操作,绘制标准曲线,分别计算各组IL-1β、IL-6、TNF-α的含量(ng/L)。

表1 荧光定量PCR引物序列表
1.2.4Western blot法检测PDTC、β-胡萝卜素对LPS刺激RAW264.7细胞NF-κB p65蛋白表达的影响 取六孔细胞板中处理后的RAW264.7,预冷的PBS洗涤2次,加入含蛋白酶抑制剂的RIPA裂解液,在冰上裂解后用细胞刮轻轻刮下,12 000 r/min、4℃ 离心5 min,取上清液,BCA法测蛋白浓度。取30 μg总蛋白进行SDS-PAGE电泳,电转印至PVDF 膜上,用3% 的BSA封闭3 h,一抗为鼠源的NF-κB p65抗体(1∶1 000),兔源的β-actin抗体(1∶5 000),4℃孵育过夜。1×TBST洗膜后分别加入相应的二抗:HRP标记的山羊抗鼠IgG(1∶2 000)和HRP标记的山羊抗兔IgG(1∶3 000),37℃ 孵育1 h。1×TBST洗膜后,感光,ECL显色,用密度比值表示目的蛋白量。
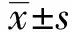
2 结果
2.1β-胡萝卜素对RAW264.7细胞活性的影响 如图1所示,β-胡萝卜素作用RAW264.7细胞3 h,可以提升细胞活性,且在浓度为20、40、80 μmol/L时,差异极显著(P<0.01);β-胡萝卜素作用RAW264.7细胞6 h,浓度为160 μmol/L时,极显著降低细胞活性(P<0.01);β-胡萝卜素作用RAW264.7细胞12 h,浓度为80、160 μmol/L时,极显著降低细胞活性(P<0.01),所以,选取不同浓度的β-胡萝卜素作用细胞3 h作为本试验的作用时间,在此浓度和时间范围内,β-胡萝卜素对细胞无明显毒性,可作为试验用安全浓度范围。
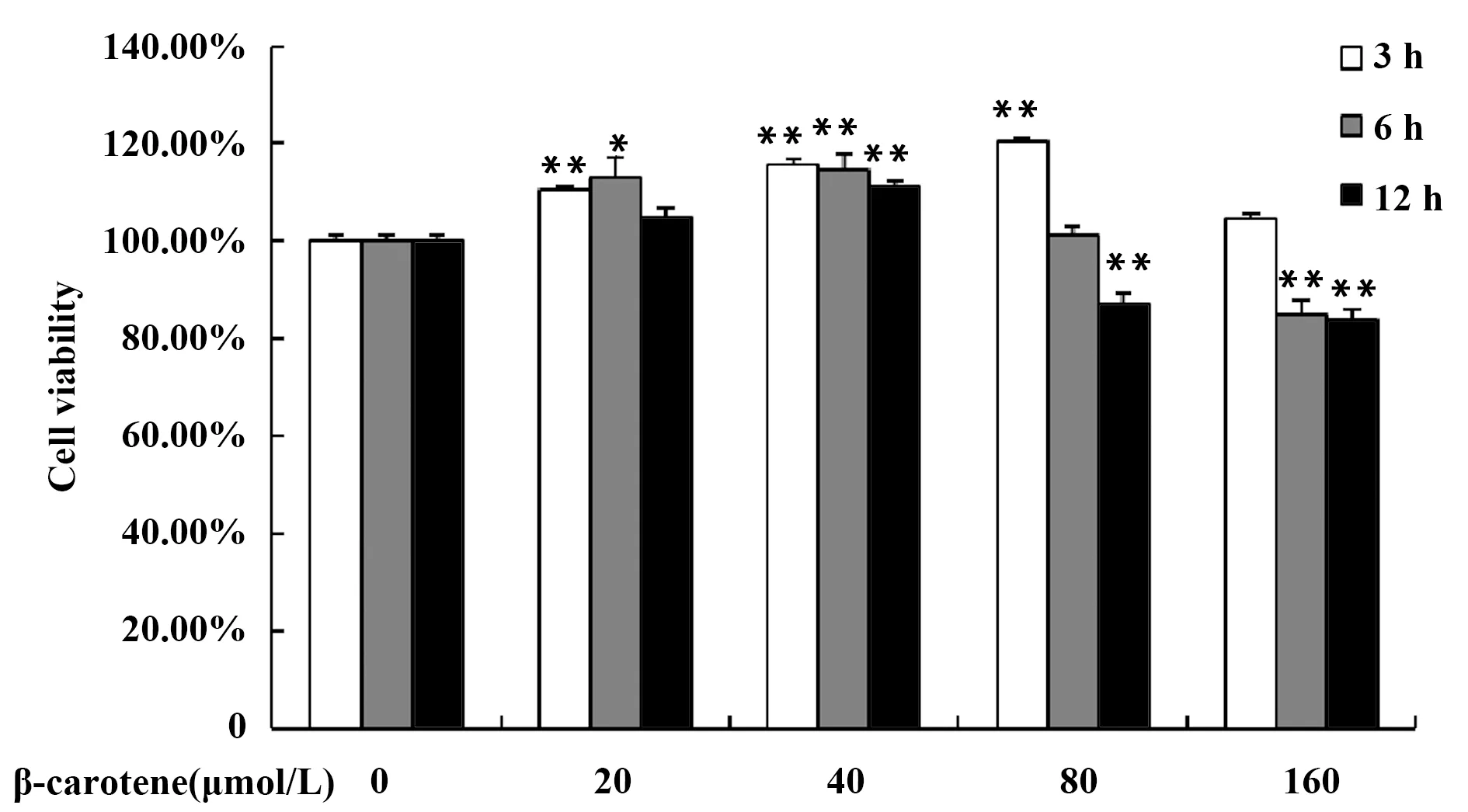
图1 不同浓度的β-胡萝卜素作用不同的时间对RAW 264.7细胞活性的影响Fig.1 Different concentration and different time of β-carotene on cell viability of RAW264.7 cellsNote:Compared with the control group(0 μmol/L),*.P<0.05,**.P<0.01.
LPS可以激活巨噬细胞,如图2所示,5 μg/ml的LPS刺激RAW264.7细胞24 h,细胞活性略有上升,继续用不同浓度的β-胡萝卜素处理细胞3 h,细胞活性随着β-胡萝卜素浓度的升高而升高,有剂量依赖效应。由图2可知,β-胡萝卜素对LPS刺激后的巨噬细胞有增殖作用,基于细胞活性方面,此细胞模型建模成功,对细胞没有毒性。
2.2β-胡萝卜素对LPS刺激RAW264.7细胞炎症因子IL-1β、IL-6、TNF-α的影响 LPS可激活巨噬细胞,诱导其分泌一系列的炎症因子,炎症因子的分泌是评价炎症严重程度的一个量化指标,如图3A所示,LPS诱导巨噬细胞炎症因子IL-1β、IL-6、TNF-α mRNA的表达,用不同浓度的β-胡萝卜素处理细胞后,炎症因子mRNA相对表达量降低,且差异极显著(P<0.01);如图3B所示,LPS刺激巨噬细胞炎症因子的分泌,不同浓度的β-胡萝卜素可降低其分泌量,提示β-胡萝卜素对炎症因子的表达和分泌有一定的抑制作用。
2.3β-胡萝卜素对LPS刺激RAW264.7细胞NF-κB p65蛋白表达的影响 NF-κB通路是炎症通路中重要的通路之一,如图4所示,用不同浓度的β-胡萝卜素处理LPS刺激后的巨噬细胞,NF-κB p65蛋白表达量随β-胡萝卜素浓度的升高而降低,说明,β-胡萝卜素在一定程度上可以抑制NF-κB p65蛋白的表达。但LPS组与对照组比,NF-κB p65蛋白表达基本没变化,可能是细胞处理24 h,在长期饥饿状态下,对照组中NF-κB通路已被激活。激活的NF-κB可结合到编码炎症因子基因启动子区域的特定序列,进而产生对应的炎症因子[1],所以,根据图3、4推测,β-胡萝卜素对炎症因子的抑制作用可能是通过抑制NF-κB p65蛋白的表达来实现的。
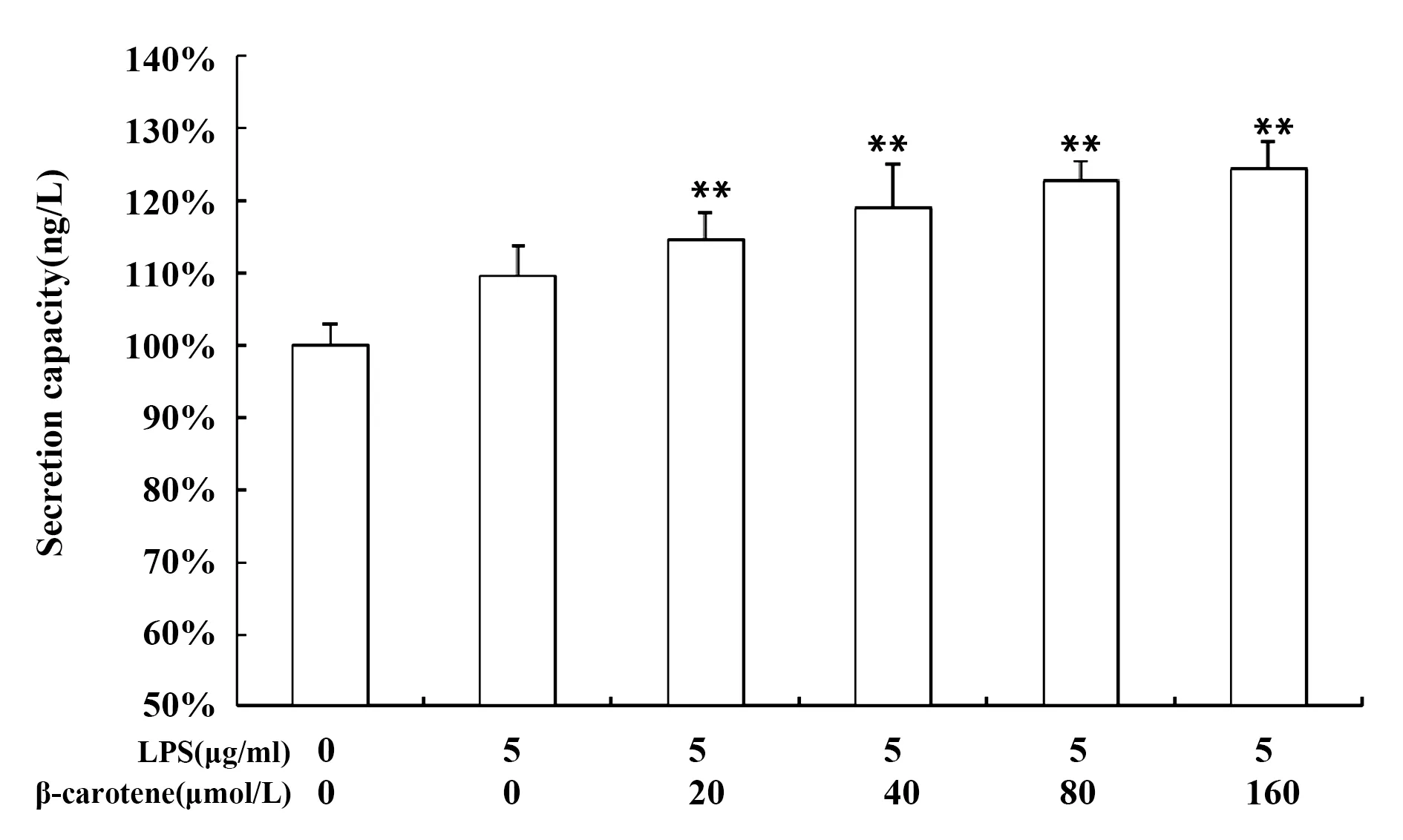
图2 不同浓度的β-胡萝卜素对LPS刺激的RAW264.7细胞活性的影响Fig.2 Different concentration of β-carotene on cell viability of LPS-induced RAW264.7 cellsNote:Compared with the LPS group,**.P<0.01.
2.4β-胡萝卜素对LPS刺激RAW264.7细胞炎症因子影响的分子机制 PDTC是常用的一种NF-κB抑制剂,能特异性的抑制NF-κB的活化,如图5所示,不同浓度的PDTC与LPS共同作用细胞24 h,与LPS组相比,可显著降低NF-κB p65蛋白的表达,验证了其抑制NF-κB活化的作用,且在浓度为10 μg/ml时,抑制效果最好。
PDTC可以抑制NF-κB p65的表达,如图6A、B所示,与LPS共同作用后,也可以抑制炎症因子IL-1β、IL-6、TNF-α mRNA相对表达和分泌,说明,通过抑制NF-κB p65的表达可以抑制炎症因子IL-1β、IL-6、TNF-α mRNA相对表达和分泌,因此,结合图3、4的结果,β-胡萝卜素可以通过抑制NF-κB p65蛋白的表达来抑制炎症因子IL-1β、IL-6、TNF-α的分泌,β-胡萝卜素对炎症因子的抑制作用与NF-κB通路有关。
图3 β-胡萝卜素对LPS刺激RAW264.7炎症因子的影响Fig.3 Different concentration of β-carotene on inflamma-tory factors of LPS-induced RAW264.7 cellsNote:A.The effects of β-carotene on the mRNA relative expression of inflammatory factors in LPS-induced RAW264.7 cells;B.The effects of β-carotene on the secretion capacity of inflammatory factors in LPS-induced RAW264.7 cells.Compared with the LPS group,*.P<0.05,**.P<0.01.
如图7A、B所示,80 μmol/L的β-胡萝卜素、10 μg/ml的PDTC以及两者共同作用,均可以抑制LPS引起的炎症因子IL-1β、IL-6、TNF-α mRNA的表达和分泌。对比LPS+PDTC组和LPS+PDTC+β-胡萝卜素组发现,后者对炎症因子IL-1β、IL-6、TNF-α的抑制作用更明显,而且,如图8所示,这两组的NF-κB p65蛋白表达差异不显著,这可能是β-胡萝卜素的抑制作用还与其他通路有关,LPS+PDTC组和LPS+β-胡萝卜素组的差异趋势也验证了这一点。
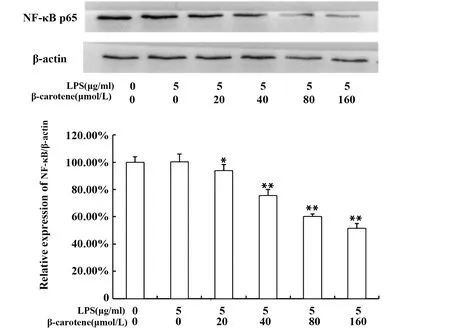
图4 β-胡萝卜素对LPS刺激RAW264.7细胞NF-κB p65蛋白表达的影响Fig.4 Different concentration of β-carotene on protein NF-κB p65 of LPS-induced RAW264.7 cellsNote: Compared with the LPS group,*.P<0.05,**.P<0.01.

图5 PDTC对LPS刺激RAW264.7细胞NF-κB p65蛋白表达的影响Fig.5 Effect of different concentration of PDTC on prot-ein NF-κB p65 of LPS-induced RAW264.7 cellsNote: Compared with the LPS group,*.P<0.05,**.P<0.01.

图6 PDTC对LPS刺激RAW264.7炎症因子的影响Fig.6 Different concentration of PDTC on inflammatory factors of LPS-induced RAW264.7 cellsNote: A.The effects of PDTC on the mRNA relative expression of inflammatory factors in LPS-induced RAW264.7 cells;B.The effects of PDTC on the secretion capacity of inflammatory factors in LPS-induced RAW264.7 cells.Compared with the LPS group,*.P<0.05,**.P<0.01.

图8 PDTC、β-胡萝卜素对LPS刺激RAW264.7NF-κB p65蛋白比较图Fig.8 Different concentration of PDTC and β-carotene on protein NF-κB p65 of LPS-induced RAW264.7 cellsNote: Compared with LPS group,*.P<0.05,**.P<0.01.
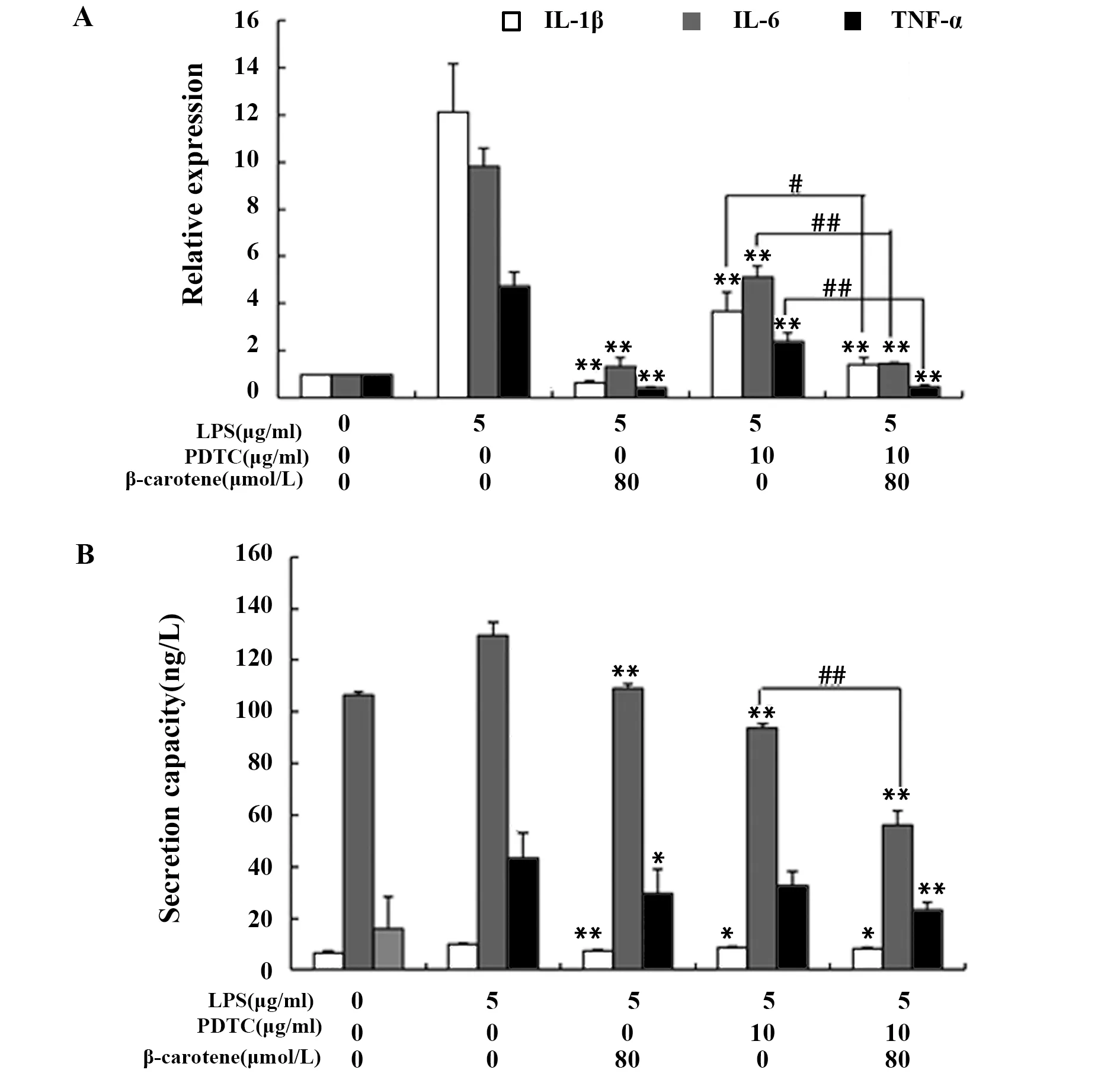
图7 PDTC、β-胡萝卜素对LPS刺激RAW264.7炎症因子的影响Fig.7 Different concentration of PDTC and β-carotene on inflammatory factors of LPS-induced RAW2 64.7 cellsNote:A.The effects of PDTC and β-carotene on the mRNA relative expression of inflammatory factors in LPS-induced RAW264.7 cells;B.The effects of PDTC and β-carotene on the secretion capacity of inflammatory factors in LPS-induced RAW264.7 cells.Compared with the LPS group,*.P<0.05,**.P<0.01,compared with the LPS+PDTC group,#.P<0.05,##.P<0.01.
3 讨论
炎症是机体保护自身并消除有害刺激的过程,一般是有利的,分为急性炎症和慢性炎症,炎症因子的持续刺激是导致慢性炎症的主要原因,如高浓度的炎症因子会诱导免疫细胞攻击自身组织,严重的与糖尿病、风湿性关节炎、哮喘等疾病的产生密切相关,所以炎症也是抗损伤和损伤的统一过程[10]。巨噬细胞在病原微生物引起的炎症中发挥重要作用,LPS即可活化巨噬细胞并诱导其分泌多种促炎因子[11],最终会导致严重的组织损伤以及系统并发症[12]。
炎症因子的分泌是检测炎症严重程度的量化指标,本试验以IL-1β、IL-6、TNF-α这三种炎症因子作为检测指标。TNF-α、IL-1β是炎症介质级联反应的始发因子[13],其中TNF-α是调节免疫细胞中重要的促炎细胞因子,通过产生IL-1β、IL-6诱导机体发热、细胞凋亡等,进而诱导炎症的发生,TNF-α含量的异常与多种疾病的发生密切相关。IL-6是调节免疫、炎症反应等生理过程的多功能细胞因子,其表达受LPS和IL-1β的正向调节[14]。本试验中,5 μg/ml的LPS刺激巨噬细胞后,IL-1β、IL-6、TNF-α的mRNA相对表达量明显升高,即细胞已经处于炎症的一个严重程度,当用不同浓度的β-胡萝卜素处理后,这些炎症因子开始降低,说明β-胡萝卜素可以减轻LPS刺激的巨噬细胞引起的炎症反应。
NF-κB通路在炎症反应中发挥重要作用,正常状态下,NF-κB以同二聚体或异二聚体存在胞质中,其p65亚基和抑制蛋白IκB结合,在受到外界刺激如LPS时,其抑制蛋白IκB发生磷酸化并降解,诱导p65亚基转位至细胞核,与靶基因启动子上的结合原件结合,诱导炎症相关基因的转录[15,16]。本试验中,LPS刺激的巨噬细胞用不同浓度的β-胡萝卜素处理后,NF-κB p65蛋白的表达剂量依赖性降低,这可能是β-胡萝卜素抑制炎症因子的原因。
NF-κB抑制剂PDTC主要抑制NF-κB的活化,在本试验中,不同浓度的PDTC可以抑制炎症因子IL-1β、IL-6、TNF-α的mRNA相对表达和分泌,已有研究证实,IL-1β、IL-6、TNF-α基因的启动子均存在NF-κB的结合位点,其表达受NF-κB活性的调控[17,18]。说明通过抑制NF-κB p65的表达的确可以抑制炎症因子的分泌,间接说明,β-胡萝卜素可以通过抑制NF-κB p65的表达从而抑制LPS刺激的巨噬细胞炎症因子的分泌。
机体中炎症信号通路受到多种复杂机制的调节,NF-κB通路只是重要的经典通路之一,大量的研究发现,LPS刺激的巨噬细胞可以激活MAPKs家族,巨噬细胞通过不同的MAPKs途径调节炎症反应[19]。本试验中,LPS刺激的巨噬细胞,在PDTC、β-胡萝卜素共同作用组和PDTC组,这两组的NF-κB p65蛋白的表达基本无差异的情况下,共同作用组炎症因子的表达和分泌较PDTC组显著降低,说明,β-胡萝卜素可能也通过其他的通路来抑制炎症因子的分泌。
综上所述,β-胡萝卜素可以抑制LPS刺激的巨噬细胞RAW264.7炎症因子的分泌,此抑制作用是通过抑制NF-κB p65蛋白的表达来实现的,与NF-κB通路有关,且此通路不是β-胡萝卜素抑制炎症因子的唯一通路。
[1] Ferrero-Miliani L,Nielsen OH,Andersen PS,etal.Chronic inflammation:importance of NOD2 and NALP3 in interleukin-1beta generation[J].Clin Exp Immunol,2007,147(2):227-235.
[2] Hwang SJ,Kim YW,Park Y,etal.Anti-inflammatory effects of chlorogenic acid in lipopolysaccharide-stimulated RAW 264.7 cells[J].Inflamm Res,2014,63(1):81-90.
[3] Ahn CB,Cho YS,Je JY.Purification and anti-inflammatory action of tripeptide from salmon pectoral fin by product protein hydrolysate[J].Food Chem,2015,168(1):151-156.
[4] Islam MN,Ishita IJ,Jin SE,etal.Anti-inflammatory activity of edible brown alga Saccharina japonica and its constituents pheophorbide a and pheophytin a in LPS-stimulated RAW 264.7 macrophage cells[J].Food Chem Toxicol,2013,55:541-548.
[5] 刘冬松,邵剑钢,韩培涛,等.β-胡萝卜素在高原功能食品中的应用[J].食品研究与开发,2015,36(13):147-149.
[6] Lin FM,Chen LR,Lin EH,etal.Compounds from wedelia chinensis synergisti-cally suppress androgen activity and growth in prostate cancer cells [J].Carcinogenesis,2007,28(12):2521-2529.
[7] Cotran RS,Kumar V,Collins T,etal.Robbins pathologic basis of disease[M].Philadelphia:WB Saunders Company,1998:1583-1584.
[8] Qin X,Qiu C,Zhao L.Lysophosphatidylcholine perpetuates macrophage polarization toward classically activated phenotype in inflammation[J].Cell Immunol,2014,289(1-2):185-190.
[9] Liu H,Beier JI,Arteel GE,etal.Transient receptor potential vanilloid 1 gene deficiency meliorates hepatic injury in a mouse model of chronic binge alcohol-induced alcoholic liver disease[J].Am J Pathol,2015,185(1):43-54.
[10] Martin P,Leibovich SJ.Inflammatory cells during wound repair:the good,the bad and the ugly[J].Trends Cell Biol,2005,15(11):599-607.
[11] Roger T,Delaloye J,Chanson AL,etal.Macrophage migration inhibitory factor deficiency is associated with impaired killing of gram-negative bacteria by macrophages and increased susceptibility to Klebsiella pneumonias sepsis[J].J Infect Dis,2013,207(2):331-339.
[12] Rosenblat JD,Cha DS,Mansur RB,etal.Inflamed moods:a review of the interactions between inflammation and disorders[J].Prog Neuropsychopharmacol Biol Psychiatry,2014,53:23-24.
[13] Malinin NL,Boldin MP,Kovalenko AV,etal.MAP3K-related kinase involved in NF-kappaB induction by TNF,CD95 and IL-1[J].Nature,1997,385(6616):540-544.
[14] 宋佳佳,白涵瑜,成 雪,等.血红素氧合酶-1介导海参蛋白肽对脂多糖诱导RAW264.7巨噬细胞炎症反应的抑制作用[J].现代食品科技,2016,32(4):1-7.
[15] Wan F,Lenardo MJ.The nuclear signaling of NF-kappaB:current knowledge, new insights,and future perspectives[J].Cell Res,2010,20(1):24-33.
[16] 吴 广,符 平,周玉生,等.芹菜素抑制脂多糖诱导小鼠巨噬细胞分泌炎症介质的分子机制[J].中国免疫学杂志,2015,31(6):753-757.
[17] 刘远锦,田媛媛,刘 博,等.γ-谷维素对脂多糖诱导巨噬细胞RAW264.7炎症因子表达的影响[J].食品科学,2015,36(19):238-243.
[18] Baud V,Derudder E.Control of NF-κB activity by proteolysis[J].Curr Top Microbiol Immunol,2011,349:97-114.
[19] Keshet Y,Seger R.The MAP kinase signaling cascades:a system of hundreds of components regulates a diverse array of physiological functions[J].Methods Mol Biol,2010,661(9):33-38.
[收稿2016-05-27 修回2016-07-20]
(编辑 许四平)
Effectsandmechanismofβ-caroteneoninflammatoryfactorsinLPS-inducedRAW264.7cells
ZHANGXiao-Yin,ZHANGShan-Shan,WUMin,JIYu-Bin,HUANGYu-Sheng,ZHENGXin.CollegeofAnimalScienceandTechnology,JilinAgriculturalUniversity,Changchun130118,China
Objective:To investigate the effects and mechanism of β-carotene on inflammatory factors(IL-1β,IL-6,TNF-α) in LPS-induced RAW264.7 cells.Methods:Firstly,RAW264.7 cells of being induced by 4(5 μg/ml)for 24 h were treated with different concentration of β-carotene(20,40,80,160 μmol/L)for 3 h.The cells viability was measured by MTT,the mRNA relative expression of IL-1β,IL-6,TNF-α was detected by fluorescence quantitative PCR,the secretion capacity of IL-1β,IL-6,TNF-α was detected by ELISA and the protein relative expression of NF-κB p65 protein was measured by Western blot.Secondly,RAW264.7 cells were induced by LPS(5 μg/ml) and different concentration of PDTC(1,5,10 μg/ml)for 24 h,NF-κB p65 protein was measured by Western blot and inflammatory factors were detected by fluorescence quantitative PCR and ELISA.Finally,compared the changes in the relative expression of inflammatory factors and NF-κB p65 protein between LPS+PDTC group and LPS+PDTC+β-carotene group.Results:Compared with the LPS-induced group,β-carotene could increase the cell viability of LPS-induced RAW264.7 cells and inhibied the relative expression of inflammatory factors and NF-κB p65 protein.Inhibited the relative expression of NF-κB p65 protein could reduce the relative expression of inflammatory factors.Compared with the LPS+PDTC group,LPS+PDTC+β-carotene group could inhibit the relative expression of inflammatory factors significantly(P<0.05).But,there was little difference about the relative expression of NF-κB p65 protein between this two groups.Conclusion:β-carotene inhibits the relative expression of inflammatory factors(IL-1β,IL-6,TNF-α) in LPS-induced RAW264.7 cells through inhibition of NF-κB p65 protein in NF-κB pathway,this pathway isn′t unique.
β-carotene;RAW264.7 cell;Inflammatory factor;NF-κB p65 protein
10.3969/j.issn.1000-484X.2017.06.007
①本文为吉林省科技厅科技成果转化促进计划(20150307021NY)。
张晓音(1991年-),女,在读硕士,主要从事细胞免疫与动物育种方面的研究,E-mail:951770634@qq.com。
及指导教师:郑 鑫(1965年-),女,博士,教授,主要从事细胞免疫与动物营养方面的研究,E-mail: zhengxinjilin@126.com。
S828
A
1000-484X(2017)06-0838-06

