Smad1在胃腺癌组织中的表达及对胃腺癌细胞迁移能力的影响研究①
王 欣 李宜炯 庞 超 张瑞华 杨艳红 朱振龙 王政民
(河北医科大学第一医院病理科,石家庄050031)
Smad1在胃腺癌组织中的表达及对胃腺癌细胞迁移能力的影响研究①
王 欣 李宜炯②庞 超 张瑞华 杨艳红 朱振龙 王政民
(河北医科大学第一医院病理科,石家庄050031)
目的:研究Smad1在胃腺癌组织中的表达及对胃腺癌细胞迁移能力的影响。方法:提取收集的胃腺癌组织及对应的癌旁组织中的蛋白,Western blot检测Smad1的表达水平。以胃腺癌细胞HGC-27为研究对象,细胞转染过表达Smad1的载体(p-EGFP-C1/Smad1)和Smad1小干扰RNA(Smad1 siRNA),同时转染p-EGFP-C1和 siRNA control为对照。细胞划痕实验检测细胞迁移能力。Western blot检测细胞中MMP-9、MMP-2、p-Akt、Akt的表达水平。Akt信号通路抑制剂LY294002(20 μg/ml)作用于胃腺癌细胞HGC-27,MTT检测细胞增殖情况,细胞划痕实验检测细胞迁移能力。Western blot检测MMP-9、MMP-2、p-Akt、Akt蛋白表达水平。结果:胃腺癌组织中Smad1的水平明显低于癌旁组织(P<0.01)。p-EGFP-C1/Smad1组细胞存活率和迁移率均明显低于p-EGFP-C1组(P<0.01)。Smad1 siRNA组细胞存活率和迁移率均明显高于siRNA control组(P<0.01)。 p-EGFP-C1、p-EGFP-C1/Smad1、siRNA control、Smad1 siRNA组细胞中Akt蛋白表达水平没有变化。p-EGFP-C1/Smad1组细胞MMP-9、MMP-2、p-Akt蛋白表达水平明显低于p-EGFP-C1组(P<0.01)。Smad1 siRNA组细胞MMP-9、MMP-2、p-Akt蛋白表达水平明显高于siRNA control(P<0.01)。胃腺癌细胞与Akt信号通路抑制剂作用后细胞增殖和迁移趋势与p-EGFP-C1/Smad1组一致。结论:Smad1在胃腺癌组织中低表达。Smad1能够抑制胃腺癌细胞增殖和迁移,作用机制与Akt信号通路有关。
胃腺癌;Akt信号通路;增殖;迁移
据统计,在世界范围内每年有超过100万的新增胃癌患者,有超过80万患者死于胃癌,其中中国的新增胃癌患者和死亡人数占三分之一[1]。在中国,胃癌的发病率和致死率在全部恶性肿瘤中位居第3位,男性的发病率高于女性,农村高于城市[2]。胃癌中有95%属于胃腺癌。胃腺癌严重威胁着人类的生命健康。
Smad是一种重要的信号转导因子[3]。Smad1是Smad受体活化类型,参与调节细胞的生长、分化、凋亡等过程,在机体免疫系统中也有重要作用[4,5]。近年来的研究表明,Smad1在结直肠癌、舌鳞癌、子宫内膜癌等多种癌症中表达下调[6,7]。本研究中运用Western blot检测胃腺癌组织中Smad1的水平,并探讨Smad1对胃腺癌细胞增殖和迁移能力的影响,以期为进一步研究胃腺癌的发病机制奠定理论基础。
1 材料与方法
1.1材料
1.1.1组织及细胞 选取2011年10月~2013年2月在我院确诊切除的胃腺癌患者胃腺癌组织及距离肿块5 cm以上的癌旁组织各56例,平均年龄(62.14±10.47)岁,其中女性20例,男性36例。人胃腺癌细胞HGC-27由河北医科大学病理教研室提供。
1.1.2主要仪器及试剂 p-EGFP-C1/Smad1、 p-EGFP-C1由本实验室保存;DMEM培养基、青链霉素、胰蛋白酶均购自于美国Sigma;胎牛血清(FBS)购自杭州四季青生物科技有限公司;MMP-9、MMP-2、p-Akt、Akt、Smad1、β-actin单克隆抗体均购自上海酶联生物研究所;CO2培养箱购自美国Thermo。
1.2方法
1.2.1Western blot检测胃癌组织中的Smad1水平 收集56例胃腺癌组织和癌旁组织,剪碎后,加入到组织匀浆器中,加入组织裂解液,放在冰上裂解30 min后,14 000 r/min离心20 min,吸取蛋白上清液到EP管中。取蛋白样品,加入Loading buffer混合后,放在100℃的孵育器中煮沸3 min。将变性蛋白样品加入到上样孔中,电泳初始电压为80 V,观察溴酚蓝进入分离胶后,将电压调整为120 V至电泳结束。取出蛋白凝胶,洗涤后,放在转印缓冲液中浸泡10 min。取出PVDF膜,100 mA恒流将蛋白转印至PVDF膜上,5%脱脂奶粉封闭液封闭后,加入一抗(500倍稀释)、二抗(1 000倍稀释)依次反应后,滴加显色液,显影定影后,以β-actin为内参,分析目的蛋白表达率。
1.2.2细胞培养 取出保存在-80℃的胃腺癌细胞HGC-27,37℃完全融化后,1 000 r/min离心10 min,弃掉上清液,在细胞中加入含有10%胎牛血清的DMEM细胞培养液,充分混合,接种到细胞培养瓶中,放在37℃,5%CO2培养箱中培养48 h。倒置显微镜下观察细胞密度超过85%时,弃掉细胞培养液,加入0.25%的胰蛋白酶消化液消化细胞,离心后,用细胞培养液悬浮细胞,根据实验要求接种到细胞培养瓶中培养。
1.2.3细胞转染 取培养至对数生长期的胃腺癌细胞,加入胰蛋白酶消化后,接种到6孔细胞培养板中培养过夜,观察细胞融合度达到75%时,更换细胞培养液为不含有胎牛血清的不完全培养液,放在37℃孵育1 h。用Lipofectamine 2000将过表达Smad1的载体(p-EGFP-C1/Smad1)和Smad1小干扰RNA(Smad1 siRNA)转染至胃腺癌细胞中,同时转染p-EGFP-C1和 siRNA control为对照。放在37℃培养48 h后,Trizol法提取细胞中的总蛋白,Western blot检测细胞中Smad1水平。
1.2.4MTT检测细胞增殖 转染后的胃腺癌细胞,经胰蛋白酶消化后,1 000 r/min离心10 min,弃掉上清液,用细胞培养液悬浮后,接种到96孔细胞培养板中,每孔中加入细胞个数为2×104个,放在CO2培养箱中培养48 h后。在细胞中加入浓度为5 mg/ml 的MTT溶液,放在CO2培养箱中孵育反应4 h。同时设置空白组,空白组中不加细胞。为了提高实验的准确性,每组设置8个复孔。吸除上清液,加入DMSO溶液150 μl,放置于避光条件下反应10 min,观察结晶物完全溶解后,酶标仪检测每孔的吸光度。计算细胞存活率。细胞存活率=(实验组OD值-空白组OD值)-(对照组OD值-空白组OD值)。
1.2.5细胞划痕实验检测细胞迁移 取转染后的胃腺癌细胞,接种到细胞培养瓶中,放在37℃,5% CO2培养箱中培养过夜,观察细胞完全贴壁后,弃上清液,用移液枪枪头垂直的在长满细胞的培养瓶壁上划出一条细痕,加入PBS洗涤两次将划出的细胞洗掉。放在37℃,5%CO2培养箱中培养48 h。倒置显微镜下观察细胞划痕宽度,计算细胞迁移率。细胞迁移率=细胞迁移距离/细胞划痕宽度。
1.2.6Western blot检测细胞中MMP-9、MMP-2、p-Akt、Akt水平 转染后的胃腺癌细胞培养48 h后,收集细胞,Trizol法提取细胞蛋白,Western blot检测细胞中MMP-9、MMP-2、p-Akt、Akt水平。步骤同1.2.1。
1.2.7阻断Akt信号通路对胃腺癌细胞增殖迁移影响 培养至对数生长期的胃腺癌细胞,与20 μg/ml的Akt信号通路抑制剂LY294002作用48 h后记为抑制剂组,同时设置对照组,对照组不加入抑制剂LY294002。MTT检测细胞增殖情况,细胞划痕实验检测细胞迁移能力。Western blot检测MMP-9、MMP-2、p-Akt、Akt水平。同1.2.1、1.2.4、1.2.5。
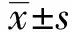
2 结果
2.1胃腺癌组织中Smad1蛋白表达水平结果 Western blot检测了56例胃腺癌组织和癌旁组织中Smad1蛋白水平。结果发现,胃癌组织中Smad1蛋白相对表达水平约为(0.18±0.05),而癌旁组织中Smad1蛋白相对表达水平约为(0.46±0.06)。Smad1蛋白在胃腺癌组织中的表达水平明显低于癌旁组织,差异有显著统计学意义(P<0.01 ),见图1。
2.2转染后细胞中Smad1蛋白表达水平结果 胃腺癌细胞转染p-EGFP-C1、p-EGFP-C1/Smad1、 siRNA control、Smad1 siRNA后,培养48 h,Western blot检测细胞中Smad1蛋白表达水平。结果显示,p-EGFP-C1/Smad1组细胞中Smad1的水平明显高于p-EGFP-C1,差异有显著统计学意义(P<0.01)。Smad1 siRNA组细胞中Smad1的水平明显低于siRNA control,差异有显著统计学意义(P<0.01),见图2、表1。

图1 Western blot检测胃腺癌组织中Smad1蛋白表达结果Fig.1 Expression of Smad1 in gastric adenocarcinoma tissues by Western blot

图2 Western blot检测转染后细胞中Smad1蛋白水平结果图Fig.2 Expression of Samd1 in gastric adenocarcinoma cells transfected by Western blotNote:1 .p-EGFP-C1;2.p-EGFP-C1/Smad1;3.siRNA control;4.Smad1 siRNA.
2.3Smad1对胃腺癌细胞增殖迁移影响结果 转染p-EGFP-C1、p-EGFP-C1/Smad1、siRNA control、Smad1 siRNA后,MTT检测48 h的细胞存活情况,细胞划痕实验检测细胞迁移能力。结果显示,p-EGFP-C1/Smad1组细胞存活率和迁移率明显低于p-EGFP-C1组,差异有显著统计学意义(P<0.01),Smad1 siRNA组细胞存活率和迁移率明显高于siRNA control,差异有显著统计学意义(P<0.01),见表1。
2.4Smad1对胃腺癌细胞MMP-9、MMP-2、p-Akt、Akt表达影响 转染p-EGFP-C1、p-EGFP-C1/Smad1、siRNA control、Smad1 siRNA后,Western blot检测48 h细胞中MMP-9、MMP-2、p-Akt、Akt蛋白水平。结果显示,p-EGFP-C1、p-EGFP-C1/Smad1、siRNA con-trol、Smad1 siRNA组细胞中Akt蛋白表达水平没有变化。p-EGFP-C1/Smad1组细胞MMP-9、MMP-2、p-Akt蛋白表达水平明显低于p-EGFP-C1组,差异显著(P<0.01)。Smad1 siRNA组细胞MMP-9、MMP-2、p-Akt蛋白表达水平明显高于siRNA control,差异显著(P<0.01)。见图3、表2。
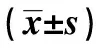
表1 转染后细胞中Smad1蛋白表达率、细胞存活率和细胞迁移率
Note:1)P<0.01 vs p-EGFP-C1;2)P<0.01 vs siRNA control.

图3 Western blot检测转染后细胞中MMP-9、MMP-2、p-Akt、Akt表达结果Fig.3 Expression of MMP-9,MMP-2,p-Akt and Akt in gastric adenocarcinoma cells transfected by Western blotNote:1.p-EGFP-C1;2.p-EGFP-C1/Smad1;3.siRNA control;4.Smad1 siRNA.
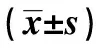
表2 转染后细胞中MMP-9、MMP-2、p-Akt、Akt蛋白表达率
Note:1)P<0.01 vs p-EGFP-C1;2)P<0.01 vs siRNA control.
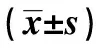
表4 阻断Akt信号通路后细胞中MMP-9、MMP-2、p-Akt、Akt蛋白表达率
Note:1)P<0.01 vs matched group.
2.5阻断Akt信号通路对胃腺癌细胞增殖迁移影响结果 胃腺癌细胞与20 μg/ml的Akt信号通路抑制剂LY294002作用48 h后,MTT检测细胞存活率,细胞划痕实验检测细胞迁移率,Western blot检测细胞中MMP-9、MMP-2、p-Akt、Akt表达水平。结果显示,抑制剂组细胞存活率和迁移率明显低于对照组,差异有显著统计学意义(P<0.01)。抑制剂组细胞中MMP-9、MMP-2、p-Akt水平明显低于对照组,差异显著(P<0.01)。见图4、表3、4。
3 讨论
Smads蛋白家族含有9个成员,其分子量大约为42~60 kD。Smad由高度保守的氨基酸、羧基端及含有脯氨酸的中间连接区组成[8]。Smad1由465个氨基酸组成,参与转化生长因子-β信号通路的转导,对组织胚胎发育、机体免疫系统、组织修复及细胞生长等都具有重要作用[9,10]。 Smad1在糖尿病、癌症等疾病的发生发展过程中也具有调控功能[11]。有研究表明,Smad1在肺癌、结直肠癌、垂体腺瘤等肿瘤中表达异常[12]。过表达Smad1后的小鼠垂体瘤细胞增殖能力明显减弱,细胞周期阻滞在S期[13]。3,4-二氯异香豆素能够通过上调BGC-823细胞中的Smad1水平发挥抗肿瘤的作用[14]。
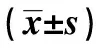
表3 阻断Akt信号通路后细胞存活率
Note:1)P<0.01 vs matched group.

图4 Western blot检测阻断Akt信号通路后细胞中MMP-9、MMP-2、p-Akt、Akt表达结果Fig.4 Expression of MMP-9,MMP-2,p-Akt and Akt in gastric adenocarcinoma cells after Akt signaling pathway blocked by Western blotNote:1.Matched group;2.Control group.
丝氨酸/苏氨酸蛋白激酶(Akt)信号通路广泛存在于生命机体中,在细胞生长、增殖等过程中发挥重要作用[15]。有研究表明,Akt信号通路在乳腺癌、肝癌、结直肠癌等多种癌症中异常活化,而磷酸化的Akt(p-Akt)具有促进癌细胞增殖的作用[16,17]。用不同浓度的Akt信号通路抑制剂LY294002处理舌鳞癌细胞后,舌鳞癌细胞增殖和迁移受到抑制[18]。基质金属蛋白酶能够降解细胞外基质,在肿瘤的转移过程中发挥重要作用。MMP-2和MMP-9是基质金属蛋白酶的重要成员,在癌症组织中过度表达[19]。
本研究中,用Western blot法检测了胃腺癌组织中Smad1的水平。结果发现,Smad1在胃腺癌组织中表达下调。进一步通过体外实验研究Smad1对胃腺癌细胞增殖迁移的影响。通过细胞转染分别过表达和抑制了胃腺癌细胞中Smad1的水平,结果发现,过表达Smad1的细胞存活率和细胞迁移能力均明显降低。这提示,Smad1在胃腺癌细胞生长过程中发挥抑癌基因的作用。过表达Smad1的胃腺癌细胞中MMP-2、MMP-9的表达也明显减弱,这说明Smad1可能是通过调控MMP-2和MMP-9影响胃腺癌细胞迁移能力的。结果还发现,过表达Smad1的细胞中p-Akt水平降低。本研究进一步用Akt信号通路抑制剂作用于胃腺癌细胞,细胞存活率和迁移率降低。这提示,Smad1能够抑制Akt信号通路的激活影响胃腺癌细胞的增殖和迁移。
综上所述,Smad1在胃腺癌组织中表达下调。Smad1能够抑制胃腺癌细胞的增殖和迁移发挥抑癌基因的作用,作用机制与Akt信号通路有关。本研究结果为进一步研究Smad1在胃腺癌发病机制中作用奠定了基础,为治疗胃腺癌提供了新方向。
[1] Van Cutsem E,Bang YJ,Feng-yi F,etal.HER2 screening data from ToGA:targeting HER2 in gastric and gastroesophageal junction cancer[J].Gastric Cancer,2015,18(3):476-484.
[2] Altini M,Carretta E,Morgagni P,etal.Is a clear benefit in survival enough to modify patient access to the surgery service? A retrospective analysis in a cohort of gastric cancer patients[J].Gastric Cancer,2015,18(1):159-166.
[3] Pak KH,Cheong JH,Park KC.TGF-β1 signaling mediated lymphangiogenesis in gastric cancer[J].Cancer Res,2016,76(14 Supplement):3373-3373.
[4] Mok MTS,Yang W,Cheng ASL.Rectifying the epigenetic field defect in gastric carcinogenesis[J].J Cancer Sci,2015,2(2):2-2.
[5] Xu J,Acharya S,Sahin O,etal.14-3-3ζ turns TGF-β′s function from tumor suppressor to metastasis promoter in breast cancer by contextual changes of Smad partners from p53 to Gli2[J].Cancer Cell,2015,27(2):177-192.
[6] Riemenschneider MJ,Hirblinger M,Vollmann-Zwerenz A,etal.TGF-β isoforms in cancer:Immunohistochemical expression and Smad-pathway-activity-analysis in thirteen major tumor types with a critical appraisal of antibody specificity and immunohistochemistry assay validity[J].Oncotarget,2015,6(29):26770-26781.
[7] Xiao F,Qiu H,Cui H,etal.MicroRNA-885-3p inhibits the growth of HT-29 colon cancer cell xenografts by disrupting angiogenesis via targeting BMPR1A and blocking BMP/Smad/Id1 signaling[J].Oncogene,2015,34(15):1968-1978.
[8] Narimatsu M,Samavarchi-Tehrani P,Varelas X,etal.Distinct polarity cues direct Taz/Yap and TGF-β receptor localization to differentially control TGFβ-induced Smad signaling[J].Dev Cell,2015,32(5):652-656.
[9] Hussein K,Ibrahim A,Paul BY,etal.Inhibition of BMP/SMAD pathway attenuates high glucose-induced retinal endothelial cell hyperpermeability[J].IOVS,2015,56(7):1533-1533.
[10] Stone JD,Holt AW,Vuncannon JR,etal.AMP-activated protein kinase inhibits transfor ming growth factor-β-mediated vascular smooth muscle cell growth:implications for a Smad-3-dependent mechanism[J].Am J Physiol Heart Circ Physiol,2015,309(8):H1251-H1259.
[11] Huang T,Ditzel EJ,Perrera AB,etal.Arsenite disrupts zinc-dependent TGF-β2-SMAD activity during murine cardiac progenitor cell differentiation[J].Toxicol Sci,2015,148(2):409-420.
[12] Whyte J,Glover JD,Woodcock M,etal.FGF,insulin,and SMAD signaling cooperate for avian primordial germ cell self-renewal[J].Stem Cell Reports,2015,5(6):1171-1182.
[13] Bui AT,Laurent F,Havard M,etal.SMAD signaling and redox imbalance cooperate to induce prostate cancer cell dormancy[J].Cell Cycle,2015,14(8):1218-1231.
[14] Xu M,Cai J,Wei H,etal.Scoparone protects against pancreatic fibrosis via TGF-β/Smad signaling in rats[J].Cell Physiol Biochem,2016,40(1-2):277-286.
[15] 杨大运,邢亚威,张月花,等.老年非小细胞肺癌中 Raf 激酶抑制蛋白与 p-AKT 的表达及意义[J].中国老年学杂志,2016,36(3):644-645.
[16] Ma S,Li Q,Pan F.CXCR4 promotes GSK3β expression in pancreatic cancer cells via the Akt pathway[J].Int J Clin Oncol,2015,20(3):525-530.
[17] Crompton JG,Sukumar M,Roychoudhuri R,etal.Akt inhibition enhances expansion of potent tumor-specific lymphocytes with memory cell characteristics[J].Cancer Res,2015,75(2):296-305.
[18] Zhou Y,Zhu LB,Peng AF,etal.LY294002 inhibits the malignant phenotype of osteosarcoma cells by modulating the phosphatidylinositol 3 kinase/Akt/fatty acid synthase signaling pathway in vitro[J].Mol Med Rep,2015,11(2):1352-1357.
[19] 陈 翔,吴曙辉,陆宝华,等.MMP-2,MMP-9 在老年结直肠癌中的表达及与其临床病理特征的关系[J].实用癌症杂志,2015,30(12):1779-1781.
[收稿2016-10-19 修回2016-11-29]
(编辑 许四平)
StudyonexpressionofSmad1ingastricadenocarcinomaanditseffectonmigrationabilityofgastriccancercells
WANGXin,LIYi-Jiong,PANGChao,ZHANGRui-Hua,YANGYan-Hong,ZHUZhen-Long,WANGZheng-Min.DepartmentofPathology,theFirstHospitalofHebeiMedicalUniversity,Shijiazhuang050031,China
Objective:To investigate the expression of Smad1 in gastric carcinoma and the influence on the migration ability of gastric cancer cells.Methods:Collected the protein from the gastric cancer tissues and corresponding adjacent tissues,the expression level of Smad1 was detected by Western blot.In HGC-27 gastric cancer cells as the research object,the carrier cells transfected with overexpression of Smad1 (p-EGFP-C1/Smad1) and Smad1 small interfering RNA (Smad1 siRNA),while transfection of p-EGFP-C1 and siRNA control as control.MTT to detect cell proliferation.Cell migration ability was detected with cell scratch test.The expression levels of MMP-9,MMP-2,p-Akt and Akt in cells were detected by Western blot.Akt signal pathway inhibitor LY294002 (20 μg/ml) in gastric adenocarcinoma cells,MTT for cell proliferation,cell scratch assay for cell migration.The expression levels of MMP-9,MMP-2,p-Akt,Akt were detected by Western blot.Results:Smad1 in gastric carcinoma was significantly lower than the adjacent tissues (P<0.01).The cell survival rate and migration rate of p-EGFP-C1/Smad1 group were significantly lower than that of p-EGFP-C1 group (P<0.01).The cell survival rate and migration rate of Smad1 siRNA group were significantly higher than those in the siRNA control group (P<0.01).The expression levels of Akt protein in P-EGFP-C1,p-EGFP-C1/Smad1,Smad1 siRNA,siRNA control cells did not change.The expression levels of MMP-9,MMP-2 and p-Akt in p-EGFP-C1/Smad1 group were significantly lower than that in p-EGFP-C1 group (P<0.01).The expression levels of MMP-9,MMP-2 and p-Akt in Smad1 siRNA group were significantly higher than that in control siRNA (P<0.01).The cell proliferation and migration trends in gastric cancer cells effected by Akt signaling pathway inhibitor consistent with the p-EGFP-C1/Smad1 group.Conclusion:Low expression of Smad1 in gastric cancer tissue.Smad1 can inhibit the proliferation and migration of gastric cancer cells,the mechanism of action is related to the Akt signaling pathway.
Gastric adenocarcinoma;Akt signal pathway;Proliferation;Migration
10.3969/j.issn.1000-484X.2017.06.008
①本文为河北省卫计委青年科技课题(20150642)项目。
②通讯作者,河北医科大学第一医院骨科,石家庄 050031,E-mail:185985103@qq.com。
王 欣(1982年-),女,硕士,主治医师,主要从事临床肿瘤病理的研究,E-mail:wangxin1850@163.com。
R735.2
A
1000-484X(2017)06-0844-05

