柿叶提取物对HEK293-APPswe转基因细胞模型的抗氧化作用及对Nrf2/HO-1途径的影响①
吴小凡 马 斌 侯训尧 洪 艳 申 超 刘雪平
(山东大学附属省立医院老年神经科,济南250021)
柿叶提取物对HEK293-APPswe转基因细胞模型的抗氧化作用及对Nrf2/HO-1途径的影响①
吴小凡 马 斌②侯训尧 洪 艳 申 超 刘雪平
(山东大学附属省立医院老年神经科,济南250021)
目的:观察柿叶提取物(PLE)对阿尔茨海默病细胞模型HEK293-APPswe(20E2)的抗氧化应激的影响,并从核因子E2相关因子2(Nrf2)/血红素加氧酶1(HO-1)信号通路研究其作用机制。方法:Western blot检测APP蛋白表达水平,ELISA检测各组细胞上清Aβ1-40的量,确定细胞模型是否建立成功。用CCK-8检测不同浓度的柿叶提取物对细胞活性的影响,选定干预最佳浓度。设分组:SH-SY5Y为空白对照组(NC组),20E2为模型组(20E2组),用柿叶提取物干预为加药组(20E2+PLE组)。DCFH-DA荧光探针检测各组细胞内ROS的变化,ELISA检测各组细胞上清Aβ1-42的量,Western blot检测胞核、胞浆Nrf2和全细胞HO-1蛋白的表达水平变化。结果:与模型组相比,加药组ROS表达减少,细胞外Aβ1-42浓度降低,细胞核内Nrf2表达增多, HO-1蛋白含量增加。结论:柿叶提取物能有效降低模型组氧化应激的水平,可能是通过降低Aβ1-42的聚集,激活Nrf2/HO-1信号途径,促进Nrf2合成和核转位,从而促进下游抗氧化蛋白HO-1的表达来减弱氧化应激的损伤。
柿叶;氧化应激;神经保护;Nrf2/HO-1
阿尔茨海默病(Alzheimer′s disease,AD)是以进行性认知功能障碍和行为损害为主的中枢神经退行性疾病,其主要病理特征是β 淀粉样蛋白(β-amyloid,Aβ)沉积[1,2]。β淀粉样前体蛋白(β-amyloid precursor protein,APP)先后经α-分泌酶、β-分泌酶和γ-分泌酶降解,但是APP基因突变使得APP蛋白更易于被β-分泌酶、γ-分泌酶降解,从而产生更多的Aβ[3]。20E2细胞株是携带瑞典突变APP基因的HEK293细胞,相比正常神经细胞可产生更多的Aβ1-40和Aβ1-42,被用作AD的转基因细胞模型[4]。SH-SY5Y是人神经母细胞瘤细胞株,作为正常的神经细胞对照。
相关研究发现,氧化应激和自由基损害与阿尔茨海默病发病极其密切,抗氧化治疗也受到越来越多的关注。近来发现,柿叶具有抗氧化、降血脂、降血糖、抗菌、止血等药效[5]。柿叶提取物可能通过调节JNK/caspase-3信号通路来减缓Aβ1-42导致的神经元凋亡[6]。临床发现,柿叶提取物在改善后循环缺血的疗效上优于银杏叶提取物[7]。柿叶提取物脑心清片可保护缺血再灌注引起的脑损伤,防止神经元兴奋性毒性作用。对H2O2诱导的NG108-15细胞损伤有显著的抗氧化作用[8,9]。柿叶提取物已广泛应用于临床防治多种脑血管疾病,然而其对神经退行性疾病的作用机制尚不明确。本文研究柿叶提取物对AD抗氧化作用的影响,观察对细胞外Aβ浓度的变化,对细胞内ROS的影响,从核转录因子 E2相关因子2(Nuclear factor-erythroid 2related factor2,Nrf2)/血红素加氧酶-1(Heme oxygenase-1,HO-1)途径研究其可能的作用机制,旨在为今后AD药物研发提供一定依据。
1 材料与方法
1.1实验材料
1.1.1实验细胞 SH-SY5Y (神经母细胞瘤细胞)购自上海细胞库,20E2(稳定转染APP的HEK293细胞)由山东大学齐鲁医院孙秀莲教授赠予。
1.1.2主要药品和试剂 DMEM高糖培养基、胰蛋白酶(美国HyClone)、胎牛血清FBS、遗传霉素G418(美国Gibco);Aβ1-40、Aβ1-42ELISA试剂盒、蛋白分子量Marker(美国Invitrogen公司);无水乙醇(国产分析纯);CCK-8细胞毒性检测试剂盒(dojindo);BCA蛋白定量分析试剂盒、细胞核蛋白与细胞浆蛋白抽提试剂盒(碧云天);兔源APP(Anti-Amyloid Precursor Protein)多克隆抗体、兔源Nrf2抗体、兔源HO-1抗体、小鼠抗人 β-actin 抗体(美国Abcam);DCHF-DA试剂盒(美国 Sigma公司);PVDF膜(美国Millipore公司);柿叶提取物(PLE)来自山东大学药学院分析测定中心实验室。
1.2实验方法
1.2.1药物配置 柿叶提取物为柿叶经乙醇回流提取,水沉淀除杂后正丁醇萃取,回收正丁醇,经干燥而得。主要成分为原儿茶酸6.26%、芦丁7.80%、金丝桃苷10.70%、山奈酚-3-O-β-D吡喃葡萄糖苷3.27%、山奈酚-3-O-β-D吡喃半乳糖苷9.55%、杨梅素1.06%、槲皮素10.2%、柚皮素0.18%和山奈酚4.3%。柿叶提取物用无水乙醇溶解,配制成为1 g/L的母液,-20℃保存,使用时用DMEM培养液稀释成终浓度为3 μg/ml。
1.2.2细胞培养、分组及药物处理 SH-SY5Y,20E2细胞在37℃,5%CO2条件下,培养在含有10%胎牛血清的DMEM培养基中,每2~3天传一代,取对数生长期的细胞进行试验。将两种细胞分为以下3组:SH-SY5Y为空白对照组(NC组),换入无血清培养基;模型组:20E2,换入无血清培养基(20E2组);给药组:加入终浓度为3 μg/ml的柿叶提取物的DMEM无血清培养基(20E2+PLE组),培养24 h后使用。
1.2.3细胞活性检测 将SH-SY5Y、20E2细胞种到96孔板中,长至80%后,换用含不同浓度梯度(0~24 μg/ml)柿叶提取物的DMEM培养基,每组设6个复孔,24 h后,吸弃培养基,加入含10%CCK-8工作液的DMEM 100 μl,37℃孵育2 h,酶标仪检测在470 nm处的吸光度。
1.2.4细胞核蛋白,细胞浆蛋白分离 各组细胞处理24 h后,弃细胞培养培养液,PBS冲洗细胞1次,用细胞刮将细胞刮下,离心,弃上清,按试剂盒说明步骤分别加入细胞核细胞浆抽提试剂,涡旋振荡,离心后得到细胞核蛋白和细胞浆蛋白。
1.2.5Western blot检测蛋白表达 各组细胞处理24 h后,按说明书分别进行全细胞、胞核和胞浆蛋白的提取,以BCA蛋白质定量法检测蛋白浓度,加上样缓冲液,100℃变性5 min。制胶(12%分离胶,5%浓缩胶),上样30 μg,SDS-PAGE电泳将蛋白分离,然后100 mA恒流将目的蛋白转移到NC膜上,用(10%)的BSA溶液室温封闭30 min,再分别与兔抗人APP抗体(1∶2 000),兔抗人Nrf2抗体(1∶500),兔抗人HO-1抗体(1∶1 000),β-actin抗体(1∶1 000),TBP(1∶1 000)于摇床上4℃过夜,TBST溶液洗膜3次,包被二抗,以β-actin、TBP为内参,扫膜。以目的条带的IOD值与β-actin、TBP条带的IOD值的比值作为该蛋白的相对表达量。
1.2.6活性氧ROS(Reactive oxygen species)水平检测 各组细胞处理24 h后吸弃培养基,用PBS冲洗1次,加入终浓度为10 μmol/L的DCFH-DA,于37℃孵育30 min,孵育结束后PBS洗二次,在荧光显微镜下选激发波长485 nm,发射波长538 nm观察细胞并拍照。
1.2.7ELISA法检测细胞上清Aβ1-42水平 相同数量级的各组细胞分别处理24 h后,取培养液上清离心后,按ELISA试剂盒说明书检测Aβ1-42,通过酶标仪检测样品吸光度,根据标准曲线计算Aβ1-42的量。
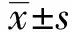
2 结果
2.1Western blot与ELISA法检测APP、Aβ1-40蛋白表达 20E2细胞较对照组APP表达量明显增加,Aβ1-40的量明显增加,NC组(47.28±5.36)pg/ml, 20E2组细胞Aβ1-40含量(2 105.84±70.69)pg/ml,两组差异具有统计学意义(P<0.01,图1)。表明20E2符合阿尔茨海默病病理细胞模型。
2.2CCK-8检测不同浓度的PLE对细胞活性的影响 结果显示PLE在3~6 μg/ml可增加细胞活性(P<0.05),超过6 μg/ml后有抑制细胞活性的作用,为了减少药物毒性作用,最终选用有效浓度范围内的低浓度的3 μg/ml为干预浓度。
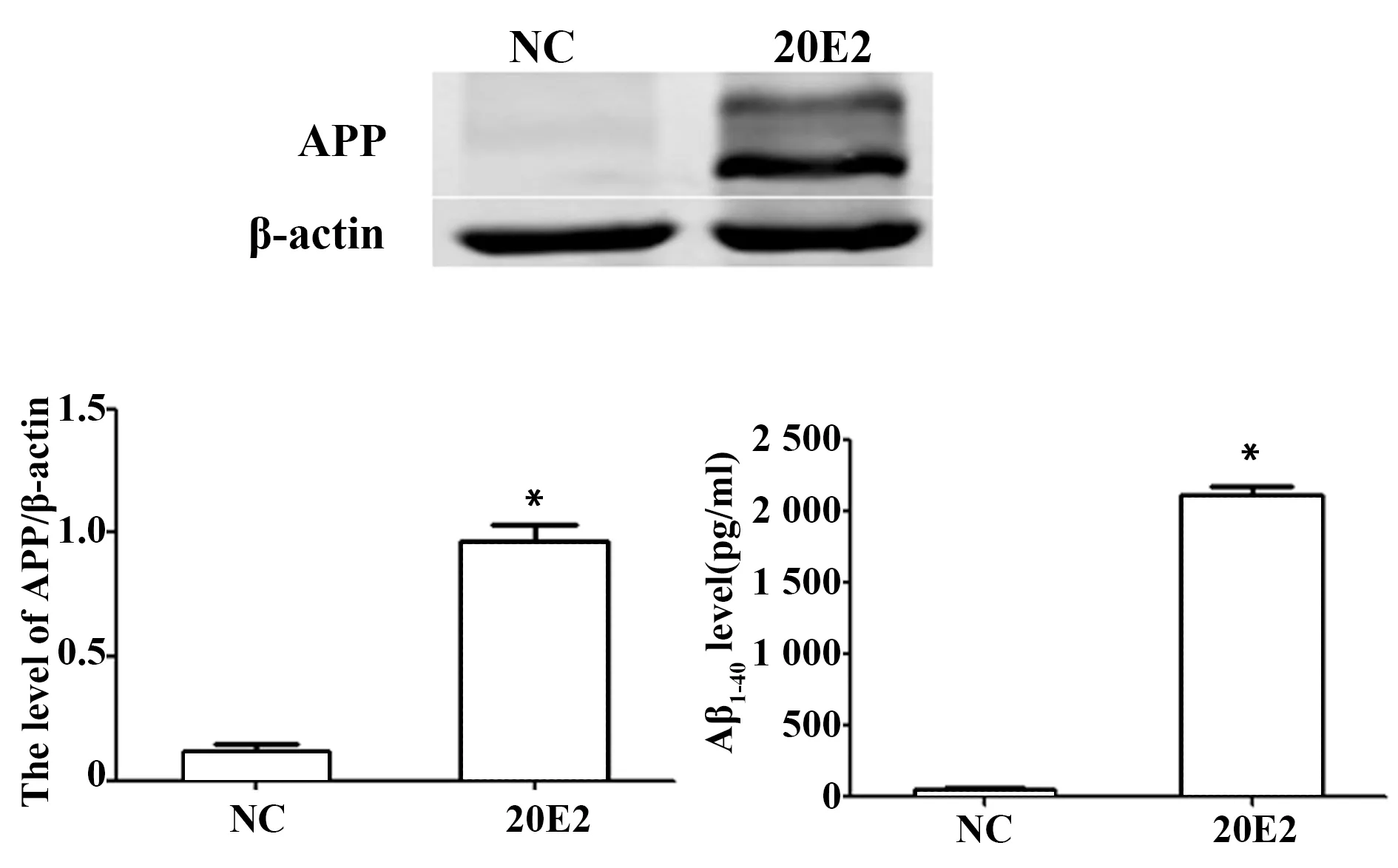
图1 Western blot与ELISA法检测APP、Aβ1-40蛋白表达Fig.1 Expression of APP,Aβ1-40 detected by Western blot and ELISANote:*.P<0.01 vs NC group.
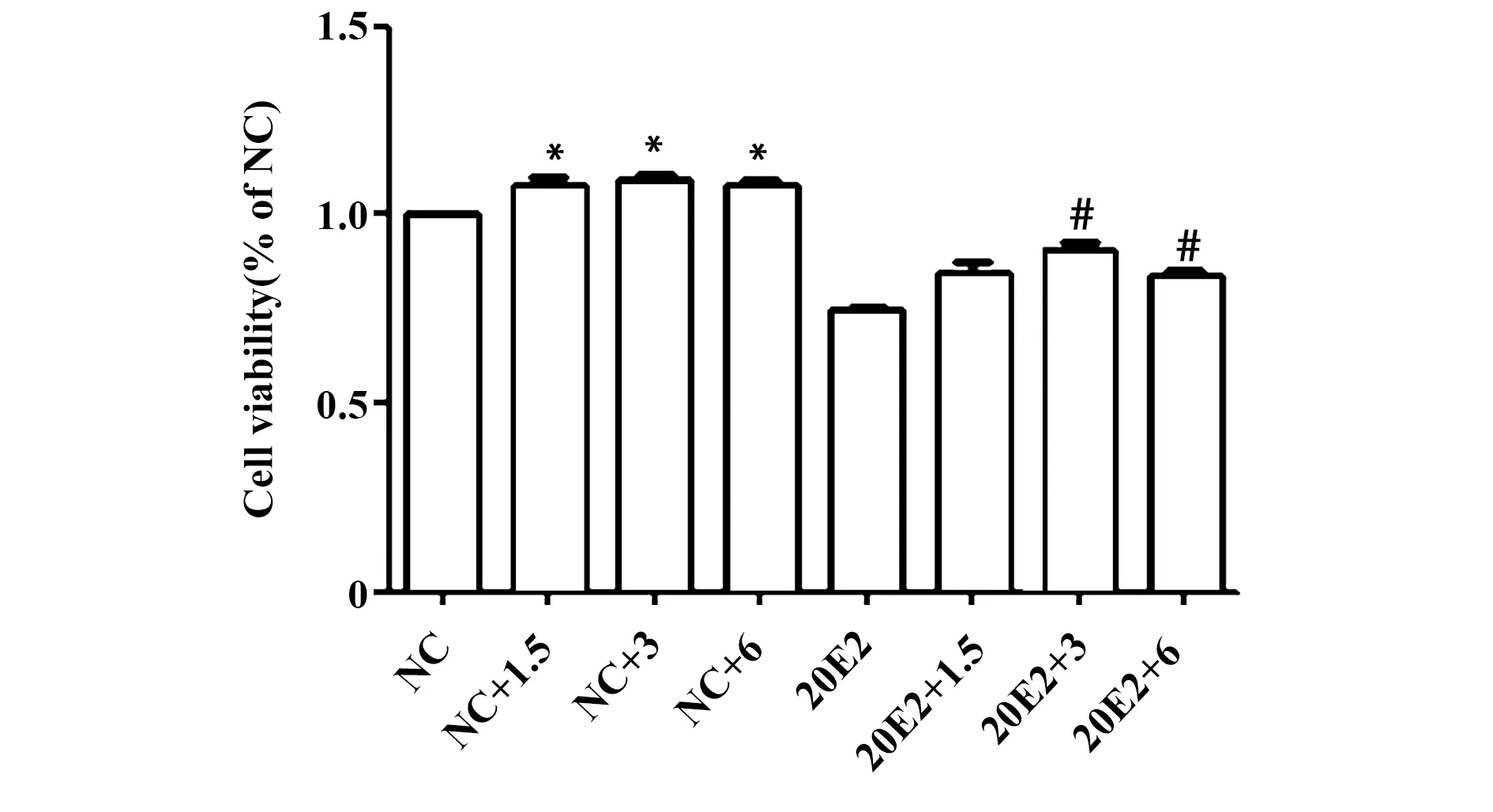
图2 不同浓度的PLE对细胞活性的影响Fig.2 Cell viability in different concentrations of PLE was assayed by CCK-8 methodNote:*.P<0.05 vs NC group;#.P<0.05 vs 20E2 group.
2.3PLE对20E2细胞内ROS变化的影响 采用DCFH-DA荧光探针检测各组细胞ROS的表达,与NC组相比,20E2细胞内ROS荧光信号明显增强,氧化损伤明显,PLE干预后,ROS荧光信号减弱(图3)。
2.4PLE对细胞外Aβ1-42浓度的影响 用ELISA检测相同数量级的各组细胞处理24 h后细胞外Aβ1-42浓度,与NC组相比,模型组细胞外Aβ1-42明显增多,PLE干预后,加药组较模型组细胞外 Aβ1-42明显减少(图4)。
2.5Western blot检测Nrf2,HO-1蛋白表达 分别检测胞浆Nrf2和胞核Nrf2,用PLE干预后,加药组较模型组胞核Nrf2表达增加,全细胞蛋白HO-1表达增加,差异具有统计学意义(图5)。
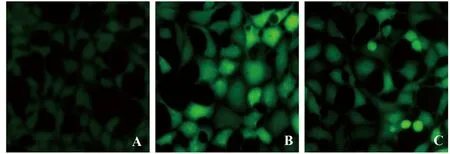
图3 PLE对20E2内ROS变化的影响(×100)Fig.3 Effect of PLE to ROS in HEK293-APPswe(×100)Note: A.NC group;B.20E2 group;C.20E2+PLE group.*.P<0.05 vs NC group.
图4 PLE对细胞外Aβ1-42浓度的影响Fig.4 Effect of PLE to extracellular level of Aβ1-42Note:A.NC group;B.20E2 group;C.20E2+PLE group;*.P<0.05 vs NC group.
图5 Western blot检测Nrf2,HO-1蛋白表达Fig.5 Expression of Nrf2 and HO-1 protein detected by Western blotNote:1.NC group;2.20E2 group;3.20E2+PLE group.*.P<0.05 vs NC group;#.P<0.05 vs 20E2 group.
3 讨论
研究表明,在AD的发生机制中,氧化应激起重要作用,Aβ已被证实是引起氧化应激的重要原因[10,11]。氧化应激可能主导 AD 的发生发展[12],促进 Aβ聚集和微管相关蛋白 tau的磷酸化,加重 AD大脑中的氧化还原反应的失衡,而过多的 Aβ 沉积及 tau蛋白的高度磷酸化则加速疾病进程[13]。Aβ既是氧化应激的来源又是结果,这种具有高度氧化还原活性的肽,能产生大量的活性氧(ROS),ROS会引起细胞膜损伤,并最终导致细胞死亡[14]。而ROS的攻击是促进Aβ恶性循环及脑内扩步的物质之一,能加速AD的进展[15]。所以,抗氧化应激损伤治疗在AD的治疗中起重要作用[16]。本实验发现,AD细胞模型中的ROS荧光强度比正常神经细胞明显增强,可能是由于Aβ聚集引发的细胞内ROS增多。用柿叶提取物干预后能明显降低AD细胞内ROS的表达,细胞外Aβ1-42的浓度也有明显下降,说明柿叶提取物可能是Aβ和ROS 的共同清除剂,可有效降低Aβ的聚集,减轻由Aβ带来的氧化应激损伤,减轻细胞毒性。
Nrf2/HO-1被认为是机体最重要的内源性抗氧化信号通路[17]。氧化应激情况下, Nrf2由细胞浆转移至细胞核内,与抗氧化反应原件结合[18],参与下游II相代谢酶基因的转录,其中就包含血红素加氧酶-1(Heme oxygenase-1,HO-1)[19]。HO-1具有抗氧化损伤和保护神经元的作用[20],HO-1蛋白量在AD患者脑内含量明显升高,与神经元纤维缠结共同存在。并且,HO-1表达增加并不促进Aβ的生成[21]。因此,我们认为上调HO-1对AD有保护作用。本实验中,AD模型20E2过量表达Aβ1-40,胞核中的Nrf2蛋白含量增加, HO-1蛋白表达增强,表明AD细胞模型氧化应激增强,激活Nrf2/HO-1途径,这是机体的保护反应。本实验发现,与模型组相比,柿叶提取物能使AD模型细胞中胞浆Nrf2蛋白含量降低而胞核Nrf2蛋白含量升高,可能是由于柿叶提取物促进了Nrf2核转位率,从而使HO-1表达增加,增加细胞抗氧化的能力。
综上所述,柿叶提取物能降低细胞外Aβ的浓度,减弱ROS对细胞的损伤,减缓氧化应激在AD中的作用,其机制可能是通过上调Nrf2/HO-1通路活性来发挥抗氧化作用,来减缓AD的进程,而柿叶提取物是否还通过其他路径来发挥作用,有待进一步实验验证。
[1] De-Paula VJ,Radanovic M,Diniz BS,etal.Alzheimer′s disease[J].Subcell Biochem,2012,65:329-352.
[2] Caldeira GL,Ferreira IL,Rego AC.Impaired transcription in Alzheimer′s disease:key role in mitochondrial dysfunction and oxidative stress[J].J Alzheimers Dis,2013,34(1):115-131.
[3] Serrano-Pozo A,Frosch MP,Masliah E,etal.Neuropathological alterations in Alzheimer disease[J].Cold Spring Harb Perspect Med,2011,1(1):a006189.
[4] Zhu Z,Yan J,Jiang W,etal.Arctigenin effectively ameliorates memory impairment in Alzheimer′s disease model mice targeting both beta-amyloid production and clearance[J].J Neurosci,2013,33(32):13138-13149.
[5] Xie C,Xie Z,Xu X,etal.Persimmon (Diospyros kaki L.) leaves:a review on traditional uses,phytochemistry and pharmacological properties[J].J Ethnopharmacol,2015,163:229-240.
[6] Huang SW,Wang W,Zhang MY,etal.The effect of ethyl acetate extract from persimmon leaves on Alzheimer′s disease and its underlying mechanism[J].Phytomedicine,2016,23(7):694-704.
[7] Guo SG,Guan SH,Wang GM,etal.Clinical research of persimmon leaf extract and ginkgo biloba extract in the treatment of vertebrobasilar insufficiency[J].J Biol Regul Homeost Agents,2015,29(1):151-157.
[8] Bei W,Zang L,Guo J,etal.Neuroprotective effects of a standardized flavonoid extract from Diospyros kaki leaves[J].J Ethnopharmacol,2009,126(1):134-142.
[9] Bei W,Peng W,Ma Y,etal.NaoXinQing,an anti-stroke herbal medicine,reduces hydrogen peroxide-induced injury in NG108-15 cells[J].Neurosci Lett,2004,363(3):262-265.
[10] Swomley AM,Forster S,Keeney JT,etal.Abeta,oxidative stress in Alzheimer disease:evidence based on proteomics studies[J].Biochim Biophys Acta,2014,1842(8):1248-1257.
[11] Butterfield DA,Swomley AM,Sultana R.Amyloid beta-peptide (1-42)-induced oxidative stress in Alzheimer disease:importance in disease pathogenesis and progression[J].Antioxid Redox Signal,2013,19(8):823-835.
[12] Tramutola A,Lanzillotta C,Perluigi M,etal.Oxidative stress,protein modification and Alzheimer disease[J].Brain Res Bull,2016.doi:10.1016/j.brainresbull,2016.06.005.
[13] Sutherland GT,Chami B,Youssef P,etal.Oxidative stress in Alzheimer′s disease:Primary villain or physiological by-product?[J].Redox Rep,2013,18(4):134-141.
[14] Wang X,Wang W,Li L,etal.Oxidative stress and mitochondrial dysfunction in Alzheimer′s disease[J].Biochim Biophys Acta,2014,1842(8):1240-1247.
[15] Huang WJ,Zhang X,Chen WW.Role of oxidative stress in Alzheimer′s disease[J].Biomed Rep,2016,4(5):519-522.
[16] Moneim AE.Oxidant/Antioxidant imbalance and the risk of Alzheimer′s disease[J].Curr Alzheimer Res,2015,12(4):335-349.
[17] Lee C,Park GH,Lee SR,etal.Attenuation of beta-amyloid-induced oxidative cell death by sulforaphane via activation of NF-E2-related factor 2[J].Oxid Med Cell Longev,2013,2013:313510.
[18] Motohashi H,Yamamoto M.Nrf2-Keap1 defines a physiologically important stress response mechanism[J].Trends Mol Med,2004,10(11):549-557.
[19] Sandberg M,Patil J,D′Angelo B,etal.NRF2-regulation in brain health and disease:implication of cerebral inflammation[J].Neuropharmacology,2014,79:298-306.
[20] Schipper HM,Song W.A heme oxygenase-1 transducer model of degenerative and developmental brain disorders[J].Int J Mol Sci,2015,16(3):5400-5419.
[21] Schipper HM,Song W,Zukor H,etal.Heme oxygenase-1 and neurodegeneration:expanding frontiers of engagement[J].J Neurochem,2009,110(2):469-485.
[收稿2016-11-22]
(编辑 张晓舟)
AntioxidanteffectofpersimmonleafextracttoHEK293-APPswetransgeniccellsandeffecttoNrf2/HO-1pathway
WUXiao-Fan,MABin,HOUXun-Yao,HONGYan,SHENChao,LIUXue-Ping.DepartmentofSenileNeurology,ShandongProvincialHospitalAffiliatedtoShandongUniversity,Ji′nan250021,China
Objective:To investigate the effect of persimmon leaf extract (PLE) on HEK293-APPswe transgenic cells(20E2).Methods:To determine whether the 20E2 cells model was successfully established,the level of Aβ1-40in SH-SY5Y was detected and 20E2 cells(HEK293 cells stably expressing Swedish mutant APP)cultured in vivo by ELISA kit,and the expression of APP protein level was detected by Western blot.Cell viability was assayed by CCK-8 method and then selected the best concentration.Set groups:SH-SY5Y as normal control group (NC group),20E2 as model group (20E2 group),treating with PLE as treating group (20E2+PLE group).Reactive oxygen species (ROS) levels of each group were detected with DCFH-DA fluorescent probe.The extracellular level of Aβ1-42were detected by ELISA kit.Cytoplasmic Nrf2,Nuclear Nrf2,Whole-cell HO-1 were detected by Western blot.Results:Compared with model group,the expressions of ROS,Aβ1-42were down-regulated and the Nuclear Nrf2 and Whole-cell HO-1 were up-regulated in 20E2+PLE group.Conclusion:PLE can reduce the level of oxidative stress of model group effectively,it possibly reduce the aggregation of Aβ1-42and prevent oxidizing via activating Nrf2/HO-1 pathway .
Persimmon leaf extract(PLE);Oxidative stress;Neuroprotection;Nrf2/HO-1
10.3969/j.issn.1000-484X.2017.06.010
①本文受国家自然科学基金(81371225)和山东省科技发展计划(2014GSF118056)项目资助。
②山东大学药学院,济南250012。
吴小凡(1991年-),女,在读硕士,主要从事神经退行性变方面研究,E-mail:wuxiaofan123@126.com。
及指导教师:刘雪平(1962年-),女,博士,教授,博士生导师,主要从事神经退行性变研究,E-mail:lxp6203@163.com。
R741.05
A
1000-484X(2017)06-0854-05

