人胚胎干细胞对肝癌HepG2细胞体外抑制作用的研究①
郑良栋 何雪梅 张 婷 刘 洁 霍本念 刘梦楠 王 薛 冯 涛
(重庆医科大学分子医学与肿瘤研究中心,重庆400016)
·生物治疗·
人胚胎干细胞对肝癌HepG2细胞体外抑制作用的研究①
郑良栋②何雪梅 张 婷②刘 洁②霍本念②刘梦楠②王 薛 冯 涛②
(重庆医科大学分子医学与肿瘤研究中心,重庆400016)
目的:研究体外共培养情况下人胚胎干细胞H9对肝癌HepG2细胞的抑制作用。方法:建立人胚胎干细胞 (H9) 与肝癌HepG2细胞共培养体系,显微镜下观察胚胎干细胞对肿瘤细胞生物学行为的影响,流式细胞仪检测H9细胞对肿瘤细胞的凋亡与周期的影响,Transwell小室法检测H9细胞对HepG2细胞侵袭和迁移的影响,基因芯片分析共培养后HepG2细胞全基因组的表达谱变化。结果:结果发现共培养过程中,肝癌HepG2细胞生长受到抑制,随共培养时间延长,细胞数量逐渐减少,出现老化或凋亡迹象;流式细胞术检测发现HepG2细胞凋亡率显著增加,细胞周期被阻滞于G0/G1期;Transwell实验发现HepG2细胞侵袭、迁移力均降低;基因芯片结果发现HepG2细胞全基因组表达谱发生了显著变化,差异基因涉及多条信号通路。结论:人胚胎干细胞H9体外对人肝癌细胞HepG2有一定程度的抑制作用。
胚胎干细胞;肝癌;共培养;抑制;凋亡
人胚胎干细胞是从人早期胚胎的囊胚内细胞团中分离出来的多潜能干细胞,具有无限增殖性、自我更新性和维持未分化状态等特性,在基础研究和临床应用方面具有广阔的前景。
在肿瘤机制研究中,研究者发现肿瘤细胞尤其是肿瘤干细胞和胚胎干细胞在许多生物学行为上具有高度相似性,比如都具有无限增殖性、高表达端粒酶、侵袭、迁移性等,并且可从机体的免疫监视中逃逸,具有一些相同的信号转导通路[1-3]。但是,二者在对肿瘤作用方面却截然不同:肿瘤基质具有很强的致癌性,能够体外诱导正常细胞癌变,然而胚胎干细胞微环境却能够使得癌细胞的恶性表型显著改善,促进其向良性转化[4]。
共培养是将两种或多种细胞混合培养,使得一种细胞的形态功能能够稳定表达并且维持相当长的时间[5]。细胞共培养技术在肿瘤的实验性治疗、干细胞分化诱导等多方面均具有广泛应用。
为了进一步验证人胚胎干细胞是否具有体外抗肿瘤效应。本研究选择人胚胎干细胞系H9与肝癌HepG2细胞建立共培养模型,并观察共培养过程中胚胎干细胞对肝癌细胞的细胞形态学、凋亡、细胞周期、侵袭、迁移等的影响,并尝试利用基因芯片技术初步探讨其作用机制。
1 材料与方法
1.1材料
1.1.1主要试剂 人胚胎干细胞系H9细胞购自北京赛贝生物技术有限公司;人肝癌HepG2细胞株由重庆医科大学分子医学与肿瘤研究中心保存;PSCeasy人多潜能干细胞培养基(北京赛贝生物技术有限公司);胎牛血清,DMEM培养基(HyClone,USA);hoechst33258(碧云天生物技术研究所);Transwell小室(Coster);Matrigel基质胶(Sigma公司)。
1.1.2主要仪器 CO2细胞培养箱(Thermo公司);-80℃超低温冰箱(Thermo公司);-20℃普通冰箱(Thermo公司);倒置荧光显微镜(Olympus公司);YJ-1450型医用超净工作台(华新器械公司);台式离心机(湘仪离心机仪器公司);普通倒置显微镜(重庆光学仪器公司)。
1.2方法
1.2.1细胞培养 HepG2细胞用含10%胎牛血清、青霉素100 U/ml、链霉素100 μg/ml的DMEM完全培养基在37℃、5%CO2培养箱中培养,3~4 d传代一次,取对数期细胞进行试验。
人胚胎干细胞系H9,培养于Basement Membrane Matrix上,培养液为胚胎干细胞完全培养基。保持每天换液1次,当细胞汇合度达到80%时,用EDTA 在37℃下温和消化5 min,然后离心细胞弃去上清,用新鲜的PSCeasy完全培养液重悬,以1∶5~1∶10的比例传代。
1.2.2共培养过程中HepG2细胞形态学观察 根据上述胚胎干细胞培养详细方法,将H9细胞接种于6孔板内,待细胞汇合度达到50%(即细胞团块约长满6孔板底面积的一半)时,吸弃原干细胞专用培养基,用PBS溶液清洗细胞2遍。取对数生长期的肝癌HepG2细胞,以每孔5×105个接种于上述已经铺有50%胚胎干细胞H9的6孔板中,每孔加入DMEM完全培养基3 ml于细胞培养箱内共培养。在共培养开始时,另外于6孔板设置相同细胞量的单独培养的胚胎干细胞和肝癌细胞作为阴性对照。每隔24 h换液一次,以保证细胞生长营养充足。共培养细胞分别于24、48、72 h后于显微镜下观察各组细胞的变化并拍照。
1.2.3肝癌细胞周期、凋亡检测 共培养:将H9细胞接种于6孔板内,待细胞汇合度达到70%时,备用。将对数期生长状态良好的HepG2细胞5×105个接种到6孔板适用的Transwell小室(0.4 μm)底部,用DMEM培养基培养到细胞贴壁。实验分组:肝癌HepG2与干细胞H9共培养为实验组(H9+HepG2),单独培养的肝癌HepG2为空白对照组(HepG2)。Transwell小室用 PBS洗2遍,然后插入预先种有H9细胞的细胞培养板里,将各组细胞同时放入孵箱中培养到48 h。
共培养结束后,收集实验组与对照组的肝癌HepG2细胞,用PBS洗2次,然后用预冷的70%乙醇固定细胞,PI染色流式细胞仪检测细胞周期。
共培养结束后,收集实验组与对照组的HepG2细胞,PBS洗2遍后,PBS重悬,上流式细胞仪,用AnnexinV-PI双染法检测细胞凋亡。
1.2.4肝癌细胞侵袭和迁移实验 Matrigel包被:将Matrigel 基质胶从-20℃拿出,于4℃冰箱放置过夜解冻,然后用4℃预冷的无血清1640培养基稀释至1 mg/ml 的浓度,取稀释过的Matrigel 胶800 μl 加入到Transwell的上室,将Transwell小室放在37℃细胞孵箱温育4~5 h,使上室膜上形成一层凝胶。将对数期生长状态良好的HepG2细胞5×105个接种到6孔板适用的8.0 μm孔径Transwell小室底部(侵袭实验使用的Transwell小室预先经Matrigel包被,迁移实验则不需Matrigel包被),用DMEM培养基培养到细胞贴壁,血清饥饿处理12 h。实验组的Transwell小室用 PBS洗2遍,然后插入预先种有70%汇合度H9细胞的细胞培养板孔里;对照组的Transwell小室用 PBS洗2遍后则插入未接种H9的空白培养板孔里将各组细胞同时放入孵箱中培养24 h。
培养结束后,用医用棉签轻柔擦去上室表面细胞,然后用甲醇固定15 min。PBS润洗2遍后,0.1%浓度的结晶紫溶液室温下染色30 min,然后用PBS洗净染液,将Transwell晾干,在倒置显微镜下观察穿过小室膜的细胞数目并拍照记录。每个小室可随机选取5个不同的视野,数出视野里的细胞数目,求出平均值。
1.2.5基因芯片检测肝癌细胞基因变化 细胞前期共培养处理同1.2.3的“共培养”项。
共培养48 h后,胰酶消化收集细胞,磷酸盐缓冲液(PBS)洗涤1次后收集细胞,并用PBS液重悬细胞,并送往上海伯豪生物技术有限公司[生物芯片(上海)国家工程研究中心]进行基因芯片分析,用Affymetrix表达谱芯片测定样品的全基因组表达情况。
2 结果
2.1共培养的生物学行为观察 人胚胎干细胞H9与肝癌HepG2细胞共培养一段时间后,肝癌细胞生长受到抑制。如图1所示,共培养0 h时,干细胞与肝癌细胞状态均很好,24 h后,肝癌细胞生长开始受到抑制,细胞开始变稀疏,尤其是靠近干细胞团块的肝癌细胞受到抑制而生长稀疏。随着共培养时间的延长,癌细胞凋亡加剧,到72 h时,已经可见细胞数量明显减少。且在共培养过程中胚胎干细胞因为受培养基、环境等因素影响,细胞极易脱落,即原来致密的细胞团块开始疏松并且脱落漂浮,脱落后其原来生长过的空间短时间肿瘤细胞无法生长。且发现,共培养初始时覆盖在胚胎干细胞表面的肿瘤细胞,最终继续贴附着在干细胞表面而漂浮死亡。而单独培养的H9和HepG2细胞,细胞生长和增殖均正常。
2.2共培养对肿瘤细胞凋亡的影响 共培养48 h后,AnnexinV-PI双染法检测细胞凋亡结果见图2。与单独培养的HepG2细胞相比,共培养的HepG2细胞,其凋亡率有所增加,具有显著性差异(P<0.05)。从单独培养时的5.21%增加到共培养时的30.14%。
2.3共培养对肿瘤细胞周期的影响 与单独培养的HepG2细胞相比,共培养组的HepG2细胞在作用48 h后,G0/G1期细胞比率增加显著,从49.80%增加到72.91%;G2/M期有所下降,从16.21%降到7.25%;S期从33.99%降到19.85%。可见,细胞停留在G0/G1期比率增加,表现出明显的G0/G1期阻滞,其差异具有显著性差异(P<0.05)。见图3。
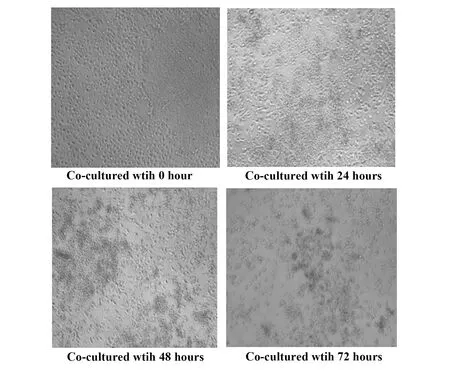
图1 HepG2的细胞形态变化(×100)Fig.1 Morphological changes of HepG2 cells(×100)
2.4共培养对肿瘤细胞侵袭和迁移的影响 如图4和表1所示,在侵袭和迁移实验中,共培养组肝癌HepG2细胞穿膜细胞数均明显少于对照组HepG2细胞(P<0.05),即共培养组肝癌HepG2细胞穿透Matrigel基底膜的侵袭力明显低于对照组细胞,共培养组肝癌HepG2细胞穿透小室底膜的迁移能力也较对照组低,差异均有统计学意义(P<0.05)。
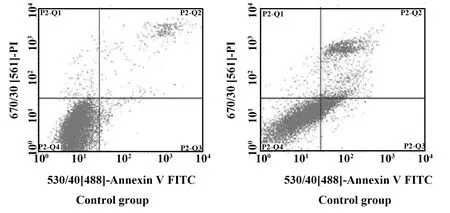
图2 H9细胞对HepG2细胞凋亡的影响Fig.2 Effect of H9 on apoptosis of HepG2 cells

图3 H9对HepG2细胞周期的影响Fig.3 Effect of H9 on cell cycle of HepG2 cellsNote: A.HepG2 cell line was cultured alone;B.HepG2 cell line was co-cultured with H9.
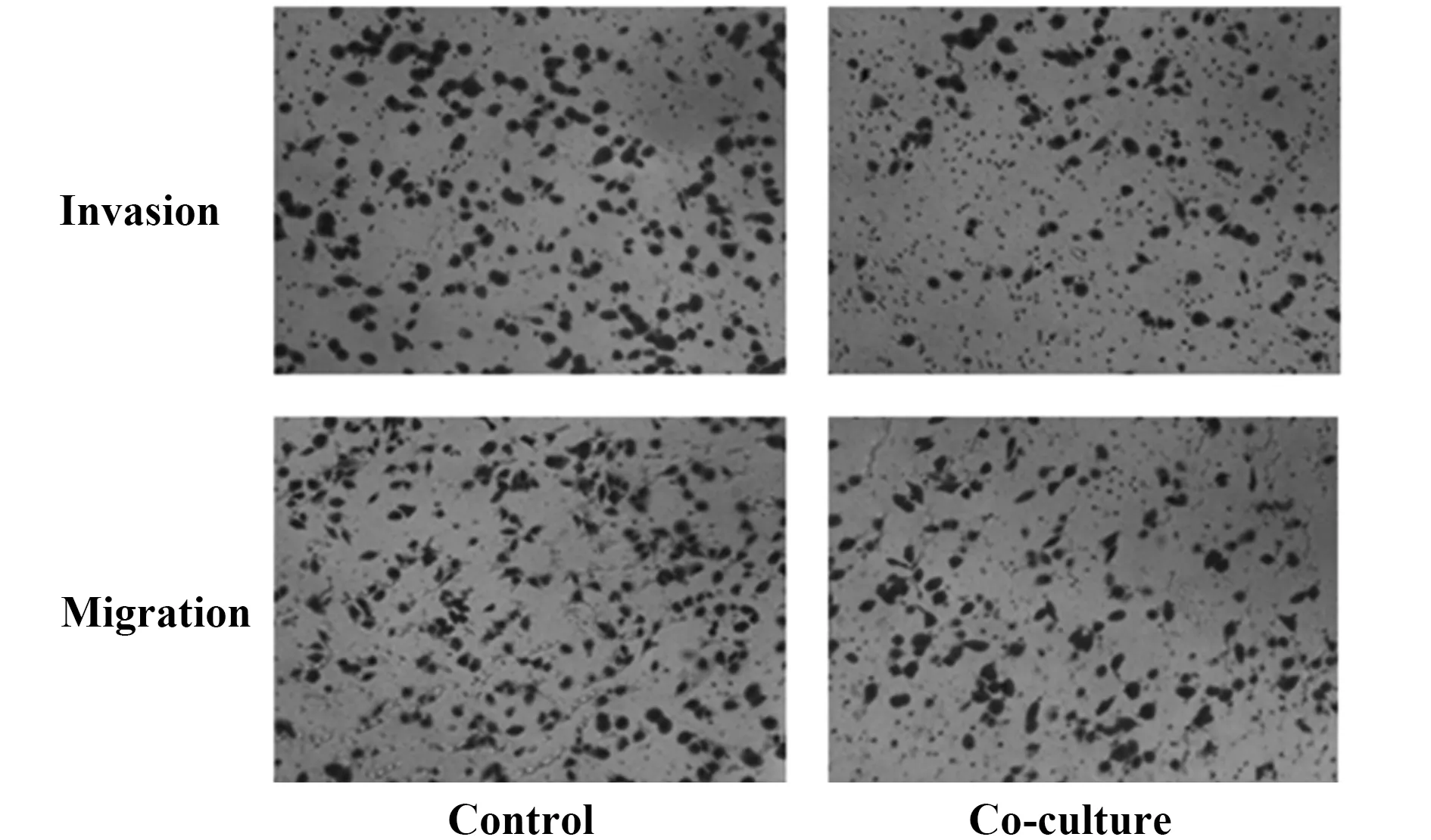
图4 H9细胞对HepG2细胞侵袭和迁移的影响(×200)Fig.4 Effect of H9 on invasion and migration of HepG2 cells(×200)
2.5共培养对肿瘤细胞全基因组表达谱的影响 采用信号比值方法对芯片结果进行分析。针对扫描到的探针信号值实验组/对照组。筛选2倍以上变化基因为差异基因。结果发现,差异的基因共15 588个。其中上调的基因6 640个,下调的基因8 948个。差异基因散点图见图5。
这些差异基因涉及多个方面,包括细胞周期调控、细胞信号转导、细胞凋亡、细胞增殖、迁移、免疫应答等。其中凋亡相关基因有BCL-2、caspase3、caspase7、caspase8、caspase9、caspase10、AKT1、TRAF1等数百条,涉及多条凋亡调控通路。免疫相关基因也有IL-1、IL-2、IL-4、IL-8、CCL1、CCL16、CCL20、HLA-A、HLA-B、HLA-C等数百条基因,涉及B细胞、T细胞和NK细胞、免疫因子如干扰素、肿瘤坏死因子等参与的信号通路。由于涉及的差异基因数目和通路较多,只列举出差异基因GO富集分析中部分我们感兴趣的结果,见表2。
表1 HepG2细胞侵袭和迁移的数量

图5 散点图Fig.5 Plot scatter plotNote:s3.Co-culture group;s5.Control group.
3 讨论
细胞共培养技术在肿瘤的实验性治疗、肿瘤的侵袭性[6-10]、体内基因表达的模拟等方面均具有重要意义[9-11]。本研究中我们采用共培养体系,研究体外环境中胚胎干细胞及其微环境对肝癌HepG2细胞的抑制作用,并探索其机制。首先,我们发现经与胚胎干细胞共培养的肝癌HepG2细胞发生了形态学变化,具体表现为癌细胞状态不佳,细胞生长缓慢,部分细胞出现老化或凋亡迹象。为了进一步验证胚胎干细胞的这种体外抑癌效应,我们使用了流式细胞仪检测共培养后肝癌HepG2细胞的凋亡率和细胞周期变化,流式检测结果与观察到的现象一致。与单独培养的HepG2细胞相比,共培养组的HepG2细胞处于G0/G1期细胞数目显著增多,而G2/M、S期细胞数目减少,表现出明显的G0/G1期阻滞,并且细胞凋亡率也有明显的升高。可能的原因是胚胎干细胞生长过程中或其微环境中,存在一些细胞因子,可调控细胞周期和诱导肝癌细胞进入凋亡程序,并在某种程度上对肿瘤细胞基因重编程,使一些恶性表型转化为良性[12,13]。
恶性肿瘤细胞的侵袭和迁移现象是肿瘤细胞有别于正常细胞的重要特性,也是临床治疗过程中肿瘤复发和转移的主要原因之一[14]。因此,我们检测了共培养条件下HepG2细胞的侵袭力和迁移力的变化。结果显示,共培养组HepG2细胞的侵袭力和迁移力均明显降低,表明胚胎干细胞及其微环境对肝癌HepG2细胞的侵袭和迁移能力也有抑制作用。
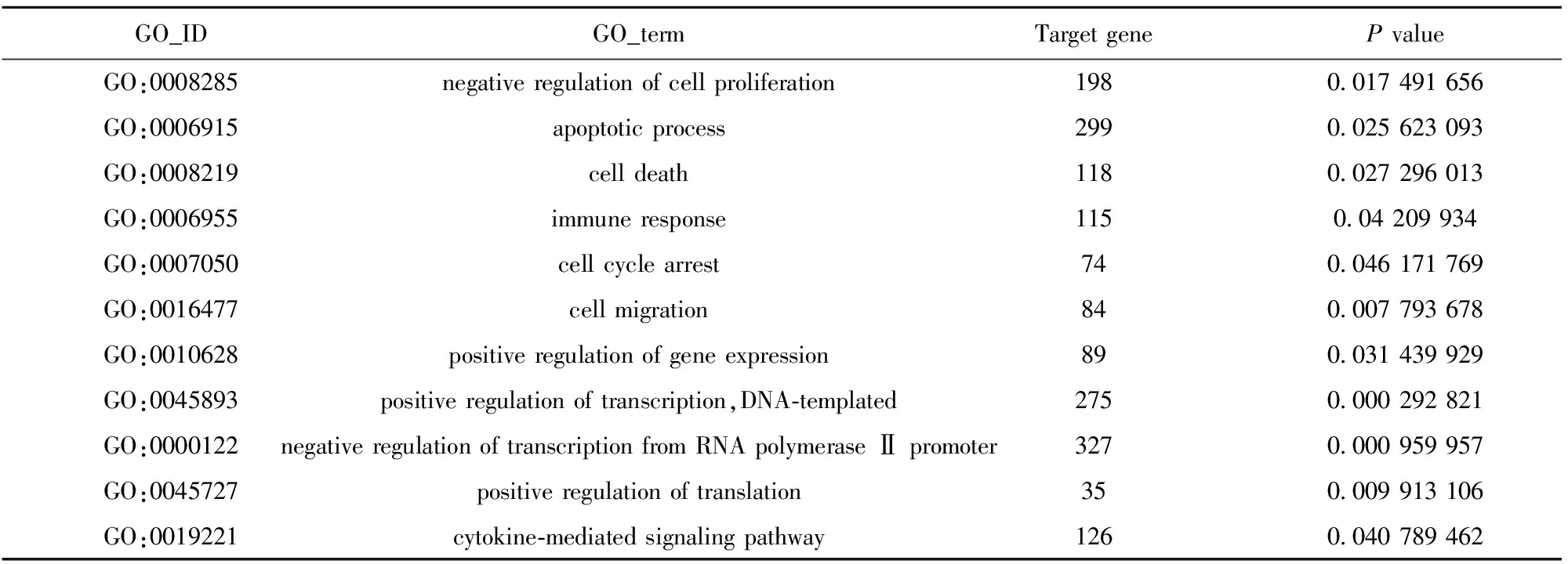
表2 GO分析结果
基因芯片技术的发展为大规模分析基因表达提供了工具[15,16]。我们通过基因芯片技术分析共培养后肝癌肝癌细胞HepG2全基因组的表达谱变化,共检测出数万个差异基因。进一步的差异基因结果富集分析也筛选出数百条GO-terms,其中涉及细胞周期调控、细胞信号转导、细胞凋亡、细胞增殖、迁移、免疫应答等,从基因层面佐证了前述实验中胚胎干细胞对肝癌HepG2细胞细胞生长、凋亡、周期、侵袭、迁移等的影响。Yaddanapudi等[17]研究证实,由胚胎干细胞诱导的抗肿瘤免疫并不是一种机体的“异物反应”,而有可能是由多种效应细胞和细胞因子参与构成的针对胚胎干细胞表面抗原的特异性免疫应答。而我们GO分析富集得出的GO 条目immune response下的115个免疫应答相关基因发生了显著变化,涉及B细胞、T细胞和NK细胞、免疫因子如干扰素、肿瘤坏死因子等参与的信号通路。从基因层面证实了胚胎干细胞可能通过影响肝癌HepG2细胞的免疫应答等产生对HepG2细胞的抑制作用。我们猜测可能是共培养过程中,由肝癌细胞作为抗原刺激胚胎干细胞分化产生一些免疫细胞或免疫因子等,对肝癌细胞产生了免疫重编程作用。基因芯片虽然有大规模、高通量、可快速筛选基因等优点,但仍然有误差存在。对筛选出的差异基因及富集分析得到的GO term仍需PCR和Western等进一步筛选验证。
综上所述,本研究初步证实了人胚胎干细胞H9体外对人肝癌细胞HepG2有一定程度的抑制作用,具体表现为对肝癌细胞的细胞生长、凋亡、侵袭、迁移等的抑制和细胞周期的影响。然而,其具体的机制仍有待进一步研究。
[1] Reya T,Clevers H.Wnt signalling in stem cells and cancer[J].Nature,2005,434(7035):843-850.
[2] Li L,Neaves WB.Normal stem cells and cancer stem cells:the niche matters[J].Cancer Res,2006,66(9):4553-4557.
[3] Pardal R,Clarke MF,Morrison SJ.Applying the principles of stem-cell biology to cancer[J].Nat Rev Cancer,2003,3(12):895-902.
[4] Miller SJ,Lavker RM,Sun TT.Interpreting epithelial cancer biology in the context of stem cells:tumor properties and therapeutic implications[J].Biochim Biophys Acta,2005,1756(1):25-52.
[5] Nakazawa K,Kalassy M,Sahuc F,etal.Pigmented human skin equivalent-as a model of the mechanisms of controI of cell-cell and cell-matrix interactions[J].Med Bio I Eng Comput,1998,36(6):813-820.
[6] Xie J,Haslam SZ.Extracellular matrix regulates ovarian hormone dependent proliferation of mouse mammary epithelial cells[J].Endocrinology,1997,138(6):2466-2473.
[7] Woodward TL,Xie J,Fendrick JL,etal.Proliferation of mouse mammary epithelial cells in vitro:Interactions among epidermal growth factor,insulin-like growth factorⅠ,ovarian hormones,and extracellular matrix proteins[J].Endocrinology,2000,141(10):3578-3586.
[8] Thiery JP,Chopin D.Epithelial cell plasticity in development and tumor progression[J].Cancer Metastasis Rev,1999,18(1):31-42.
[9] Kamolz LP,Kolbus A,Wick N,etal.Cultured human epithelium:human umbilical cord blood stem cells differentiate into keratinocytes under in vitro conditions[J].Burns,2006,32(1):16-19.
[10] Ubels JL,Hoffman HM,Srikanth S,etal.Gene expression in rat lacrimal gland duct cells collected using laser capture microdissection:evidence for K+secretion by duct cells[J].Invest Ophthalmol Vis Sci,2006,47(5):1876-1885.
[11] Seam N,Gonzales DA,Kern SJ,etal.Quality control of serum albumin depletion for proteomic analysis[J].Clin Chem,2007,53(11):1915-1920.
[12] Lee LM,Seftor EA,Bonde G,etal.The fate of human malignant melanoma cells transplanted into zebrafish embryos:assessment of migration and cell division in the absence of tumor formation[J].Dev Dyn,2005,233(4):1560-1570.
[13] Giuffrida D,Rogers IM,Nagy A,etal.Human embryonic stem cells secrete soluble factors that inhibit cancer cell growth[J].Cell Prolif,2009,42(6):788-798.
[14] Liotta LA.Cancer cell invasion and metastasis[J].Sci Am,1992,266(2):54-59,62-53.
[15] Chang BD,Swift ME,Shen M,etal.Molecular determinants of terminal growth arrest induced in tumor cells by a chemoth era-peutic agent[J].Proc Natl Acad Sci U S A,2002,99(1):389-394.
[16] Zhou Y,Gwadry FG,Reinhold WC,etal.Transcriptional regulation of mitotic genes by camptothecin-induced DNA damage:Microarray analysis of dose-and time-dependent effects[J].Cancer Res,2002,62(6):1688-1695.
[17] Yaddanapudi K,Mitchell RA,Putty K,etal. Vaccination with embryonic stem cells protects against lung cancer:is a broad-spectrum prophylactic vaccine against cancer possible? [J]. PLoS One,2012,7:e42289.
[收稿2016-09-23 修回2016-10-19]
(编辑 张晓舟)
InhibitoryeffectofhumanembryonicstemcellsonHepG2cellsinvitro
ZHENGLiang-Dong,HEXue-Mei,ZHANGTing,LIUJie,HUOBen-Nian,LIUMeng-Nan,WANGXue,FENGTao.ResearchCenterofMolecularMedicineandCancer,ChongqingMedicalUniversity,Chongqing400016,China
Objective:To study the inhibitory effect of human embryonic stem cells on the HepG2 cells in vitro.Methods:The co-culture system of Human embryonic stem cells (H9) and liver cancer HepG2 cells was established.The effect of H9 on the biological behavior of HepG2 cells was observed by microscope,the flow cytometry was used to detect the apoptosis of tumor cells and the cell cycle alteration.Transwell assay was used to detect the migration and invasion of tumor cells.Gene microarray technique was used to examine the change of gene expression profile of HepG2 cells.Results:In the process of co-culture,the growth of hepatoma cells was inhibited.With the extension of the culture time,cells decreased gradually,and occurred signs of aging or apoptosis.Flow cytometry test results showed that the apoptosis rate of hepatoma cells was significantly increased,and the cell cycle was blocked in the G0/G1 phase.Transwell test results showed that the invasion and migration of HepG2 cells were decreased.The gene chip results showed that the whole genome expression profile of HepG2 cells had a significant change.Conclusion:The human embryonic stem cells had an inhibitory effect on HepG2 cells in vitro.
Embryonic stem cells;Hepatoma;Co-culture;Inhibition;Apoptosis
10.3969/j.issn.1000-484X.2017.06.012
①本文为国家自然科学基金资助项目(81071770,81201679)。
②同时供职于重庆市生物化学与分子药理学重点实验室,重庆400016。
郑良栋(1989年-),男,硕士,主要从事分子药理学与肿瘤药理学研究,E-mail:zishangjun@126.com。
及指导教师:冯 涛(1963年-),男,教授,博士生导师,主要从事肿瘤机理和治疗方面的研究,E-mail:478240069@qq.com。
R392
A
1000-484X(2017)06-0864-05

