免疫检查点抑制剂治疗中的疗效评估:RECIST还是irRC①
王巧红 吴 霞
(上海交通大学医学院附属仁济医院妇产科,上海200127)
免疫检查点抑制剂治疗中的疗效评估:RECIST还是irRC①
王巧红 吴 霞
(上海交通大学医学院附属仁济医院妇产科,上海200127)
肿瘤细胞通过多种机制产生免疫抑制环境,以逃避免疫攻击,如破坏有效抗原递呈、下调效应T细胞作用、上调促进免疫耐受及T细胞“无能”的通路等。肿瘤免疫治疗旨在靶向机体免疫系统,刺激宿主产生抗肿瘤反应。2012年新英格兰医学杂志报道了抗程序性死亡蛋白-1(Programmed death protein-1,PD-1)、程序性死亡配体1(Programmed cell death-ligand 1,PD-L1)抗体在晚期肿瘤患者中获得了持久的肿瘤消退及疾病稳定期,这2个里程碑式的临床试验使肿瘤免疫治疗进入了一个新时代[1,2]。美国《科学》杂志将癌症免疫治疗列为2013年最重大的科学突破之一,这预示着免疫治疗在恶性肿瘤治疗领域的广阔前景。现今肿瘤免疫治疗已越来越多应用于患者,而适用于传统化疗药物的实体瘤评价标准(Response evaluation criteria in solid tumors,RECIST)不能精确地评估免疫治疗疗效。临床医生亟待熟悉和掌握免疫相关疗效评价标准(immune-related response criteria,irRC)从而指导临床实践。本文就目前免疫检查点抑制剂治疗中irRC的应用及相关问题作一综述。
1 RECIST
肿瘤治疗中通常对肿瘤负荷进行评估,肿瘤负荷即肿瘤对机体的危害程度,包括肿瘤的大小、活跃程度、转移情况以及不同部位肿瘤对机体的危险程度等。在肿瘤治疗中,初始用药后传统化疗药物的直接细胞毒性作用常能转化为可测量肿瘤病灶的大小变化,因此临床实践中肿瘤负荷的变化主要依赖病灶大小的解剖学测量,对此进行总体评估以反映疗效。1981年WHO第一次发布基于解剖学测量的肿瘤疗效标准用于临床试验,其中肿瘤的客观缓解(Objective response,OR)是试验的主要终点。WHO标准引入二维测量(即病灶的最长垂直径乘积)的概念,通过评估治疗后肿瘤负荷与基线负荷的变化确定疗效[3]。为了适应新的影像学技术或因原始文件的概念模糊,应用WHO标准的研究组和医药公司常常在应用过程中根据自身情况对WHO标准进行修改,导致试验结果的解读出现混乱。甚至不同疗效标准的应用在同一药物得出不同的疗效结论。为了应对这一问题,二十世纪九十年代中期国际工作小组组成了以标准化和简化肿瘤治疗的疗效评价标准,并在2000年发布了新的标准,即RECIST[4]。初始RECIST标准定义了可测量病灶的最小尺寸,测量病灶的数目(最多10个,每个器官5个),同时使用一维测量(病灶的最长直径)代替二维测量评估肿瘤总体负荷,并以肿瘤的客观缓解或疾病进展作为试验的主要终点。这一标准随后被各研究机构广泛采用,并被作为肿瘤疗效评估的指南。2009年RECIST工作组进行修订并发布了1.1版本,对初始RECIST进行简化和标准化,详细说明了肿瘤治疗评估中的各种定义及可能出现的情况。
传统细胞毒性药物通常直接作用于肿瘤细胞,发挥效应迅速,治疗后能够很快观察到肿瘤变化,主要有三种形式:①肿瘤缩减(有效);②肿瘤长大(进展);③肿瘤无明显变化(稳定)。临床上肿瘤化疗后无明显变化的状态持续时间极为短暂,通常难以定义药物的抗肿瘤效应。根据RECIST标准,将有意义的肿瘤病灶增加和出现新病灶定义为肿瘤进展(Progressive disease,PD)。一旦患者满足PD标准,建议终止正在进行的治疗并寻求替代治疗。RECIST 1.1版为化疗疗效的客观评价提供了标准化的方法,其中一维测量简便易行且使变异最小化。但是RECIST的建立来源于细胞毒性药物的临床数据,仅将病灶缩小判定为客观有效,忽视了疾病稳定(Stable disease,SD)的潜在有效可能,也无法发现PD后的肿瘤客观反应,因而RECIST标准是否适用于肿瘤免疫治疗的疗效评估一直有争议。
2 免疫检查点抑制剂治疗的疗效特点
免疫检查点阻断治疗,通过抑制CTLA-4和PD-1/PD-L1途径,旨在恢复并促进效应T细胞特异性识别和杀伤肿瘤细胞的功能。不同于化疗和分子靶向治疗,通过对肿瘤特异性T细胞的诱导、活化和增殖,免疫检查点阻断治疗能系统性地增强全身的抗肿瘤免疫反应,产生持久的临床疗效。免疫检查点抑制剂治疗中免疫系统招募淋巴细胞进入肿瘤组织、启动抗肿瘤免疫需要一定时间,因而肿瘤免疫治疗疗效的出现时间较化疗晚,且有时可观察到已判定为PD的患者在继续接受免疫治疗后出现疾病的改善,这种情况被称为肿瘤免疫治疗的“延迟效应”[5]。接受Ipilimumab治疗的黑色素瘤患者,治疗后出现肿瘤病灶增大随后缩小的现象,相关活检证实增大的病灶为炎症细胞浸润或坏死。提示免疫治疗除化疗的三种反应模式外,还存在第四种独特的免疫相关反应模式,即肿瘤应答发生在肿瘤负荷增加或出现新病灶后,称为“假性进展”。短期肿瘤负荷增加可能因为免疫细胞浸润而非肿瘤细胞生长,而新病灶的出现可能源于基线不可测量病灶发生免疫细胞浸润的局部炎症反应。接受Nivolumab治疗的Ⅰ期试验,10%(11/107)患者具有明显的免疫相关反应[6]。另一抗PD-1单抗Pembrolizumab试验数据显示6.7%(13/192)患者在符合RECIST的PD标准后的再次评估时发生肿瘤应答,即出现肿瘤的假性进展。基于免疫检查点抑制剂治疗中不同于传统化疗药物的疗效特点,PD未必代表治疗失败,传统的RECIST无法充分评估相关药物活性,必须探寻较RECIST更合理的疗效评估标准。
3 irRC
3.1irRC标准的建立 2004年、2005年,约200名专家组成工作组对他们在肿瘤免疫治疗药物的经验进行讨论,评估了487例接受Ipilimumab治疗的晚期黑色素瘤患者。约30%患者在12周获得疾病控制,包括完全缓解(Complete response,CR),部分缓解(Partial response,PR)和SD,并观察到SD的患者在之后较长时间内伴有肿瘤负荷的稳定减少和缓慢发生的客观反应(PR甚至CR)[7]。另外根据WHO标准判定为PD的患者,在肿瘤负荷增加或新病灶出现后仍然可能会发生客观反应,因此Ipilimumab的抗肿瘤反应可能直到治疗的诱导后期才会发生,并且发生于WHO标准或RECIST定义的PD之后[7,8]。据此工作组得出以下结论:①免疫治疗测量抗肿瘤活性的出现时间可能较化疗药物晚;②免疫治疗的客观反应可能出现在传统标准判定的PD之后;③除非PD得到证实否则并不适合终止治疗;④建议允许临床不重要的PD(如小的新病灶);⑤持续SD可能代表抗肿瘤活性。2009年irRC发布,基于修订的WHO标准,应用肿瘤病灶的二维测量即最长垂直径的乘积之和,将可测量的新病灶纳入总体肿瘤负荷,比较总体肿瘤负荷与基线负荷间变化进行疗效评估,并且CR、PR、PD的确认需要间隔至少4周的重复评估方可证实[9]。3.2irRC与RECIST 1.1版的差异 表1总结了irRC与RECIST 1.1版间的差异。irRC创新性地将可测量新病灶纳入总体肿瘤负荷,而不在新病灶出现时直接判定为PD。试验发现即使新病灶的测量包括在肿瘤负荷的计算中,部分患者实际的总体抗肿瘤效应并未减少。irRC在病灶增加大于25%时,仍然继续治疗并进行二次评估,只有连续两次有意义的总体肿瘤负荷增加才被认为PD。对于WHO标准或RECIST定义的PD的应对往往是终止治疗,而irRC避免了过早确定PD,间隔期间的继续治疗很有可能发现肿瘤病灶缩减。RECIST在出现新病灶或有意义的肿瘤负荷增加后即定义PD,造成治疗终止,低估了免疫治疗药物的临床获益因而推进了irRC的产生。irRC提供了更为全面的临床活性评估,依据irRC可以额外鉴定约10%具有良好生存期的患者。
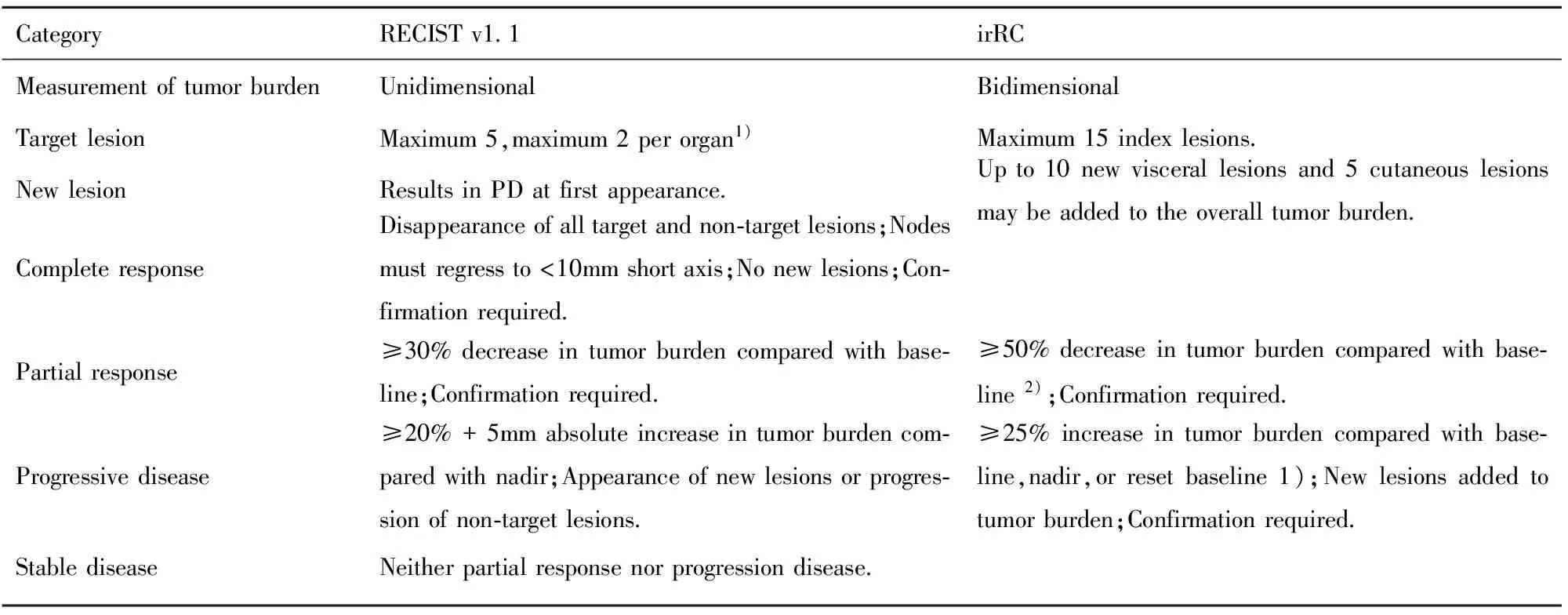
表1 比较RECIST 1.1版与irRC的主要差异
Note:1)For the present analyses,the maximum of target lesion was 10;2)If an increase in tumor burden is observed in first scheduled assessment,the baseline is reset to the value observed at the first assessment.
4 irRC标准中尚需进一步完善的相关问题
4.1测量方法仍需完善 目前irRC基于WHO标准采用了二维测量,即病灶最大垂直径乘积的总和以量化肿瘤负荷,而RECIST v1.1则采用一维测量——病灶最长直径和淋巴结短径[4,9,10]。两者测量方法的差异使得运用不同标准的临床试验结果难以比较,甚至有质疑不同标准疗效评估的差异可能源于测量方法的差异。因此亟需选择更具有优势的合适测量方法以实现标准的统一。多项研究证实RECIST采用的一维测量较irRC的二维测量具有更少的测量变异[11,12]。WHO标准产生的测量变异造成了43%患者错误分类为PD。二维测量导致的测量变异对小病灶而言更需重视,它们的测量变异易造成更多的错误分类,极可能严重影响疗效的客观评价[13]。
Nishino等[14]在57例接受ipilimumab治疗的晚期黑色素瘤患者中比较了irRC使用一维测量和二维测量的差异,其中一维测量界限值的选择基于RECIST(PR为30%,PD为20%)。根据RECIST提供的数学转换,一维测量20%的增加对应二维测量44%的增加。尽管两种测量方法PD的界限值不同,研究证实了两者的高度一致性。此外还发现一维测量较二维测量具有更好的可重复性且测量变异也更少。irRC使用一维测量的可行性和有效性已得到初步证实,今后在irRC中是否以一维测量替代二维测量需进一步研究。
4.2假性进展的定义需进一步精确 免疫治疗患者出现肿瘤增大或新病灶时可能是潜在的假性进展,irRC避免了过早判定PD,使得患者能够继续治疗,提高了免疫治疗药物的获益。然而实体瘤中假性进展的发生率并不高,部分患者是真正的PD[15]。Hodi等[16]的研究描述了两种类型的假性进展:①早期假性进展,12周时出现≥25%增加而下次评估未证实PD;②延迟假性进展,12周后出现≥25%增加而下次评估未证实PD。多数肿瘤负荷增加后减少的情况属于早期假性进展,延迟假性进展的发现可能是因为测量变异,并不是真正的假性进展。治疗12周似乎是评价相应疗效的关键时间点,12周时RECIST和irRC均判定SD,RECIST判定PD而irRC判定非PD以及两者均判定PD患者的2年生存率分别为77.6%、37.5%、17.3%[16]。因而认为12周时应用irRC有助于筛选PD-1抗体治疗有效的患者,减少假性进展的误判。尽管假性进展是免疫治疗的独特反应模式,它需要更为详细精确的定义,包括肿瘤缩减后SD持续时间的要求,同时也需要相关预测因子和生物标志物以帮助区分假性进展和真实进展。目前临床医生使用irRC评估疗效决策临床时仍需结合实际,谨慎考虑,必要时进行替代治疗。
4.3基线重置是否合理尚不明确 临床实践中,肿瘤评估通常倾向于和前次评估进行比较,以掌握肿瘤治疗的最新变化。因而irRC基于此提出“基线重置”概念:当肿瘤负荷在初次评估有所增加时,可以重置基线(将此次评估的肿瘤负荷值作为基线),运用于后续比较。而在传统WHO标准或RECIST中,肿瘤负荷始终与初始基线负荷进行比较(判定PD时与肿瘤负荷最低点比较)。这是因为过去30多年肿瘤学家认为,开始于基线的肿瘤负荷连续动力学评估是疗效评价的基础,基线负荷作为描述肿瘤动力学总体趋势的关键有助于研究者和临床医生更为全面地评估疗效[17-19]。贸然引入“基线重置”概念缺乏严谨科学的数据支持,同时也会破坏肿瘤动力学变化的整体曲线,很有可能导致免疫相关疗效评价系统混乱。目前基线重置概念在各评价标准中缺乏统一,同时也会受到假性进展问题的影响,因此对待基线重置的问题需要慎重,其有效性和可行性仍然需要进一步的数据支持。
5 irRC评估免疫检查点抑制剂治疗中临床疗效的实例
在应用PD-1抑制剂Pembrolizumab治疗黑色素瘤的多中心Ⅰb期临床试验中,同时应用irRC和RECIST 1.1版对疗效进行评价[16]。655例患者接受不同剂量的Pembrolizumab治疗,包括每3周1次,每次2 mg/kg;每3周1次,每次10 mg/kg;以及每两周1次,每次10 mg/kg。仅在发生证实的PD,不能耐受毒性,临床医生决策或其他原因的情况下终止治疗。治疗过程中每12周进行影像学的肿瘤测量,证实影像学PD的患者继续治疗直至至少4周后的评估仍然证实PD。327例患者影像学随访时间≥28周,通过irRC评估发现7.3%(24/327)的独特免疫相关反应,包括出现新病灶后的肿瘤负荷衰退和疾病稳定,或是病灶大小先增大后减少。同时试验评估了RECIST和irRC均判定非PD,RECIST判定PD而irRC判定非PD以及两者均判定PD三组患者的总生存期(Overall survival,OS)差异,发现RECIST判定PD而irRC判定非PD患者OS较两者均判定PD长。三组的中位OS分别为未达到、22.5个月、8.4个月;此外2年生存率分别为77.6%、37.5%、17.3%。
irRC在接受PD-1抗体治疗的患者中发现了独特的免疫相关反应,对这部分患者继续治疗可观察到明显的抗肿瘤效应。尽管非典型反应的发生率并不高,对于患者而言仍然具有重要意义。不同组别间观察到的生存期差异证实irRC提高了患者的治疗获益,RECIST 1.1版低估了Pembrolizumab在约15%患者中的获益。这些数据极大地支持了基于免疫相关反应修订的irRC,同时反映了irRC作为评估免疫治疗疗效标准的优越性和可行性。
6 展望
肿瘤免疫治疗是目前新兴的肿瘤治疗方式,免疫治疗药物的产生离不开简易标准化的疗效评估标准。目前主要的RECIST和irRC标准各有优势及不足,RECIST采用测量变异更少的一维测量,但可能低估患者获益;irRC的二维测量相对繁复测量变异大,但是能有效避免过早判定PD。期待建立一维测量的irRC标准或修订针对免疫相关反应的RECIST以简化和标准化肿瘤免疫治疗的评估。如何使得测量变异最小化,精确定义假性进展的概念,如何有效区分假性进展和真实进展帮助临床决策,以及基线重置概念的合理性与统一化等问题仍然需要我们深入研究。相信随着irRC越来越多的应用以及RECIST和irRC两种标准的进一步分析比较,我们一定能在不久的将来获得可行的标准化疗效评估标准,及早解决相关困扰问题。
[1] Topalian SL,Hodi FS,Brahmer JR,etal.Safety,activity,and immune correlates of anti-PD-1 antibody in cancer[J].N Engl J Med,2012,366(26):2443-2454.
[2] Brahmer JR,Tykodi SS,Chow LQ,etal.Safety and activity of anti-PD-L1 antibody in patients with advanced cancer[J].N Engl J Med,2012,366(26):2455-2465.
[3] Miller AB,Hoogstraten B,Staquet M,etal.Reporting results of cancer treatment[J].Cancer,1981,47(1):207-214.
[4] Eisenhauer EA,Therasse P,Bogaerts J,etal.New response evaluation criteria in solid tumours:revised RECIST guideline (version 1.1)[J].Eur J Cancer,2009,45(2):228-247.
[5] Di Giacomo AM,Danielli R,Guidoboni M,etal.Therapeutic efficacy of ipilimumab,an anti-CTLA-4 monoclonal antibody,in patients with metastatic melanoma unresponsive to prior systemic treatments:clinical and immunological evidence from three patient cases[J].Cancer Immunol Immun,2009,58(8):1297-1306.
[6] Hodi FS,Sznol M,Kluger HM,etal.Long-term survival of ipilimumab-naive patients (pts) with advanced melanoma (MEL) treated with nivolumab (anti-PD-1,BMS-936558,ONO-4538) in a phase I trial[J].J Clin Oncol,2014,(suppl 15s):abstr 9002.
[7] Weber J,Gibney G,Kudchadkar R,etal.Phase I/II study of metastatic melanoma patients treated with nivolumab who had progressed after ipilimumab[J].Cancer Immunol Res,2016,4(4):345-353.
[8] Giacomo AMD,Danielli R,Guidoboni M,etal.Therapeutic efficacy of ipilimumab,an anti-CTLA-4 monoclonal antibody,in patients with metastatic melanoma unresponsive to prior systemic treatments:clinical and immunological evidence from three patient cases[J].Cancer Immunol Immun,2009,58(8):1297-1306.
[9] Wolchok JD,Hoos A,O′Day S,etal.Guidelines for the evaluation of immune therapy activity in solid tumors:immune-related response criteria[J].Clin Cancer Res,2009,15(23):7412-7420.
[10] Nishino M,Jagannathan JP,Ramaiya NH,etal.Revised RECIST guideline version 1.1:What oncologists want to know and what radiologists need to know[J].Am J Roentgenol,2010,195(2):281-289.
[11] Nishino M,Guo M,Jackman DM,etal.CT tumor volume measurement in advanced non-small-cell lung cancer:Performance characteristics of an emerging clinical tool[J].Acad Radiol,2011,18(1):54-62.
[12] Zhao B,James LP,Moskowitz CS,etal.Evaluating variability in tumor measurements from same-day repeat CT scans of patients with non-small cell lung cancer[J].Radiology,2009,252(1):263-272.
[13] Oxnard GR,Zhao B,Sima CS,etal.Variability of lung tumor measurements on repeat computed tomography scans taken within 15 minutes[J].J Clin Oncol,2011,29(23):3114-3119.
[14] Nishino M,Giobbie-Hurder A,Gargano M,etal.Developing a common language for tumor response to immunotherapy:immune-related response criteria using unidimensional measurements[J].Clin Cancer Res,2013,19(14):3936-3943.
[15] Chiou VL,Burotto M.Pseudoprogression and immune-related response in solid tumors[J].J Clin Oncol,2015,33(31):3541-3543.
[16] Hodi FS,Hwu WJ,Kefford R,etal.Evaluation of immune-related response criteria and RECIST v1.1 in patients with advanced melanoma treated with pembrolizumab[J].J Clin Oncol,2016,34(13):1510-1517.
[17] Jain RK,Lee JJ,Ng C,etal.Change in tumor size by RECIST correlates linearly with overall survival in phase I oncology studies[J].J Clin Oncol,2012,30(21):2684-2690.
[18] Nishino M,Cardarella S,Dahlberg SE,etal.Radiographic assessment and therapeutic decisions at RECIST progression in EGFR-mutant NSCLC treated with EGFR tyrosine kinase inhibitors[J].Lung Cancer,2013,79(3):283-288.
[19] Nishino M,Dahlberg SE,Cardarella S,etal.Volumetric tumor growth in advanced non-small cell lung cancer patients with EGFR mutations during EGFR-tyrosine kinase inhibitor therapy:developing criteria to continue therapy beyond RECIST progression[J].Cancer,2013,119(21):3761-3768.
[收稿2016-11-11 修回2016-12-01]
(编辑 许四平)
10.3969/j.issn.1000-484X.2017.06.031
①本文受国家自然科学基金面上项目(81472843)和上海市科学技术委员会上海市科研计划项目(14ZR1424700)资助。
王巧红(1993年-),女,在读硕士,主要从事妇科恶性肿瘤临床与基础研究,E-mail:wqh930814@126.com。
及指导教师:吴 霞(1973年-),女,博士,副主任医师,副教授,硕士生导师,主要从事妇科恶性肿瘤临床与基础研究,E-mail:wuxia1225@aliyun.com。
R711.75
A
1000-484X(2017)06-0951-04

