颗粒蛋白前体在高脂饮食诱导的肥胖PCOS大鼠卵巢中的表达
李赛姣,周丹妮,李维,尹太郎,杨菁
(武汉大学人民医院生殖医学中心,湖北省辅助生育与胚胎发育医学临床研究中心,武汉 430060)
·实验研究·
颗粒蛋白前体在高脂饮食诱导的肥胖PCOS大鼠卵巢中的表达
李赛姣,周丹妮,李维,尹太郎,杨菁*
(武汉大学人民医院生殖医学中心,湖北省辅助生育与胚胎发育医学临床研究中心,武汉 430060)
目的研究颗粒蛋白前体(PGRN)在肥胖PCOS大鼠卵巢中的表达情况,初步探讨PGRN在PCOS发病中的作用。方法选择SPF级23日龄SD雌性大鼠38只,使用随机数字表随机分为3组:正常对照组(n=8)、PCOS组(DHEA组,n=15)及肥胖PCOS组(DHEA+HFD组,n=15)。采用脱氢表雄酮联合高脂饲料(DHEA+HFD)诱导肥胖PCOS大鼠。HE染色光镜下观察PCOS大鼠卵巢的病理结构改变。酶联免疫吸附法测定血清睾酮(T)、雌二醇(E2)及空腹血糖(FBG)、空腹胰岛素(FINS)含量等,比较各组间的水平差异。采用免疫组织化学法检测各组卵巢PGRN的表达水平及分布情况。结果造模结束时,DHEA+HFD组体重显著高于对照组(P<0.01)及DHEA组(P<0.05)。DHEA组及DHEA+HFD组的FINS、稳态模型评估的胰岛素抵抗指数(HOMA-IR)均显著高于对照组(P<0.05)。DHEA组及DHEA+HFD组的睾酮(T)、FSH水平均显著升高(P<0.01)。DHEA组及DHEA+HFD组卵巢组织光镜下均表现出典型的多囊样改变。免疫组化结果显示各组大鼠卵巢中均可见PGRN蛋白表达,主要分布于卵泡的颗粒细胞层及黄体;DHEA组PGRN表达水平显著高于对照组(P<0.01),DHEA+HFD组PGRN表达水平显著高于DHEA组及对照组(P<0.01)。结论PGRN在卵巢颗粒细胞层有表达。其在PCOS大鼠和肥胖PCOS大鼠卵巢组织中的差异性表达,提示PGRN可能通过作用于局部卵泡微环境,参与PCOS肥胖及慢性代谢性炎症的发生。
多囊卵巢综合征; 颗粒细胞; 颗粒蛋白前体
(JReprodMed2017,26(9):921-926)
多囊卵巢综合征(PCOS)是育龄期妇女最常见的内分泌和代谢性紊乱的慢性疾病,是导致女性不孕的主要原因之一。PCOS发病率在生育期妇女中高达5%~10%[1-2],是一种高度异质、病因复杂的内分泌、代谢紊乱性疾病,常伴随肥胖、代谢紊乱及心血管疾病特征[3-4],其发病机制不明,目前慢性炎症学说已成为研究的热点。但PCOS代谢性炎症形成的机制未明,炎症信号通路活性改变可能是PCOS发病机制之一。
颗粒蛋白前体(PGRN)是参与人体炎症和免疫反应的一种重要分泌蛋白。近年国内外多项研究发现PGRN是一种重要的调控葡萄糖代谢和胰岛素敏感性的炎症因子,与代谢综合征、胰岛素抵抗(IR)以及炎症反应密切相关[5-6,7]。研究显示,PGRN对肥胖和IR的糖尿病具有促炎效果,被发现是一个关键的脂肪因子,可以调节高脂饮食诱导的IR[5]。PGRN在女性子宫腺上皮及卵巢滤泡上皮细胞中均有表达[8]。新的研究证实,PCOS患者与年龄、体重匹配的对照组相比PGRN表达水平显著升高,PGRN与血清高密度脂蛋白胆固醇HDL-C水平显著相关,提示PGRN可能是PCOS患者心血管疾病的生物标记物[9]。然而PGRN在PCOS患者卵巢中表达的研究目前仍为空白。考虑到肥胖是PCOS妇女常见的表现,约35%~50%的患者有肥胖[10],本实验中以脱氢表雄酮(DHEA)联合高脂饲料(HFD)诱导肥胖PCOS大鼠,在成功建模的基础上,检测PGRN表达水平;并进一步解释PCOS的病理生理改变,初步探讨PCOS肥胖大鼠卵巢上PGRN的表达差异。
材料与方法
一、材料
1.实验动物:SPF级21日龄SD雌性大鼠38只,购自武汉大学实验动物中心。自21 d龄开始断奶,标准颗粒饲料喂养,自由进食、饮水适应性喂养2日后,进行随机分组。
2.药物及试剂:兔抗大鼠PGRN单克隆抗体购自美国Abcam公司;DHEA购自湖北芳通药业;免疫组化染色试剂盒、甲醛及多聚赖氨酸处理的硅化玻片均购自武汉博士德公司;胰岛素放免法试剂盒(批内变异系数<10%;批间变异系数<15%)、性激素酶联免疫分析试剂盒为美国R&D公司产品;苯巴比妥钠购自北京索莱宝公司;高脂饲料购自上海斯莱克实验动物公司,成分为:54.2%标准饮食,16.8%猪油,15%蔗糖,9%酪蛋白,1%无机物,1%维生素和3%麦芽糊精。其他试剂均为国产分析纯。
二、方法
1.动物分组及建模:按随机数字表将23日龄大鼠38只随机分为3组:正常对照组、PCOS组及肥胖PCOS组。
对照组(n=8):给予标准饮食(52%碳水化合物,22.1%蛋白质,9.2%水,5.28%脂肪,4.12%纤维素,4.22%矿物盐)和注射用蓖麻油0.2 ml每日皮下注射。PCOS组(DHEA组,n=15):给予标准饮食,每日给予皮下注射DHEA 6 mg/100 g/d的剂量(溶于0.2 ml注射用蓖麻油),连续3周。肥胖PCOS组(DHEA+HFD组,n=15):每日给予皮下注射DHEA 6 mg/100 g/d的剂量(溶于0.2 ml注射用蓖麻油),连续3周,同时给予高脂饮食。每周称量大鼠体重,实验药物剂量进行相应调整。3周以后,隔夜禁食的大鼠用苯巴比妥钠(120 mg/kg)皮下注射麻醉,取大鼠下腔静脉血,3 000 r/min,离心3 min,收集血清,-20℃保存测量血液样本。切除双侧卵巢,小心修剪脂肪组织,4%多聚甲醛固定作光镜HE染色。
2.血清性激素及胰岛素的检测:血清激素水平的测定采用化学免疫发光法,包括血清空腹血糖(FPS)、雌二醇(E2)、睾酮(T)、卵泡刺激素(FSH)及黄体生成素(LH),空腹胰岛素(FINS)水平测定采用放免法。稳态模型评估的胰岛素抵抗指数(HOMA-IR)计算公式为FINS(mU/L)×FBG(mmol/L)/22.5。
3.光镜标本制作:取卵巢组织迅速置入10%中性甲醛中固定,以卵巢最大平面为待检测面,进行常规石蜡包埋,连续切片(4 μm厚),粘贴于涂有多聚赖氨酸的清洁载玻片上,按照每隔20张取1张的方法,制备切片。烤片后,室温无尘保存,切片用于HE染色观察卵巢的病理结构。
4.卵巢PGRN蛋白的表达检测:取出卵巢组织固定于10%的甲醛溶液中。将石蜡包埋标本制成常规切片,采用免疫组织化学SABC法。操作按试剂盒说明进行。切片脱蜡至水后,95℃水浴中抗原修复,加入1:200稀释的一抗。依次加二抗、三抗作用,DAB显色,苏木素复染,二甲苯透明,中性树胶封片。以已知阳性片作为阳性对照,用PBS代替一抗作为阴性对照。
三、统计学分析
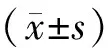
结 果
一、各组体重增长情况
各组大鼠实验前体重比较无显著性差异(P>0.05)。造模结束时,DHEA组大鼠体重显著高于对照组(P<0.05),DHEA+HFD组大鼠体重显著高于对照组(P<0.01)及DHEA组(P<0.05)(图1)。

注:与对照组比较,*P<0.05,**P<0.01;与DHEA组比较,# P<0.05图1 三组大鼠体重增长曲线图
二、各组FPS、胰岛素检测结果比较
与对照组相比,DHEA组和DHEA+HFD组的FINS水平、HOMA-IR均显著升高(P<0.05),DHEA组与DHEA+HFD组间则无显著性差异(P>0.05);3组的FPS比较无显著性差异(P>0.05)(表1)。
三、血清激素水平比较
与对照组相比,DHEA组及DHEA+HFD组的T、FSH水平均显著升高(P<0.01),证实经过DHEA处理的大鼠均存在高雄激素血症。而各组的E2、LH水平均无显著性差异(P>0.05)(表2)。

表1 三组大鼠血清FINS、FPS水平及HOMA-IR比较 (-±s)
注:与对照组比较,*P<0.05

表2 三组大鼠血清性激素浓度比较(-±s)
注:与对照组比较,*P<0.01
四、卵巢病理结构光镜观察情况
光学显微镜观察显示,对照组(图2A)中显示正常卵巢结构,可见不同发育阶段的卵泡及黄体,未见明显囊性扩张卵泡,卵泡有8~9层的颗粒细胞,明显多于DHEA组及DHEA+HFD组。DHEA组及DHEA+HFD组(图2B、C)中卵巢均较对照组增大,光镜下可见卵巢多个囊性扩张卵泡,颗粒细胞层厚约2~3层。
五、PGRN在卵巢中的表达
免疫组化法分析PGRN在卵巢中的定位及表达。PGRN阳性表达主要为棕黄色颗粒沉着。由图3可见,PGRN主要分布于卵泡的颗粒细胞层及黄体。PGRN蛋白在各组大鼠卵巢始基卵泡、窦前卵泡及窦状卵泡的卵母细胞、颗粒细胞上均有强阳性表达,各级别卵泡膜细胞层均为弱阳性表达。

A:对照组;B:DHEA组;C:DHEA+HFD组图2 三组大鼠卵巢组织形态学分析(HE染色,×100)

A:对照组;B:DHEA组;C:DHEA+HFD组图3 三组大鼠卵巢组织PGRN蛋白的表达(免疫组化染色,×100)
统计学分析各组卵泡颗粒细胞层及膜细胞层PGRN表达差异:各组膜细胞层中PGRN表达水平比较无显著性差异(P>0.05);颗粒细胞层中,DHEA组PGRN表达水平显著高于对照组(P<0.01),DHEA+HFD组PGRN表达水平显著高于DHEA组及对照组(P<0.01)(表3)。

表3 三组大鼠卵巢组织PGRN表达水平比较(以平均光密度表示)(-±s)
注:与对照组比较,*P<0.01;与DHEA组比较,#P<0.01
讨 论
PGRN由于其在肿瘤的发生发展过程中的关键作用,目前已成为多种肿瘤研究的热点,而炎症方面的研究刚刚起步。目前的研究证实PGRN与多种脂肪炎性因子密切相关,近年来,Matsubara等[5]研究表明PGRN是一种关键的脂肪因子,能够调节高脂饮食诱导的IR。Youn等[11]的研究发现人血清中的PGRN水平与炎症标记物C反应蛋白(CRP)以及糖化血红蛋白相关,且与单核细胞趋化因子1(MCP-1)类似,能参与到脂肪组织巨噬细胞的浸润,提示PGRN是一种新的慢性炎性反应标志物。
肥胖是PCOS妇女常见的表现[12],脂肪细胞能够分泌多种脂肪炎性因子如肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)等影响全身的代谢状态,从而导致系统性的、代谢激活的慢性低度炎症,称之为代谢性炎症。这种炎症状态会影响能量储存及转化的代谢器官如肝脏、脂肪、骨骼肌等,导致IR等系统性代谢紊乱[10]。目前越来越多的证据支持PCOS是一种慢性炎性疾病,PCOS患者血清中炎症因子如IL-6、TNF-α以及MCP-1等的水平升高,而抗炎症因子如脂联素水平下降[13-15],提示PCOS患者体内存在代谢性炎症。PCOS卵巢局部亦存在炎症反应[16],研究显示TNF-α、IL-6和IL-1在PCOS患者壁层颗粒细胞[17]以及PCOS大鼠模型卵巢组织的表达水平均升高[18]。PGRN作为一种脂肪炎性因子,在本实验中亦被证实高表达于PCOS大鼠卵巢颗粒细胞层,进一步证实卵巢局部存在的炎症反应。
高脂饮食能够引起动物及人群的肥胖,导致与肥胖相关的代谢紊乱症状,增加炎症细胞的浸润及炎性反应的标记物表达,诱导肝脏的IR[19-20]。在本研究结束时,DHEA+HFD组体重显著高于DHEA组(P<0.05),且HOMA-IR指数显著高于对照组(P<0.05),提示HFD能有效诱导大鼠肥胖,并表现为IR。因此,用高脂饮食诱导的PCOS肥胖大鼠模型能很好的研究PCOS患者肥胖、IR及其相关代谢疾病的发生机制,对于PCOS肥胖、IR及2型糖尿病的预防和治疗能够提供较好的模型。
本研究中,DHEA组及DHEA+HFD组的大鼠PGRN表达增加,提示PGRN在PCOS大鼠中的表达增加;体重高的DHEA+HFD组大鼠PGRN表达水平较DHEA组高,提示肥胖能够使PGRN的表达增加。既往研究亦证实,高脂饮食诱导的肥胖小鼠PGRN表达增加[5]。瞿华等[21]研究亦证实血浆PGRN水平在2型糖尿病及肥胖患者体内均升高,且其水平与糖脂代谢紊乱、肥胖、IR及炎症的程度密切相关。其可能的机制为,高脂饮食导致肥胖产生,PCOS患者脂肪细胞增大、坏死,释放的脂肪细胞因子从血液中招募巨噬细胞[22]。同时肥胖能够激活炎症信号通路,增加炎症因子包括PGRN的表达。
本实验首次证实PGRN表达于卵巢颗粒细胞层,并且PCOS大鼠PGRN蛋白的表达明显增高,而肥胖的PCOS大鼠卵巢颗粒细胞中PGRN又显著高于正常体重的PCOS大鼠,提示了肥胖与卵巢局部炎症的关系;PGRN在各组卵巢中的差异性表达,提示PGRN可能通过作用于卵巢局部卵泡微环境,参与PCOS肥胖及慢性代谢性炎症的发生,其具体相关性及机制需进一步的研究探讨。
[1] Goodarzi MO,Azziz R.Diagnosis,epidemiology,and genetics of the polycystic ovary syndrome[J].Best Pract Res Clin Endoerinol Metab,2006,20:193-205.
[2] Azziz R,Woods KS,Reyna R,et al.The prevalence and features of the polycystic ovary syndrome in an unselected population[J].J Clin Endocrinol Metab,2004,89:2745-2749.
[3] Legro RS,Castracane VD,Kauffman RP.Detecting insulin resistance in polycystic ovary syndrome:purposes and pitfalls[J].Obstet Gynecol Surv,2004,59:141-154.
[4] 李赛姣,李维,周丹妮,等.ATP合酶β亚单位在PCOS伴2型糖尿病大鼠胰岛中的表达[J].生殖医学杂志,2017,26:64-69.
[5] Matsubara T,Mita A,Minami K,et al.PGRN is a key adipokine mediating high fat diet-induced insulin resistance and obesity through IL-6 in adipose tissue[J].Cell Metab,2012,15:38-50.
[6] Yoo HJ,Hwang SY,Hong HC,et al.Implication of progranulin and C1q/TNF-related protein-3 (CTRP3) on inflammation and atherosclerosis in subjects with or without metabolic syndrome[J/OL].PLoS One,2013,8:e55744.
[7] 李赛姣,杨菁.颗粒蛋白前体在生殖医学中的研究进展[J].中华临床医师杂志(电子版),2016,10:3798-3801.
[8] Daniel R,He Z,Carmichael KP,et al.Cellular localization of gene expression for progranulin[J].J Histochem Cytochem,2000,48:999-1009.
[9] Ersoy AO,Tokmak A,Ozler S,et al.Are progranulin levels associated with polycystic ovary syndrome and its possible metabolic effects in adolescents and young women?[J].Arch Gynecol Obstet,2016,294:403-409.
[10] González F,Rote NS,Minium J,et al.Evidence of proatherogenic inflammation in polycystic ovary syndrome[J].Metabolism,2009,58:954-962.
[11] Youn BS,Bang SI,Klöting N,et al.Serum progranulin concentrations may be associated with macrophage infiltration into omental adipose tissue[J].Diabetes,2009,58:627-636.
[12] 蔡志明,李蓉,卢丽华,等.胰岛素抵抗与多囊卵巢综合征[J].生殖医学杂志,2005,14:189-192.
[13] Toulis KA,Goulis DG,Farmakiotis D,et al.Adiponectin levels in women with polycystic ovary syndrome:a systematic review and a meta-analysis [J].Hum Reprod Update,2009,15:297-307.
[14] 王汝琴,陈倩,陈晓军,等.炎症标志物血清降钙素原和超敏C反应蛋白与多囊卵巢综合征相关因素研究[J].生殖医学杂志,2015,24:357-362.
[15] Qiao J,Feng HL.Extra-and intra-ovarian factors in polycystic ovary syndrome:impact on oocyte maturation and embryo developmental competence[J].Hum Reprod Update,2011,17:17-33.
[16] 吴庚香,杨菁,尹太郎,等.PCOS及PCOS伴2型糖尿病大鼠卵巢热休克蛋白70的研究[J].生殖医学杂志,2015,24:311-315.
[17] Zhao Y,Zhang C,Huang Y,et al.Up-regulated expression of WNT5a increases inflammation and oxidative stress via PI3K/Akt/NF-κB signaling in the granulosa cells of PCOS patients[J].J Clin Endocrinol Metab,2015,100:201-211.
[18] Wang Z,Zhai D,Zhang D,et al.Quercetin decreases insulin resistance in a polycystic ovary syndrome rat model by improving inflammatory microenvironment[J].Reprod Sci,2017,24:682-690.
[19] Minassian C,Tarpin S,Mithieux G.Role of glucose-6 phosphatase,glucokinase,and glucose-6 phosphate in liver insulin resistance and its correction by metformin[J].Biochem Pharmacol,1998,55:1213-1219.
[20] Zhai HL,Wu H,Xu H,et al.Trace glucose and lipid metabolism in high androgen and high-fat diet induced polycystic ovary syndrome rats[J].Reprod Biol Endocrinol,2012,10:5.
[21] 瞿华,邓华聪,胡振平,等.2型糖尿病及肥胖患者血浆颗粒蛋白前体水平及其与胰岛素抵抗的关系[J].中华内分泌代谢杂志,2013,29:570-574.
[22] Cortón M,Botella-Carretero JI,Benguría A,et al.Differential gene expression profile in omental adipose tissue in women with polycystic ovary syndrome[J].J Clin Endocrinol Metab,2007,92:328-337.
[编辑:侯丽]
Expressionofprogranulininovaryinhighdietinducedoverweightratswithpolycysticovarysyndrome
LI Sai-jiao,ZHOU Dan-ni,LI Wei,YIN Tai-lang,YANG Jing*
ReproductiveMedicalCenter,HubeiClinicResearchCenterforAssistedReproductiveTechnologyandEmbryonicDevelopment,RenminHospitalofWuhanUniversity,Wuhan430060
Objective: To investigate the expression of progranulin (PGRN) in ovary in high diet induced overweight rats with polycystic ovary syndrome (PCOS).
Methods: Thirty eight rats aged 23 days were divided into three groups:normal control group (n=8),DHEA group (n=15) and overweight PCOS group (DHEA+HFD,n=15).The overweight PCOS female rats were induced by dehydroepiandrosterone combined with high fat diet (DHEA+HFD).The pathological changes of ovary of PCOS rats were observed by HE staining.Serum levels of testosterone (T),estradiol (E2) and fasting blood glucose (FBG),fasting insulin (FINS) were measured by enzyme-linked immunosorbent assay.The expression level and distribution of PGRN in ovaries were detected by immunohistochemistry.
Results: The weight of DHEA+HFD group was significantly higher than that of control group (P<0.01) and DHEA group (P<0.05).The HOMA-IR in DHEA+HFD group and DHEA group was significantly higher than that in control group (P<0.05).The ovaries of rats modeled by DHEA in two groups showed typical polycystic changes.Additionally,the expression of PGRN in granulose cell layer was significantly up-regulated in DHEA and DHEA+HFD groups compared with control group (P<0.01),and the PGRN expression in DHEA+HFD group was significantly higher than DHEA group (P<0.01).
Conclusions: The expression of PGRN is up-regulated in the granulosa cells of the PCOS rats.Obesity can further induce PGRN up-regulated in the granulosa cells of PCOS rats.It indicates that the differential expression of PGRN may be related to the pathogenesis of PCOS obesity and chronic inflammation.
Polycystic ovarian syndrome; Granulosa cell; Progranulin
10.3969/j.issn.1004-3845.2017.09.013
2017-03-21;
2017-04-20
中央高校青年教师资助项目(2042016kf0086);默克雪兰诺生殖医学基金(MerckSerono_CREATE-2016141)
李赛姣,女,云南玉溪人,博士,主治医师,生殖医学专业.(*
)

