雌激素-雌激素受体信号通路对趋化因子的调控作用研究进展
许莹萍,王菲菲,李大金,王凌*
(1.复旦大学附属妇产科医院,上海 200011;2.复旦大学上海医学院附属妇产科医院研究所,上海 200011;3.复旦大学中西医结合研究院,上海 200011;4.上海市女性生殖内分泌相关疾病重点实验室,上海 200011)
·综述·
雌激素-雌激素受体信号通路对趋化因子的调控作用研究进展
许莹萍1,2,3,4,王菲菲1,2,3,4,李大金1,2,3,王凌1,2,3,4*
(1.复旦大学附属妇产科医院,上海 200011;2.复旦大学上海医学院附属妇产科医院研究所,上海 200011;3.复旦大学中西医结合研究院,上海 200011;4.上海市女性生殖内分泌相关疾病重点实验室,上海 200011)
雌激素参与机体多项生理、病理调节机制,在机体稳态中发挥不可或缺的作用。趋化因子作为低分子量趋化性细胞因子超家族的一员,活跃于机体各个系统的调节,并且其自身的表达也受到了全身各系统的调控,如内分泌系统的性甾体类固醇激素等。本文对雌激素-雌激素受体信号通路对趋化因子的调控及其机制作一综述。
雌激素; 雌激素受体; 趋化因子
(JReprodMed2017,26(9):940-945)
雌激素(Estrogen)不仅促进女性第二性征的发育,建立并维持生殖功能,并且可以调控细胞生长、分裂、发育和分化等多种生理过程[1]。绝经前,雌激素主要由卵巢分泌;绝经后,性腺外器官如乳腺、大脑和脂肪等组织细胞中,细胞色素P450芳香化酶转化睾酮与雄烯二酮生成雌二醇和雌酮。雌激素在男性和女性各项生理、病理机能调节中发挥至关重要的作用。近来越来越多的研究显示,趋化因子受雌激素调控并在相关疾病的发生、发展、转归中扮演重要角色,因此,深入研究雌激素-雌激素受体(ER)信号通路对趋化因子调控机制将有助于我们更深入地探索疾病本质,有望改善目前受科学局限的疾病治疗方案。
一、ER及其介导的信号通路
1.ER:雌激素各种功能的发挥主要通过与细胞内的ER结合实现。ERs包括ERα、ERβ和G蛋白偶联雌激素受体-1(GPER-1)。ERα主要表达于生殖系统、乳腺、肾脏、骨、白色脂肪组织和肝脏等;ERβ主要表达于卵巢、中枢神经系统、心血管系统和免疫系统等[2];ERα和ERβ是核受体蛋白家族成员,主要位于细胞核,少量位于细胞质和线粒体。GPER-1存在于细胞膜,属于G蛋白偶联受体超家族,在雌激素调节机体免疫系统、神经系统、泌尿系统、循环系统和生殖系统中均发挥重要作用[3]。ER信号异常会导致各种疾病发生,如代谢性疾病、心血管疾病、神经退行性变、骨质疏松[4],甚至癌症。
2.ER介导的信号通路:ER介导的信号通路大致可以分为4条[5],即直接基因信号通路、间接基因信号通路、配体非依赖的信号通路和非基因信号通路。(1)直接信号通路:经典信号通路,E2与ER结合后形成复合体与细胞核DNA上雌激素反应元件(ERE)直接结合。ERE定位在目的基因启动子附近,从而调控基因的表达。(2)间接基因信号通路:E2与ER复合物并不直接结合DNA,而是结合细胞核DNA相关反应元件上其他转录因子,通过蛋白间相互作用,间接调控目的基因表达。(3)配体非依赖的信号通路:不需要E2刺激,通过ER残基磷酸化或相应共调节分子激活ER。(4)非基因信号通路[6]:E2与细胞膜ER结合,激活胞内蛋白-激酶级联反应,通过转录因子磷酸化,间接调控基因表达。
ERα和ERβ主要通过直接、间接、配体非依赖的基因信号通路调控目的基因表达,而GPER-1主要通过激活各种蛋白激酶级联而发挥作用。GPER-1能激活丝裂原激活蛋白激酶(MAPK)[7]、磷脂酰肌醇-3-激酶(PI3K),刺激腺苷酸环化酶,动员细胞内钙离子,还参与基因表达调控,如上调FOS基因和结缔组织生长因子(CTGF)基因表达[8]。雌激素与GPER-1结合,激活Gs蛋白,上调胞内环腺苷酸(cAMP),介导胞内钙离子转移,激活PI3K信号通路[9]。GPER-1还通过激活金属蛋白酶增加表皮生长因子(EGF)水平,上调表皮生长因子受体(EGFR)表达,激活胞外信号调节激酶1/2(ERK1/2)[10]。某些转录因子恰好是此类通路的磷酸化靶点,从而将非基因组信号通路与基因组信号通路联系在一起[9-10]。
二、趋化因子与趋化因子受体
在脊椎动物免疫系统中,趋化因子系统包含了50多种配体以及20种专属受体,主要功能是在生理和病理情况下调控白细胞迁移。该系统具有复杂的调节网络,通常一种白细胞可受到多种不同趋化因子调控,并且大多数趋化因子可与不止一种趋化因子受体相互结合[11],呈现“多对多”而非“一一对应”的调控关系。
趋化因子属于细胞因子超家族,根据蛋白质氨基末端上4个半胱氨酸位置的不同,分为C趋化因子、CC趋化因子、CXC趋化因子、CX3C趋化因子4个亚家族。趋化因子不仅能诱导靶细胞趋向运动[12],还在机体细胞活化、增殖、分化、免疫耐受、骨髓造血、血管生成、细胞代谢等方面发挥重要作用[13]。
趋化因子受体包括传统G蛋白偶联受体(GPCRs)和非典型性趋化因子受体(ACKRs)。大部分趋化因子受体属于传统GPCR,通过偶联G蛋白转导胞内信号[11]。GPCRs据其识别的趋化因子亚群相应分为XCR、CCR、CXCR、CX3CR等4个亚群[14]。ACKRs结构类似GPCRs但不偶联G蛋白,不传导信号。确切地说,ACKRs并不直接促进细胞迁移,而是通过将趋化因子内化、清除,形成化学浓度梯度而发挥作用[15],因此它被看作趋化因子网络的关键调控分子[16]。
三、雌激素-ER信号通路调控趋化因子表达
1.C趋化因子:研究表明ERα阴性乳腺癌患者对激素治疗反应不佳,预后不良。表观遗传学因素(DNA甲基化和组蛋白去乙酰化)是ER基因沉默的常见原因,而5-氮-2’脱氧胞苷(AZA)和曲古抑菌素A(TSA)可使ER mRNA及其功能蛋白协同再表达。Keen等[17]研究证实淋巴细胞趋化因子(XCL1)和蛋白磷酸酯酶2A(PP2A)基因表达与ER有关,当AZA、TSA、ER拮抗剂(ICI 182 780)存在时,XCL1表达下降,而PP2A表达无变化,提示PP2A可能是影响ER表达的上游因子,而XCL1位于ER基因下游,受ER表达影响。综上,AZA、TSA通过抑制DNA甲基化和组蛋白去乙酰化使ER基因再表达,ER结合ICI 182 780降低XCL1表达,从而在乳腺癌的治疗中发挥重要作用。
2.CC趋化因子:雌激素具有免疫调节功能,在不同组织细胞中发挥不同作用。研究发现,雌激素可调控脾细胞、淋巴细胞的趋化因子分泌,促进小鼠活化脾细胞分泌MCP-1(CCL2)、MCP-3(CCL7)等多种趋化因子[18]。雌激素还可下调小鼠乳腺组织趋化因子MIP-1α和MCP-1/JE水平促乳腺癌细胞生长[19],下调小鼠单核细胞表面CCR2表达,降低对MCP-1/JE趋化活性,抑制免疫监视功能[20]。除此外,雌激素还抑制BALB/c鼠子宫腺上皮细胞CCL20分泌[21],促进小鼠子宫组织细胞MEC/CCL28表达,引导分泌IgA抗体的CCR10(+)细胞(ASCs)由鼻粘膜迁移到子宫,生殖道免疫屏障组成[22]。研究表明,雌激素还可使胶原诱导性关节炎模型小鼠淋巴结中Th17细胞上CCR6及CCL20表达增高,减少关节中Th17细胞数量,缓解关节炎症[23]。
选择性ER调节剂(SERM)减少实验性自身免疫性脑脊髓炎小鼠模型上反应性星形胶质细胞CCL20表达,抑制CCL20促Th17细胞迁移功能,有望作为一种治疗自身免疫性脑脊髓炎的方法[24]。在人体中,雌激素可以下调人冠状动脉内皮细胞(HCAEC)MCP-1水平减少巨噬细胞募集,减少单核细胞U937细胞中CCR2表达,降低单核细胞对受损内皮细胞的粘附,缓解动脉粥样硬化症状[25-26],并可以抑制受损的人脐静脉内皮细胞(HUVEC)的MCP-1分泌[26]。总体来说,雌激素对趋化因子的特异性调控与机体的生理、病理机能关系密切,但在不同组织细胞中,雌激素对CC趋化因子家族成员表达具有不同的调控作用。
3.CXC趋化因子:研究显示,雌激素和EGF可以显著促进人乳腺癌MCF-7细胞中血管生成趋化因子CXCL8的释放,体外共培养实验中联合使用雌激素与EGF引起的CXCL8释放量是单用雌激素或EGF的两倍[27]。新鲜分离和体外培养分化24 h的小鼠子宫腺上皮细胞中,E2可以增加KGF诱导的CXCL1表达[20]。体内实验中,雌激素调控去势BALB/c小鼠生殖系统中CXCL1分泌量,且这一作用可直接被ERα拮抗剂阻断[28]。雌激素可抑制Foxp3-/-EAE小鼠CCL2、CXCL2表达,减少脾脏和淋巴结T细胞CCR6表达,增加B细胞和树突细中CXCL13分泌和CXCR5表达[29]。与BALB/c小鼠相比,Theiler’s鼠脑脊髓炎病毒(TMEV)可以上调敏感品系小鼠(SJL/J)星形胶质细胞CXCL10(IP-10)表达,而17β-E2或SERM可与星形胶质细胞上ERα结合抑制该过程[30]。雌激素对趋化因子的调控在疾病的发生、发展、转归中扮演重要角色,因此,深入研究雌激素-ER信号通路对趋化因子调控机制将有助于我们进一步了解疾病发生机制,寻求新的治疗方法。
4.CX3C趋化因子:雌激素亦能调控CX3C趋化因子的表达。Nii等[31]研究感染性支气管炎(IB)病毒感染早期的母鸡输卵管细胞,发现雌激素能上调输卵管细胞CX3CL1、CXCL12和干扰素-γ(IFN-γ)表达。还有研究表明,染料木黄酮(Genistein,雌激素样活性的多酚非甾体类异黄酮)强烈抑制TNF-α诱导的单核细胞上CX3CR1表达以及HUVEC上曲动蛋白(Fractalkine)的表达[32]。
雌激素-ER信号通路对趋化因子及其受体家族的表达具有多重、复杂的调控作用,而且在不同组织细胞、不同状态下,其具体作用有所不同。因此,我们绘制表1,对趋化因子、趋化因子受体,及其在不同组织细胞中受雌激素的不同调控作用一一列出,旨在更加直观地呈现雌激素-ER信号通路对趋化因子及其受体家族的调控作用。
四、雌激素调控趋化因子的机制
雌激素、ER、趋化因子之间关系密切。E2与脾内皮细胞共培养可以使脾内皮细胞ERα数量增加,ERβ数量下降,但相同条件下E2使真皮血管内皮细胞ERα和ERβ均下降;如果将脾内皮细胞与他莫昔芬(一种ER拮抗剂)或ICI 182 780共培养,会消除E2介导产生的脾趋化因子效应,说明雌激素通过作用于ER选择性调节趋化因子[17]。雷洛昔芬是一种SERM,可以降低星形胶质细胞CCL20产生,缓解EAE。ER拮抗剂ICI 182 780可以抵消雷洛昔芬的作用,同时雷洛昔芬抑制IL-1β诱导的NF-κB活化(p65磷酸化),说明雷洛昔芬是通过ER和NF-κB通路调控CCL20[20,23]。Haim等[27]提出,雌激素通过ERα上调乳腺癌细胞中血管生成相关趋化因子CXCL8的转录和分泌。曲动蛋白是促炎因子激活的血管内皮细胞趋化分子,其受体CX3CR1表达于单核细胞。曲动蛋白与CX3CR1相互作用对单核渗出具有重要作用。染料木黄酮具有雌激素样活性,可与ER结合。有报道称染料木黄酮可降低TNF-α诱导的内皮细胞上曲动蛋白的表达,发挥治疗血管炎症损伤的作用[32]。研究表明,雌激素还可以通过ERβ/NO/NF-κB通路下调损伤的HUVECs中MCP-1的生成以及粘附分子的表达,对动脉粥样硬化起到一定的防治作用[33]。因此,雌激素主要通过ERα、ERβ、NF-κB通路调控趋化因子的表达,影响细胞与组织的生物学功能,从而调节机体多项生命活动。
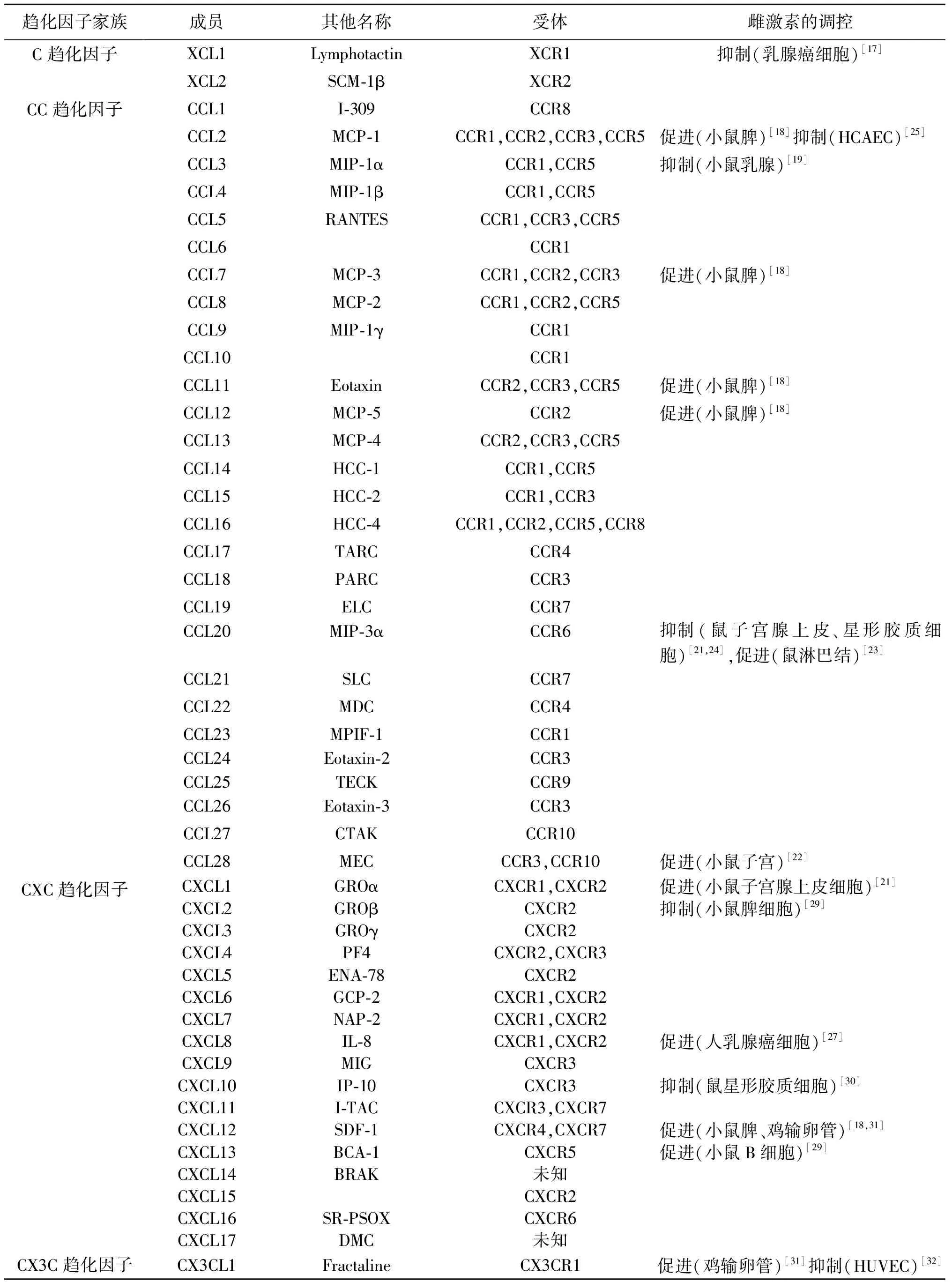
表1 趋化因子种类及其相应受体
五、总结
综上所述,趋化因子在雌激素调控机体各项生理、病理活动方面都发挥重要作用,研究雌激素-ER信号通路对趋化因子的调控能更好地帮助我们深入理解生命科学的各种调节机制,以期发现疾病更多新的靶点。
[1] Jia M,Dahlman-Wright K,Gustafsson JÅ.Estrogen receptor alpha and beta in health and disease[J].Best Pract Res Clin Endocrinol Metab,2015,29:557-568.
[2] Kim MJ,Kim TH,Lee HH.G-protein coupled estrogen receptor (GPER/GPR30) and women's health[J].J Menopausal Med,2015,21:79-81.
[3] Prossnitz ER,Barton M.The G-protein-coupled estrogen receptor GPER in health and disease[J].Nat Rev Endocrinol,2011,7:715-726.
[4] 王亚平,陈蓉,林守清,等.观察低雌激素闭经患者骨密度情况及性激素治疗对其骨密度的影响[J].生殖医学杂志,2014,23:351-355.
[5] D’Amelio P.The immune system and postmenopausal osteoporosis[J].Immunol Invest,2013,42:544-554.
[6] Vrtaĉnik P,Ostanek B,Mencej-Bedraĉ S,et al.The many faces of estrogen signaling[J].Biochem Med (Zagreb),2014,24:329-342.
[7] Pupo M,Maggiolini M,Musti AM.GPER Mediates Non-Genomic Effects of Estrogen[J].Methods Mol Biol,2016,1366:471-488.
[8] Cygankiewicz AI,Jacenik D,Krajewska WM.GPER receptor-the new player in estrogen signaling[J].Postepy Biochem,2015,61:52-60.
[9] Filardo EJ,Thomas P.GPR30:a seven-transmembrane-spanning estrogen receptor that triggers EGF release[J].Trends Endocrinol Metab,2005,16:362-367.
[10] Prossnitz ER,Arterburn JB,Smith HO,et al.Estrogen signaling through the transmembrane G protein-coupled receptor GPR30[J].Annu Rev Physiol,2008,70:165-190.
[11] Vacchini A,Locati M,Borroni EM.Overview and potential unifying themes of the atypical chemokine receptor family[J].J Leukoc Biol,2016,99:883-892.
[12] Antonelli A,Ferrari SM,Ruffilli I,et al.Cytokines and HCV-related autoimmune disorders[J].Immunol Res,2014,60:311-319.
[13] Szekanecz Z,Kim J,Koch AE.Chemokines and chemokine receptors in rheumatoid arthritis[J].Semin Immunol,2003,15:15-21.
[14] Zlotnik A,Yoshie O.The chemokine superfamily revisited[J].Immunity,2012,36:705-716.
[15] Bonecchi R,Savino B,Borroni EM,et al.Chemokine decoy receptors:structure-function and biological properties[J].Curr Top Microbiol Immunol,2010,341:15-36.
[16] Nibbs RJ,Graham GJ.Immune regulation by atypical chemokine receptors[J].Nat Rev Immunol,2013,13:815-829.
[17] Keen JC,Garrett-Mayer E,Pettit C,et al.Epigenetic regulation of protein phosphatase 2A (PP2A),lymphotactin (XCL1) and estrogen receptor alpha (ER) expression in human breast cancer cells[J].Cancer Biol Ther,2004,3:1304-1312.
[18] Lengi AJ,Phillips RA,Karpuzoglu E,et al.Estrogen selectively regulates chemokines in murine splenocytes[J].J Leukoc Biol,2007,81:1065-1074.
[19] Fanti P,Nazareth M,Bucelli R,et al.Estrogen decreases chemokine levels in murine mammary tissue:implications for the regulatory role of MIP-1 alpha and MCP-1/JE in mammary tumor formation[J].Endocrine,2003,22:161-167.
[20] Janis K,Hoeltke J,Nazareth M,et al.Estrogen decreases expression of chemokine receptors,and suppresses chemokine bioactivity in murine monocytes[J].Am J Reprod Immunol,2004,51:22-31.
[21] Haddad SN,Wira CR.Estradiol regulation of constitutive and keratinocyte growth factor-induced CCL20 and CXCL1 secretion by mouse uterine epithelial cells[J].Am J Reprod Immunol,2014,72:34-44.
[22] Cha HR,Ko HJ,Kim ED,et al.Mucosa-associated epithelial chemokine/CCL28 expression in the uterus attracts CCR10+IgA plasma cells following mucosal vaccination via estrogen control[J].J Immunol,2011,187:3044-3052.
[23] Andersson A,Stubelius A,Karlsson MN,et al.Estrogen regulates T helper 17 phenotype and localization in experimental autoimmune arthritis[J].Arthritis Res Ther,2015,17:32-43.
[24] Li R,Xu W,Chen Y,et al.Raloxifene suppresses experimental autoimmune encephalomyelitis and NF-κB-dependent CCL20 expression in reactive astrocytes[J/OL].PLoS One,2014,9:e94320.
[25] Seli E,Pehlivan T,Selam B,et al.Estradiol down-regulates MCP-1 expression in human coronary artery endothelial cells[J].Fertil Steril,2002,77:542-547.
[26] Wang L,Hao Q,Wang YD,et al.Protective effects of dehydroepiandrosterone on atherosclerosis in ovariectomized rabbits via alleviating inflammatory injury in endothelial cells[J].Atherosclerosis,2011,214:47-57.
[27] Haim K,Weitzenfeld P,Meshel T,et al.Epidermal growth factor and estrogen act by independent pathways to additively promote the release of the angiogenic chemokine CXCL8 by breast tumor cells[J].Neoplasia,2011,13:230-243.
[28] Hickey DK,Fahey JV,Wira CR.Estrogen receptor α antagonists mediate changes in CCL20 and CXCL1 secretions in the murine female reproductive tract[J].Am J Reprod Immunol,2013,69:159-167.
[29] Subramanian S,Yates M,Vandenbark AA,et al.Oestrogen-mediated protection of experimental autoimmune encephalomyelitis in the absence of Foxp3+regulatory T cells implicates compensatory pathways including regulatory B cells[J].Immunology,2011,132:340-347.
[30] Rubio N,Arevalo MA,Cerciat M,et al.Theiler’s virus infection provokes the overexpression of genes coding for the chemokine Ip10 (CXCL10) in SJL/J murine astrocytes,which can be inhibited by modulators of estrogen receptors[J].J Neurovirol,2014,20:485-495.
[31] Nii T,Isobe N,Yoshimura Y.The effect of estrogen on the early cytotoxic response to IB virus infection in hen oviduct[J].Vet Immunol Immunopathol,2015,164:56-66.
[32] Sung MJ,Kim DH,Davaatseren M,et al.Genistein suppression of TNF-alpha-induced fractalkine expression in endothelial cells[J].Cell Physiol Biochem,2010,26:431-440.
[33] Wang L,Qiu XM,Hao Q,et al.Anti-inflammatory effects of a Chinese herbal medicine in atherosclerosis via estrogen receptor beta mediating nitric oxide production and NF-kappaB suppression in endothelial cells[J].Cell Death Dis,2013,4:e551.
[编辑:侯丽]
Roleofestrogen-estrogenreceptorsignalingpathwayinregulatingchemokine
XU Ying-ping1,2,3,4,WANG Fei-fei1,2,3,4,LI Da-jin1,2,3,WANG Ling1,2,3,4*
1.ObstetricsandGynecologyHospital,FudanUniversity,Shanghai200011 2.LaboratoryforReproductiveImmunology,Hospital&InstituteofObstetricsandGynecology,IBS,FudanUniversityShanghaiMedicalCollege,Shanghai200011 3.TheAcademyofIntegrativeMedicineofFudanUniversity,Shanghai200011 4.ShanghaiKeyLaboratoryofFemaleReproductiveEndocrine-relatedDiseases,Shanghai200011
In human body,estrogen involves many physiological and pathological regulation mechanism,and plays an integral role in homeostasis.Chemokines are members of a superfamily of low-molecular-weight chemoattractant cytokines.While chemokines play actively in regulation of various systems,and their own expression is also regulated by the whole body system,such as the steroid hormones of the endocrine system.This review summarized the role of estrogen-estrogen receptor signaling pathway in regulating chemokine.
Estrogen; Estrogen receptor; Chemokine
10.3969/j.issn.1004-3845.2017.09.017
2016-10-31;
2017-02-27
国家自然科学基金(31571196);上海市医学引导类项目(15401932200);上海市浦江人才计划(11PJ1401900);国家自然科学基金(30801502);日本学术振兴会海外博士后研究员项目(P08471);国家自然科学基金(81401171);上海市高峰学科(中西医结合)建设项目(20150407)
许莹萍,女,汉族,浙江台州人,在读硕士,生殖免疫专业.(*
)

