二维M2XO2−2x(OH)2x (M = Ti, V; X = C, N)析氢催化活性的第一性原理研究
张绍政 刘 佳 谢 艳 陆银稷 李 林吕 亮 杨建辉 ,* 韦世豪
(1衢州学院教师教育学院,浙江 衢州 324000;2衢州学院化学与材料工程学院,浙江 衢州 324000;3宁波大学微电子科学与工程系,浙江 宁波 315211)
二维M2XO2−2x(OH)2x(M = Ti, V; X = C, N)析氢催化活性的第一性原理研究
张绍政1刘 佳2谢 艳2陆银稷2李 林1吕 亮2杨建辉1,*韦世豪3
(1衢州学院教师教育学院,浙江 衢州 324000;2衢州学院化学与材料工程学院,浙江 衢州 324000;3宁波大学微电子科学与工程系,浙江 宁波 315211)
MXene是一种新型的二维析氢催化材料,其表面容易被亲水基团O和OH混合覆盖。我们基于第一性原理计算的方法,研究了M2XO2−2x(OH)2x(M = Ti, V; X = C, N)的析氢催化活性。计算结果显示,M2XO2−2x(OH)2x的析氢催化活性与其表面OH覆盖率(x)密切相关。对Ti2CO2−2x(OH)2x来说,OH覆盖率不超过1/3时,具有优异的析氢催化活性。对Ti2NO2−2x(OH)2x、V2CO2−2x(OH)2x和V2NO2−2x(OH)2x来说,OH覆盖率分别达到4/9、1/3和5/9时,才具有最佳的析氢催化活性。接着,电荷分析显示OH覆盖率会显著影响M2XO2−2x(OH)2x活性位点O基团的电荷量。最后,我们从态密度的角度揭示了析氢催化活性变化的原因,即活性位点O基团的氧化性随OH覆盖率的增大而被削弱。因此,本文提出了调节表面OH覆盖率来获取M2XO2−2x(OH)2x最佳析氢催化活性状态的方法,这在工业制氢生产过程中具有重要的应用价值。
二维材料;MXene;第一性原理;析氢催化;吸附
1 引 言
传统化石燃料的非再生性及其燃烧带来的环境污染问题迫使人们去寻找一种清洁的可再生能源1,2。氢气是一种比较理想的可再生能源,具有储能密度高和氧化产物无污染的特点,有望成为传统化石燃料的代替品。当前,大规模工业制氢的方法有天然气重整法、煤气化法、石油热裂法、电解水制氢法等。其中,电解水制氢法具有耗能低、设备简单、原料可持续、无污染且制氢纯度高的优点而备受关注3。然而,由电极材料引入的析氢过电位会导致大量额外的电能被消耗,降低了电能的转换效率4。为了高效地利用宝贵的电力资源,除了设计新的电极材料来增强导电性能之外5,还可以在电极上添加析氢催化剂来降低析氢过电位。贵金属Pt是一种较理想的析氢催化材料6,但其应用成本过高,不利于大规模制备氢气。因此,人们急需寻找其它廉价的析氢催化材料。已有报道研究指出,金属合金、金属氧化物、金属磷化物、金属碳化物、过渡金属二硫化物等具有良好的析氢催化性能7–9。过渡金属二硫化物不同于其它的析氢材料,它属于二维材料,具有比表面大、活性位点多的优点而被广泛关注。第一性原理计算和实验测试结果表明,过渡金属二硫化物具有优异的析氢催化活性,且其活性位点处于边缘裸露位点10–13。制备出尽可能多的边缘裸露活性位点能提升过渡金属二硫化物在单位质量下的析氢催化效率。然而,这会增加过渡金属二硫化物制备的难度和成本,不利于推广其在制氢领域的应用。为了充分发挥二维析氢催化材料的比表面大和活性位点多的优势,我们需要寻找一种新型的二维材料。
MXene是近年合成的新型二维材料,由三维块体材料MAX相(M为过渡金属,A为A族元素,X为碳或氮)置于氢氟酸溶液中去除层间A族元素得来 14–18,在锂电池 19–22、重金属吸附 23–26、气体吸附27–29、稀磁半导体30,31等方面有重要的应用前景。类似于其它纳米材料在纳米器件领域的应用,MXene在纳米器件方面的应用也日益广泛32–37。MXene在制备过程中有氢气释出,这意味着它或许有良好的析氢催化活性38,39。为验证MXene是否具有用作析氢催化剂的潜力,Vojvodic等40应用第一性原理计算研究了数种MXene的析氢催化活性,发现MXene的析氢催化活性与组成元素M、X密切相关,并在实验上进行了验证。Wang等41则利用第一性原理计算研究了吸附过渡金属元素和施加压应力对V2CO2的析氢催化活性的影响,发现两者均能有效提升 V2CO2的析氢催化活性。此外,Wang等还指出MXene析氢催化性能取决于活性位点处O原子对H原子的束缚作用。束缚作用过强,则氢原子不易脱离MXene表面;束缚作用过弱,则氢原子不易吸附在MXene表面。适宜的束缚作用,才能使MXene具有优异的析氢催化活性。考虑到MXene制备是在水性溶液环境中进行的,其表面具有较强的还原性,易造成MXene表面被亲水基团O和OH混合覆盖。O和OH是两种带电量不同的基团,当它们按不同混合比例覆盖在MXene表面时,MXene电荷分布也会受到影响,尤其是表面活性位点处的电荷分布24。而活性位点处电荷分布会直接影响MXene析氢催化性能,因此,我们有必要研究混合比例即不同OH覆盖率对MXene析氢催化性能的影响。
我们基于密度泛函理论下的赝势平面波方法,研究了OH覆盖率(x)对M2XO2−2x(OH)2x(M =Ti, V; X = C, N)析氢催化活性的影响。首先,我们计算了OH覆盖率为零的结构即M2XO2的氢原子吸附自由能,仅Ti2CO2呈现出优异的析氢催化活性.接着,研究了 OH覆盖率对 M2XO2−2x(OH)2x的氢原子吸附自由能的影响。计算结果显示,四种MXene在特定OH覆盖率下才拥有良好的析氢催化活性。然后,分析了OH覆盖率对MXene表面活性位点O基团处电荷的影响。最后,从态密度的角度揭示了 M2XO2−2x(OH)2x析氢催化活性变化的根本原因,即活性位点处O基团的氧化性发生了变化。
2 模型搭建及计算方法
2.1 模型搭建
M2X表面有三种不同的吸附位点,分别为A位(M原子的顶位)、B位(对应X原子的空心位点)和C位(对应M原子的空心位点),如图1(a)所示。因此,我们构建出图 1(b)所示的四种不同的吸附结构:Model-1、Model-2、Model-3和Model-4。Model-1表示基团吸附在M2X两表面的A位处。Model-2表示基团吸附在M2X两表面的B位处。Model-3表示基团吸附在M2X两表面的C位处。Model-4则表示基团分别吸附在M2X两表面的B位和C位处。接着,我们计算了四种可能吸附构型的能量来获取了最稳定吸附构型,计算结果见表1。O和OH基团满吸附在四种M2X表面的最稳定吸附构型均为 Model-3型,且晶格常数也与文献报导结果一致,验证了我们计算的合理性42。除此之外,我们还观察到O和OH基团最稳定吸附构型相同,这意味着可以在 M2CO2的 Model-3结构上用OH基团取代O基团的方式来构建混合吸附模型。为便于找出 OH覆盖率 x对M2CO2−2x(OH)2x析氢催化活性的影响,我们使用了OH均匀覆盖的模型来有效避免OH不均匀覆盖带来的干扰。此外,OH不均匀覆盖结构可等效于某一特定均匀分布结构,也就是说不均匀覆盖情形也已经处于我们的研究框架内。因此,我们选择(3 × 3) M2X的Model-3吸附结构来搭建O和OH的混合覆盖模型M2XO2−2x(OH)2x的时候,尽可能用OH均匀替代表面O基团,如图1(c)所示39。计算OH覆盖率为x下H原子的吸附自由能时,我们采取超晶胞模型中吸附一个原子来研究。H原子在M2CO2−2x(OH)2x表面倾向于吸附在O基团的顶位,形成新的OH基团。图1(c)中给出了H原子在M2CO2−2x(OH)2x表面O基团处可能的吸附位点,易得出H原子吸附在A处能保证吸附后OH覆盖均匀,这也保证了OH均匀覆盖的条件。此时,H原子的吸附自由能(ΔG)定义如下

表1 M2XT2 (T = O, OH)最稳定吸附构型及其晶格常数Table 1 Most stable adsorption configurations and corresponding lattice constants for M2XT2 (T = O, OH).
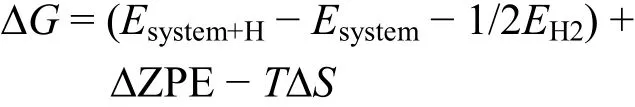
其中,Esystem+H和Esystem是均匀覆盖模型中OH覆盖率为(x + 1/9)和x的系统总能量。EH2是氢分子的能量。ΔZPE是总系统零点能的变化量。在室温反应条件下,T取值为300 K。ΔS为H原子从气态转变到吸附态后的熵变(近似取值为1/2S0H2)6。

图 1 M2XT2 (T = O, OH)和 M2XO2−2x(OH)2x 的构型Fig.1 Structural configuration for M2XT2 (T = O, OH) and M2XO2−2x(OH)2x.(a) top view of (3 × 3) M2X; (b) side views of four possible structural configuration for (1 × 1) M2XT2 (T = O, OH); (c) top views of M2XO2−2x(OH)2x (1/9 ≤ x ≤ 8/9). A primary cell is given by red lines and three possible groups adsorption sites are labeled by a, b and c in (a).Adsorption sites for H atom on oxygen groups are labeled by A, B and C are label in (c). color online.
2.2 计算方法
本文计算采用基于自旋密度泛函理论的VASP软件包43,44完成.使用投影缀加波(PAW)方法来描述离子与价电子之间的相互作用45,46。使用PBE函数来处理电子间的交换关联势47。经过严格的测试,平面波的截断动能设定为500 eV时能够保证模拟的准确性。原子弛豫力和自洽能量的收敛标准分别设置为0.2 eV·nm−1和10−4eV。布里渊区K点取样采用MP方案48,且其网格密度在几何优化和电子结构计算阶段分别取为 3 ×3 × 1 和 6 × 6 × 1。为了避免 MXene 层间的干扰,我们引入了200 nm的真空层。
3 结果与讨论
首先,我们分析了 OH覆盖率为零的结构即M2XO2(M = Ti, V; X = C, N)的析氢催化活性。大量实验结果指出,析氢催化剂表面氢原子吸附自由能接近零时,其催化效果最佳49−51。Ti2CO2、Ti2NO2、V2CO2和 V2NO2的氢原子吸附自由能的计算结果分别为−0.048、−0.439、−0.579和−0.962 eV。其中,仅Ti2CO2的氢原子吸附自由能接近零,表明它具有非常优异的析氢催化活性。而其余三种MXene的氢原子吸附自由能均小于−0.4 eV,意味着它们表面O原子对H原子的束缚力过强而不易析出氢气。适当削弱后三种MXene表面O原子对H原子的束缚力,提升它们的析氢催化活性,将能为我们提供更多材料选择的余地。Wang等41已经指出两种实现的途径:在MXene表面吸附过渡金属原子和对MXene施加应力。为了进一步降低制氢成本,我们需探索其它的途径。
MXene裸露的表面具有较强的还原性,在制备过程中易被O和OH混合覆盖。而O和OH基团是两种截然不同的含氧基团,对MXene电子结构影响也不相同,所以需要考虑 OH的引入对MXene析氢催化活性的影响。为方便解释,我们将OH基团看成O基团吸附H原子的结构,并用Bader电荷分析的方法来获取原子电荷量。计算显示,M2XO2满吸附H原子后,O原子电荷量分别增加了 0.530e (Ti2C)、0.529e (Ti2C)、0.653e (Ti2C)和0.613e (Ti2C)。M2XO2内部的M和X原子也获取了部分电荷量,造成晶格常数出现轻微变化。这表明,H原子吸附在M2XO2表面后,会将自身的电荷注入到M2XO2中,改变了原先M2XO2的电荷分布。因此,我们猜想,H原子的吸附会改变吸附O原子周围的其它O原子的电荷量,也就是说,OH基团的引入或许能改变其周围活性位点处O基团的电荷量,进而影响了MXene的析氢催化活性。
接着,我们研究了 OH 覆盖率对M2XO2−2x(OH)2x析氢催化活性的影响。图 2给出了四种 M2XO2−2x(OH)2x的氢原子吸附自由能随OH覆盖率的变化,显示它们的析氢催化活性与OH 覆盖率密切相关。对 Ti2CO2−2x(OH)2x来说,OH覆盖率在1/3以内时,它拥有极高的析氢催化活性;而OH覆盖率超过1/3后,其析氢催化活性变 差 。 对 Ti2NO2−2x(OH)2x、V2CO2−2x(OH)2x和V2NO2−2x(OH)2x来说,OH 覆盖率分别等于 4/9、1/3和5/9时,才具有了良好的析氢催化活性;而远离最优 OH覆盖率后,它们的析氢催化活性变差。此外,我们还观察到四种 M2XO2−2x(OH)2x的氢原子吸附自由能都是从负值增加至0 eV左右,然后转变为正值。在这个过程中,四种M2XO2−2x(OH)2x的氢原子吸附自由能呈现出了良好的可调性。因此,在工业生产过程中,我们可以通过调整MXene表面OH覆盖率来达到它最佳析氢催化活性状态。
然后,我们分析了 M2XO2−2x(OH)2x活性位点O基团电荷分布随 OH覆盖率的变化。由于V2NO2−2x(OH)2x析氢催化活性的调节范围远超过其余三种,我们以它为例,探索氧原子层电荷分布随 OH 覆盖率的变化。图 3给出了V2NO2−2x(OH)2x表面OH覆盖率分别为1/9、1/3、5/9和2/3下的氧原子层转移电荷密度图。当OH覆盖率为1/9时,汇聚电荷基本分布在OH基团中的O原子周围,而OH基团周围的O基团处汇聚电荷仅有微弱分布。随着OH覆盖率从1/9增加至2/3,OH基团中O原子周围汇聚电荷分布基本无变化,而O基团周围汇聚电荷分布越来越显著。我们用Bader电荷的手段来定量获取O基团电荷量,发现其与OH覆盖率呈近似线性递增的趋势,如图 4所示。这表明增大 OH覆盖率会使M2XO2−2x(OH)2x表面 O基团的电荷量增加,削弱了O基团对吸附H原子的束缚作用。

图2 M2XO2−2x(OH)2x表面氢原子的吸附自由能Fig.2 Adsorption free energy of hydrogen atom on the surface of M2XO2−2x(OH)2x.
最后,我们从态密度的角度分析了O基团氧化性的变化。V2NO2特殊的二维几何结构使其表面O基团的px与py轨道平行V2NO2的表面即x-y平面,pz轨道垂直于x-y平面。当H原子吸附在活性位点O基团处时,O基团的pz轨道将与H原子的 s轨道发生明显的杂化。电荷分析指出,O基团的轨道未被电子填满,因此在费米能级以上存在电子空态。如图5(a)所示,电子空态主要由O基团 pz轨道提供,而 O基团 px与py轨道由于与M原子存在强杂化不能提供空态。随着OH覆盖率的增加,我们发现原先分布在[−8, −2] eV区间内的电子态出现右移趋势,并且将原先数个峰位逐渐合并成一个大的峰位,这意味着O基团获取了一定量的电子。此外,我们还观察到费米能级附近的态分布逐渐被拓宽,从原来分布区间[−1.1,1.4] eV展宽至[−2.7, 1.7] eV,并且峰值也被降低,这说明O基团接受电子的能力在减弱。综合以上对态密度的分析,容易得出O基团的氧化性即获取电荷的能力随 OH覆盖率的增大而被削弱。再结合图 2给出的析氢催化活性变化曲线,我们最终得到MXene析氢催化活性变化的根本原因是其表面活性位点的氧化性发生了变化。

图3 V2NO2−2x(OH)2x氧原子层转移电荷密度差分图Fig.3 Charge transferring density of oxygen layers for V2NO2−2x(OH)2x.OH occupied coverages are (a) 1/9, (b) 1/3, (c) 5/9 and 2/3,respectively. Oxygen atoms in O or OH groups are indicated by red balls. color online.

图4 M2XO2−2x(OH)2x表面O基团的平均电荷量Fig.4 Average charge of oxygen groups on the surface of M2XO2−2x(OH)2x.

图5 V2NO2−2x(OH)2x中O基团的投影态密度Fig.5 Projected density of states (PDOS) of O groupsfor V2NO2−2x(OH)2x.OH occupied coverages are (a) 0, (b) 1/3 and (c) 2/3, respectively.color online.
4 结 论
我们采用第一性原理计算的方法,研究了OH覆盖率对M2XO2−2x(OH)2x(M = Ti, V; X = C, N)析氢催化活性的影响。研究结果显示,M2XO2−2x(OH)2x的析氢催化活性与OH覆盖率密切相关。增大OH覆盖率会削弱活性位点O基团的氧化性,即降低了O基团对吸附氢原子的束缚作用。合理调节OH覆盖率,即可使M2XO2−2x(OH)2x达到最佳析氢活性状态。我们提出了一种新的调节MXene析氢催化活性状态的方法,在工业制氢过程中有重要的应用价值。
(1) Shafiee, S.; Topal, E. Energy Policy 2009, 37, 181.doi: 10.1016/j.enpol.2008.08.016
(2) Chu, S.; Majumdar, A. Nature 2012, 488, 294.doi: 10.1038/nature11475
(4) Jin, Z. H.; Liu, B. F.; Liang, J. H.; Wang, N.; Zhang, Q. X.; Liu, C.C.; Zhao, Y.; Zhang, X. D. Acta Phys. Sin. 2016, 65, 118801. [晋中华, 刘伯飞, 梁俊辉, 王 宁, 张奇星, 刘彩池, 赵 颖, 张晓丹.物理学报, 2016, 65, 118801.] doi: 10.7498/aps.65.118801
(5) Yang, J.; Zhang, Q.; Chen, L.; Wang, G.; Chen, X. Adv. Sci. 2016, 3,1500314. doi: 10.1002/advs.201500314
(6) Hinnemann, B.; Moses, P. G.; Bonde, J.; Jø rgensen, K. P.; Nielsen, J.H.; Horch, S.; Chorkendorff, I.; Nø rskov, J. K. J. Am. Chem. Soc.2005, 127, 5308. doi: 10.1021/ja0504690
(7) Walter, M. G.; Warren, E. L.; McKone, J. R.; Boettcher, S. W.; Mi,Q.; Santori, E. A.; Lewis, N. S. Chem. Rev. 2010, 110, 6446.doi: 10.1021/cr1002326
(8) Liu, T.; Ma, X.; Liu, D.; Hao, S.; Du, G.; Ma, Y.; Asiri, A. M.; Sun,X.; Chen, L. ACS Catal. 2017, 7, 98. doi: 10.1021/acscatal.6b02849
(9) Tang, C.; Gan, L.; Zhang, R.; Lu, W.; Jiang, X.; Asiri, A. M.; Sun,X.; Wang, J.; Chen, L. Nano Lett. 2016, 16, 6617.doi: 10.1021/acs.nanolett.6b03332
(10) Chung, D. Y. ; Park, S. K.; Chung, Y. H.; Yu, S. H.; Lim, D.H.; Jung, N.; Ham, H. C.; Park, H. Y.; Piao, Y.; Yoo, S. J.;Sung, Y. E. Nanoscale 2014, 6, 2131.doi: 10.1039/C3NR05228A
(11) Wu, Z.; Fang, B.; Wang, Z.; Wang, C.; Liu, Z.; Liu, F.; Wang,W.; Alfantazi, A.; Wang, D.; Wilkinson, D. P. ACS Catal.2013, 3, 2101. doi: 10.1021/cs400384h
(12) Chen, X.; Gu, Y.; Tao, G.; Pei, Y.; Wang, G.; Cui, N. J. Mater.Chem. A 2015, 3, 18898. doi: 10.1039/C5TA02817E
(13) Tang, H.; Dou, K.; Kaun, C. C.; Kuang, Q.; Yang, S. J. Mater.Chem. A 2014, 2, 360. doi: 10.1039/C3TA13584E
(14) Barsoum, M. W. Prog. Solid Solid State Chem. 2000, 28, 201.doi: 10.1016/S0079-6786(00)00006-6
(15) Naguib, M.; Kurtoglu, M.; Presser, V.; Lu, J.; Niu, J.; Heon,M.; Hultman, L.; Gogotsi, Y.; Barsoum, M. W. Adv. Mater.2011, 23, 4248. doi: 10.1002/adma.201102306
(16) Naguib, M.; Come, J.; Dyatkin, B.; Presser, V.; Taberna, P.-L.;Simon, P.; Barsoum, M. W.; Gogotsi, Y. Electrochem.Commun. 2012, 16, 61. doi: 10.1016/j.elecom.2012.01.002
(17) Yang, J. H.; Chen, Y. X.; Wu, L. H.; Wei, S. H. Acta Phys. Sin.2014, 63, 237301. [杨建辉, 陈言星, 吴丽慧, 韦世豪. 物理学报, 2014, 63, 237301.] doi: 10.7498/aps.63.237301
(18) Hu, J. Q.; Xie, M.; Chen, J. L.; Liu, M. M.; Chen, Y. T.; Wang,S.; Wang, S. B.; Li, A. K. Acta Phys. Sin. 2017, 66, 57102. [胡洁琼, 谢 明, 陈家林, 刘满门, 陈永泰, 王 松, 王塞北,李爱坤. 物理学报, 2017, 66, 57102.]doi: 10.7498/aps.66.057102
(19) Er, D.; Li, J.; Naguib, M.; Gogotsi, Y.; Shenoy, V. B. ACS Appl. Mater. Inter. 2014, 6, 11173. doi: 10.1021/am501144q
(20) Lukatskaya, M. R.; Mashtalir, O.; Ren, C. E.; Dall'Agnese, Y.;Rozier, P.; Taberna, P. L.; Naguib, M.; Simon, P.; Barsoum, M.W.; Gogotsi, Y. Science 2013, 341, 1502.doi: 10.1126/science.1241488
(21) Xie, Y.; Naguib, M.; Mochalin, V. N.; Barsoum, M. W.;Gogotsi, Y.; Yu, X.; Nam, K. W.; Yang, X. Q.; Kolesnikov, A.I.; Kent, P. R. C. J. Am. Chem. Soc. 2014, 136, 6385.doi: 10.1021/ja501520b
(22) Tang, Q.; Zhou, Z.; Shen, P. J. Am. Chem. Soc. 2012, 134,16909. doi: 10.1021/ja308463r
(23) Peng, Q.; Guo, J.; Zhang, Q.; Xiang, J.; Liu, B.; Zhou, A.; Liu,R.; Tian, Y. J. Am. Chem. Soc. 2014, 136, 4113.doi: 10.1021/ja500506k
(24) Guo, J.; Peng, Q.; Fu, H.; Zou, G.; Zhang, Q. J. Phys. Chem. C 2015, 119, 20923. doi: 10.1021/acs.jpcc.5b05426
(25) Guo, X.; Zhang, X.; Zhao, S.; Huang, Q.; Xue, J. Phys. Chem.Chem. Phys. 2016, 18, 228. doi: 10.1039/c5cp06078h
(26) Guo, J.; Fu, H.; Zou, G.; Zhang, Q.; Zhang, Z.; Peng, Q. J.Alloy. Compd. 2016, 684, 504.doi: 10.1016/j.jallcom.2016.05.217
(27) Hu, Q.; Sun, D.; Wu, Q.; Wang, H.; Wang, L.; Liu, B.; Zhou,A.; He, J. J. Phys. Chem. A 2013, 117, 14253.doi: 10.1021/jp409585v
(28) Chen, J.; Chen, K.; Tong, D.; Huang, Y.; Zhang, J.; Xue, J.;Huang, Q.; Chen, T. Chem. Commun. 2015, 51, 314.doi: 10.1039/c4cc07220k
(29) Yu, X. F.; Li, Y. C.; Cheng, J. B.; Liu, Z. B.; Li, Q. Z.; Li, W.Z.; Yang, X.; Xiao, B. ACS Appl. Mater. Inter. 2015, 7, 13707.doi: 10.1021/acsami.5b03737
(30) Yang, J.; Luo, X.; Zhang, S.; Chen, L. Phys. Chem. Chem.Phys. 2016, 18, 12914. doi: 10.1039/C6CP00138F
(31) Yang, J.; Zhou, X.; Luo, X.; Zhang, S.; Chen, L. Appl. Phys.Lett. 2016, 109, 203109. doi: 10.1063/1.4967983
(32) Wang, R. N.; Zheng, X. H.; Song, L. L.; Zeng, Z. J. Chem.Phys. 2011, 135, 044703. doi: 10.1063/1.3613647
(33) Wang, R. N.; Zheng, X. H.; Dai, Z. X.; Hao, H.; Song, L. L.;Zeng, Z. Phys. Lett. A 2011, 375, 657.doi: 10.1016/j.physleta.2010.11.031
(34) Wang, R. N.; Zheng, X. H.; Lan, J.; Shi, X. Q.; Zeng, Z. RSC Adv. 2014, 4, 9172. doi: 10.1039/C3RA45715J
(35) Zhang, H. W.; Duan, G. T.; Liu, G. Q.; Li, Y.; Xu, X. X.; Dai,Z. F.; Wang, J. J.; Cai, W. P. Nanoscale 2013, 5, 2460.doi: 10.1039/C3NR33378G
(36) Berdiyorov, G. R. Euro Phys. Lett. 2015, 111, 67002.doi: 10.1209/0295-5075/111/67002
(37) Lai, S.; Jeon, J.; Jang, S. K.; Xu, J.; Choi, Y. J.; Park, J. H.;Hwang, E.; Lee, S. Nanoscale 2015, 7, 19390.doi: 10.1039/C5NR06513E
(38) Hope, M. A.; Forse, A. C.; Griffith, K. J.; Lukatskaya, M. R.;Ghidiu, M.; Gogotsi, Y.; Grey, C. P. Phys. Chem. Chem. Phys.2016, 18, 5099. doi: 10.1039/C6CP00330C
(39) Yang, J. H.; Zhang, S. Z.; Ji, J. L.; Wei, S. H. Acta Phys.-Chim. Sin. 2015, 31, 369. [杨建辉, 张绍政, 计嘉琳, 韦世豪. 物理化学学报, 2015, 31, 369.]doi: 10.3866/PKU.WHXB201412121
(40) Seh, Z. W.; Fredrickson, K. D.; Anasori, B.; Kibsgaard, J.;Strickler, A. L.; Lukatskaya, M. R.; Gogotsi, Y.; Jaramillo, T.F.; Vojvodic, A. ACS Energy Lett. 2016, 1, 589.doi: 10.1021/acsenergylett.6b00247
(41) Ling, C.; Shi, L.; Ouyang, Y.; Chen, Q.; Wang, J. Adv. Sci.2016, 3, 1600180. doi: 10.1002/advs.201600180
(42) Khazaei, M.; Arai, M.; Sasaki, T.; Chung, C. Y.;Venkataramanan, N. S.; Estili, M.; Sakka, Y.; Kawazoe, Y.Adv. Funct. Mater. 2013, 23, 2185.doi: 10.1002/adfm.201202502
(43) Kresse, G.; Furthmü ller, J. Phys. Rev. B 1996, 54, 11169.doi: 10.1103/PhysRevB.54.11169
(44) Kresse, G.; Furthmü ller, J. Comp. Mater. Sci. 1996, 6, 15.doi: 10.1016/0927-0256(96)00008-0
(45) Blö chl, P. E. Phys. Rev. B 1994, 50, 17953.doi: 10.1103/PhysRevB.50.17953
(46) Kresse, G.; Joubert, D. Phys. Rev. B 1999, 59, 1758.doi: 10.1103/PhysRevB.59.1758
(47) Perdew, J. P.; Burke, K.; Ernzerhof, M. Phys. Rev. Lett. 1996,77, 3865. doi: 10.1103/PhysRevLett.77.3865
(48) Monkhorst, H. J.; Pack, J. D. Phys. Rev. B 1976, 13, 5188.doi: 10.1103/PhysRevB.13.5188
(49) Parsons, R. Trans. Faraday Soc. 1958, 54, 1053.doi: 10.1039/TF9585401053
(50) GreeleyJ; Stephens, I. E. L.; Bondarenko, A. S.; Johansson, T.P.; Hansen, H. A.; Jaramillo, T. F.; RossmeislJ; ChorkendorffI;Nø rskov, J. K. Nat. Chem. 2009, 1, 552.doi: 10.1038/nchem.367
(51) Greeley, J.; Jaramillo, T. F.; Bonde, J.; Chorkendorff, I.;Norskov, J. K. Nat. Mater. 2006, 5, 909.doi: 10.1038/nmat1752
First-Principles Study of Hydrogen Evolution Activity for Two-Dimensional M2XO2−2x(OH)2x(M = Ti, V; X = C, N)
ZHANG Shao-Zheng1LIU Jia2XIE Yan2LU Yin-Ji2LI Lin1LÜ Liang2YANG Jian-Hui1,*WEI Shi-Hao3
(1College of Teacher Education, Quzhou University, Quzhou 324000, Zhejiang Province, P. R. China;2College of Chemical and Material Engineering, Quzhou University, Quzhou 324000, Zhejiang Province, P. R. China;3Department of Microelectronic Science and Engineering, Ningbo University, Ningbo 315211, Zhejiang Province, P. R. China)
MXene is a new group of electrocatalysts for two-dimensional hydrogen evolution reaction(HER). Its surfaces are often covered by hydrophilic O and OH mixed groups. To find the effect of the O and OH mixed groups on HER, we studied the HER activity for M2XO2−2x(OH)2x(M = Ti, V; X = C, N) by first-principle calculations. Results indicate that HER activity is closely related to OH-occupied coverage(x). For Ti2CO2−2x(OH)2x, excellent HER activity could be maintained when the OH-occupied coverage was not larger than 1/3. For Ti2NO2−2x(OH)2x, V2CO2−2x(OH)2x, and V2NO2−2x(OH)2x, high HER activity was obtained when OH-occupied coverage reached 4/9, 1/3, and 5/9, respectively. Next, we analyzed thecharge-transfer density and found that the charges on the oxygen groups were strongly affected by the OH-occupied coverage. Finally, we revealed the variation of HER activity that oxidizability of O groups is weakened with increasing OH-occupied coverage. In this paper, we propose a new method to obtain the optimal HER activity for M2XO2−2x(OH)2xby adjusting the OH-occupied coverage of the surfaces, which is useful in industrial hydrogen production.
Two-dimensional material; MXene; First-principle method; Hydrogen evolution reaction; Adsorption
April 7, 2017; Revised: May 7, 2017; Published online: May 17, 2017.
O643
10.1126/science.1103197
[Article]
10.3866/PKU.WHXB201705174 www.whxb.pku.edu.cn
*Corresponding author. Email: jianhuiyoung@gmail.com; Tel: +86-18805703257.
The project was supported by the National Natural Science Foundation of China (51502154, 21271116, 21476127, u1607119) and the Young Academic Leading Training Plan, Quzhou University, China (XNZQN201517).
国家自然科学基金(51502154, 21271116, 21476127, u1607119)和衢州学院青年学术骨干培养计划(XNZQN201517)资助项目
© Editorial office of Acta Physico-Chimica Sinica

