光诱导约束刻蚀体系中的TiO2纳米管阵列光电极上Cu的沉积及抑制
黄雅钰 方秋艳 周剑章 詹东平 时 康 田中群
(厦门大学化学化工学院化学系, 固体表面化学国家重点实验室, 福建 厦门 361005)
光诱导约束刻蚀体系中的TiO2纳米管阵列光电极上Cu的沉积及抑制
黄雅钰 方秋艳 周剑章*詹东平 时 康 田中群
(厦门大学化学化工学院化学系, 固体表面化学国家重点实验室, 福建 厦门 361005)
光诱导约束刻蚀可作为一种无应力的化学平坦化方法用于Cu的抛光。我们发现在光诱导约束刻蚀工件Cu的过程中,工具表面的TiO2纳米管上可能出现Cu沉积。通过扫描电子显微镜及其能谱,X射线光电子能谱等方法分析其沉积形貌和成分组成,探究在工具–工件之间的微纳尺度液层中Cu光催化还原沉积的机制,并在模拟液中研究Cu沉积对刻蚀体系的影响。探究引入搅拌、加入络合剂对TiO2纳米管表面Cu的沉积的抑制,并考察抑制措施对于工件Cu刻蚀的影响。结果表明Cu沉积会增强TiO2纳米管光电极的光催化性能,但随着沉积量的增加,增强机制会发生变化;在尝试抑制Cu沉积时也发现改善传质以抑制Cu沉积的同时也会带来工件Cu的刻蚀增强;采用添加络合剂结合改善传质的方法有望在抑制Cu沉积的同时提高平坦化效果。所以抑制方法和条件的选择需兼顾对工具–工件之间微纳液层中的多个化学和传质过程的影响。这些研究对于进一步优化光诱导约束刻蚀体系及其在化学平坦化中的应用有重要的指导意义。
光诱导约束刻蚀;TiO2纳米管阵列;羟基自由基;约束剂;Cu的光催化沉积;传质
1 引 言
田昭武院士提出的约束刻蚀剂层技术具有有效控制刻蚀程度和对距离敏感的特点,已在半导体、金属及合金等材料上实现了三维超微图形的复制加工1−3。我们课题组在此基础上提出了一种新的无应力抛光技术—光诱导约束化学平坦化方法,并应用于铜(Cu)的平坦化4。其基本原理是:加工工具表面的TiO2纳米管光催化剂层在光诱导下产生刻蚀剂羟基自由基(∙OH),溶液中的约束剂(H2O、甘氨酸等)与∙OH发生清除反应,使∙OH的扩散受限而被约束在表面的微纳米尺度中,形成约束刻蚀剂层;当逼近工具的工件Cu的突起部分进入约束刻蚀剂层时将发生化学刻蚀溶解,而未进入约束刻蚀剂层的部分则基本不发生反应,从而实现Cu表面平坦化的效果。
但是在光诱导约束刻蚀Cu的过程中,我们观察到在工具表面的TiO2纳米管光催化剂层上可能出现Cu的沉积。文献中已有一些在TiO2表面光催化沉积Cu的报道。如Montini等5在TiO2表面光催化沉积Cu以制备活泼和廉价的纳米复合物。Lv等6在TiO2光催化剂层表面光沉积Cu纳米粒子以获得可以和TiO2表面修饰Pt媲美的光催化剂。Canterino等7研究了Cu(II)在有机物种存在的情况下,作为牺牲剂而在TiO2表面光催化沉积的机制。还有一些关于TiO2表面修饰、掺杂Cu及其氧化物以改变其光催化性能的报道。如Wu等8报道了在锐钛矿晶型的TiO2表面沉积Cu的粒子(介于0和+1价之间)会大大提高TiO2从甲醇水溶液中制氢的光催化活性。Tseng等9报道适量地沉积Cu2O及单质Cu可以增加活性位点的数量从而提高光催化的效率,但当沉积位点更多时,单位时间内单位催化活性位点上的转化数将下降,即意味着光催化活性的下降。并且过量的沉积也会带来TiO2表面的遮挡,减小光催化的能力。那么在光诱导约束刻蚀体系中,TiO2纳米管光催化剂层表面的Cu是如何沉积的?沉积的Cu或其氧化物是否会对TiO2纳米管的光催化活性有影响,是否会影响刻蚀剂∙OH的生成,进而对光诱导约束刻蚀和平坦化产生影响?如何抑制TiO2纳米管表面Cu的沉积?因此,很有必要深入探究光诱导约束刻蚀体系中工具表面的TiO2纳米管表面光催化沉积Cu的生成机制以及研究Cu沉积对光诱导约束刻蚀的影响。
本文着眼于研究光诱导约束刻蚀体系中 TiO2纳米管光电极上光催化还原 Cu的沉积机制及其对刻蚀体系的影响,并尝试添加络合剂和增加对流抑制Cu的沉积,探究优化光诱导约束刻蚀的条件参数对约束刻蚀体系各个过程的影响。
2 实验部分
2.1 试剂与仪器
试剂:六次甲基四胺(化学纯,广州化学试剂厂);Zn(NO3)2∙6H2O、甘氨酸、硼酸、尿素、氨水、无水乙醇、丙酮、乙二胺四乙酸(EDTA)、硝酸铜(分析纯,国药集团化学试剂有限公司);六氟钛酸铵(98%,Aldrich公司);FTO(武汉格奥仪器公司代理,美国 LOF公司生产);Cu片(99.9%,北京翠铂林有色金属技术开发中心)。所有的试剂没有进一步纯化。所用的溶液采用超纯水(电阻率 18.2 MΩ∙cm)配制。
仪器:光照光源采用北京赛凡光电的 500 W氙灯和北京卓立汉光150 W氙灯;电镜测试采用日本Hitachi公司的S4800 FESEM型扫描电镜,能谱分析采用该仪器所配的X射线能谱分析(EDS)附件;X射线衍射测定采用荷兰帕纳科公司的Panalytical XʹPert PRO X射线衍射仪。Cu靶,扫描步长0.02°;X射线光电子能谱采用英国VG公司生产的ESCA LAB MK-Ⅱ型,Al Kα为X射线源,以C 1s的284.5 eV峰为参考;吸收光谱采用美国Varian公司生产的Cary 5000紫外-可见-近红外分光光度计,测试时都扣除 FTO基底的吸收;暂态光电流响应采用上海辰华仪器公司生产的CHI-630a电化学工作站;荧光测试采用日本Hitachi公司的F-7000型荧光光谱仪。
2.2 实验过程
TiO2纳米管(NTs)阵列的制备:FTO导电玻璃依次在丙酮、乙醇和三次去离子水中超声清洗两次,氮气吹干备用。采用恒电流阴极还原法制备ZnO纳米棒,工作电极为FTO电极(10 mm × 20 mm),对电极为 Pt片电极(10 mm × 20 mm),两电极平行相距10 mm,电解液为硝酸锌(5 mmol∙L−1Zn(NO3)2)和六次甲基四胺(5 mmol∙L−1C6H12N4)的混合溶液,沉积电流密度为 0.25 mA∙cm−2,沉积温度控制在90 °C,沉积时间为20 min。用液相沉积的方法,将制备好的ZnO纳米棒阵列浸入摩尔比1 : 3的六氟钛酸铵和硼酸的混合溶液中4 h,液相沉积制备 TiO2纳米管阵列。最后将制备好的TiO2纳米管阵列在450 °C下煅烧2 h,升温速率5 °C∙min−1。
光诱导约束刻蚀Cu的实验过程:将TiO2纳米管阵列(10 mm × 10 mm)、100 μm 厚的聚四氟乙烯薄膜垫片(PTFE spacer)和 Cu 片(10 mm × 10 mm)用两片带螺孔的厚聚四氟乙烯固定座(厚度 2.2 mm)固定,其中一片聚四氟乙烯中间有一个8 mm ×8 mm的正方形孔允许光通过,具体结构示意如图1所示。将固定好的整个装置放入一个圆柱形电解池中,光从上向下照射,光照时间为4 h,光强为1.58 W∙cm−2。本文中聚四氟乙烯薄膜垫片为十字型。刻蚀实验中TiO2纳米管阵列及Cu片上被垫片所遮挡的区域称为遮挡区,未遮挡部分称为镂空区。只有在外置了搅拌的实验中,磁子转速为0–1000 r∙min−1,其余均无外置搅拌。
模拟液中光催化还原沉积Cu的实验过程:模拟液为1% (w)甘氨酸和1.25% (w) Cu(NO3)2,溶液pH ~ 2.5,加硝酸调整后为 pH ~ 5.8。将 TiO2纳米管阵列置于该混合模拟溶液中,置于500 W氙灯下,在1.58 W∙cm−2的光强下光照不同的时间。取出Cu/TiO2纳米管阵列电极,用三次水冲洗,立即用氮气吹干。
(1)给出输入信号x(t),设置迭代次数,通常情况下,迭代次数越高,分解越精确,但是同时所花时间也越长。将重建信号初始化置零。

图1 光诱导约束刻蚀Cu实验装置Fig.1 Experimental installation of photoinduced confined etching of Cu.
荧光测试实验:选用荧光分析法对游离的·OH进行定量检测。以无荧光特性的对苯二甲酸(TA)为分子探针,它与∙OH反应后生成专一稳定且具有很强荧光特性的产物 2-羟基对苯二甲酸(TAOH)。通过测量424 nm处产物TAOH的荧光峰强度可以间接测出∙OH的浓度。将TiO2纳米管阵列放入自制石英光电解池中,溶液为1 mmol∙L−1的对苯二甲酸(TA)和 0.01 mol∙L−1的 NaOH,体积为3 mL。用150 W氙灯在35 mW∙cm−2的光强下光照60 min,放置2 h后进行荧光测试。荧光测试的激发波长为312 nm。
暂态光电流响应测试:以TiO2纳米管阵列或Cu/TiO2纳米管阵列为工作电极,Pt丝为对电极,饱和甘汞电极(SCE)为参比电极,测试体系为0.01 mol∙L−1NaOH 溶液,测试光强为 35 mW∙cm−2。
3 结果与讨论
3.1 光诱导约束刻蚀Cu后TiO2纳米管的表征
光诱导约束刻蚀后,我们发现在工具表面的TiO2纳米管上的镂空区局部会出现肉眼可见的紫铜色。为确定该物质的形貌和组分,我们采用扫描电子显微镜(SEM)及扫描能谱(EDS)对该紫铜色区域进行表征。如图 2的 SEM 所示,刻蚀后的TiO2纳米管表面上覆盖了一些由许多小颗粒堆积而成的大颗粒(主要是集中在纳米管顶端),直径可达微米级别。由图2的EDS图可见,刻蚀前TiO2纳米管表面有Ti、O、Sn、C等信号,其中Sn信号主要来自基底 FTO,C等信号来自仪器和样品表面的少量污染;而刻蚀后的 TiO2纳米管表面,除了Ti和O信号外还多出了较强的Cu信号,由此可推测SEM图中的大颗粒状物质为Cu或者Cu的氧化物。
为进一步确认刻蚀后 TiO2纳米管上沉积的Cu的价态,对其进行了XPS分析。图3是刻蚀后TiO2纳米管表面镂空区的XPS谱。从图3(a)的Cu 2p谱图可知,Cu 2p3/2和Cu 2p1/2分别为932.4和952.3 eV,与单质Cu相符,与CuO(其Cu 2p3/2峰值为933.7 eV)不符,且没有出现特征的CuO的震激伴峰,这说明了 TiO2纳米管表面不存在 CuO。但Cu和Cu2O的2p3/2峰位置相近(Cu为932.6 eV,Cu2O为932.5 eV),因此我们进一步通过Cu LMM俄歇谱区分表面的氧化状态。从图3(b)的Cu LMM俄歇谱可以观察到,图中有两个峰在 918.7和916.4 eV,分别归属于单质Cu和Cu2O。并且在918.7 eV处的峰很突出,916.4 eV处出现的峰很微弱,这表示在TiO2纳米管表面镂空区沉积的主要是单质Cu,以及微量的Cu2O。
3.2 光诱导约束刻蚀后TiO2纳米管表面Cu的沉积机制
关于Cu2+在TiO2表面光催化还原的生成机制和产物组成存在着不同的报道。Bideau等10认为,在TiO2上光催化还原沉积的产物为Cu(I)和Cu(0)的混合物。Foster等11认为,在光还原过程中,TiO2表面紫色的Cu沉积为Cu(I),是由Cu2+被TiO2生成的光生电子还原而成的。Lv等6认为,Cu2+是直接被光催化还原而成Cu(0),产物主要是Cu(0)的纳米粒子。这些不同可能是由于不同的反应条件引起的,如TiO2的晶型结构、形貌及掺杂,Cu2+的浓度,光照的强度和光照的时间等等,都会影响沉积及组成12。因此有必要研究光诱导约束刻蚀中TiO2纳米管表面Cu的沉积机制。

图2 光诱导约束刻蚀Cu的TiO2 NTs表面的SEM及EDS图Fig.2 SEM and EDS images of TiO2 NTs after photoinduced confined etching.(a, c) before etching, (b, d) after etching. 1% (w) glycine solution; pH ~5.8.

图3 光诱导约束刻蚀后TiO2纳米管表面的XPS能谱图Fig.3 Surface XPS spectra of TiO2 NTs after photoinduced confined etching.(a) Cu 2p, (b) Cu LMM.
光诱导约束刻蚀 Cu主要包括三个化学反应过程和三个传质过程。三个化学反应过程分别是光诱导产生刻蚀剂∙OH、∙OH 被清除、和∙OH 与Cu发生氧化反应。三个传质过程分别是刻蚀剂∙OH的传质过程、Cu被氧化后的产物Cu(II)的传质过程、和约束剂甘氨酸的传质过程。实验过程中未搅拌,可忽略对流的作用。在工具TiO2纳米管和工件Cu上都未施加电压,电迁移作用也可忽略。所以传质过程主要以扩散的方式进行,即主要是刻蚀剂∙OH从TiO2纳米管表面到Cu表面的扩散,氧化之后的Cu(II)从工件Cu表面向溶液本体的扩散,及溶液中的甘氨酸向TiO2纳米管与Cu之间的液层扩散。当这个液层缩小到微纳尺度时,三种扩散都受到很大限制。图 4(a)是光诱导约束刻蚀过程中刻蚀以及光催化沉积 Cu的机理示意图。TiO2纳米管在光激发下将同时产生空穴和电子,前者输运到表面构成氧化位点,而后者输运到表面产生还原位点。一方面,空穴在溶液环境中氧化生成刻蚀剂∙OH,∙OH扩散到Cu表面并将其刻蚀成 Cu2+,并与溶液中的约束剂甘氨酸(gly)形成可溶性络合物[Cu(gly)2]2+,该络合物将脱离表面从而实现工件 Cu表面的连续刻蚀。另一方面,光生电子倾向于沿纳米管管轴向传输,既会沿着纳米管传输到电极基底,也可能传输到纳米管顶端13,随着光照时间增加,在纳米管顶端的光生电子有可能发生一定程度的富集。由于TiO2的光生电子导带电位(CB)为−0.53 V (vs NHE (标准氢电极))14,E0(Cu2+/Cu0) = +0.340 V (vs NHE)15,当添加络合剂甘氨酸后,根据 Cu2+和甘氨酸及 Cu+和甘氨酸的二级络合常数lgβ,分别为15和10,计算得到E0([Cu(gly)2]2+/Cu0)、E0([Cu(gly)2]+/Cu0)和 E0([Cu(gly)2]2+/[Cu(gly)2]+)分 别 为 −0.103、−0.0712 和−0.138 V (vs NHE),均高于 TiO2的光生电子的电位16。因此,从热力学上说Cu2+被TiO2的光生电子还原是可行的。由于工具–工件之间的距离很小,为微米数量级,[Cu(gly)2]2+向外的扩散受到限制,随着光照时间的增加及刻蚀反应的进行,刻蚀产物[Cu(gly)2]2+将在该微米级别的液层之间逐渐累积,并且扩散到工具TiO2纳米管表面,从 TiO2纳米管上得到电子还原生成 Cu(0),生成的 Cu(0)还会进一步被溶液中含有的微量氧气氧化6。不同的是,跟纳米微粒膜相比,由于光生电子在纳米管末端沉积的 Cu颗粒上的富集使其较不容易被进一步氧化成 Cu2O,从而生成的Cu2O量较少。因此,在光诱导约束刻蚀体系中沉积在 TiO2纳米管表面的沉积产物主要为单质Cu(0),以及随后氧化生成的微量Cu2O。

图4 (a)光诱导约束刻蚀体系中Cu的刻蚀和光催化沉积的机制示意图和(b) Cu2O, TiO2和Cu的能带及费米能级图,pH = 7Fig.4 (a) Mechanism of the etching and photodeposition of Cu in photoinduced confined etching system (b) Energy band and Fermi level of Cu2O, TiO2 and Cu, pH = 7.
由于光诱导约束刻蚀反应后TiO2纳米管表面只有局部区域有Cu沉积,且沉积量有限,用常规的光电化学表征方法难以精确评估不同参数条件下沉积在TiO2纳米管上的Cu对于光电转换效率的影响。因此我们采用Cu(NO3)2和甘氨酸的混合溶液来模拟研究Cu2+在TiO2纳米管表面的光催化还原沉积及对TiO2纳米管光催化性能影响。通过比较不同光还原时间下 TiO2纳米管表面的 SEM图(图5(a–c))可看出,TiO2纳米管表面先是出现一些Cu的小颗粒,随着光还原时间的增加,Cu颗粒尺寸逐渐变大,表面的覆盖度也增大。这是由于,当少量Cu在表面成核后,在Cu和TiO2纳米管的接触面上,由于Cu的费米能级低于TiO2导带的费米能级,如 4(b)所示,导带上的电子会向金属颗粒迁移直至二者表面的费米能级相等17。因而随着反应的进行,最初生成的金属Cu颗粒会因聚集导带上的电子而作为后续还原沉积反应的形核核心,而起到催化的作用,使得Cu颗粒不断长大。
模拟液的pH为2.5时,光还原得到的Cu颗粒分布较宽易出现大尺寸颗粒且带有整齐的表面和棱角。Foster等18指出溶液的 pH在 0.60−6.60范围内,pH对Cu2+的光催化还原有着重要的影响。在碱性条件下,Cu离子易水解生成沉淀(光诱导约束刻蚀体系中生成的Cu离子浓度较低,不易出现此问题),因此我们进一步在pH为5.8的环境下考察模拟液中光催化沉积 Cu的形貌。如图 5(d)的SEM图所示,光催化还原60 min后,TiO2纳米管表面沉积的Cu与pH 2.5下得到的Cu相比,更像是由许多小颗粒团聚而成的疏松的团簇,与光诱导约束刻蚀 Cu体系中的沉积 Cu形貌更为相近。但因为该模拟溶液中的 Cu离子浓度远高于刻蚀体系的,因此沉积反应的速度快得多,使沉积的Cu颗粒更为小和分散。
从Cu/TiO2NTs复合电极表面的XPS谱(图S1(Supporting Information))可知,Cu 2p3/2和Cu 2p1/2分别为932.2和952.0 eV,与单质Cu相符,而且没有出现特征的CuO的震激伴峰,说明电极表面不存在CuO。从图S1(b)的Cu LMM俄歇谱来可观察到,图中有两个峰分别归属于单质Cu和Cu2O。这表明模拟液中在TiO2纳米管表面沉积的是单质Cu和Cu2O的混合物,和光诱导约束刻蚀体系中的成分的结果类似,但模拟液中沉积产物中Cu2O的含量较高。可能原因是该 Cu2+浓度下颗粒生长较快,难以生成大颗粒且颗粒间堆积较为疏松,存在大量的晶界,使得光生电子在Cu颗粒间传输时容易被捕获,失去对Cu的阴极保护,从而较为容易被氧化成Cu2O。

图5 不同光还原时间下Cu/TiO2 NTs电极的SEM图Fig.5 SEM of photo-reduced Cu/TiO2 NTs under different irradiation times.(a) 10 min; (b) 30 min; (c) 60 min; (d) 60 min; Solution contained 1% (w) glycine and 1.25% (w) Cu(NO3)2; (a, b, c) pH ~2.5; (d) pH ~5.8.

图6 TiO2 NTs和Cu/TiO2 NTs电极的吸收光谱图Fig.6 Absorption spectra of TiO2 NTs and Cu/TiO2 NTs.
为考察沉积Cu对TiO2纳米管光催化性能的影响,分别测定了 TiO2纳米管阵列光电极和Cu/TiO2纳米管阵列复合电极的吸收光谱和暂态光电流响应。图 6是采用固体透射方式测定的Cu/TiO2纳米管阵列复合电极的紫外可见吸收光谱。由图可见,沉积Cu后,复合电极的吸收带边由380 nm左右拓展到了500 nm左右,且350 nm以后的吸收均有明显增加。图 7是在白光照射下外加电位为0 V时的TiO2纳米管阵列电极和不同光催化还原时间下制备的 Cu/TiO2纳米管阵列电极的暂态光电流响应。从图7(a)的TiO2纳米管阵列电极的阳极光电流响应曲线中,未观察到光照开始和停止瞬间由表面态引起的明显的前后峰,由此可见所制备的TiO2纳米管晶型较好、表面态浓度小。从图 7(b)中三种光催化还原时间制备的Cu/TiO2纳米管复合电极的暂态光电流响应曲线可见,复合电极的光电流响应明显强于TiO2纳米管电极的,且随着光催化还原时间的增加,所得到的复合电极的光电流响应逐渐增强。与TiO2纳米管电极不同的是:在光照开始时,复合电极会出现一个先增大后减小的光电流瞬变。这可归咎于沉积Cu后TiO2纳米管阵列电极表面缺陷态增加。在光照瞬间,光生电子和空穴快速分离,光生电子的电化学复合与光生电子朝体相迁移到外电路产生一个正向的阳极光电流;由于表面缺陷态的存在,光生电子和空穴随即也会掉进表面态能级,发生表面态复合,使阳极光电流减小。之后,随着光生电子和空穴的分离及复合的动力学过程逐步趋于平衡,光电流又趋于稳定19。当沉积时间增加,复合电极的光电流增大。这首先可归咎于光吸收的增加(由吸收光谱图可见);其次,电子在TiO2和Cu之间重新富集,并由TiO2注入Cu中17,Cu作为电子捕获剂,阻止空穴和电子的重组。并且,激发电子快速转移到Cu上会增强电子和空穴的分离,因此光电流将明显增加9。第三,根据文献报道,适量的Cu2O掺杂不仅含有丰富的电子陷阱,也会捕获光生电子,从而有效地抑制光生载流子的复合,提高TiO2的光催化活性20。然而当光催化还原时间较长,如 60 min时,Cu/TiO2纳米管复合电极光电流响应又发生较大的变化:光电流先出现一个表面态的尖峰后,不是逐步趋向稳态而是又缓慢升高。我们认为,这可能是由于长时间沉积的Cu和Cu2O数量多到一定程度,作为p-型半导体的Cu2O自身的光电转换效应已不可忽略:刚开始其光生电子被溶液捕捉产生的阴极光电流成份会抵消一部分TiO2产生的阳极光电流;随着光照持续进行,由于能带匹配(见图4b的能带图)14,21,Cu2O导带上富集的电子又会通过Cu2O和TiO2之间的异质结界面传输给TiO2导带,反而增强TiO2的阳极光电流,随着这两个过程慢慢达到平衡,光电流也慢慢升高达到稳态。虽然实验结果表明,在目前条件下工具表面TiO2上沉积Cu有利于提高光催化性能,但对于光诱导约束平坦化的应用而言,也存在两个潜在的不利因素:第一,过量的Cu沉积可能会造成会破坏纳米管的原有形貌,造成工具表面的不平整,不利于平坦化;第二,反应过程中不断增加的沉积 Cu的光催化性能不利于控制刻蚀的速度和平坦化精度。因此,接下来我们也继续探索如何控制光诱导约束刻蚀的实验条件,以抑制纳米管表面Cu的沉积。
3.4 TiO2纳米管表面Cu沉积的抑制
刻蚀产物在工具–工件之间狭小空间内的扩散受限是TiO2纳米管上Cu沉积的主要原因之一。因此,抑制Cu沉积的思路之一就是改善刻蚀产物在工具–工件之间的传质。我们同时也尝试了通过引入搅拌和添加络合剂来控制工具表面TiO2层上的Cu沉积。
3.4.1 Cu沉积抑制实验中的pH的选择
pH既会影响TiO2的光催化,又会影响Cu离子的光催化还原。我们上一节在模拟液中的实验结果表明,在pH 5.8下Cu沉积相对于2.5下要快。Kabra等22指出溶液的 pH在2−10范围内,Cu2+的光催化沉积的量在pH为7左右达到最大值。而我们课题组之前的研究发现,pH为10左右时生成的游离态∙OH 浓度最高23。因此,我们比较了pH为5.8和10时TiO2纳米管表面Cu的沉积情况及Cu表面的刻蚀情况。
分别对在pH 5.8下和pH 10光诱导约束刻蚀后的Cu表面和TiO2纳米管表面做SEM,结果如图S2 (Supporting Information)所示。比较图S2(a)和(b)的TiO2表面可见,pH 10下TiO2纳米管表面沉积的Cu比pH 5.8下的颗粒更小且更为分散和均匀。这是因为pH 10下产生的·OH浓度更高,更容易刻蚀Cu表面,产生更多的Cu2+,使沉积的速度更快,因此沉积的面更广,颗粒更小。比较S2(c)和(d)的Cu表面可见,pH 10下Cu表面的刻蚀比pH 5.8下Cu表面的刻蚀更明显,这与pH 10下产生的·OH浓度更高的结论是相一致的。因此,后续选用溶液pH为10用于抑制Cu沉积的光诱导约束刻蚀实验。一来是因为刻蚀的效果更明显;二来是因为沉积的Cu的量足够大,更方便进行检测和比较。
3.4.2 引入搅拌和加入络合剂
引入外置搅拌,将在一定程度上促进工具–工件之间的液层与本体溶液的对流传质,使液层中的刻蚀产物[Cu(gly)2]2+尽快地被带离,降低其浓度,并使约束剂得到不断的补充,从而有效地增加Cu表面的刻蚀进程。为了探究引入搅拌对光诱导约束刻蚀体系的影响和抑制TiO2纳米管表面沉积Cu的情况,在pH 10下引入一系列转速,并进行光诱导约束刻蚀。其中不加转速、引入 1000 r∙min−1转速的光诱导约束刻蚀后的TiO2纳米管表面和 Cu表面的 SEM 表征分别如图 8和图 S3(Supporting Information)所示。1000 r∙min−1的图 8(b)相比于0 r∙min−1的图8(a),沉积的Cu颗粒更大。这是由于当引入1000 r∙min−1的外置转速后,外界对流在一定程度上能使液层中的[Cu(gly)2]2+更快地被带离,并补充约束剂,因此液层中的[Cu(gly)2]2+浓度更低,使得 Cu的生长更慢。但TiO2和Cu之间的距离相对自身的尺寸较小,随着时间的推移,刻蚀产物仍然将持续积累在距离很小的液层中,因此仍存在Cu的沉积。比较图S3(a)和 S3(b)可见,当引入 1000 r∙min−1的外置转速后,Cu表面的刻蚀情况有所加剧。这是因为外置搅拌会使液层中的[Cu(gly)2]2+更快地被带离,使刻蚀反应向正向移动,因此Cu表面的刻蚀情况随转速增加有所提高。由此可见,加入外置搅拌会抑制Cu的沉积,同时加剧刻蚀的程度。
在光诱导约束刻蚀体系中,络合剂的加入会增加Cu的去除率,防止形成氧化物膜进一步氧化。但同时络合剂还可能被∙OH氧化作为约束剂,起到约束剂的作用。因此,加入一个能络合Cu且不约束∙OH的络合剂将有助于对Cu表面的约束刻蚀。为了比较不同的络合剂对TiO2纳米管产生∙OH的影响,分别做了不同络合剂对游离∙OH浓度影响的荧光检测,如图S4 (Supporting Information)所示。当加入尿素后,对∙OH影响较小。对于氨水,荧光峰(曲线 c)很低,说明氨水会约束∙OH24。至于EDTA,荧光峰(曲线d)很低,这是因为EDTA会作为空穴捕获剂25,使得∙OH 的产生量下降。因此,只有尿素(曲线b)对体系中游离∙OH影响最小,而其他的络合剂均会与∙OH 反应或者抑制∙OH 的生成,因此这里选用尿素作为引入的络合剂。
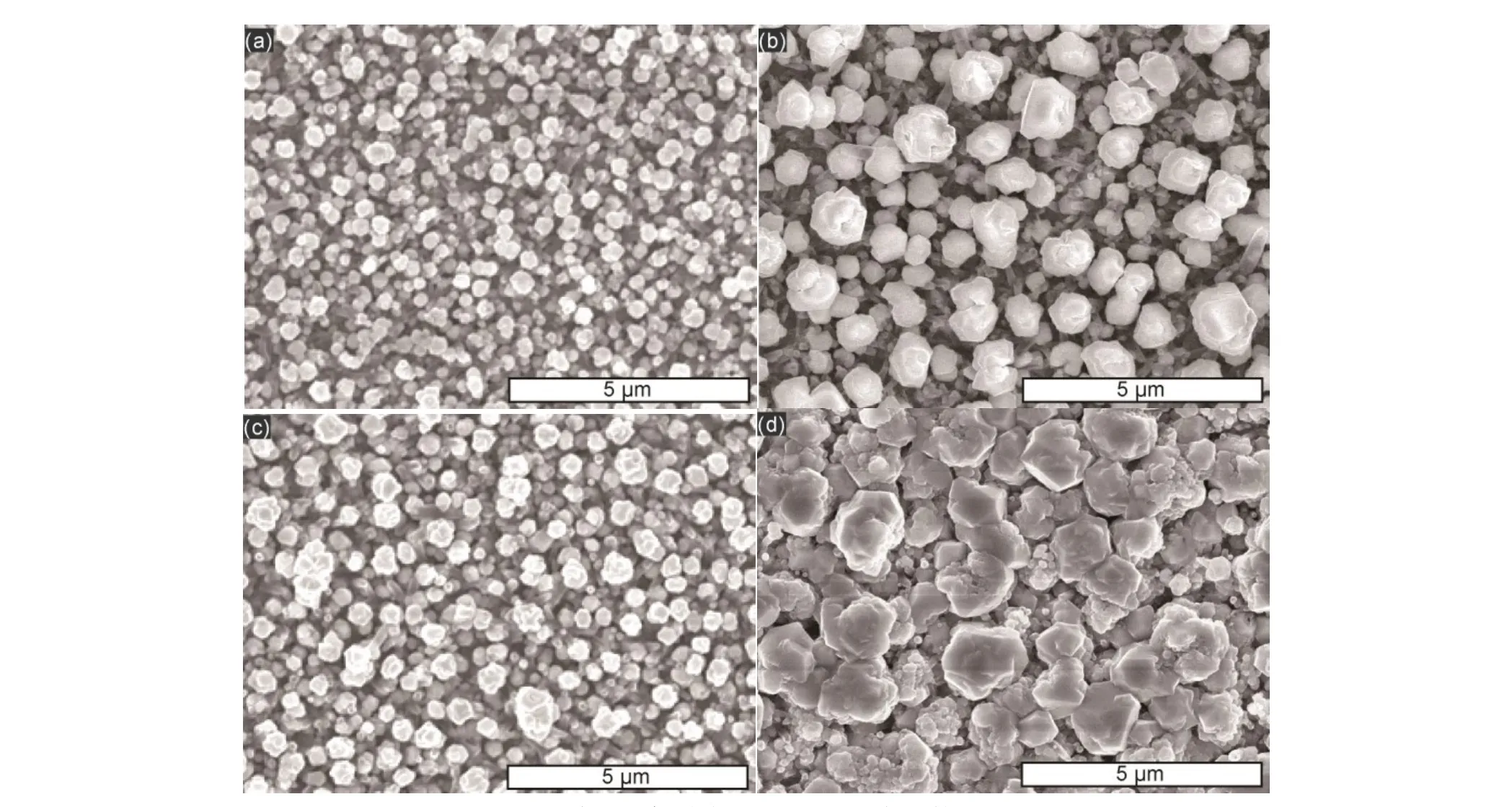
图8 光诱导约束刻蚀后TiO2 NTs表面的SEM图Fig.8 SEM of TiO2 NTs after photoinduced confined etching.(a) 0 r∙min−1, 1% (w) glycine; (b) 1000 r∙min−1, 1% (w) glycine; (c) 0 r∙min−1, 1% (w) glycine + 0.05 mol·L−1 urea;(d) 1000 r∙min−1, 1% (w) glycine + 0.05 mol·L−1 urea.
为了比较加入络合剂对光诱导约束刻蚀体系的影响和抑制TiO2纳米管表面沉积Cu的情况,分别对在pH 10下未搅拌、引入1000 r∙min−1搅拌的光诱导约束刻蚀及加入尿素后未搅拌和 1000 r∙min−1搅拌的光诱导约束刻蚀后,Cu表面和TiO2纳米管表面做SEM。比较未搅拌的图8(a, (c),及比较 1000 r∙min−1搅拌的图 8(b, d)可见,当加入络合剂后,TiO2纳米管表面沉积的Cu的颗粒更大,这和引入外置搅拌的原因一致,同样是因为Cu的生长速度更慢,使得颗粒更大,Cu的沉积受到了抑制。因此,加入外置搅拌和加入络合剂会更有利于Cu沉积的抑制。而加入尿素和1000 r∙min−1搅拌的图 8(d)比未搅拌和加尿素的图 8(b)沉积颗粒更大,也是因为沉积的Cu生长速度更慢,沉积受到了抑制。对于刻蚀后的Cu表面,比较未搅拌的图 S3(a)和 S3(c),及比较加入 1000 r∙min−1的图S3(b)和 S3(d)可见,当加入尿素后,Cu表面的晶型重整程度都有所减少,并且表面趋向于更加平坦。这是由于当 Cu表面与高浓度·OH反应,Cu氧化速度虽然较快,但是伴随着Cu的原位沉积26,长时间后Cu表面将出现晶型重整。当加入络合剂后,加入的络合剂将提高刻蚀产物被络合的程度,减少Cu的原位沉积。而减少刻蚀过程的晶型重整将有利于提高平坦化的程度。该结果在图S3(d)中最为明显。因此,加入外置搅拌的同时,加入络合剂不仅会提高约束刻蚀的程度,也将可能更有利于表面的平坦化。
由以上结果可见,通过改善传质来抑制Cu的沉积的方法虽然会在一定程度上增强光诱导约束刻蚀的程度,但未必都有利于Cu的表面的平坦化。由于工具和工件间的微纳米尺度液层中涉及多个化学和传质过程,如引入搅拌在改变刻蚀产物的传质的同时也会改变刻蚀剂的传质过程,使刻蚀剂在液层之间的分布变得不均一,即约束刻蚀层厚度的不均一,从而影响工件的抛光效果。为了解决这个问题,可在引入搅拌的同时通过控制工具和工件之间的相对运动(如相对旋转),将能有效地使抛光更均一。因此在抑制Cu沉积的方法和条件参数的选择上需同时评估多方面的影响。
4 结 论
通过SEM、EDS及XPS表征发现,在光诱导约束刻蚀Cu的过程中,工具TiO2纳米管表面会沉积单质Cu及少量Cu2O。Cu的沉积是由工具–工件之间累积的约束刻蚀产物[Cu(gly)2]2+在 TiO2纳米管表面被光激发下产生的电子还原生成的,而微量的Cu2O是由单质Cu随后氧化生成的。通过采用 Cu(NO3)2和甘氨酸的混合溶液模拟研究Cu2+在 TiO2纳米管表面的光催化还原沉积及对TiO2纳米管光催化性能的影响,进一步解释了沉积机制并发现沉积增强了TiO2纳米管的光催化性能:当少量Cu在表面成核后,会因聚集导带上的电子而作为后续还原沉积反应的形核核心,使得Cu颗粒不断长大;当TiO2纳米管表面沉积上Cu后,Cu/TiO2复合电极的吸收带边由380 nm左右拓展到了500 nm左右,增强了光吸收;随着光催化还原时间的增加,复合电极的光电流逐渐增强;还发现当光催化还原时间过长时,Cu2O自身的光电转换效应已不可忽略,出现不同的暂态光电流响应。虽然沉积Cu有利于增强TiO2纳米管的光催化性能,但过量的Cu沉积可能会改变工具表面的原有形貌,且反应过程中不断增加的沉积Cu不利于控制刻蚀速度和平坦化精度。初步的抑制实验表明:加入外置搅拌会使Cu的沉积更慢,在一定程度上抑制Cu的沉积,但加剧刻蚀的程度;而搅拌的同时加入络合剂尿素可能会更有利于 Cu表面的平坦化。所以,抑制Cu的沉积需要兼顾提高约束刻蚀和平坦化程度,抑制的方法和条件的选择需要同时考虑在微纳尺寸的工具–工件之间液层的多种化学反应和传质过程。
Supporting Information: available free of charge via the internet at http://www.whxb.pku.edu.cn.
(1) Tian, Z. W.; Fen, Z. D.; Tian, Z. Q.; Zhuo, X. D.; Mu, J. Q.; Li, C. Z.;Lin, H. S.; Ren, B.; Xie, Z. X.; Hu, W. L. Faraday Discussions 1992,94, 37. doi: 10.1039/FD9929400037
(2) Zhang, L.; Ma, X. Z.; Lin, M. X.; Lin, Y.; Cao, G. H.; Tang, J.; Tian,Z. W. J. Phys. Chem. B 2006, 110, 18432. doi: 10.1021/jp063110m
(3) Zu, Y. B.; Xie, L.; Mao, B. W.; Tian, Z. W. Electrochim. Acta 1998,43, 1683. doi: 10.1016/S0013-4686(97)00301-0
(4) Fang, Q. Y.; Zhou, J. Z.; Zhan, D. P.; Shi, K.; Tian, Z. W.; Tian, Z. Q.Chem. Commun. 2013, 49, 6451. doi: 10.1039/c3cc42368a
(5) Montini, T.; Gombac, V.; Sordelli, L.; Delgado, J. J.; Chen, X.;Adami, G.; Fornasiero, P. ChemCatChem 2011, 3, 574.doi: 10.1002/cctc.201000289
(6) Lv, X. J.; Zhou, S. X.; Zhang, C.; Chang, H. X.; Chen, Y.; Fu, W. F.J. Mater. Chem. 2012, 22, 18542. doi: 10.1039/c2jm33325b
(7) Canterino, M.; Somma, I. D.; Marotta, R.; Andreozzi, R. Water Res.2008, 42, 4498. doi: 10.1016/j.watres.2008.07.035
(8) Wu, N. L.; Lee, M. S. Int. J. Hydrog. Energy 2004, 29, 160.doi: 10.1016/j.ijhydene.2004.02.013
(9) Tseng, I. H.; Chang, W. C.; Wu, J. C. S. Appl Catal B:Environ 2002, 37, 37. doi: 10.1016/S0926-3373(01)00322-8
(10) Bideau, M.; Claudel, B.; Faure, L.; Rachimoellah, M. Chem.Eng. Commun. 1990, 93, 167.doi: 10.1080/00986449008911444
(11) Foster, N. S. ; Noble, R. D. ; and Kovel, C. A. Environ. Sci.Technol. 1993, 34, 3865. doi: 10.1021/es00039a016
(12) Jacobs, J. W. M.; Kampers, F. W. H.; Rikken, J. M. G.;Bulle-Lieuwma, C. W. T.; Koningsberger, D. C.J. Electrochem. Soc. 1989, 136, 2914.doi: 10.1149/1.2096373
(13) Beranek, R.; Tsuchiya, H.; Sugishima, T.; Macak, J. M.;Taveira, L.; Fujimoto, S.; Kisch, H.; Schmuki, P. Appl. Phys.Lett. 2005, 87, 167. doi: 10.1063/1.2140085
(14) Xiong, Z. G.; Zhao, X. S. J. Mater. Chem. A 2013, 1, 7738.doi: 10.1039/c3ta11247k
(15) Tavares, M. C.; Machado, S. A. S.; Mazo, L. H. Electrochim.Acta 2001, 46, 4359. doi: 10.1016/S0013-4686(01)00726-5
(16) Kiss, T.; Sovago, I.; Gergely, A. Pure Appl. Chem., 1991, 63,597. doi: 10.1351/pac199163040597
(17) Wood, A.; Giersig, M.; Mulvaney, P. J. Phys. Chem. B 2001,105, 8810. doi: 10.1021/jp011576t
(18) Foster, N. S.; Lancaster, A. N.; Noble, R. D.; Koval, C. A. Ind.Eng. Chem. Res. 1995, 34, 3865. doi: 10.1021/ie00038a025
(19) Tafalla, D.; Salvador, P.; Benito, R. M. J. Electrochem. Soc.1990, 137, 1810. doi: 10.1149/1.2086809
(20) Xin, B. F.; Wang, P.; Ding, D. D.; Liu, J.; Ren, Z. Y.; Fu, H. G.Appl. Surf. Sci. 2008, 254, 2569.doi: 10.1016/j.apsusc.2007.09.002
(21) Bessekhouad, Y.; Robert, D.; Weber, J. V. Catal. Today 2005,101, 315. doi: 10.1016/j.cattod.2005.03.038
(22) Kabra, K.; Chaudhary, R.; Sawhney, R. L. J. Hazard. Mater.2007, 149, 680. doi: 10.1016/j.jhazmat.2007.04.028
(23) Hu, Y.; Fang. Q. Y.; Zhou, J. Z.; Zhan, D. P.; Shi, K.;Tian, Z.Q.; Tian, Z. W. Acta Phys. -Chim. Sin., 2013, 29 (11) , 2392.[胡 艳, 方秋艳, 周剑章, 詹东平, 时 康, 田中群, 田昭武. 物理化学学报, 2013, 29 (11) , 2392.]doi: 10.3866/PKU.WHXB201309043
(24) Hickel, B.; Sehested, K. Radiat. Phys. Chem. 1992, 39, 355.doi: 10.1016/1359-0197(92)90244-A
(25) Qu, P.; Zhao, J. C.; Shen, T.; Hidaka, H. J. Mol. Catal. A:Chem. 1998, 129, 257. doi: 10.1016/S1381-1169(97)00185-4
(26) Kirino, O.; Enomoto, T. Precis. Eng. 2011, 35, 669.doi: 10.1016/j.precisioneng.2011.05.0
Deposition and Inhibition of Cu on TiO2Nanotube Photoelectrode in Photoinduced Confined Etching System
HUANG Ya-Yu FANG Qiu-Yan ZHOU Jian-Zhang*ZHAN Dong-Ping SHI Kang TIAN Zhong-Qun
(State Key Laboratory of Physical Chemistry of Solid Surfaces and Department of Chemistry, College of Chemistry and Chemical Engineering, Xiamen University, Xiamen 361005, Fujian Province, P. R. China)
A photoinduced confined etching system was used for the unstressed chemical planarization of Cu. Cu deposits were found on the surface of TiO2nanotubes of the tool during the photoinduced confined etching of the Cu workpiece. Scanning electron microscopy, energy-dispersive X-ray spectroscopy, and X-ray photoelectron spectroscopy were used to analyze the morphology and composition of the Cu deposits, and the mechanism of the photodeposition of Cu in the micro/nanoscale liquid layer between the tool and the workpiece was investigated. Moreover, a simulated cupric solution was used to study the effect of the Cu deposits during the photoinduced confined etching. Several routes including stirring and complexing agent were used to investigate the inhibition of Cu deposition on the surface of TiO2nanotubes and the simultaneous effect on the etching of Cu workpiece. The results showed that the Cu deposits enhanced the photocatalytic performance of TiO2nanotubes, but the mechanism of enhancement changed with the increase in Cu deposits. Inhibition of Cu deposition byimproving mass transfer can lead to the increase in the etching of Cu; addition of complexing agent combined with enhanced mass -transfer can inhibit Cu deposition, while improving the planing effect.Thus, the choice of inhibition methods and conditions should balance the effect of the micro/nano liquid layer between the tool and workpiece on multiple chemical reactions and mass transfer processes. The results provide an important guiding significance for further regulation and optimization of the photoinduced confined etching system.
Photo-induced confined etching; TiO2nanotube arrays; ∙OH; Scavenging agent;Photo-deposition of Cu; Mass transfer
April 13, 2017; Revised: May 2, 2017; Published online: May 12, 2017.
O649
10.3866/PKU.WHXB201705125 www.whxb.pku.edu.cn
*Corresponding author. Email: jzzhou@xmu.edu.cn; Tel: +86-0592-2189663.
The project was supported by the National Natural Science Foundation of China (91023043, 21021002, 91023006).
国家自然科学基金(21273182, 21533006, 21621091)资助项目
© Editorial office of Acta Physico-Chimica Sinica

