单分散铁氧体纳米颗粒的生长机制与成分偏聚的透射电子显微研究
刘为燕 李亚东 ,2 刘 甜 干 林 ,2,*
(1清华大学深圳研究生院,能源与环境学部,广东 深圳 518055;2清华大学深圳研究生院,材料与器件检测中心,电子显微镜实验室,广东 深圳 518055)
单分散铁氧体纳米颗粒的生长机制与成分偏聚的透射电子显微研究
刘为燕1李亚东1,2刘 甜1干 林1,2,*
(1清华大学深圳研究生院,能源与环境学部,广东 深圳 518055;2清华大学深圳研究生院,材料与器件检测中心,电子显微镜实验室,广东 深圳 518055)
理解纳米晶的生长机制对单分散纳米晶的可控合成至关重要。本文以热分解法制备的双金属铁氧体(钴铁氧和锰铁氧)纳米颗粒为例,利用透射电子显微镜(TEM)系统研究了铁氧体纳米晶的生长机制,揭示了由此造成的成分偏聚现象。对不同时间阶段的反应产物的分析结果表明,两步加热法(即先后在相对低的温度和相对高的温度下加热反应)是制备高质量的单分散铁氧体纳米晶的关键;通过控制低温反应阶段的时间可实现纳米晶的形核阶段和生长阶段的有效分离,从而有利于单分散纳米晶的合成。利用扫描透射电子显微镜(STEM)及电子能量损失谱(EELS)谱学成像技术分析,我们进一步发现了双金属铁氧体纳米晶中的成分偏聚现象,表明双金属铁氧体纳米晶在形核阶段主要形成富Fe的核芯,而在生长阶段则形成更富Co/Mn的双金属铁氧体壳层。这些结果对制备高质量的单分散铁氧体纳米晶具有重要的指导意义,同时也有助于正确理解热分解法制备的铁氧体纳米晶的表面成分和相关表面物理化学性质。
纳米晶生长机制;铁氧体;表面偏聚;透射电子显微镜;电子能量损失谱
1 引 言
铁氧体纳米晶在催化1−8、磁存储9、生命医学9−14等领域应用潜力巨大,且其原料在地壳中储量丰富,备受材料研究者的重视。近年来人们研发出了许多种铁氧体纳米晶的制备方法,如共沉淀法4,5、热分解法1,8,9,15−17、喷雾热解法18、电沉积法2等。其中,孙守恒等报道的采用有机金属前驱体(如过渡金属的乙酰丙酮盐)在高沸点溶剂中的热分解法1,9,16,因其制备的铁氧体纳米晶(如Fe3O4,CoFe2O4,MnFe2O4)具有尺寸均匀、单分散性好等特点,受到人们的广泛关注19。尽管如此,目前对热分解法制备铁氧体纳米晶的生长机制仍缺乏系统的认识,而这对制备高质量的单分散纳米颗粒具有重要的意义。该法采用首先在较低温度下(如 200 °C)加热,然后在较高的温度(265−300 °C)再加热的两步加热方式1,9,16,才能得到高质量的单分散纳米晶;对这两步加热的目的和原因目前仍不太清楚。同时,近年来在双金属纳米晶的生长机制研究中逐渐发现不同金属元素具有不同的生长轨迹,由此造成纳米晶中显著的成分偏聚现象,进一步对纳米晶的化学性质产生显著的影响20−22。双组元金属氧化物纳米晶是否也存在类似的成分偏聚现象,未见相关的研究报道。
事实上,相比已被广泛研究的金属纳米晶的生长机制20−25,对金属氧化物纳米晶的生长机制的认识十分匮乏。Liang等26通过原位液体池透射电镜技术初步研究了在电子束还原作用下双金属铁氧体纳米晶的原位生长机制,发现过渡金属离子的还原电位以及金属前驱体的分解温度是控制纳米颗粒的形核生长的两个重要参数;金属离子的还原电位过低,或金属前驱体的分解温度过高,均不利于氧化物纳米晶的形核和生长。尽管原位液体透射电镜研究提供了许多有用的信息,但对实际液相热分解法制备铁氧体纳米晶中两步加热反应阶段中各阶段的生长机制,尤其是不同金属元素的生长轨迹仍不是很清楚。
本文我们利用(扫描)透射电子显微镜及电子能量损失谱谱学成像技术,结合X射线衍射分析,详细研究了热分解法合成高质量、单分散的双组元铁氧体纳米晶(钴铁氧和锰铁氧)的生长机制。我们发现,两步加热法是制备高质量的单分散铁氧体纳米晶的关键,通过控制两步加热阶段的时间,可以有效地实现纳米晶形核过程和生长过程的分离,有利于单分散纳米晶的制备。我们还发现,纳米晶生长过程中首先形成的是富Fe的核芯,而随后在其表面生长更富Co/Mn的壳层,最终导致制备的铁氧体纳米晶中具有显著的成分偏聚现象。这些结果对制备高质量的单分散铁氧体纳米晶以及正确理解纳米晶的表面物理化学性质具有重要的意义。
2 实验部分
2.1 试 剂
乙酰丙酮铁(Fe(acac)3,97%)、乙酰丙酮钴(Co(acac)2,≥ 99.0%)、乙酰丙酮锰(Mn(acac)2,97%)、油胺(> 70%)、油酸(90%)、1,2-十四烷二醇(90%)及苄醚(99%)等试剂均购于Alfa Aesar公司,导电炭黑(Carbot Vulcan XC-72)购于上海卡博特公司。
2.2 热分解法合成铁氧体纳米晶的样品制备
纳米颗粒采用孙守恒等9报道的热分解法。具体方法是称量 1 mmol Co(acac)2、2 mmol Fe(acac)3、10 mmol十四烷二醇、6 mmol油胺、6 mmol油酸及20 mL苄醚,加入到50 mL容量的三颈烧瓶中,在氮气氛围中搅拌加热至110 °C,保持半小时,以去除前驱体中含有的少量水分;然后将温度升至200 °C,反应2 h,此时溶液颜色转为黑色,表明纳米晶的形核生长已经开始;最后升温至265 °C,反应1 h。自然冷却至室温后,用无水乙醇离心洗涤多次,最后将得到的产物CoxFe3−xO4纳米晶。将前驱体中 Co(acac)2换成Mn(acac)2,采用同样的方法可合成MnxFe3−xO4。
为了系统研究纳米晶的生长机制,可利用玻璃滴管在不同反应阶段抽取小量反应液体迅速降至室温后,转移到离心管中并加入乙醇进行离心洗涤,然后将纳米晶均匀分散在正己烷中,取少量纳米晶溶胶滴于3 mm直径的铜载网上,彻底干燥后用于透射电子显微镜观察。
2.3 透射电子显微镜、扫描透射电子显微镜及电子能量损失谱表征
实验采用的透射电镜为美国 FEI公司 Tecnai G2F30场发射透射电镜,加速电压300 kV,配置有牛津仪器的X-MAX 80T EDX (energy dispersive X-ray spectrum)探头以及Fischione 3000高角度环形暗场像(HAADF)探头。纳米晶形貌图在TEM模式下获取,成分由EDX分析器获得,选取5个以上大面积区进行EDX成分分析并计算标准差。电子能量损失谱谱学成像(EELS)在STEM模式下获得,主要采集O的K边及Mn、Fe、Co的L边信号,束斑尺寸选择spot size 7,相机长度为80 mm,置入HAADF探头,像素设置为32 × 32,电子束驻留时间0.2 s。为了减小电子束辐照损伤的影响,采集前后分别获取纳米晶的STEM图像以确定其形貌无明显变化。
X射线衍射谱(XRD)利用日本理学公司Rigaku D/MAX 2500/PC型号X射线衍射仪来表征材料晶体结构,光源为Cu Kα(λ = 0.154 nm),测试角度范围 10°到 90°,扫速为 5 (°)·min−1。
3 结果与讨论
3.1 钴铁氧(CFO)尖晶石纳米晶的生长机制
我们首先研究了热分解法制备钴铁氧尖晶石纳米晶的生长机制。制备过程主要由两步组成:首先在较低温度下(200 °C)反应一段时间,然后在较高的温度下(265 °C)继续反应一段时间,最终得到单分散的纳米晶产物。图 1(a−d)分别显示了在200 °C下反应0.5、1、1.5和2 h后的纳米晶形貌,其相应的颗粒尺寸分布图如图 1g所示(每个样品的统计样本数大于250个纳米颗粒)。随着反应时间增加至1.5 h (图1a−c),平均颗粒尺寸由4.2 nm缓慢增加至 4.9 nm;当反应时间继续延长至 2 h(图 1c, d),平均颗粒尺寸几乎不再发生变化。这一结果说明在该反应阶段,纳米晶主要以形核为主,而生长速度较慢。
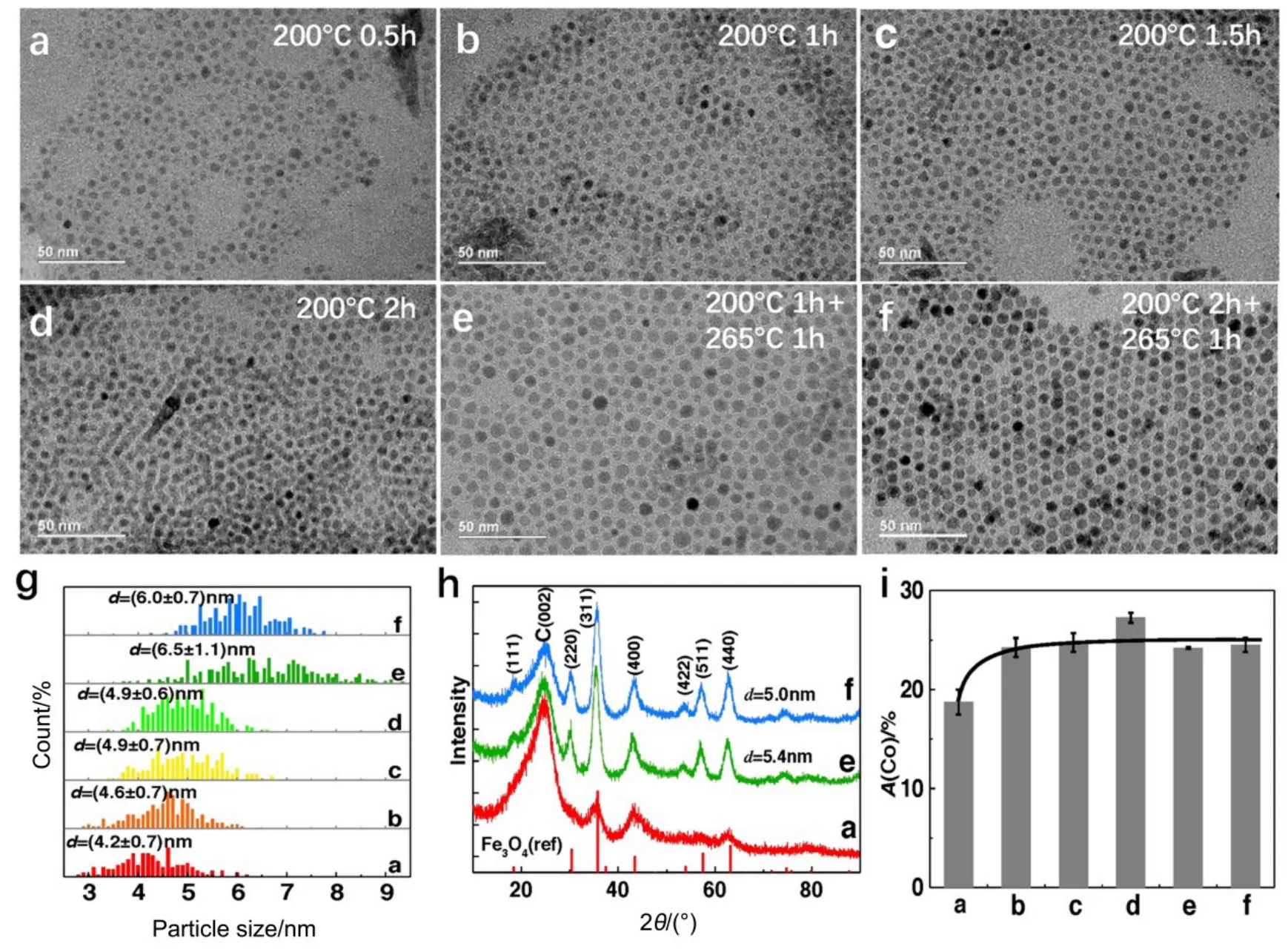
图1 前驱体中Co(acac)2 : Fe(acac)3摩尔比为1 : 2时不同反应阶段所得到的CFO纳米颗粒形貌、尺寸及成分变化Fig.1 Morphology, size and compositional evolution of CFO nanoparticles prepared with nominal molar ratio of n(Co(acac)2) : n(Fe(acac)3) = 1 : 2 at different growth stages.(a−d) CFO nanoparticles prepared by thermal decomposition at 200 °C for 0.5, 1, 1.5 and 2 h, respectively; (e, f) CFO nanoparticles prepared by thermal decomposition at 200 °C for 1 and 2 h, respectively and subsequently heated at 265 °C for 1 h; (g) particle size distributions at different stages;(h) XRD patterns of CFO nanoparticles supported on carbon support, and (i) Co compositional evolution at different growth stages. A: atomic fraction;color online.
图1e和f分别为在200 °C下反应1 h和2 h后继续升高反应温度至265 °C反应1 h所形成的纳米晶颗粒。相比于图1 (b, d),图1(e, f)中纳米晶的颗粒尺寸明显增大,表明在这一阶段生长速度显著加快。有趣的是,图1f的平均粒径(6.0 nm)不仅比图1e (6.5 nm)要稍小、而且粒径分布更窄、尺寸更加均匀。这表明,低温加热阶段的反应时间对最终纳米晶的平均尺寸和单分散性有显著影响:延长低温反应时间,可使最终得到的纳米晶尺寸更均匀、单分散性更好。图1 h给出了不同反应阶段的 XRD图,其衍射峰位与反尖晶石型Fe3O4的(111)、(220)、(311)、(400)、(511)、(440)晶面一一对应,表明不同反应阶段的纳米晶均属于反尖晶石结构。进一步利用Scherer公式计算出图1e和图1f阶段的纳米晶平均尺寸分别为5.4 nm和5.0 nm,同样表明图1f阶段纳米晶的尺寸更小,这与TEM结果一致。
为了更深入理解纳米晶中各元素的生长轨迹及成分变化,我们进一步利用EDX对不同阶段纳米晶的至少 5个大面积区进行了成分分析并计算标准差,其变化趋势如图1i所示。在生长初期(图1a阶段),纳米颗粒表现出富Fe的成分(Co18Fe82),远低于金属前驱体中的名义成分(Co33Fe67),说明反应初期形成的晶核更富Fe。这可能是由于Fe3+在反应初期很容易被溶液中的还原剂十四烷二醇还原(Fe3+/Fe2+标准电极电势为 0.77 V)并形成Fe3O49,26,而Co2+则相对较难被还原(Co2+/Co的标准电极电势−0.28 V)26;同时,Fe(acac)3的分解温度(180 °C)与 Co(acac)2比较接近(约 175 °C)27,因此在还原剂的作用下反应初期形成更富 Fe的核心。而随反应时间延长,纳米颗粒中Co的成分逐渐增加至 Co25Fe75左右,表明在反应后期纳米晶表面可能形成更富 Co的壳层。这一结果被STEM-EELS谱学成像进一步证实(图 2),结果发现纳米晶中确实存在核芯富 Fe、表面富 Co的成分偏聚现象。
根据已有的文献报道21,24,单分散纳米晶的生长机制主要有LaMer28模型和Finke29模型两种不同的生长模式。前者的特点是短时间内的快速形核随后缓慢均匀的生长,而后者则是连续缓慢形核以及自催化的表面生长。综合上述结果,我们认为:(1) 在低温反应阶段,钴铁氧纳米晶的形核生长主要服从Finke模型,即以连续缓慢的形核为主(且形核成分主要富Fe),而生长速度较慢(如图3所示);但随着反应时间延长,纳米晶的形核数量逐渐增多,溶液中金属前驱体浓度的下降,形核过程也逐渐结束;(2) 在高温反应阶段,纳米晶生长速度显著加快;其最终颗粒的尺寸和单分散性取决于低温阶段的反应时间:低温反应时间越长,形核数量越多,形核过程也越接近结束期,因此在高温阶段纳米晶的生长主要在已有的晶核上进行,避免了形核与生长过程的耦合,有利于形成尺寸分布更窄的单分散纳米晶(对比图 1e和图1f)。这一结果解释了此前在孙守恒等的工作中为什么直接一步加热至高温(265 °C)反而无法得到单分散纳米晶,充分说明了在热分解法制备单分散铁氧体纳米晶过程中不同反应阶段的作用。
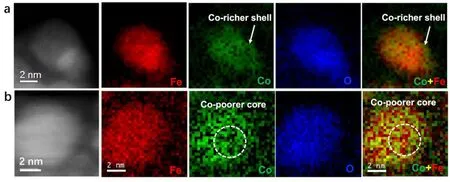
图2 利用STEM-EELS谱学成像获得的钴铁氧纳米晶中的元素分布图Fig.2 STEM-EELS elemental mapping of as-prepared CFO nanocrystals(a) 200 °C 2 h; (b) 200 °C 2 h + 265 °C 1 h
3.2 锰铁氧(MFO)尖晶石纳米晶的生长机制
为了验证我们揭示的生长机制是否适用于其他铁氧体纳米晶,我们同样采用热分解法合成方法合成了锰铁氧纳米颗粒(图4),并重点研究了低温阶段(200 °C)的反应时间对纳米晶的平均尺寸和单分散性的影响。在保持265 °C反应时间不变(1 h)的条件下,随着前期200 °C反应阶段的时间从0.5 h延长至2 h (图4(a−c)),最终得到的纳米晶的平均颗粒尺寸逐渐减小(6.1, 5.8, 5.6 nm,见图4d),并且其尺寸分布逐渐变窄,单分散性更强。这一尺寸变化趋势同样得到了 XRD分析结果(图4e)的支持。这说明,与钴铁氧纳米晶类似,锰铁氧纳米晶在200 °C反应阶段主要以连续缓慢的形核为主(Finke生长机制),该阶段反应时间越长,形核数量越多,从而导致高温生长阶段主要以生长为主,最终的纳米晶尺寸也越小并且越均匀。
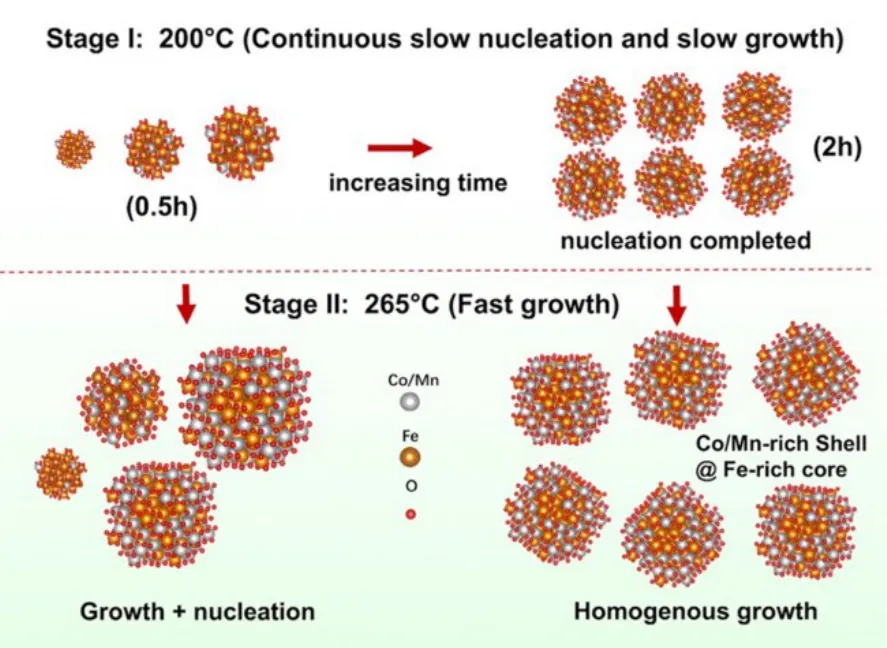
图3 热分解法制备铁氧体纳米晶的生长机制示意图Fig.3 Schematic diagram of growth mechanism of ferrite nanocrystals prepared by thermal decomposition.
通过大面积的EDX成分分析发现,MFO纳米晶的 Mn的含量(Mn7Fe93–Mn17Fe83)远低于其名义成分(Mn33Fe67),也低于钴铁氧纳米晶中 Co的含量(Co25Fe75)。这是由于Mn(acac)2不仅其分解温度(250 °C)远 高 于 Co(acac)2(175 °C)和Fe(acac)3(180 °C),同时 Mn2+/Mn 标准还原电极电势 (−1.18 V)也 远 低 于 Co2+/Co(−0.28 V)和Fe3+/Fe2+(0.77 V),从而导致加热过程中Mn的生长速度远低于 Co和 Fe。在我们的实际热分解反应条件下,虽然高温加热阶段的温度已超过Mn(acac)2的分解温度,但生成 MFO纳米晶 Mn的含量仍然严重偏低。这一结果也暗示着,在200 °C反应阶段(低于Mn(acac)2的分解温度)主要形成的是FeOx晶核,而在265 °C反应阶段(高于Mn(acac)2的分解温度)将会形成锰铁氧壳层。尽管如此,所形成的纳米晶仍然呈现单晶结构,如图4f中的高分辨TEM像所示,其与反尖晶石结构的<111>带轴符合很好。
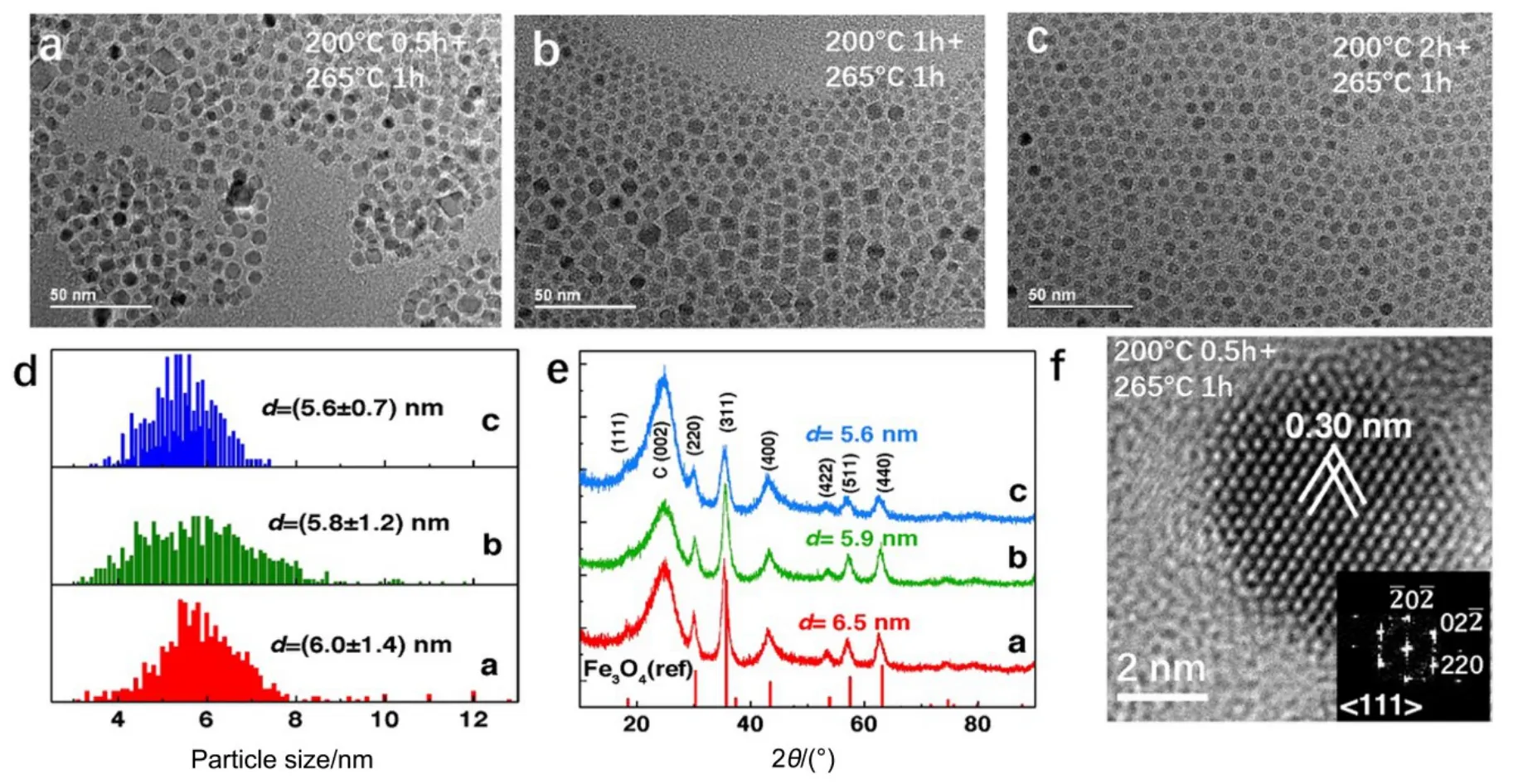
图4 改变低温反应阶段反应时间制备所得到的MFO纳米颗粒Fig.4 Preparation of MFO nanoparticles by changing the reaction time at low temperature stage.(a) 200 °C for 0.5 h, 265 °C for 1 h; (b) 200 °C for 1 h, 265 °C for 1 h; (c) 200 °C for 2 h, 265 °C for 1 h; (d) particle size distributions with the average sizes and standard deviations indicated; (e) XRD patterns; (f) high-resolution TEM image of a MFO nanocrystal in(a) oriented along <111> zone axis (inset shows the fast Fourier Transform pattern).
为了验证MFO纳米晶中的核壳结构,图5进一步给出了利用 STEM-EELS谱学成像得到的图4a中 MFO纳米晶的元素分布图,可以清楚地看到,其较大的颗粒(颗粒i)具有富Fe的核心和更富Mn的壳层;而较小的颗粒(颗粒ii和颗粒iii)则基本上只含有 Fe和 O,表明其为 FeOx颗粒。这进一步验证了在MFO纳米晶生长过程中,初期形成FeOx晶核、而后期形成更富 Mn的壳层,且这种偏聚程度比CFO纳米晶更为明显。这种偏聚结构的稳定存在也表明,即使在265 °C高温反应阶段,纳米晶内部并没有明显的离子扩散以抵消这种成分偏聚现象。通过计算其EELS能量损失峰中Mn及 Fe的L边的L3峰与L2峰的比值(图 5b),可以得出该氧化物中Mn和Fe的平均价态分别为+230和+2.530,31,表明相对于纯的Fe3O4反尖晶石结构,Mn2+占据Fe2+位,而Fe(acac)3则被部分还原成Fe2+和Fe3+,与MFO反尖晶石结构符合得较好。
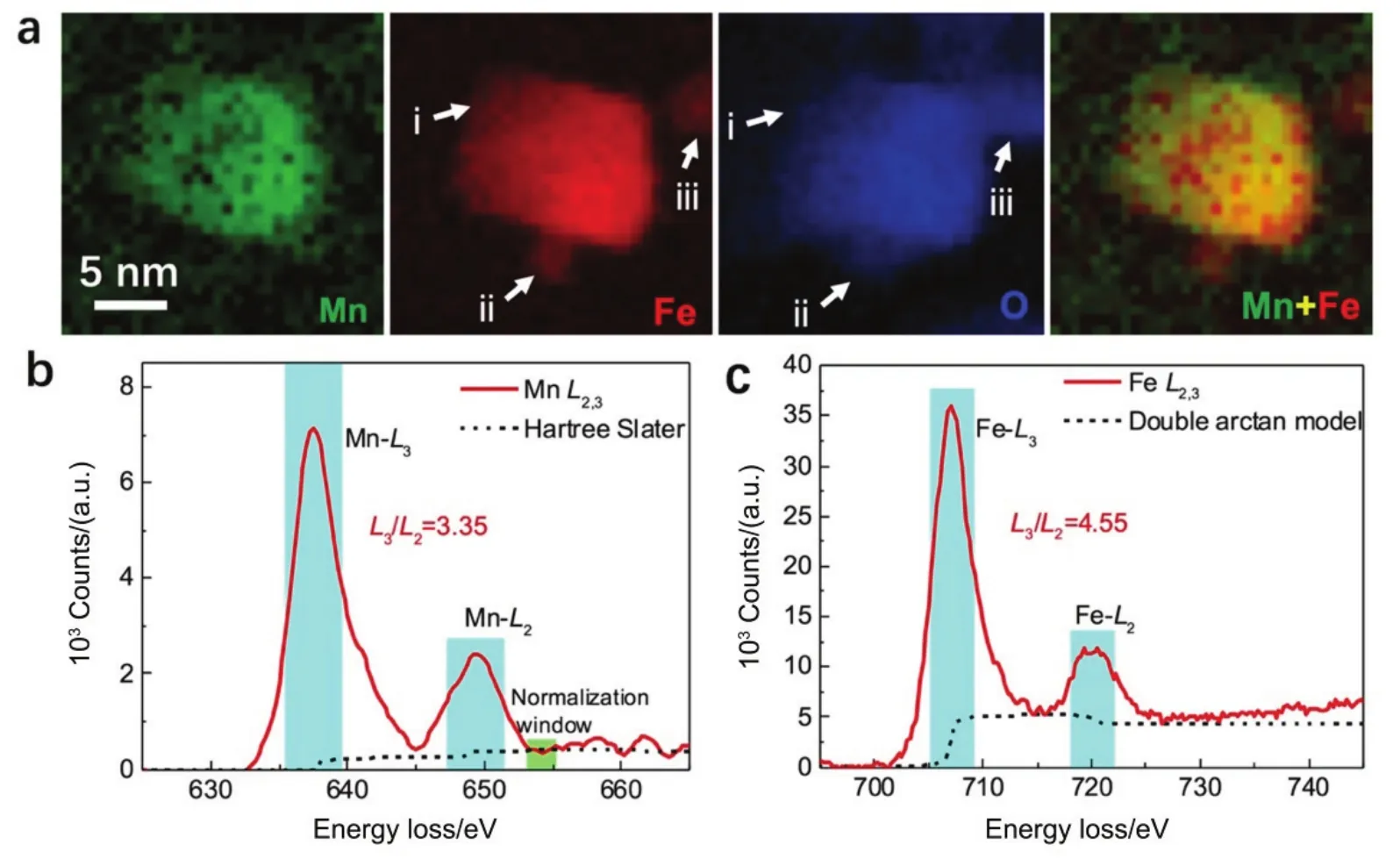
图5 利用STEM-EELS谱学成像获得的MFO纳米晶中的元素分布及Mn元素和Fe元素的价态分析Fig.5 (a) STEM-EELS mapping of MFO nanocrystals and (b) EELS spectra of Mn and Fe.The background-subtracted Mn-L2,3 edge and Fe-L2,3 edge are modeled with Hartree-Slater30 and double arctan model31, respectively.L3: 2p3/2→3d3/23d5/2; L2: 2p1/2→3d3/2.
4 结 论
利用透射电子显微镜、扫描透射电子显微镜及电子能量谱谱学成像技术,我们详细研究了热分解法合成单分散钴铁氧和锰铁氧纳米晶颗粒的生长机制。结果显示铁氧体纳米晶的形核生长过程服从Finke机制,具有连续缓慢形核的特征。通过两步加热法,可以在一定程度上将形核过程和生长过程分离开来:在低温反应阶段主要以连续缓慢的形核为主,而在高温反应阶段纳米晶以生长为主。低温反应时间越长,形核过程和生长过程分离越明显,最终得到的产物尺寸越均匀,单分散性越高。利用电子能量损失谱谱学成像进一步发现,纳米晶在形核过程中生成富Fe核芯,而在生长过程中形成表面更富 Co/Mn的壳层(尤其是 MFO纳米颗粒)。上述结果一方面有助于我们如何控制热分解法的反应条件获得高质量的单分散铁氧体纳米晶;另一方面,所揭示的特殊表面成分偏聚现象对正确理解热分解法制备的铁氧体纳米晶的物理化学性质具有重要的作用。
(1) Zhu, H.; Zhang, S.; Huang, Y. X.; Wu, L.; Sun, S. Nano Lett. 2013,13, 2947. doi: 10.1021/nl401325u
(2) Sartale, S. D.; Lokhande, C. D.; Ganesan, V. Phys. Status Solidi A 2005, 202, 85. doi: 10.1002/pssa.200406898
(3) Wu, Z. S.; Yang, S.; Sun, Y.; Parvez, K.; Feng, X.; Mullen, K. J. Am.Chem. Soc. 2012, 134, 9082. doi: 10.1021/ja3030565
(4) Singh, J. P.; Singh, N. K.; Singh, R. N. Int. J. Hydrog. Energy 1999,24, 322. doi: 10.1016/S0360-3199(98)00084-6
(5) Singh, N. K.; Singh, R. N. Indian J. Chem. 1999, 38, 491.
(6) Singh, R. N.; Singh, J. P.; Lal, B.; Thomas, M. J. K.; Bera, S.Electrochim. Acta 2006, 51, 5515. doi: 10.1016/j.electacta.200602028
(7) Landon, J.; Demeter, E.; İnoğlu, N.; Keturakis, C.; Wachs, I. E.;Vasić, R.; Frenkel, A. I.; Kitchin, J. R. ACS Catal. 2012, 2, 1793.doi: 10.1021/cs3002644
(8) Khurshid, H.; Li, W. F.; Chandra, S.; Phan, M. H.; Hadjipanayis, G.C.; Mukherjeea, P.; Srikanth, H. Nanoscale 2013, 5, 7942.doi: 10.1039/c3nr02596a
(9) Sun, S.; Zeng, H.; Robinson, D. B.; Raoux, S.; Rice, P. M.; Wang, S.X.; Li, G. J. Am. Chem. Soc. 2004, 126, 273. doi: 10.1021/ja0380852
(10) Xie, J.; Liu, G.; Eden, H. S.; Ai, H.; Chen, X. Y. Acc. Chem.Res. 2011, 44, 883. doi: 10.1021/ar200044b
(11) Kumar, C. S.; Mohammad, F. Adv. Drug Deliv. Rev. 2011, 63,789. doi: 10.1016/j.addr.2011.03.008
(12) Hao, R.; Xing, R.; Xu, Z.; Hou, Y.; Gao, S.; Sun, S. Adv.Mater. 2010, 22, 2729. doi: 10.1002/adma.201000260
(13) Liong, M.; Lu, J.; Kovochich, M.; Xia, T.; Ruehm, S. G.; Nel,A. E.; Tamanoi, F.; Zink, J. I. ACS Nano 2008, 2, 889.doi: 10.1021/nn800072t
(14) Kikuchi, T.; Kasuya, R.; Endo, S.; Nakamura, A.; Takai, T.;Metzler-Nolte, N.; Balachandran, J. J. Magn. Magn. Mater.2011, 323, 1216. doi: 10.1016/j.jmmm.2010.11.009
(15) Xu, Z. C.; Shen, C. M.; Hou, Y. L.; Gao, H. J.; Sun, S. S.Chem. Mater. 2009, 21, 1778. doi: 10.1021/cm802978z
(16) Zeng, H.; Rice, P. M.; Wang, S. X.; Sun, S. J. Am. Chem. Soc.2004, 126, 11458. doi: 10.1021/ja045911d
(17) Jana, N. R.; Chen, Y. F.; Peng, X. G. Chem. Mater. 2004, 16,3931. doi: 10.1021/cm049221k
(18) Li, M.; Xiong, Y.; Liu, X.; Bo, X.; Zhang, Y.; Han, C.; Guo, L.Nanoscale 2015, 7, 8920. doi: 10.1039/c4nr07243j
(19) Harris, R. A.; Shumbula, P. M.; van der Walt, H. Langmuir 2015, 31, 3934. doi: 10.1021/acs.langmuir.5b00671
(20) Gan, L.; Cui, C. H.; Heggen, M.; Dionigi, F.; Rudi, S.;Strasser, P. Science 2014, 346, 1502.doi: 10.1126/science.1261212
(21) Gan, L.; Rudi, S.; Cui, C. H.; Heggen, M.; Strasser, P. Small 2016, 12, 3189. doi: 10.1002/smll.201600027
(22) Niu, Z. Q.; Becknell, N.; Yu, Y.; Kim, D.; Chen, C.;Kornienko, N.; Somorjai, G. A.; Yang, P. D. Nat. Mater. 2016,15, 1188. doi: 10.1038/nmat4724
(23) Zheng, H. M.; Smith, R. K.; Jun, Y. W.; Kisielowski, C.;Dahmen, U.; Alivisatos, A. P. Science 2009, 324, 1309.doi: 10.1126/science.1172104
(24) Snyder, J.; McCue, I.; Livi, K.; Erlebacher, J. J. Am. Chem.Soc. 2012, 134, 8633. doi: 10.1021/ja3019498
(25) Xia, Y. N.; Xiong, Y. J.; Lim, B.; Skrabalak, S. E. Angew.Chem. Int. Edit. 2009, 48, 60. doi: 10.1002/anie.200802248
(26) Liang, W.; Zhang, X.; Bustillo, K.; Chiu, C. H.; Wu, W. W.;Xu, J.; Chu, Y. H.; Zheng, H. Chem. Mater. 2015, 27, 8146.doi: 10.1021/acs.chemmater.5b03930
(27) Zhang, F.; Yuan, C.; Zhu, J.; Wang, J.; Zhang, X.; Lou, X. W.D. Adv. Funct. Mater. 2013, 23, 3909.doi: 10.1002/adfm.201203844
(28) LaMer, V. K.; Dinegar, R. H. J. Am. Chem. Soc. 1950, 72,4847. doi: 10.1021/ja01167a001
(29) Watzky, M. A.; Finke, R. G. J. Am. Chem. Soc. 1997, 119,10382. doi: 10.1021/ja9705102
(30) Schmid, H. K.; Mader, W. Micron 2006, 37, 426.doi: 10.1016/j.micron.2005.12.004
(31) Van Aken, P. A.; Liebscher, B. Phys. Chem. Miner. 2002, 29,188. doi: 10.1007/s00269-001-0222-6
Investigation of the Growth Mechanism and Compositional Segregations of Monodispersed Ferrite Nanoparticles by Transmission Electron Microscopy
LIU Wei-Yan1LI Ya-Dong1,2LIU Tian1GAN Lin1,2,*
(1Division of Energy and Environment, Graduate School at Shenzhen, Tsinghua University, Shenzhen 518055, Guangdong Province,P. R. China;2Electron Microscopy Laboratory, Materials and Devices Testing Center, Graduate School at Shenzhen,Tsinghua University, Shenzhen 518055, Guangdong Province, P. R. China)
Understanding the growth mechanism of nanocrystals is crucial for the synthesis of high-quality monodispersed nanoparticles. In contrast to the widely studied growth mechanism of metal nanocrystals, the growth mechanism of metal oxide nanoparticles is still poorly understood. Exemplified by cobalt/manganese ferrite nanoparticles prepared by thermal decomposition, we reveal the growth mechanism and associated compositional segregations of bimetallic metal oxide nanoparticles by using transmission electron microscopy combined with electron energy loss spectroscopy (EELS). We found that a two-stage heating protocol, involving a first-stage heating at a relatively lower temperature followed by a second-stage heating at a relatively higher temperature, is crucial to synthesize monodispersed ferrite nanoparticles. Controlling the reaction time of the first-stage heating can effectively decouple the nucleation stage and growth stage of ferrite nanoparticles, leading to monodispersed nanoparticles with anarrow size distribution. EELS spectrum imaging further reveals previously unreported compositional segregations in the as-prepared ferrite nanoparticles, suggesting that an Fe-rich core formed at the nucleation stage and a Co-/Mn-rich shell formed at the growth stage. Our results provide useful insight into the synthesis of high-quality monodispersed metal oxide nanoparticles as well as a correct understanding of the surface chemistry and related physiochemical properties of spinel oxide nanocrystals prepared by thermal decomposition.
Nanocrystal growth mechanism; Ferrite nanocrystals; Surface segregation;Transmission electron microscopy; Electron energy loss spectroscopy
March 30, 2017; Revised: May 2, 2017; Published online: May 18, 2017.
O642
10.3866/PKU.WHXB201705186 www.whxb.pku.edu.cn
*Corresponding author. Email: lgan@sz.tsinghua.edu.cn; Tel: +86-755-26032622.
The project was supported by the Guangdong Natural Science Foundation for Distinguished Young Scholars, China (2016A030306035) and Shenzhen Basic Research Program, China (JCYJ20160531194754308).
广东省自然科学基金杰出青年项目(2016A030306035)和深圳市基础研究项目(JCYJ20160531194754308)资助
© Editorial office of Acta Physico-Chimica Sinica

