制备方法对Nd2O3上过氧物种光诱导生成的影响
吴 倩 翁维正 刘春丽 黄传敬 夏文生 万惠霖
(厦门大学固体表面物理化学国家重点实验室,醇醚酯化工清洁生产国家工程实验室,化学化工学院化学系,福建 厦门 361005)
制备方法对Nd2O3上过氧物种光诱导生成的影响
吴 倩 翁维正*刘春丽 黄传敬 夏文生 万惠霖*
(厦门大学固体表面物理化学国家重点实验室,醇醚酯化工清洁生产国家工程实验室,化学化工学院化学系,福建 厦门 361005)
分别采用水解、水热和燃烧法制备了三种主要物相均为立方Nd2O3的样品。以325 nm激光为激发源,在室温和空气气氛下对上述样品上过氧物种的光诱导生成情况进行了比较考察。经Raman光谱仪的激光束照射后,三种样品上均可检测到过氧物种的生成,但燃烧法制备的样品上过氧的生成速率显著大于其他两种样品。O2-和CO2-TPD(程序升温脱附)的表征结果表明,与水解和水热法制备的立方Nd2O3相比,燃烧法制备的样品表面含有更多的低配位晶格氧物种,晶格氧的碱性也更强,因而更有利于在光诱导下与分子氧反应生成过氧物种。
氧化钕;制备方法;光诱导反应;过氧物种;晶格氧
1 引 言
分子氧在固体催化剂表面的吸附和活化是多相选择氧化研究中的重要课题之一1,2。本课题组3−5在采用Raman光谱对O2气氛下的稀土倍半氧化物进行原位表征时发现,在激光的照射下,分子氧可与稀土氧化物表面的晶格氧反应生成过氧物种。这一现象的发现不仅丰富了对分子氧在阳离子价态不变的金属氧化物表面活化和转化机理的认识,也为分子氧在氧化物表面的活化提供了一条新途径。在后续的工作中我们进一步发现,过氧物种的光诱导生成情况还与稀土氧化物的预处理条件以及其物相等因素密切相关6,7。考虑到氧化物的制备方法有许多,包括沉淀法8,9,溶剂热法10,11,水热法12−14,燃烧法15−17,溶胶凝胶法18,19和水解法20,21等。不同的制备方法将直接影响样品尺寸,形貌及表面结构,进而影响其物理和化学性质。为了进一步探究影响稀土倍半氧化物表面过氧物种光诱导生成的因素,本文采用水解、水热和燃烧法制备了三种Nd2O3样品。以325 nm激光为激发源,在室温和空气气氛下对上述样品上过氧物种的光诱导生成情况进行了比较考察,并采用低温N2吸附、X射线粉末衍射(XRD)、拉曼(Raman)光谱、扫描电子显微镜(SEM)、CO2-和O2-程序升温脱附(TPD)等实验技术对影响上述样品表面过氧物种生成的关键因素进行了表征。
2 实验部分
2.1 样品的制备
水解法:样品的制备参照文献21。称取研细后的商品Nd2O3(99.99%,Alfa Aesar) 1.0 g,于管式炉中加热至110 °C后用O2/N2体积比为21/79 混合气(50 mol∙L−1)鼓泡带入室温下的饱和水蒸气水解100 h,得到Nd(OH)3,接着在管式炉中通入 O2/N2体积比为 21/79混合气(30 mol∙L−1),以 10 °C∙min−1的速率升温至 650 °C焙烧3 h,得到的样品标记为Nd2O3-H。
水热法:样品的制备参照文献12。称取1.0 g商品Nd2O3于200 mL反应釜中,加入100 mL去离子水,超声10 min后,置于110 °C烘箱中水热反应24 h。所得固体用去离子水离心洗涤3次后于烘箱中 110 °C干燥 12 h,得到白色Nd(OH)3固体。将白色固体研磨后在管式炉中通入 O2/N2体积比为 21/79 混合气(30 mol∙L−1),以10 °C∙min−1的速率升温至 650 °C 焙烧 3 h,得到的样品标记为Nd2O3-HT。
燃烧法:样品的制备参照文献15。向1.0 g商品 Nd2O3中加入 5.0 mL 浓硝酸(14.4 mol∙L−1,国药集团上海化学试剂公司)至完全溶解,再加入0.22 g甘氨酸(分析纯,国药集团上海化学试剂公司),于85 °C水浴锅上加热搅拌至溶胶状态。冷却后在马弗炉中于以 10 °C∙min−1的速率升温至650 °C焙烧3 h,再将固体转移至管式炉中并通入 O2/N2体积比为 21/79混合气(30 mol∙L−1),以 10 °C∙min−1的速率升温至 650 °C焙烧3 h,得到的样品标记为Nd2O3-C。
2.2 样品的表征
拉曼(Raman)光谱测试在英国 Renishaw UV-Vis RT 1000和Renishaw in via显微拉曼光谱仪上进行。两台光谱仪器均采用Leica显微系统,以CCD为检测器,以325 nm (He-Cd激光器),457 nm (固体激光器),514.5 nm (固体激光器)和 633 nm (固体激光器)等波长的激光为激发光源。采用325 nm的激光为激发光源时,使用OFR LMU 15倍NUV物镜,Raman光谱仪的分辨率约为6 cm−1。采用457、514和633 nm激光为激发光源时,使用Leica PL Fluotar 50倍物镜,Raman光谱仪的分辨率约为4 cm−1。
样品的比表面积采用 BET方法在美国Micromeritics Tristar 3020型物理吸附仪上测定。样品用量约为1.0 g,以氮气为吸附质,吸附温度为−196 °C。吸附前,样品先在 200 °C 下抽真空处理2 h。
X射线粉末衍射(XRD) 实验在日本Rigaku Ultima IV型X射线粉末衍射仪上进行,采用石墨单色器滤光。测定条件为:Cu Kα(λ =0.15406 nm),管压为40 kV,管电流为30 mA,扫描范围 10°−90°,扫描速率为 10 (°)∙min−1。
SEM表征在日本Hitachi冷场发射扫描电子显微镜S-4800上进行,加速电压为15 kV。将样品分散于无水乙醇中,超声30 min后,均匀滴到硅片上,自然晾干,备用。
CO2程序升温脱附(CO2-TPD)实验在自行搭建的TPD-MS (Hiden Analytical QIC-20型四极质谱仪)装置上进行。具体实验步骤如下:称取0.50 g样品,在He (99.999%,爱康尼克气体有限公司,20 mol∙L−1)气氛中以 20 °C∙min−1的速率升温至650 °C处理0.5 h,降至20 °C后切入 CO2(99.995%,林德气体有限公司,20 mol∙L−1) 吸附 30 min,再切入 He 吹扫 1 h 至基线平稳后从 20 °C 开始以 20 °C∙min−1的速率进行程序升温,终止温度为950 °C。采用质谱在线跟踪离子碎片,m/z:44 (CO2),32 (O2),28(CO),18 (H2O),16 (O2)。
O2程序升温脱附(O2-TPD)实验在自行搭建的TPD-MS (Hiden Analytical QIC-20型四极质谱仪)装置上进行。具体实验步骤如下:称取1.0 g样品,在 O2/Ar 体积比为 5/95混合气(20 mol∙L−1)中以 20 °C∙min−1的速率升温至 650 °C处理1 h后在O2/Ar气氛下降至20 °C并停留1 h,再切入高纯 He (20 mol∙L−1)吹扫 1 h 至基线平稳后从 20 °C 开始以 20 °C∙min−1的速率进行程序升温,终止温度为930 °C。采用质谱在线跟踪离子碎片,m/z:32 (O2)、44 (CO2)、28 (CO)、18 (H2O)、16 (O2)。
3 结果与讨论
3.1 不同方法制备的 Nd2O3上过氧物种光诱导生成考察
我们首先以325 nm激光(5.5 mW)为激发源,在室温和空气气氛下分别考察了水解、水热和燃烧法制备的Nd2O3上过氧物种的光诱导生成情况,相关的Raman谱图见图1(a−c)。从图中可以看出,三种方法制备的Nd2O3表面均可检测到位于336、406、438、542、833和1079 cm−1处的Raman谱带,其中位于336、406和542 cm−1等处的谱峰为立方相Nd2O3的特征峰22,23,位于833 cm−1的谱峰源于光诱导生成的过氧物种的O―O键伸缩振动24。位于438 cm−1处的谱峰归属于六方Nd2O3的Raman谱带25,26,而位于1079 cm−1处的Raman谱带可归属于碳酸盐物种的特征振动峰27,28。在其他实验条件相同的情况下,三种Nd2O3样品表面经激光照射后均能检测到位于833 cm−1的过氧物种O―O键伸缩振动峰。随着激光照射时间的延长,位于336 cm−1处归属于立方Nd2O3晶格氧振动的Raman谱带强度逐渐减弱,而位于833 cm−1处归属于过氧物种的Raman谱带强度逐渐增加,与此同时,位于438 cm−1处归属于六方Nd2O3的Raman谱带强度也逐渐增加,这与景孝廉等以325 nm激光照射O2气氛下的立方Nd2O3所观察到的现象一致4,7。
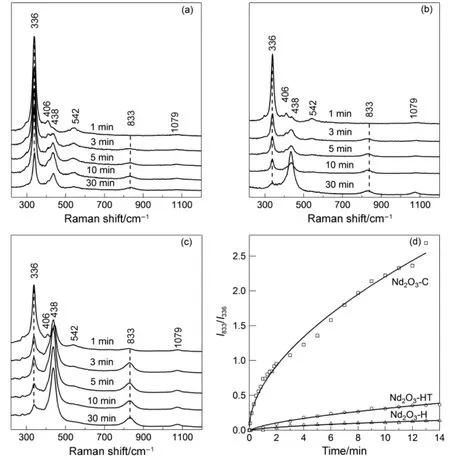
图1 (a)水解(Nd2O3-H)、(b)水热(Nd2O3-HT)和(c)燃烧(Nd2O3-C)法制备的Nd2O3在室温和空气中用325 nm (5.5 mW)激光照射后过氧物种生成的Raman谱图以及(d)各样品上833与336 cm−1谱带强度比(I833/I336)随光照时间的变化Fig.1 Raman spectra of the peroxide formation induced by 325 nm laser (5.5 mW) at 25 °C under air over the Nd2O3 synthesized by (a) hydrolysis (Nd2O3-H), (b) hydrothermal (Nd2O3-HT) and (c) combustion (Nd2O3-C)methods, and (d) the intensity ratio of the Raman peaks at 833 and 336 cm−1 (I833/I336) as a function of photo irradiation time for the above three samples.
值得注意的是经30 min光照后,三个样品上过氧谱带的强度差异较大。为了更清楚地说明各样品上过氧谱带的增长速率,我们以位于833 cm−1处过氧物种的谱带强度与位于336 cm−1处立方Nd2O3的谱带强度之比对光照时间作图来衡量各样品表面过氧谱带的增长速率,相关的结果见图1(d)。可以看出在三个样品中水解法制备的Nd2O3-H上过氧谱带的增长速率最慢,而以燃烧法制备的Nd2O3-C样品上过氧谱带的增长速率远高于其他两种方法制备的Nd2O3-H和Nd2O3-HT样品,说明Nd2O3-C样品更有利于过氧的光诱导生成。
3.2 样品的比表面积测试以及物相和形貌表征
考虑到不同制备方法可能影响样品的比表面积,相结构和形貌,进而影响样品上过氧物种光诱导生成速率6,7。为探明不同方法制备的Nd2O3样品上过氧物种光诱导生成速率的差异是否源于样品的比表面积,相结构和形貌的差异,我们采用低温 N2吸附、XRD、Raman和SEM等实验技术对相关样品进行了表征。
表 1列出了水解、水热和燃烧法制备的Nd2O3的低温N2吸附表征结果。各样品的比表面积均较小,其中水热法制备的Nd2O3-HT比表面积最大,达到 13.6 m2·g−1,燃烧法制备的Nd2O3-C比表面积次之,水解法制备的Nd2O3-H比表面积最小,只有 6.7 m2·g−1。显然 Nd2O3的比表面与其表面过氧物种的光诱导生成速率并没有直接的对应关系,说明 Nd2O3的比表面不是影响过氧物种生成速率的主要因素。
图 2为采用水解、水热和燃烧法制备的Nd2O3的XRD图。三种方法制备的Nd2O3样品上均出现了立方相 Nd2O3的衍射峰(2θ =19.72°,27.99°,32.41°,34.43°,38.19°,41.69°,46.42°,50.89°,53.74°,55.06°,56.40°,57.71°,对应的PDF卡片为03-065-3184)。在水解和水热法制备的样品上还可检测出少量归属于六方Nd2O3的衍射峰(2θ = 30.9°,对应的 PDF 卡片为03-065-6729),且前者上六方Nd2O3含量多于后者,但与立方相相比,六方 Nd2O3的含量要低得多。
为了进一步确认不同方法制备的 Nd2O3在物相结构上可能存在的差异,我们分别以波长为325、457、514和633 nm的激光为激发源对相关样品物相进行了Raman光谱表征。为了避免激光照射对样品组成或结构(如生成过氧物种导致样品向六方相Nd2O3转化等)的影响4,7,我们将摄谱时照射到样品表面的激光功率控制在0.1 mW左右,所得结果见图3。从图中可以看出,采用不同波长激光所摄取的Raman谱图十分相似。三种方法制备的 Nd2O3均可在 121、336、406和540 cm−1附近检出与立方Nd2O3相关的Raman谱峰,说明样品的主要成分为立方Nd2O3。由水解和水热法制备的样品在107、195和438 cm−1附近还可检出一组强度较弱,可归属为六方Nd2O3的Raman谱峰25,26,其中位于107和195 cm−1的Raman谱带为Nd―O的弯曲振动,而位于438 cm−1的Raman谱带为Nd―O的伸缩振动。水解法制备的 Nd2O3样品上六方相的谱峰强度略高于水热法制备的样品。这些结果与XRD的表征结果完全一致。在先前的工作中我们发现,O2气氛下的立方 Nd2O3在 325 nm的激光照射下可生成过氧物种。但在相同实验条件下,六方 Nd2O3上则检测不到过氧物种的生成。造成两种结构的 Nd2O3上过氧物种光诱导生成性能显著差异的原因可能是立方相的Nd2O3较六方相含有更多氧空位,因而更有利于对分子氧的吸附和活化7。然而从三种方法制备的Nd2O3的XRD图和Raman谱图可以看出,三个样品的主要物相均为立方 Nd2O3,因此依据XRD和Raman的表征结果,仍难以说明相关样品上过氧物种光诱导生成速率的差异。
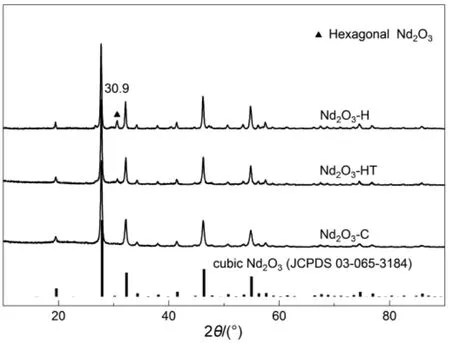
图 2 水解(Nd2O3-H)、水热(Nd2O3-HT)和燃烧(Nd2O3-C)法制备的Nd2O3的XRD图Fig.2 XRD patterns of the Nd2O3 synthesized by hydrolysis (Nd2O3-H), hydrothermal (Nd2O3-HT) and combustion (Nd2O3-C) methods.
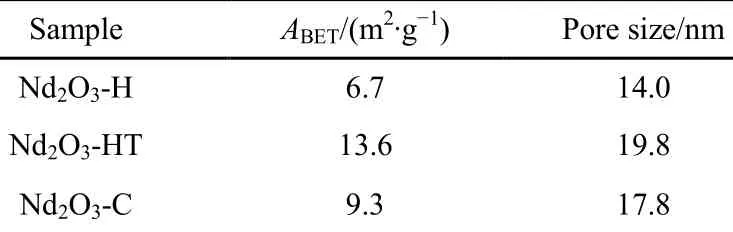
表1 水解(Nd2O3-H)、水热(Nd2O3-HT)和燃烧(Nd2O3-C)法制备的Nd2O3的比表面积(ABET)Table 1 BET surface area (ABET) of the Nd2O3 samples synthesized by hydrolysis (Nd2O3-H), hydrothermal(Nd2O3-HT) and combustion (Nd2O3-C) methods.

图3 (a)水解、(b)水热和(c)燃烧法制备的Nd2O3的Raman光谱Fig.3 Raman spectra of the Nd2O3 synthesized by (a) hydrolysis, (b) hydrothermal and (c) combustion methods.

图4 (a)水解、(b)水热和(c)燃烧法制备的Nd2O3的SEM照片Fig.4 SEM images of the Nd2O3 synthesized by (a) hydrolysis, (b) hydrothermal and (c) combustion methods.
图 4为水解、水热和燃烧法制备的 Nd2O3的SEM照片。从图中可以看出,三种Nd2O3的形貌差异较大,水解和水热法制备的 Nd2O3均由不规整的颗粒堆积而成,其中水热法制备的Nd2O3粒径小于水解法,这与其比表面积大于水解法的结果一致。燃烧法制备的 Nd2O3为片状结构,尺寸较大,排布也较为松散,这可能与燃烧法15的特点有关。在燃烧法制备 Nd2O3的过程中,体系中的甘氨酸与稀土硝酸盐在空气中加热至一定温度时会发生剧烈的燃烧反应并放出的大量气体,这不仅有助于阻止分解过程中生成的 Nd2O3颗粒的聚集,也有助于热量的迅速扩散,从而防止产物的烧结。燃烧过程结束后,体系温度迅速降低,易生成活性高的亚稳态粉末,氧化物上可能出现缺陷集中和非平衡物相29,这些因素都有可能影响稀土氧化物的表面结构,进而影响其表面过氧物种的生成速率。
3.3 CO2-和O2-TPD表征
鉴于稀土倍半氧化物(Ln2O3)表面过氧物种的光诱导生成本质是分子氧在光照条件下对Ln2O3晶格氧的氧化,因此稀土氧化物表面晶格氧性质是影响过氧生成的重要因素之一3,4,7。先前研究表明,随着镧系元素原子序数的增加,晶格氧的碱性逐渐下降,分子氧与稀土倍半氧化物晶格氧反应生成过氧物种的难度逐渐加大4。研究还发现,在激光的诱导下,Ln2O3表面和体相的晶格氧均可参与过氧的生成,与六方相的 Ln2O3相比,含较多氧空位的立方相Ln2O3更有利于过氧物种的生成4,5,7,说明晶格氧所处的微环境也是影响过氧光诱导生成的重要因素。为了确认三种方法合成的立方 Nd2O3上晶格氧性质是否存在差异,我们对相关样品进行CO2-和O2-TPD表征。
图 5为三种方法制备的立方 Nd2O3的CO2-TPD表征结果。可以看出在所考察的温度范围内(20−950 °C),各样品的 CO2-TPD 图上都出现了两至三个较强 CO2脱附峰,对应于样品上不同强度的碱中心。其中,位于400 °C附近的低温脱附峰对应于样品表面中等强度的碱中心,位于800 °C以上的高温脱附峰,对应于样品表面的强碱中心30−32。不同方法制备的立方Nd2O3样品的低温脱附峰温均在408 °C附近,但 Nd2O3-C的高温脱附峰温高于其他两个样品,说明其表面晶格氧的碱性强于水解和水热法制备的 Nd2O3,在与分子氧的反应过程中较易于给出电子,进而有利于过氧物种的生成。在水解和水热法制备的 Nd2O3中,后者晶格氧的碱性强于前者,因而更有利于过氧的生成,这与实验观测到的两者上过氧光诱导生成的相对速率(图1)也是一致的。
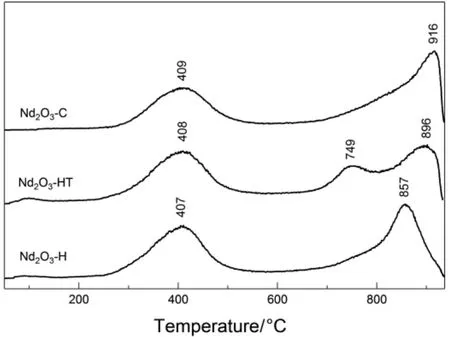
图5 水解(Nd2O3-H)、水热(Nd2O3-HT)和燃烧(Nd2O3-C)法制备的Nd2O3的CO2-TPD图Fig.5 CO2-TPD profiles of the Nd2O3 synthesized by hydrolysis (Nd2O3-H), hydrothermal (Nd2O3-HT) and combustion (Nd2O3-C) methods.
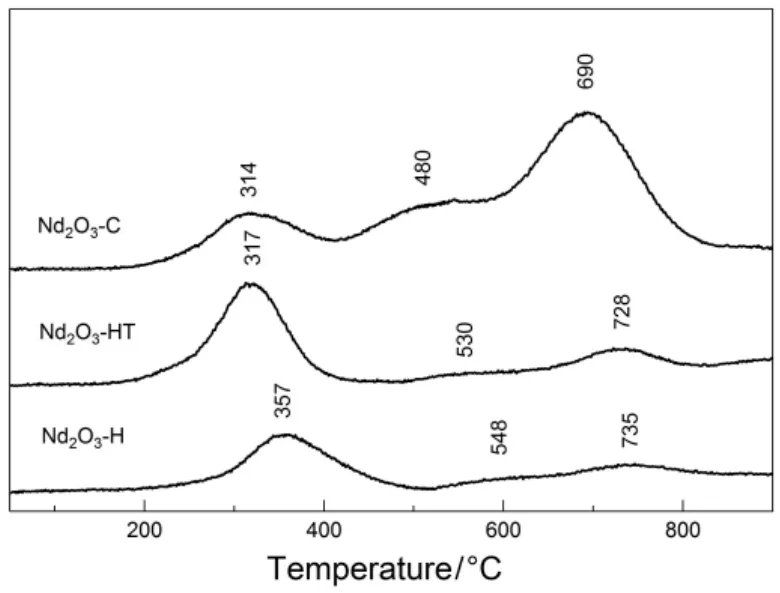
图6 水解(Nd2O3-H)、水热(Nd2O3-HT)和燃烧(Nd2O3-C)法制备的Nd2O3的O2-TPD图Fig.6 O2-TPD profiles of the Nd2O3 synthesized by hydrolysis (Nd2O3-H), hydrothermal (Nd2O3-HT) and combustion (Nd2O3-C) methods.
图6给出了相关样品的O2-TPD表征结果。各样品上均可检出三组 O2脱附峰,分别位于314−357 °C、480−548 °C 以及 690−735 °C,但在水解和水热法制备的 Nd2O3样品上,后两组峰的强度较弱。参考相关文献33−36可将O2-TPD谱中脱附峰温低于600 °C的物种归属为吸附于样品表面的分子态和原子态氧物种,如O2,O2−,O22−和 O−等,将脱附峰温位于 690−735 °C 物种归属于样品表面晶格氧物种的脱附。Huang等37在采用 TPD-MS技术考察 La2O3上氧物种的脱附时发现,经700 °C通O2预处理后的La2O3仅在344 °C处检出一组O2脱附峰,这一结果与本文中水解和水热法制备的立方 Nd2O3的O2-TPD谱类似。Jiang等38采用类似的实验手段考察了5%La2O3/γ-Al2O3上氧物种的脱附,发现经 500 °C通 O2预处理后的样品在 540和695 °C处分别可检测到两个O2脱附峰。显然将稀土倍半氧化物分散于γ-Al2O3载体表面后有利于生成更多低配位表面晶格氧物种。在本文所考察的三种不同方法制备的立方 Nd2O3中,燃烧法制备的样品表面晶格氧脱附峰面积显著高于其他两种方法制备的立方 Nd2O3,且表面晶格氧的脱附峰温也低于其他两种方法制备的样品,说明燃烧法制备的立方 Nd2O3表面含有更多配位不饱和的晶格氧物种,因而更有利于在光诱导下与分子氧反应生成过氧物种。
4 结 论
采用水解、水热和燃烧法制备了三种Nd2O3样品。XRD和Raman光谱测试结果表明,三种样品的主要物相均为立方 Nd2O3,但燃烧法制备的样品纯度最高,其他两种方法制备的Nd2O3中均含有少量六方Nd2O3物相。在空气中经325 nm激光照射后,三种样品表面均可检测到过氧物种的生成,但在相同的实验条件下,燃烧法制备的立方 Nd2O3上过氧物种的光诱导生成速率显著高于其他两种方法制备的样品。O2-和CO2-TPD的表征结果表明,与水解和水热法制备的立方 Nd2O3相比,燃烧法制备的样品表面含有更多低配位的晶格氧物种,晶格氧的碱性也更强,因而更有利于在光诱导下与分子氧反应生成过氧物种。
(1) Panov, G. I.; Dubkov, K. A.; Starokon, E. V. Catal. Today 2006,117 (1), 148. doi: 10.1016/j.cattod.2006.05.019
(2) Guo, Z.; Liu, B.; Zhang, Q.; Deng, W.; Wang, Y.; Yang, Y.Chem. Soc. Rev. 2014, 43 (10), 3480. doi: 10.1039/c3cs60282f
(3) Weng, W. Z.; Wan, H. L.; Li, J. M.; Cao, Z. X. Angew. Chem.Int. Ed. 2004, 43 (8), 975. doi: 10.1002/anie.200351706
(4) Jing, X. L.; Chen, Q. C.; He, C.; Zhu, X. Q.; Weng, W. Z.; Xia,W. S.; Wan, H. L. Phys. Chem. Chem. Phys. 2012, 14 (19),6898. doi: 10.1039/c2cp40086c
(5) Jing, X. L.; She, W. Y.; Weng, W. Z.; Li, J. M.; Xia, W. S.; Wan,H. L. Chin. J. Catal. 2014, 35 (8), 1385. [景孝廉, 佘雯瑜, 翁维正, 李建梅, 夏文生, 万惠霖. 催化学报, 2014, 35 (8),1385.] doi: 10.1016/S1872-2067(14)60153-4
(6) Li, J. M.; Jing, X. L.; Weng, W. Z.; Chang, Z. Y.; An, D. L.;Xia, W. S.; Wan, H. L. Scientia Sinica Chimica 2014, 44 (12),1931. [李建梅, 景孝廉, 翁维正, 常泽英, 安冬丽, 夏文生,万惠霖. 中国科学: 化学, 2014, 44 (12), 1931.]doi: 10.1360/N032014-00222
(7) Jing, X. L.; She, W. Y.; Li, J. M.; Chen, Q. C.; Weng, W. Z.; An,D. L.; Wan, H. L. Chem. Asian J. 2015, 10 (10), 2162.doi: 10.1002/asia.201500312
(8) Bazzi, R.; Flores-Gonzalez, M. A.; Louis, C.; Lebbou, K.;Dujardin, C.; Brenier, A.; Zhang, W.; Tillement, O.; Bernstein,E.; Perriat, P. J. Lumin. 2003, 102−103, 445.doi: 10.1016/S0022-2313(02)00588-4
(9) Qian, H.; Lin, G.; Zhang, Y.; Gunawan, P.; Xu, R.Nanotechnology 2007, 18 (35), 355602.doi: 10.1088/0957-4484/18/35/355602
(10) Zawadzki, M.; Kepinski, L. J. Alloys Compd. 2004, 380 (1),255. doi: 10.1016/j.jallcom.2004.03.053
(11) Zeng, W. W.; Huang, K. L.; Yang, Y. P.; Liu, S. Q.; Liu, R. S.Acta Phys. -Chim. Sin. 2008, 24 (2), 263. [曾雯雯, 黄可龙,杨幼平, 刘素琴, 刘人生. 物理化学学报, 2008, 24 (2), 263.]doi: 10.3866/PKU.WHXB20080214
(12) Kepinski, L.; Zawadzki, M.; Mista, W. Solid State Sci. 2004, 6(12), 1327. doi: 10.1016/j.solidstatesciences.2004.07.003
(13) Hayashi, H.; Hakuta, Y. Mater. 2010, 3 (7), 3794.doi: 10.3390/ma3073794
(14) Hu, H. F.; He, T. Acta Phys. -Chim. Sin. 2016, 32 (2), 543.[胡海峰, 贺 涛. 物理化学学报, 2016, 32 (2), 543.]doi: 10.3866/PKU.WHXB201511194
(15) Chavan, S. V.; Sastry, P. U. M.; Tyagi, A. K. J. Alloys Compd.2008, 456 (1), 51. doi: 10.1016/j.jallcom.2007.02.019
(16) Umesh, B.; Eraiah, B.; Nagabhushana, H.; Nagabhushana, B.M.; Nagaraja, G.; Shivakumara, C.; Chakradhar, R. P. S.J. Alloys Compd. 2011, 509 (4), 1146.doi: 10.1016/j.jallcom.2010.09.143
(17) Yu, R. B.; Yu, K. H.; Wei, W.; Xu, X. X.; Qiu, X. M.; Liu, S.;Huang, W.; Tang, G.; Ford, H.; Peng, B. Adv. Mater. 2007, 19(6), 838. doi: 10.1002/adma.200600936
(18) Sreethawong, T.; Chavadej, S.; Ngamsinlapasathian, S.;Yoshikawa, S. Solid State Sci. 2008, 10 (1), 20.doi: 10.1016/j.solidstatesciences.2007.08.010
(19) Duhan, S.; Aghamkar, P. Acta Phys. Pol. A 2008, 113 (6), 1671.doi: 10.12693/APhysPolA.113.1671
(20) Shafer, M. W.; Roy, R. J. Am. Ceram. Soc. 1959, 42 (11), 563.doi: 10.1111/j.1151-2916.1959.tb13574.x
(21) Tong, J.; Eyring, L. J. Alloys Compd. 1995, 225 (1−2), 139.doi: 10.1016/0925-8388(94)07079-2
(22) Ubaldini, A.; Carnasciali, M. M. J. Alloys Compd. 2008, 454(1−2), 374. doi: 10.1016/j.jallcom.2006.12.067
(23) Abrashev, M. V.; Todorov, N. D.; Geshev, J. J. Appl. Phys.2014, 116 (10), 103508. doi: 10.1063/1.4894775
(24) Lunsford, J. H.; Yang, X.; Haller, K.; Laane, J.; Mestl, G.;Knozinger, H. J. Phys. Chem. 1993, 97 (51), 13810.doi: 10.1021/j100153a061
(25) Boldish, S. I.; White, W. B. Spectrochim. Acta 1979, 35 (11),1235. doi: 10.1016/0584-8539(79)80204-4
(26) Gopinatht, C. R.; Brown, I. D. J. Raman Spectrosc. 1982, 12(3), 278. doi: 10.1002/jrs.1250120315
(27) Turcotte, R. P.; Sawyer, J. O.; Eyring, L. J. Inorg. Chem. 1969,8 (2), 238. doi: 10.1021/ic50072a012
(28) Klingenberg, B.; Vannice, M. A. J. Chem. Mater. 1996, 8 (12),2755. doi: 10.1021/cm9602555
(29) Jiang, G. J.; Zhuang, H. R.; Li, W. L.; Wu, F. Y.; Zhang, B. L.Prog. Chem. 1998, 10 (3), 327. [江国健, 庄汉锐, 李文兰,邬凤英, 张宝林. 化学进展, 1998, 10 (3), 327.]doi: 10.3321/j.issn:1005-281X.1998.03.011
(30) Auroux, A.; Gervasini, A. J. Phys. Chem. 1990, 94 (16), 6371.doi: 10.1021/j100379a041
(31) Choudhary, V. R.; Uphade, B. S.; Mulla, S. A. R. Ind. Eng.Chem. Res. 1997, 36 (9), 3594. doi: 10.1021/ie960676w
(32) Choudhary, V. R.; Mulla, S. A. R.; Uphade, B. S. Fuel 1999,78 (4), 427. doi: 10.1016/S0016-2361(98)00168-9
(33) Yamazoe, N.; Teraoka, Y.; Seiyama, T. Chem. Lett. 1981, 10(12), 1767. doi: 10.1246/cl.1981.1767
(34) Kung, H. H. Transition Metal Oxides: Surface Chemistry and Catalysis, Elsevier: Amsterdam, 1989; pp 112−113.
(35) Ding, W.; Chen, Y.; Fu, X. Catal. Lett. 1994, 23 (1), 69.doi: 10.1007/BF00812132
(36) You, R.; Zhang, Y.; Liu, D.; Meng, M.; Zheng, L.; Zhang, J.;Hu, T. J. Phys. Chem. C 2014, 118 (44), 25403.doi: 10.1021/jp505601x
(37) Huang, S. J.; Walters, A. B.; Vannice, M. A. J. Catal. 2000,192 (1), 29. doi: 10.1006/jcat.2000.2846
(38) Jiang, X. Y.; Zhou, R. X.; Pan, P.; Zhu, B.; Yuan, X. X.; Zheng,X. M. Appl. Catal. A: Gen. 1997, 150 (1), 131.doi: 10.1016/S0926-860X(96)00293-1
Effect of Preparation Methods on Photo-Induced Formation of Peroxide Species on Nd2O3
WU Qian WENG Wei-Zheng*LIU Chun-Li HUANG Chuan-Jing XIA Wen-Sheng WAN Hui-Lin*
(State Key Laboratory of Physical Chemistry of Solid State Surfaces, National Engineering Laboratory for Green Chemical Productions of Alcohols-Ethers-Esters, Department of Chemistry, College of Chemistry and Chemical Engineering,Xiamen University, Xiamen 361005, Fujian Province, P. R. China)
Three Nd2O3samples with cubic phase being the main component phase, denoted as Nd2O3-H, Nd2O3-HT, and Nd2O3-C, were synthesized by hydrolysis, hydrothermal, and combustion methods, respectively. A comparative study of the photo-induced formation of peroxide species on the three Nd2O3samples was carried out using Raman spectroscopy with a 325 nm laser as the excitation source. After irradiation with the laser of the Raman spectrometer at room temperature in air, peroxide species was detected in all Nd2O3samples. However, the rate of peroxide formation over Nd2O3-C was much greater than that over the other two samples. This observation can be explained by the differences in the structure and basicity of the surface lattice oxygen (O2−) species of the samples. As evidenced by the results of O2- and CO2-temperature-programmed desorption (TPD) characterizations, the Nd2O3-C sample contains greater number of surface lattice oxygen (O2−) species with low coordination numbers than the other two samples. Moreover, the basicity of the surface O2−species in Nd2O3-C is stronger than that in the Nd2O3-H and Nd2O3-HT samples. Both these factors are in favor of the reaction of lattice oxygen with molecular oxygen to generate peroxide species under photo irradiation.
Nd2O3; Preparation method; Photo-induced; Peroxide species; Lattice oxygen
February 27, 2017; Revised: April 24, 2017; Published online: May 10, 2017.
O647
10.3866/PKU.WHXB201705103 www.whxb.pku.edu.cn
*Corresponding authors. WENG Wei-Zheng, Email: wzweng@xmu.edu.cn. WAN Hui-Lin, Email: hlwan@xmu.edu.cn; Tel: +86-592-2185192.
The project was supported by the National Key Basic Research Program of China (973) (2013CB933102), National Natural Science Foundation of China(21173173, 21473144), and Program for Innovative Research Team in University, China (IRT−14R31).
国家重点基础研究发展规划项目(973) (2013CB933102), 国家自然科学基金(21173173, 21473144)和教育部创新研究团队项目(IRT−14R31)资助
© Editorial office of Acta Physico-Chimica Sinica
——过氧碳酸钠

