五味子糖蛋白的纯化及其抗氧化活性
,,,,,
(长春中医药大学,吉林长春 130117)
五味子为木兰科五味子属植物五味子Schisandrachinensis(Turcz)Baill的果实,习称北五味子,五味子性酸、甘、温,归肺、心、肾经,有收敛固涩、益气生津、补肾宁心之功效[1],五味子化学成分主要有木脂素、挥发油、多糖、有机酸、氨基酸等。药理活性表明五味子具有抗氧化、抗肿瘤、抗衰老等多种生物活性[2-8]。以往对五味子的研究主要集中在木脂素、多糖、有机酸等方面,而对五味子糖蛋白的研究未见报道。
研究表明,糖蛋白是一大类具有较强生物活性的物质[9],近年来糖蛋白的研究越来越受到重视,而除游离蛋白是糖蛋白纯化的重要环节。目前,常用的除蛋白方法主要有Sevage法、三氯乙酸法、蛋白酶水解法等[10]。其中,Sevage法是除蛋白质的经典方法,其操作简单,条件温和,试剂廉价,是常用的除游离蛋白的方法[11]。本实验采用单因素方法研究了不同因素对Sevage法除五味子糖蛋白中游离蛋白效果的影响,并在单因素实验的基础上采用正交设计法与响应面法对比确定得到Sevage法除五味子糖蛋白中游离蛋白的最佳工艺条件,最后进行了体外抗氧化活性研究,以期为五味子糖蛋白的进一步研究和开发奠定理论基础,并为其今后开发药品及保健品打下基础。
1 材料与方法
1.1材料与仪器
北五味子药材 采于吉林省长白山自然保护区,经长春中医药大学姜大成教授鉴定为木兰科五味子属植物五味子Schisandrachinensis(Turcz)Baills的干燥果实;Bradford蛋白浓度测定试剂盒 天根生化科技有限公司;葡萄糖、苯酚、浓硫酸、氢氧化钠、浓盐酸等 均为国产分析纯。
SHZ-B水浴恒温振荡器 上海博讯实业有限公司医疗设备厂;UV-1700紫外可见分光光度计 日本岛津公司;JA1203N型电子天平 上海精密科学仪器有限公司;AB265-S分析天平(十万分之一)METTLER TOLEDO;沙冰料理机 中山市快特电器有限公司;S82-2磁力搅拌器 上海志威电器有限公司;UB-7pH计Denver Instrument;FDU-1200冷冻干燥机 东京理化器械株式会社。
1.2实验方法
1.2.1 五味子糖蛋白的提取 称取一定量北五味子干燥果实,0.1 mol/L NaOH匀浆,并将原液pH调9.5,35 ℃水浴提取3 h后离心(3500 r/min,15 min,下同),弃沉淀,收集上清液,并将pH调至3.4,静置2 h后离心,弃上清,将沉淀用少量蒸馏水溶解,pH调至中性后装入透析袋,透析过夜,将透析袋中液体冷冻干燥,此冷冻干燥物即为五味子糖蛋白[12]。
1.2.2 蛋白质清除率测定 采用考马斯亮蓝Bradfrod法测定糖蛋白中蛋白质的含量[13],得回归方程A=0.15x+0.043,r=0.9989。按以下公式计算蛋白质清除率:
蛋白质清除率(%)=(脱蛋白前糖蛋白溶液中蛋白的含量-脱蛋白后糖蛋白溶液中蛋白的含量)/脱蛋白前糖蛋白溶液中蛋白的含量×100
1.2.3 多糖损失率测定 采用苯酚-浓硫酸法测定糖蛋白中多糖的含量[14],得回归方程A=0.144x-0.045,r=0.9989。按以下公式计算多糖损失率:
多糖损失率(%)=(脱蛋白前糖蛋白溶液中多糖的含量-脱蛋白后糖蛋白溶液中多糖的含量)/脱蛋白前糖蛋白溶液中多糖的含量×100
1.2.4 综合评分计算方法 综合评分=[(脱蛋白率/最大脱蛋白率)×0.5+(最小多糖损失率/多糖损失率)×0. 5]×100
1.2.5 单因素实验
1.2.5.1 氯仿与正丁醇比例的确定 固定反应条件为样液与Sevage试剂比例为3∶1,振摇时间20 min,脱蛋白1次,考察氯仿与正丁醇比例(1∶1、2∶1、3∶1、4∶1、5∶1)对糖蛋白纯化的影响[15]。
1.2.5.2 样液与Sevage试剂比例的确定 固定反应条件为氯仿与正丁醇比例为3∶1,振摇时间20 min,脱蛋白1次,考察样液与Sevage试剂比例(1∶1、2∶1、3∶1、4∶1、5∶1)对糖蛋白纯化的影响。
1.2.5.3 振摇时间的确定 固定反应条件为氯仿与正丁醇比例为3∶1,样液与Sevage试剂比例为3∶1,脱蛋白1次,考察振摇时间(5、10、15、20、25 min)对糖蛋白纯化的影响。
1.2.5.4 脱蛋白次数的确定 固定反应条件为氯仿与正丁醇比例为3∶1,样液与Sevage试剂比例为3∶1,振摇时间20 min,考察脱蛋白次数(1、2、3、4、5次)对糖蛋白纯化的影响。
1.2.6 正交实验设计 以L9(34)表安排正交实验,由单因素实验结果设计因素水平表,见表1。
1.2.7 响应面法优选设计 根据单因素实验结果,采用Design-Expert 8.0.5.0软件依据Box-Behnken[16]实验设计原理,选择氯仿与正丁醇比例(A)、样液与Sevage试剂比例(B)、振摇时间(C)、脱蛋白次数(D)四个因素进行响应面优化设计,因素水平编码见表2。

表2 响应面实验因素与水平Table 2 Factors and levels of response surface experiment
1.2.8 体外抗氧化实验 根据响应面实验结果,取一定量最佳工艺条件下纯化得到的五味子糖蛋白,进行抗氧化活性实验。
1.2.8.1 DPPH自由基清除率的测定 取不同浓度的五味子糖蛋白溶液1 mL于10 mL试管,加入3 mL 0.004% DPPH溶液,涡旋混匀;空白组依次加入1 mL蒸馏水和3 mL 0.004% DPPH溶液,涡旋混匀;样品对照组加入1 mL不同浓度的五味子糖蛋白溶液,再加入3 mL甲醇,涡旋混匀。置黑暗中静置20 min,以甲醇为空白调零,以VC为阳性对照组,用紫外吸光光度计于517 nm下测其吸光度。清除率按下式计算,并计算IC50值[17]。
清除率(%)=[A0-(A1-A2)]/A0×100
式中,A0为空白的吸光度,A1为加入样品的吸光度,A2为样品本身吸光度。
1.2.8.2 超氧阴离子清除率的测定 样品组每管加入3 mL 0.1 mol/mL Tris-HCl(pH为8.2)缓冲溶液和不同浓度样品溶液0.1 mL,放入25 ℃水浴20 min,加入0.3 mL已经于25 ℃预热的7 mmol/L邻苯三酚溶液,于25 ℃精准反应4 min,最后加入1 mL10 mol/L盐酸终止反应;空白组以0.1 mL蒸馏水代替样品溶液;样品对照组以0.3 mL蒸馏水代替0.3 mL 7 mmol/L邻苯三酚溶液,用1 mL蒸馏水代替1 mL 10 mol/L盐酸。以VC为阳性对照,用蒸馏水做空白调零,于420 nm波长处测其吸光度。清除率按下式计算,并计算IC50值[18]。
清除率=[A0-(A1-A2)]/A0×100
式中,A0为空白的吸光度,A1为加入样品的吸光度,A2为样品本身吸光度。
1.2.8.3 还原能力的测定 取不同浓度的样品溶液1 mL于试管,分别加入2.5 mL 0.2 mol/L磷酸缓冲溶液(pH6.6)和2.5 mL 1%铁氰化钾溶液,混匀后于50 ℃水浴保温20 min,冷却,加入2.5 mL 10%三氯乙酸,混匀,离心(3000 r/min),取上清2.5 mL,依次加入2.5 mL蒸馏水和0.5 mL 0.1%三氯化铁,充分混匀,以蒸馏水做空白调零,在最大吸收波长700 nm下测其吸光度A1,考虑到糖蛋白本身的吸光度,以2.5 mL蒸馏水代替2.5 mL 1%铁氰化钾溶液,其余步骤一样,测得吸光度A2。VC为阳性对照,吸光度越大其还原能力越强。还原能力按下式计算[19]:
A=A1-A2
式中,A1为加入样品的吸光度,A2为样品本身的吸光度。
1.3数据处理

2017年9月11日,肇庆中院作出“(2017)粤12刑初32号”刑事判决:被告人邓强犯受贿罪,判处有期徒刑4年6个月,并处罚金人民币50万元;邓强退出的赃款人民币260万元,依法予以没收,并由扣押机关上缴国库。
2 结果与分析
2.1单因素实验
2.1.1 氯仿与正丁醇比例的单因素实验 由图1可知,当氯仿与正丁醇体积比为3∶1时,游离蛋白的清除率最大,同时多糖损失率达到最低值,这是由于在Sevage法脱蛋白过程中,氯仿对蛋白质变性起重要作用,正丁醇只是起到一定的促进作用,因此选择2∶1、3∶1、4∶1三个水平。

图1 氯仿与正丁醇的比例 Fig.1 The ratio of chloroform and n-butanol
2.1.2 样液与Sevage试剂比例的单因素实验 由图2可知,随着样液与Sevage试剂比例的增大,游离蛋白的清除率先逐步升高后趋于平缓,在比例从2∶1增大到3∶1时,蛋白清除率略有升高,同时多糖损失率最小,因此选择2∶1、3∶1、4∶1三个水平。

图2 样液与Sevage试剂的比例Fig.2 The proportion of sample solution and Sevage reagent

图3 振摇时间Fig.3 The shaking time
2.1.3 振摇时间的单因素实验 由图3可知,当振摇时间为15 min时,蛋白清除率达到最大值,之后随着振摇时间的增加,蛋白清除率基本不再升高,同时,多糖损失率在振摇15 min之前无明显变化,之后逐渐增大,这是由于振摇15 min后,样液中的大部分游离蛋白已经除去,蛋白含量不会发生太大变化,因此选择10、15、20 min三个水平。

图4 脱蛋白次数Fig.4 The number of proteins on the removal
2.1.4 脱蛋白次数的单因素实验 由图4可知,脱蛋白次数在1~3次时,蛋白清除率有所升高,同时,多糖损失率略有升高,当脱蛋白次数超过3次时,蛋白清除率基本保持不变,而多糖损失率升高则较为明显,说明样液中的游离蛋白已基本除去,所以选择2、3、4次三个水平。

表3 正交实验设计结果Table 3 Results of orthogonal experiment design

表4 正交结果方差分析表Table 4 Variance analysis table of orthogonal results
注:** p<0.01为极显著;*p<0.05为显著。
2.2正交实验
直观分析结果表明(见表3),RC>RA>RB>RD,因此,影响Sevage法除五味子糖蛋白中游离蛋白效果的主次因素依次为C(振摇温度)>A(氯仿与正丁醇比例)>B(样液与Sevage试剂比例)>D(脱蛋白次数),方差分析表明(见表4),因素C(振摇温度)具有极显著影响,因素A(氯仿与正丁醇比例)与因素B(样液与Sevage试剂比例)对提取过程有显著影响,因素D(脱蛋白次数)对实验影响较小,综上所述,最后确定最佳工艺条件为A2B2C2D2,即氯仿与正丁醇比例为3∶1,样液与Sevage试剂比例为3∶1,振摇时间为15 min,脱蛋白次数为3次。
2.3响应面优化实验
2.3.1 回归方程拟合及方差分析 将所得实验数据采用Design-Expert 8.0.5.0软件进行多元回归拟合,得到综合评分对氯仿与正丁醇的比例(A)、样液与Sevage试剂的比例(B)、振摇时间(C)、脱蛋白次数(D)的二元多项回归方程:
Y=73.00+0.74A+1.07B-0.92C+0.24D+0.016AB+0.65AC-2.38AD-0.31BC-2.20BD+0.89CD-3.79A2-2.95B2-4.02C2-3.89D2
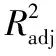

表5 响应面设计方案及结果Table 5 Design scheme and result of response surface

表6 响应面方差分析Table 6 Analysis variance of response surface
注:** p<0.01为极显著;*p<0.05为显著。
由表6可知,B、AD、BD、A2、B2、C2、D2对综合评分影响极显著,A、C对综合评分影响显著,D、AB、AC、BC、CD对综合评分影响不显著,根据F值可知,各因素对综合评分影响的大小顺序为:样液与Sevage试剂的比例(B)>振摇时间(C)>氯仿与正丁醇的比例(A)>脱蛋白次数(D)。
2.3.2 交互作用分析 将两个因素固定在0水平,经Design-Expert 8.0.5.0软件分析,观察剩余两个因素的交互作用。由表6可知,有两组因素交互作用显著,其等高线图和响应面图见图5、图6。

图5 氯仿与正丁醇的比例和脱蛋白次数对综合评分影响Fig.5 Effect of the ratio of chloroform and n-butanol and the number of removing protein on the comprehensive score

图6 样液与Sevage试剂的比例与脱蛋白次数对综合评分影响 Fig.6 Effect of the ratio of sample solution and Sevage reagent on the comprehensive score
由图5可知,氯仿与正丁醇的比例(A)和脱蛋白次数(D)的等高线呈椭圆形[20],响应面陡峭,随着氯仿与正丁醇的比例(A)和脱蛋白次数(D)的增加,综合评分逐渐增高并达到极值,之后缓慢下降,表明二者交互作用显著,由图6可知,样液与Sevage试剂的比例(B)与脱蛋白次数(D)的等高线呈椭圆形,响应面曲线较陡,随着样液与Sevage试剂的比例(B)与脱蛋白次数(D)的增加,综合评分越来越高,达到极值后逐渐下降,表明两者之间交互作用较为显著。
通过Design-Expert 8.0.5.0软件分析可知,Sevage法除五味子糖蛋白中游离蛋白的最佳工艺条件为:氯仿与正丁醇的比例3.15∶1、样液与Sevage试剂的比例3.21∶1、振摇时间14.28 min、脱蛋白次数3.07次,结合实际操作,确定最佳工艺条件为:氯仿与正丁醇比例为3∶1、样液与Sevage试剂的比例为3∶1、振摇时间14 min、脱蛋白次数3次。按照响应面法优化得到的最佳工艺条件,平行做3组验证实验,3次实验中蛋白质平均清除率为30.09%(RSD=1.41%),多糖平均损失率为4.71%(RSD=1.13%),综合评分平均值为88.11。
2.4体外抗氧化实验结果
2.4.1 DPPH自由基清除率测定结果 1,1-二苯基-2-三硝基苯肼(DPPH)自由基是一种很稳定的氮中心的自由基,其甲醇溶液为深紫色,最大吸收波长为517 nm,抗氧化物质的加入与DPPH不成对电子配对,使其褪色,吸收减少,故可通过吸光度的减少程度测得抗氧化剂消除DPPH自由基的能力,以消除率表示。由图7可知,在0.20~1.60 mg/mL范围内,五味子糖蛋白对DPPH自由基有较强消除作用,且随浓度的增大而增大,IC50值为1.08 mg/mL,但与VC相比,其清除能力较弱。

图7 五味子糖蛋白对DPPH自由基的清除作用Fig.7 Scavenging effect of Schisandra glycoprotein on DPPH free radical
2.4.2 超氧阴离子清除率测定结果 邻苯三酚在弱碱性环境下发生自动氧化反应,释放出超氧阴离子,并进一步促进自氧化产物的积累,自氧产物浓度在一定时间内呈线性增长,可以在较短时间内维持稳定,自氧化产物在420 nm处有最大吸收,故可通过计算吸光度的变化率测得抗氧化剂清除超氧阴离子的能力。由图8可知,在0.20~1.60 mg/mL范围内,五味子糖蛋白对超氧阴离子自由基有较强的消除作用,且随浓度的增大而增大,IC50值为0.80 mg/mL,但与VC相比,其清除能力较弱。

图8 五味子糖蛋白对超氧阴离子的清除作用Fig.8 Scavenging effects of Schisandra glycoprotein on Superoxide anion
2.4.3 还原能力测定结果 抗氧化剂使铁氰化钾(K3Fe(CN)6)被还原成亚铁氰化钾(K4Fe(CN)6),Fe3+与亚铁氰化钾可以发生反应,产生的普鲁士蓝在700 nm处有强吸光峰,还原力与抗氧化剂的能力成一定正比例,所以吸光度值越大,说明产生的普鲁士蓝越多,抗氧化剂的还原能力越强,间接说明其抗氧化能力越强。由图9可知,在0.20~3.20 mg/mL范围内,五味子糖蛋白清除能力逐渐增强,但与VC相比,其还原能力明显较弱。

图9 五味子糖蛋白的还原能力Fig.9 Reduction of Schisandra glycoprotein
3 结论
首次采用Sevage法对五味子糖蛋白中游离蛋白的清除条件进行了研究,通过实验综合考察了氯仿
与正丁醇的比例,样液与Sevage试剂的比例,振摇时间和脱蛋白次数对五味子糖蛋白中游离蛋白清除效果的影响,采用正交实验和响应面法对除蛋白工艺进行了优选,最后确定的最佳工艺条件为氯仿与正丁醇的比例为3∶1,样液与Sevage试剂的比例为3∶1,振摇时间为14 min,脱蛋白次数为3次,此条件下,蛋白质平均清除率为30.09%,多糖平均损失率为4.71%,综合评分平均值为88.11。过实验我们发现,响应面法优化工艺精确度高,能很好的预测实验结果。抗氧化活性研究表明,五味子糖蛋白具有较强的清除DPPH自由基和超氧阴离子的能力(IC50值为1.08 mg/mL和0.8 mg/mL),并具有一定的还原能力。本文对于Sevage法纯化五味子糖蛋白的研究具有重要的意义,这为进一步开发利用五味子糖蛋白提供了理论基础。
[1]国家药典委员会. 中华人民共和国药典. 一部[S]. 北京:中国医药科技出版社,2010:61-62.
[2]史琳,王志成,冯叙桥. 五味子化学成分及药理作用的研究进展[J]. 药物评价研究,2012,34(3):208.
[3]黄玲,陈玲,张振林. 五味子多糖对荷瘤鼠瘤体抑制作用的病理学观察[J]. 中药材,2004,7(3):202-203.
[4]苗明三. 五味子多糖对衰老模型小鼠的影响[J]. 中国医药学报,2002,17(3):187-188.
[5]Kang S,Lee K P,Park S J,et al. Identification of a novel anti-inflammatory compound,α-cudedenoate from Schisabdra chinensis[J]. J Ethnopharmacol,2014,153(1):242-249.
[6]Qu H M,Liu S J,Zhang C Y. Antitumor and antiangiogenic activity of Schisabdra chinensis polysaccharide in a renal cell carcinoma model[J]. Int J Biol Macromol,2014,66(1):52-56.
[7]Zhao T,Mao R. Antitumor and immunomodulatory activity of a water-soluble low molecular weight polysaccharide fromSchisabdrachinensis(Turcz.)Baill[J]. Food Chem Toxicol,2013,55(1):609-616.
[8]Zhang M,Liu M,Xiong M,et al. Schisabdra chinensis fruit extract attenuates albuminuria and protects podocyte integrity in a mouse model of streptozotocin-induced diabetic nephropathy[J]. J Ethnopharmacol,2012,141(1):111-118.
[9]张淑媛,吴蕾,庞广昌,等. 植物糖蛋白的提取及其生物活性研究进展[J]. 食品研究与开发,2010,31(4):174-176.
[10]马丽,覃小林,刘雄民,等. 不同脱蛋白方法用于螺旋藻多糖提取工艺的研究[J]. 食品科学,2004,25(6):116-119.
[11]王珊,黄胜阳. 植物多糖提取液脱蛋白方法的研究进展[J]. 食品科技,2012,37(9):188-191.
[12]董银卯,冯明珠,赵华,等. 燕麦麸蛋白质等电点测定及其稀碱法提取工艺优化的研究[J]. 食品科技,2007,32(3):258-265.
[13]Bradford M M. A rapid and sensitive method for quantitation of microgram quantites of protein utilizing principle of protein-dye binding[J]. Anal Biochem,1976,72(1):248-254.
[14]张志君,孙伟,李永亮,等. 3,5-二硝基水杨酸法联合苯酚-浓硫酸法测定不同产地黄精中多糖含量[J]. 中国实验方剂学杂志,2012,18(6):106-109.
[15]张萍,贺茂萍,殷力,等. 石榴皮多糖的Sevage法除蛋白工艺研究[J]. 食品科技,2013,38(12):219-231.
[16]Box G P,Behnken D W. Some new three level design for the study of quantitative variables[J]. Technometrics,1960,2(4):456.
[17]马虎飞,王思敏,杨章民.陕北野生枸杞多糖的体外抗氧化活性[J]. 食品科学,2011,32(3):60-63.
[18]惠和平,封兰士.红芪多糖的体外抗氧化活性研究[J]. 安徽农业科学,2010,38(8):4056-4057.
[19]Kumaran A,Joel K R. Antioxidant and free radical scavenging activity of an aqueous extract of Coleus aromaticus[J]. Food Chemistry,2006,97(1):109-114.
[20]Muralidhar R V,Chirmamila R R,Merchant R. Response sullface approach for comparison of lipase production by Canidida using two different carbon sources[J]. Biochemistry Engineering Journal,2001,9(1):17.

