糖尿病患者miRNA-29水平与胰岛素抵抗的相关性
罗 艳 胡桂英 李长勇
(武汉市普仁医院,湖北 武汉 430081)
糖尿病(DM)前期指的是一种异常血糖水平,特点为糖耐量减低(IGT)或空腹血糖受损(IFG),是DM易感者发展为显性2型DM(T2DM)的病理发展过程〔1〕。DM前期发病率非常高,胰岛素敏感指数(ISI)发生变化,而且发展为DM的风险远高于健康人群,若能在此期进行监测、有效延缓或甚至逆转这种异常状态,可能在DM防治中具有重要意义〔2〕。miRNAs是一类长20~25个核苷酸的具有调控功能的非编码RNA,在T2DM在内的多种代谢疾病的发生发展中具有重要作用,可能作为临床应用。而对于T2DM的研究,组织特别是胰腺组织的标本难以获得,但miRNAs能够在外周血中稳定检测到,称为循环miRNAs,对于T2DM的研究具有更为显著的意义〔3〕。研究表明〔4〕,miRNA-29在DM鼠的肝脏和胰腺组织中高表达,可能作为诊断标志物之一,推测为DM的候选基因之一,且其通路与翼螺旋转录因子(FOXA)2密切相关。但miRNA-29在DM发生发展中的具体机制仍待进一步探索,本研究探讨循环miRNA-29水平与胰岛素抵抗(IR)的相关性。
1 资料与方法
1.1研究对象 选取2014年3月至2015年9月武汉市普仁医院内分泌门诊查体或就诊的患者作为研究对象,纳入标准:①自愿参加该项研究并能配合随访;②均接受口服葡萄糖耐量试验(OGTT):采用2 h,75 g葡萄糖的OGTT试验,患者在空腹口服糖后2 h采集肘静脉血液,检测血浆葡萄糖(PG)含量;③糖耐量评价标准:糖耐量正常为空腹血糖(FPG)<5.6 mmol/L并且餐后2 h血糖(2 h PG)<7.8 mmol/L;空腹血糖受损(IFG)为FPG 5.6~6.9 mmol/L且2 d h PG<7.8 mmol/L;糖耐量减低(IGT)为FPG<5.6 mmol/L且2 h PG7.8~11.0 mmol/L;IFG+IGT为FPG 5.6~6.9 mmol/L且2 h PG 7.8~11.0 mmol/L,初发DM(n-DM)为FPG≥7.0 mmol/L和(或)2 h PG≥11.1 mmol/L。④排除有恶性肿瘤、心脑血管疾病或可能影响miRNA表达的慢性病等患者。本研究经本单位医学伦理委员会批准,且所有受试者签署针对研究的知情同意书。研究分组:将所有纳入对象按照糖耐量试验结果及评价标准分为:糖耐量正常(NGT)组56例,DM前期(pre-DM)组51例和n-DM组58例。
1.2一般资料检测 测量3组受检者的身高、体重、腰围和臀围,计算体重指数(BMI)、腰臀比。在清晨空腹状态下测量血压,连续测量2次,取其平均值,并抽取静脉血,送检验科,检测FPG(氧化酶法,日立7600-020全自动生化分析仪),检测血脂包括总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)(酶法,美国雅培AR-CHTECT C800全自动生化分析仪),检测糖化血红蛋白(HbA1c,HLC-723G7全自动HbA1c分析仪),检测空腹胰岛素(FINS,化学发光法)。胰岛素抵抗指数(HOMA-IR)=FPG(mmol/L)×FINS(mU/L)/22.5;ISI=1/(FPG×FINS)。
1.3血清miRNA-29及FOXA2 mRNA检测 所用试剂和仪器:Trizol 试剂由美国Invitrogen公司提供,TaqMan MicroRNA反转录试剂盒、miR29、FOXA2 mRNA和U6 TaqMan检测试剂盒(美国Applied Biosystems)。Liofectamine2000(Invitrogen)氯仿、异丙醇和无水乙醇等常规化学试剂为分析纯产品。所有受试者清晨空腹抽取10 ml全血,1 200 r/min离心血清,保存于-80℃冰箱待下一步检测。Trizol法提取血液中总RNA,严格按说明书操作,用TaqMan法进行miR29、FOXA2 mRNA和U6的实时定量PCR检测。PCR反应在Tpersonal PCR仪上进行。
1.4统计学方法 采用SPSS19.0软件进行方差分析t检验。相关性采用简单线性相关分析或者偏相关分析,多因素采用多元逐步回归分析。
2 结 果
2.1临床基本指标特征 3组受检者的BMI、TG、TC、LDL-C、HOMA-IR、ISI、FPG、FINS和HbA1c比较,差异均有统计学意义(P<0.01),且这些指标水平在NGT组、pre-DM组和n-DM组中逐渐增加,组间两两比较差异均有统计学意义(P<0.05)。见表1。
2.2miRNA-29和FOXA2 mRNA的检测比较 miRNA-29在NGT组、pre-DM组及n-DM组中的相对表达逐渐增加,组间差异有统计学意义(P<0.05);n-DM组血清FOXA2 mRNA明显高于pre-DM组和NGT组,pre-DM组血清FOXA2 mRNA明显高于NGT组(P<0.05)。见表1。
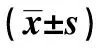
表1 各组受检者临床特征比较
与NGT组比较:1)P<0.05,2)P<0.01;与pre-DM组比较:3)P<0.05
2.3血清miRNA-29与各代谢指标的相关性 在DM人群(n=58)中评估miRNA-29水平与各代谢指标变量之间的关系。结果显示,在DM人群中,血清miRNA-29水平与FOXA2 mRNA、BMI、FINS、TG、FPG和HOMA-IR呈正相关(r=0.553,0.401,0.239,0.420,0.202,0.445,均P<0.05),与HDL-C和ISI呈负相关性(r=-0.424,-0.354,均P<0.05),而与年龄和收缩压无相关性(r=0.106,0.098,均P>0.05)。
2.4影响HOMA-IR的多元逐步回归分析 在纳入受检者总队列(n=165)人群中,以HOMA-IR为因变量,血清miRNA-29、FOXA2 mRNA、BMI、TG、TC、HDL-C、LDL-C和HbA1c为自变量,进行多元逐步回归分析。结果显示,影响HOMA-IR的独立危险因素为miRNA-29、FOXA2、BMI和TG(均P<0.05)。见表2。

表2 HOMA-IR水平的多元逐步回归分析
3 讨 论
肝脏作为胰岛素作用的靶器官,在维持体内葡萄糖水平和IR等方面具有重要作用。肝脏可以分泌多种与IR及T2DM发生发展的相关蛋白,如默调节蛋白(SIRT)1〔5〕、线粒体脱耦连蛋白(UCP)2表达〔6〕、fetuin-A〔7〕和血管生成素样蛋白等〔8〕。miRNA是一类与代谢疾病密切相关的微小RNA,已知的与DM及IR相关的miRNA有miRNA-10、miRNA-107和miR-802等〔9~11〕。例如miRNA-29能干扰骨组织中的成骨作用与脂肪化的平衡,最终通过Runx2的脱乙酰化缓解糖皮质激素引起的骨质疏松〔12〕。敲除miRNA-29后,DM鼠的HHDAC4蛋白信号通路被抑制,Nephrin蛋白泛素化,从而增加肾脏足突细胞的紊乱〔13〕。
miRNA-29也与DM发生密切相关,在IR中的作用备受关注,在一些有关IR或DM动物模型中已经得到证实。miRNA-29在糖耐量异常和DM模型鼠的肝脏中表达明显增加,而胰岛素增敏剂使得血清miRNA-29水平回归正常〔14〕。
本研究表明,初诊DM患者血清miRNA-29和FOXA2高于糖耐量异常的人群,糖耐量异常又高于糖耐量正常的易感人群,而此三者人群的HOMA-IR逐渐增大,血糖水平也逐渐上升,推测随着糖耐量异常的程度及HOMA-IR的增加,血清miRNA-29和FOXA2的水平逐渐增加。本研究显示miRNA-29能通过FOXA2途径影响HOMA-IR〔4〕,而且,多元回归分析显示,血清miRNA-29水平是IR和胰岛素敏感的独立影响因素。动物模型研究表明〔15,16〕,miRNA-29参与肝脏细胞转录后调节剂信号转导途径,可能是参与IR水平的重要途径。miRNA-29a首先通过3′UTR区域结合PI3K的亚基p85α,该亚基也是蛋白激酶Akt的上游调节介质,而Akt能通过抑制PEPCK蛋白的表达影响胰岛素的水平。研究显示miRNA-29可能是通过FOXA2途径调节Akt的磷酸化过程,从而影响HOMA-IR〔4,15〕。
本研究也发现,在DM人群中血清miRNA-29水平不仅较易感人群高,而且miRNA-29与BMI、腰臀比和TG呈正相关,说明TG、FPG与IR的关键因素肥胖和BMI密切相关,研究表明〔17〕,miRNA-29在脂肪细胞中能影响胰岛素刺激的Akt磷酸化过程,故推测随着BMI的升高,腹内脂肪面积增加,导致血清游离脂肪酸和TG水平上升,影响了Akt磷酸化过程,从而发生IR。此外,本研究提示FOXA2与miRNA-29呈正相关,即FOXA2随miRNA-29的增加而上调,且FOXA2也是IR的独立危险因素。FOXA2是已经被确认的胰岛素敏感性转录调节因子,参与糖和脂质代谢调节的基因表达〔18〕。研究表明〔19〕,野生型小鼠血浆胰岛素通过核排斥可以抑制FOXA2,而在IR的小鼠中FOXA2持续定位于肝脏细胞中,FOXA2还可以介导Akt的去磷酸化增加肝脏TG的含量,降低肝脏胰岛细胞的敏感性,导致血糖紊乱。而抑制FOXA2磷酸化的药物能促进机体能量消耗,改善血糖,可能达到治疗T2DM或代谢综合征的效果。
本研究也存在很多不足,例如对HOMA-IR指数的评估未能采取金标准-葡萄糖钳夹法,而是采用基础状态的指数-HOMA-IR和ISI,而且,本研究是一个小样本的横断面研究,只能从相关性的角度去探讨,无法完全确认miRNA-29是直接导致IR的危险因素,还是在发生IR或糖耐量异常时代偿性升高,还需要大样本研究及相关基础研究进一步阐明。
1晏少颖,王天琼,黄盛文,等.糖尿病和糖尿病前期患者血浆微小 RNA 差异表达谱分析〔J〕.广东医学,2015;20(24):3148-52.
2李少卿,王 坚.2型糖尿病患者血25-羟维生素D3缺乏对胰岛素抵抗及骨量的影响〔J〕.国际内分泌代谢杂志,2015;35(6):384-7.
3颜 蕾,徐梅珍,孔 磊.循环微RNA在2型糖尿病及糖尿病前期中的意义〔J〕.医学综述,2015;21(3):477-9.
4C Lisa K,Peck BCE,Fannin EE,etal.MicroRNA-29 fine-tunes the expression of key FOXA2-activated lipid metabolism genes and is dysregulated in animal models of insulin resistance and diabetes〔J〕.Diabetes,2014;63(9):3141-8.
5Yue C,Jiang X,Ma H,etal.SIRT1 and insulin resistance.〔J〕.J Diabet Complicat,2016;30(1):178-83.
6Marmontel DSB,Marcus M,Alves SD,etal.Polymorphisms of the UCP2 gene are associated with glomerular filtration rate in type 2 diabetic patients and with decreased UCP2 gene expression in human kidney〔J〕.PLoS One,2015;10(7):e0132938.
7Aiyun S,Min X,Yufang B,etal.Serum fetuin-A associates with type 2 diabetes and insulin resistance in Chinese adults〔J〕.PLoS One,2011;6(4):1712.
8杜 幸,谢 莹,宗海军,等.血清血管生成素样蛋白2水平与2型糖尿病大血管并发症的相关性研究〔J〕.中华内分泌代谢杂志,2015;31(1):52-4.
9Trajkovski M,Hausser J,Soutschek J,etal.MicroRNAs 103 and 107 regulate insulin sensitivity〔J〕.Nature,2011;474(7353):649-53.
10Boon RA,Vickers KC.Intercellular transport of microRNAs〔J〕.Arterioscler Thromb Vasc Biol,2013;33(2):186-92.
11Kornfeld JW,Baitzel C,Könner AC,etal.Obesity-induced overexpression of miR-802 impairs glucose metabolism through silencing of Hnf1b〔J〕.Nature,2013;494(7435):111-5.
12Lin CL,Lee PH,Hsu YC,etal.MicroRNA-29a promotion of nephrin acetylation ameliorates hyperglycemia-induced podocyte dysfunction〔J〕.J Am Soc Nephrol,2014;25(8):1698-709.
13Dooley J,Garcia-Perez JE,Sreenivasan J,etal.The microRNA-29 family dictates the balance between homeostatic and pathological glucose handling in diabetes and obesity〔J〕.Diabetes,2016;65(1):53-61.
14Ko JY,Chuang PC,Ke HJ,etal.MicroRNA-29a mitigates glucocorticoid induction of bone loss and fatty marrow by rescuing Runx2 acetylation〔J〕.Bone,2015;81(12):80-8.
15Bagge A,Clausen TR,Larsen S,etal.MicroRNA-29a is up-regulated in beta-cells by glucose and decreases glucose-stimulated insulin secretion〔J〕.Biochem Biophys Res Commun,2012;426(2):266-72.
16Pandey AK,Verma G,Vig S,etal.miR-29a levels are elevated in the db/db mice liver and its overexpression leads to at-tenuation of insulin action on PEPCK gene expression in HepG2 cells〔J〕.Mol Cell Endocrinol,2011;332(1-2):125-33.
17Pullen TJ,da Silva Xavier G,Kelsey G,etal.miR-29a and miR-29b contribute to pancreatic beta-cell-specific silencing of monocarboxylate trans-porter 1 (Mct1)〔J〕.Mol Cell Biol,2011;31(15):3182-94.
18杨金奎.Foxa2与2型糖尿病肝脏胰岛素抵抗的分子病因学——解读2006年美国糖尿病学会(ADA)“杰出科学成就奖”演讲报告〔J〕.国际内分泌代谢杂志,2006;26(5):317-9.
19陆 明,刘丽梅.翼螺旋转录因子Foxa2与糖脂代谢及糖尿病关系的研究进展〔J〕.上海交通大学学报(医学版),2011;31(4):497-500.

