益肾蠲痹丸对破骨细胞-调节性T细胞共培养体系中破骨细胞分化及功能的影响❋
郭明慧,徐慧慧,李晓亚,王 贵,黄 晶,吕 爽,路相臣,赵宏艳,肖 诚
(1.北京中医药大学,北京 100029; 2. 中日友好医院临床医学研究所,北京 100029; 3. 中国医学科学院/北京协和医科大学,北京 100193; 4. 中国中医科学院医学实验中心,北京 100700)
骨骼处于不断更新的动态平衡中,重复着骨吸收-骨形成的过程,免疫系统能影响骨组织的动态平衡[1]。调节性T细胞(regulatory t cells,Tregs)是一类控制体内自身免疫反应性的T细胞亚群,与自身免疫性疾病的发生关系密切,增强Tregs细胞的活性有助于治疗类风湿关节炎(RA)诱发的骨丢失[2]。破骨细胞(osteoclast,OC)在骨破坏的过程中发挥着重要的作用。有证据表明,Treg细胞可以在体外和体内抑制OC分化,这与其通过分泌转化生长因子β(TGF-β)、白介素(IL)-10和IL-4调节破骨细胞生成有关。Tregs不仅通过细胞因子途径发挥对OC的抑制作用,还可通过直接接触途径抑制破骨细胞分化及功能[3-4],因此本课题组建立了OC-Tregs共培养体系[4]。益肾蠲痹丸(YSJB)是著名医家朱良春先生的名方,可以调节RA患者的免疫功能,临床疗效显著[5-6]。本研究通过此建立的OC-Tregs共培养体系,探讨益肾蠲痹丸对共培养体系中OC分化及功能的影响。
1 材料
1.1 动物
6~8周龄雄性C57BL/6小鼠,由北京斯贝福生物技术有限公司提供,饲养于首都医科大学附属安贞医院清洁级实验动物室(实验动物使用许可证号SCXK(京)2016-0002)。6周龄雄性SD大鼠,由中国食品药品检定研究所提供,饲养于中国中医科学院中医基础理论研究所(实验动物使用许可证号SCXK(京)2016-0021)。
1.2 药品及主要试剂
YSJB由江苏正大清江制药公司提供;来氟米特(LEF),苏州长征-欣凯制药有限公司提供。α-MEM培养基、RPMI-1640培养基,美国Hyclone公司;青霉素、链霉素,美国Gibco公司;FBS胎牛血清,美国BioTech公司;小鼠重组核因子κв受体活化因子配基(RANKL)、巨噬细胞集落刺激因子(M-CSF)、小鼠重组IL-2,美国Peprotech公司;小鼠TGF-β1,美国R&D公司;抗小鼠CD3抗体、抗小鼠CD28抗体,美国BD公司;小鼠CD4+T细胞预富集试剂盒、小鼠CD25+T细胞分选试剂盒、Blocking Solution,加拿大Stemcell公司;甲苯胺蓝、抗酒石酸磷酸酶(TRAP)试剂盒,美国Sigma公司;牛骨片,英国Immunodiagnostic Systems Limited公司;小鼠IL-10 ELISA试剂盒,法国Diaclone公司;小鼠高迁移率族蛋白1(HMGB1)ELISA试剂盒,美国Chondrex公司;总RNA提取试剂盒、PrimeScriptTMRTreagent Kit试剂盒、SYBR Premix Ex TaqTMⅡRT-PCR试剂盒,日本Takara公司。
1.3 主要仪器
二氧化碳细胞培养箱、NanoDrop 2000C超微量分光光度计,美国 Thermo Scientific 公司;PCR仪,美国 Bio-RAD公司。
2 方法
2.1 制备含药血清
40只6周龄雄性SD大鼠按随机数字表法分为假免疫组、CIA 组、CIA+LEF组、CIA+YSJB 4组各10只,采用Ⅱ型胶原免疫制作CIA模型免疫2周后, LEF组灌服LEF(2.15 mg/kg/d),每日1次,连续灌胃给药3 d,YSJB组灌服YSJB(3.702 g/kg/d),每日2次,连续灌胃给药3 d;末次给药1 h 后,戊巴比妥钠麻醉,无菌条件下经腹主动脉采血,静置 1 h 后离心,分离血清是为含药血清。CIA 组和假免疫组灌服等容积的蒸馏水,按以上程序分离血清,所取血清分别为 CIA 组血清和假免疫组血清。血清于-80 ℃冰箱保存备用。
2.2 Tregs-OC共培养体系的建立
2.2.1 破骨细胞前体细胞的分离与培养 C57BL/6 小鼠脱颈处死,无菌分离股骨、胫骨,收集骨髓细胞悬液,用含20ng/ml M -CSF 的 α -MEM 培养液(含10% FBS、100U/ml 青霉素、100μg/ml链霉素)接种于培养瓶中。24 h后收集未贴壁细胞,以1×105个/孔加入96 孔培养板内,5×105个/孔加入24孔培养板内。培养3 d后得到破骨前体细胞。
2.2.2 CD4+CD25+Tregs的诱导激活 C57BL/6 小鼠脱颈处死,无菌分离脾脏制备脾细胞悬液,将细胞浓度调整至1×108个/ml,用小鼠CD4+T细胞预富集、小鼠CD25+T细胞分选试剂盒及磁珠分选器进行分选,用分化培养液(RPMI-1640培养基+2 μg/ml抗小鼠CD28+1000 U/ml IL-2+10 ng/ml TGF-β+10%FBS+100 U/ml 青霉素、100 μg/ml链霉素)重悬细胞,接种于用抗小鼠CD3(10 μg/ml,50 μl/孔)包被过的圆底96孔板内,此为诱导成功的Tregs,阳选的CD4+CD25+Tregs用于进行后续实验。此为本课题前期摸索的实验方法,经流式细胞术鉴定Tregs表型[4]。
2.2.3 OC-Tregs共培养体系的建立 按前期方法[4],将M-CSF预诱导3 d后的破骨前体细胞与诱导激活后阳选的Tregs以1∶25比例加入96孔/24孔板内,建立共培养体系,所采用的培养液为OC分化培养基(20 ng/mlM-CSF、100ng/mlRANKL、10%FBS、100 U/ml 青霉素、100 μg/ml链霉素的α-MEM培养基)。
2.3 共培养体系中破骨细胞分化及骨吸收功能的检测
按上述方法,将M-CSF预诱导3 d后的破骨前体细胞与诱导激活后阳选的Tregs以1∶25的比例加入96孔板内(孔板内预置盖玻片或牛骨片),第3天加入10%含药血清,分别是假免疫组血清(OC+Tregs+Control组)、CIA模型组血清(OC+Tregs+CIA组)、CIA+LEF组血清(OC+Tregs+LEF组)、CIA+YSJB组血清(OC+Tregs+YSJB组),隔日半量换液,保持含药血清浓度不变。培养第6天,TRAP染色后倒置相差显微镜下计数96孔板内TRAP染色阳性的OC(细胞核≥3)数目;培养至第12天,取出牛骨片进行甲苯胺蓝染色,显微镜下观察骨吸收陷窝形态,用Leica Qwin图像分析系统分析骨吸收陷窝面积。
2.4 共培养体系上清中IL-10和HMGB1含量的检测
培养至第6天取各组的培养上清,采用ELISA法测定细胞上清中IL-10和HMGB1的含量。
2.5 共培养体系中HMGB1、晚期糖基化终末产物受体(RAGE)和IL-10基因表达的检测
表1显示,培养至第6天,采用Real-time PCR法检测Tregs中的IL-10mRNA和OC内的HMGB1、RAGE mRNA表达水平。各组细胞按Takara RNA 提取试剂盒说明书提取总RNA,并测定总RNA纯度和浓度,根据总RNA用PrimeScriptTMRTreagent Kit试剂盒合成cDNA。引物根据基因库同源基因序列进行设计,由上海生工合成。Real-time PCR 步骤按照SYBR Premix Ex TaqTMⅡRT-PCR试剂盒说明书进行,扩增条件为95 ℃变性30 s,95 ℃ 5 s,60 ℃ 30 s,扩增45个循环,实验数据由PCR检测仪收集,按照2-△△ct相对定量公式计算各组目的基因表达量。

表1 引物序列
2.6 统计学方法

3 结果
3.1 益肾蠲痹丸对OC-Tregs共培养体系中破骨细胞分化及骨吸收功能的影响
表2图1显示,与OC+Tregs+Control组比较,OC+Tregs+CIA组、OC+Tregs+LEF组、OC+Tregs+YSJB组OC数目及骨吸收陷窝面积明显增加(P<0.01,P<0.05);与OC+Tregs+CIA组比较,OC+Tregs+LEF组和OC+Tregs+YSJB组OC分化数目和骨吸收陷窝面积显著减少(P<0.01)。
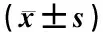
表2 OC-Tregs共培养体系内OC数量和骨陷窝吸收面积的变化
注:与OC+Tregs+Control组比较:*P<0.05,**P<0.01;与OC+Tregs+CIA组比较:##P<0.01

图1 OC-Tregs共培养体系中OC数量和骨吸收陷窝的变化(×100)注:a.OC+Tregs+Control组;b.OC+Tregs+CIA组;c.OC+Tregs+LEF组;d.OC+Tregs+YSJB组
3.2 益肾蠲痹丸对OC-Tregs共培养内IL-10 和HMGB1蛋白表达的影响
与OC+Tregs+Control组比较,OC+Tregs+CIA组、OC+Tregs+LEF组和OC+Tregs+YSJB组Tregs分泌的IL-10含量显著降低(P<0.01);与OC+Tregs+CIA组比较,OC+Tregs+LEF组和OC+Tregs+YSJB组Tregs分泌的IL-10含量显著增加(P<0.01)。
表3显示,与OC+Tregs+Control组比较,OC+Tregs+CIA组、OC+Tregs+LEF组和OC+Tregs+YSJB组破骨细胞分泌的HMGB1含量显著增加(P<0.01);与OC+Tregs+CIA组比较,OC+Tregs+LEF组和OC+Tregs+YSJB组破骨细胞分泌的HMGB1含量显著减少(P<0.01)。
3.3 益肾蠲痹丸对OC-Tregs共培养内IL-10 mRNA和HMGB1、RAGE mRNA表达的影响
与OC+Tregs+Control组比较,OC+Tregs+CIA组Tregs中IL-10 mRNA表达量显著降低(P<0.01);与OC+Tregs+CIA组比较,OC+Tregs+LEF组和OC+Tregs+YSJB组Tregs中IL-10 mRNA表达量显著增加(P<0.01)。
表3显示,与OC+Tregs+Control组比较,OC+Tregs+CIA组、OC+Tregs+YSJB组中破骨细胞HMGB1 mRNA表达量明显增加(P<0.01,P<0.05),OC+Tregs+CIA组中破骨细胞RAGE mRNA表达量明显升高(P<0.05);与OC+Tregs+CIA组比较,OC+Tregs+LEF组和OC+Tregs+YSJB组中破骨细胞HMGB1、RAGE mRNA表达量明显减少(P<0.01,P<0.05)。

表3 OC-Tregs共培养体系内IL-10、HMGB1、RAGE 表达的变化
注:与OC+Tregs+Control组比较:**P<0.01,*P<0.05;与OC+Tregs+CIA组比较:##P<0.01,#P<0.05
4 讨论
益肾蠲痹丸以熟地黄、淫羊藿、骨碎补补肝肾、扶正气;以乌梢蛇、白僵蚕、全蝎、露蜂房蠲痹通络,搜剔病邪,诸药相合、标本兼顾、扶正祛邪对痹症有较好的疗效[7-8]。实验研究也表明,益肾蠲痹丸能减轻CIA大鼠踝关节肿胀程度,显著抑制CIA大鼠组织病理改变,且对肾虚证和脾虚证CIA大鼠也有明显的疗效[9-11]。大鼠的病理学研究表明,益肾蠲痹丸能使滑膜组织炎症减轻,胶原纤维沉着减少,软骨细胞增生修复[12]。
RA是最常见的自身免疫性疾病,可以导致关节畸形及功能丧失,抑制RA患者关节局部破坏对于治疗RA有重要意义。研究表明,骨组织和免疫系统之间相互影响[13]。因此本课题组建立了OC-Tregs共培养体系,以期探讨骨与免疫系统之间的关系,并应用此培养体系探讨雷公藤甲素对该培养体系中OC分化的影响[4]。YSJB是临床治疗类风湿关节炎的常用中成药,研究表明该药对免疫系统有调节作用,因此本研究以该共培养体系为研究对象,探讨YSJB治疗RA 的作用机制。结果显示,OC+Tregs+CIA组OC数目和骨陷窝吸收面积显著高于OC+Tregs+Control组,而YSJB能明显抑制共培养体系中OC 的分化,减少OC的骨吸收。
有研究表明,Tregs调节作用部分依赖于IL-10抑制促炎因子生成[14]。HMGB1是RA中重要的促炎介质,血清HMGB1水平升高与更具破坏性的关节炎有关[15];而且RAGE是HMGB1的受体, HMGB1的分泌增加和RAGE的表达增加能促进炎症的发展[16]。本实验结果表明,共培养体系Tregs IL-10分泌OC+Tregs+CIA组明显低于OC+Tregs+Control组,OC HMGB1、RAGE分泌和表达OC+Tregs+CIA组明显高于OC+Tregs+Control组;而OC+Tregs+YSJB组IL-10含量明显高于OC+Tregs+CIA组,HMGB1、RAGE表达明显低于OC+Tregs+CIA组,说明YSJB能促进共培养体系中Tregs对IL-10的分泌,抑制OC中HMGB1和RAGE的表达。
综上所述,益肾蠲痹丸能抑制OC-Tregs共培养体系中OC分化和骨吸收功能,其机制与促进Tregs IL-10的分泌,抑制OC HMGB1、RAGE表达有关,这可能是其治疗RA的作用机制之一。
参考文献:
[1] CRISCITIELLO C,VIALE G,GELAO L,et al. Crosstalk between bone niche and immune system:osteoimmunology signaling as a potential target for cancer treatment[J]. Cancer Treat Rev,2015,41(2):61-68.
[2] ZAISS MM,FREY B,HESS A,et al. Regulatory T cells protect from local and systemic bone destruction in arthritis [J]. J Immunol,2010,184(12):7238-7246.
[3] BOZEC A,ZAISS MM. T Regulatory Cells in Bone Remodelling [J]. Curr Osteoporos Rep,2017,15(3):121-125.
[4] HUIHUI XU,HONGYAN ZHAO,CHENG LU, et al. Triptolide Inhibits Osteoclast Differentiation and Bone Resorption In Vitro via Enhancing the Production of IL-10 and TGF-β by Regulatory T Cells [J]. Mediators Inflamm,2016,2016:8048170.
[5] 郭会卿.益肾蠲痹丸治疗顽痹150例疗效观察[J].时珍国医国药,2006,17(10):2039-2040.
[6] 李雪芬,钟诗婷,邓矢明.益肾蠲痹丸治疗类风湿性关节炎临床研究[J]. 河南中医,2017,37(2):313-315.
[7] 华江. 益肾蠲痹丸治疗痹症60例[J]. 浙江中医学院学报,2002,26(3):39.
[8] 王露,黄云台,孟庆良. 益肾蠲痹丸治疗骨性关节炎的临床疗效及安全性研究[J]. 中国中医药现代远程,2010,8(13):192-193.
[9] 赵宏艳,王燕,于峥,等. 益肾蠲痹丸对肾虚证与脾虚证CIA大鼠免疫因子的调节作用研究[J]. 中国中医基础医学杂志,2013,19(3):261-263.
[10] 王晶晶,刘静,裴天仙,等. 益肾蠲痹丸对Ⅱ型胶原致关节炎大鼠踝关节组织病理改变的影响及其机制研究[J]. 中草药,2016,47(17):3064-3069.
[11] 肖诚,赵宏艳,王燕,等. 益肾蠲痹丸对肾虚证与脾虚证胶原诱导性关节炎大鼠的疗效比较[J]. 中日友好医院学报,2014,28(2):102-107.
[12] 吕爱平,王安民, 曾晓莲. 益肾蠲痹丸对大鼠实验性痹症影响的病理学研究[J]. 中医杂志,1998,6:49-51.
[14] 汪锡金,叶民,张宇红,等. 白介素-10抑制促炎因子生成保护多巴胺能神经元[J]. 上海交通大学学报,2008,28(5):521-524.
[15] PULLERITS R,SCHIERBECK H,UIBO K,et al. High mobility group box protein 1-A prognostic marker for structural joint damage in 10-year follow-up of patients with juvenile idiopathic arthritis[J]. Semin Arthritis Rheum,2017,46 (4):444-450.
[16] BEIJNUM JR,BUURMAN WA,GRIFFIOEN AW. Convergence and amplification of toll-like receptor (TLR) and receptor for advanced glycation end products (RAGE) signaling pathways via high mobility group B1 (HMGB1)[J]. Angiogenesis, 2008,11(1):91-99.

