黄芪多糖对缺血再灌注损伤脐静脉内皮细胞抗氧化应激机制探讨❋
王红芹,孙明杰,武 乾,石晓路,孙丽华,吴 旸
(1. 北京市中医药防治重大疾病基础研究重点实验室,中国中医科学院医学实验中心机能室,北京 100700; 2. 北京中医药大学东方医院心血管内科,北京 100078)
缺血性心脏病是全人类发病率和死亡率最高的常见疾病之一,临床表明及时恢复缺血心肌的血运供应(再灌注治疗)可有效减少心肌梗塞面积,提高长期的心肌功能,降低死亡率[1]。但研究发现,再灌注疗法可加重缺血区域组织的损伤,临床主要表现为心肌顿抑、心律失常、心脏微血管“无复流”现象的发生[2]。其中,心脏微血管“无复流”的发生与内皮细胞功能障碍密切相关[3],内皮细胞功能障碍在心肌缺血的起始和发展阶段均起到重要作用[4]。因此,保护内皮细胞功能对抗心肌缺血再灌注损伤(myocardial ischemia reperfusion injury,MIRI)有重要意义。中医理论认为,心肌缺血再灌注损伤“无复流”现象的发生与气虚血瘀密切相关,其中心气虚是造成血瘀的重要原因[5],益气活血法是中医治疗MIRI 的主要手段。黄芪是传统的补气中药,临床治疗心肌缺血再灌注损伤疗效确定。黄芪多糖是黄芪的主要成分之一,研究表明黄芪多糖具有抗氧化、抗炎、增加内皮细胞活性等作用[6]。本实验以脐静脉内皮细胞(human umbilical Vein Endothelial cell,HUVEC)为靶细胞,探讨黄芪多糖对缺血再灌注损伤内皮细胞氧化应激机制的影响。
1 材料
1.1 细胞
脐静脉内皮细胞(原代细胞株,ScienCell,8000)。
1.2 试剂
内皮细胞培养基(ScienCell,1001)内含500 ml内皮培养基、25 ml胎牛血清、5 ml内皮细胞生长因子、5 ml青/链霉素溶液,RIRP裂解液(碧云天生物技术,P0013B), PMSF(碧云天生物技术,ST506),黄芪多糖(贵州迪大生物科技有限公司,GZDD-2490),美托洛尔(Sigma,80337), 活性氧检测试剂盒(碧云天生物技术,S0033),LDH检测试剂盒(碧云天生物技术,C0016),MDA检测试剂盒(碧云天生物技术,S0131),JC-1检测试剂盒(碧云天生物技术,C2006),BCA蛋白浓度测定试剂盒(碧云天生物技术,P0010)。仪器:倒置相差显微镜(Olympus,IMT-2),CO2培养箱(Thermo,51030999),三气培养箱(Thermo,3131),全自动酶标仪(Biotec,synergyH1),离心机(Ependorff,5804R)
2 方法
2.1 细胞培养
原代细胞株复苏后,待细胞长到85%左右融合,将其消化、离心重悬后按照1∶3比例传代,细胞周期为24 h。
2.2 模型建立
将培养至5代85%左右融合的HUVEC消化重悬后(密度 1×10-5/ml)随机分为正常对照组、模型组、黄芪多糖组(25 μg·ml-1)、美托洛尔组(20 μmol·L-1)。2 h细胞贴壁后,模型组与药物组原培养液吸出,PBS洗1遍,模型组换为无糖造模液(NaCl 6.80、KCl 0.40、NaHCO32.20、CaCl20.20、MgSO4·7H2O 0.20、NaH2PO4·2H2O 0.140 g/L),药物组换为含有相应药物浓度的无糖造模液,将其放入三气培养箱(94%N2、5%CO2、1%O2)中培养4 h模拟缺血缺氧,之后更换为内皮细胞培养基(含5%FBS、1%ECGS、1%P/S)放入正常培养箱(95%O2、5%CO2)中培养16 h模拟再灌注,模型和各药物组分别于缺氧和复氧的同时加入相应浓度的药物,正常对照组始终在正常条件下培养24 h。
2.3 MTT法检测细胞活性
将培养至5代的85%左右融合的HUVEC消化重悬后(密度 1×10-5/ml)随机分为正常对照组、模型组、黄芪多糖 12.5 μg·ml-1组、黄芪多糖 25 μg·ml-1组、 黄芪多糖 50 μg·ml-1组、美托洛尔组(20 μmol·L-1),按照上述模型建立的方法造模结束后,将孔内的培养液吸出,每孔加入含有MTT溶液(5 mg/ml)的内皮细胞培养基100 μl(MTT溶液∶培养基=1∶10),放入37℃ CO2培养箱避光孵育4 h,孵育结束后将孔内液体吸出,每孔加入100 μl DMSO,摇床中摇10 min,酶标仪490 nm检测吸光值。
2.4 细胞内ROS检测
将铺到6孔板的HUVEC按照模型建立的方法分组、造模,结束后将6孔板内的细胞消化离心后倒掉上清,PBS洗1遍,按照试剂盒操作说明书悬浮细胞检测方法进行后续操作,酶标仪488 nm激发波长,525 nm发射波长进行检测。
2.5 细胞内MDA检测
将铺到培养皿(10×10 mm)的HUVEC按照模型建立的方法分组、造模,结束后将各培养皿内细胞消化离心后PBS洗1遍,1000 r/5 min离心倒掉上清,每组加入200 μl 含有1 mmol PMSF的RIPA裂解液,冰上裂解20 min,裂解结束后10000 r/5 min 离心,使用BCA蛋白测定试剂盒进行蛋白定量,按照试剂盒说明书进行后续操作,酶标仪530 nm进行检测。
2.6 LDH漏出率检测
将铺到96孔板的HUVEC按照模型建立的方法分组、造模,分别收集缺氧结束后的无糖造模液和复氧结束后的细胞培养液,按照试剂盒方法检测OD值。细胞内LDH OD值测定:复氧结束后收集细胞培养液,按照试剂盒操作说明书每孔加入含有LDH释放试剂的无血清培养基120 μl,室温避光孵育30 min,400 g/5 min离心,按照试剂盒操作说明书进行后续操作,酶标仪490 nm检测,600 nm作为参考波长。LDH漏出率=[(无糖造模液OD值-相应空白对照组OD值)+(复氧细胞培养液OD值-细胞培养液空白对照OD值)]/[(无糖造模液OD值-相应空白对照组OD值)+(复氧细胞培养液OD值-细胞培养液空白对照OD值)+含LDH释放试剂的无血清培养基OD值]。
2.7 线粒体膜电位(JC-1)检测
将铺到6孔板的HUVEC按照模型建立的方法分组、造模,结束后将6孔板内的细胞消化离心后倒掉上清,PBS洗1遍,按照试剂盒操作说明书上悬浮细胞检测方法进行后续操作,酶标仪490 nm激发波长,530 nm发射波长检测单体,500 nm激发波长、540 nm发射波长检测聚合物。
2.8 统计学方法

3 结果
3.1 不同浓度黄芪多糖对缺血再灌注损伤HUVEC活性的影响
表1显示,与正常对照组比较,模型组及模型加各加药组的OD值均降低,差异有统计学意义(P<0.05),表明HUVEC缺氧4 h、复氧16 h后细胞活性降低,模型成功;与模型组比较,黄芪多糖25 μg·ml-1组与美托洛尔组(20 μmol·L-1)OD值升高且差异有统计学意义(P<0.05),而黄芪多糖12.5 μg·ml-1、50 μg·ml-1组与模型组OD值比较差异无统计学意义(P>0.05),表明黄芪多糖25 μg·ml-1对缺血再灌注损伤HUVEC的保护作用最为明显,故后续实验选用黄芪多糖25 μg·ml-1作为最佳实验浓度。
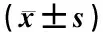
表1 不同浓度黄芪多糖对缺血再灌注损伤HUVEC活性比较
注:与正常对照组比较:*P<0.05;与模型组比较:△P<0.05
3.2 黄芪多糖对缺血再灌注损伤HUVEC ROS、MDA含量及线粒体膜电位、LDH漏出率影响
表2显示,与正常对照组比较,模型组、黄芪多糖组及美托洛尔组细胞内ROS、MDA含量、LDH漏出率显著升高(P<0.05),线粒体膜电位显著降低(P<0.05);与模型组比较,黄芪多糖组、美托洛尔组细胞内ROS、MDA含量、LDH漏出率显著降低(P<0.05),线粒体膜电位显著升高(P<0.05)。
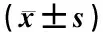
表2 黄芪多糖对缺血再灌注损伤HUVEC ROS、MDA含量及线粒体膜电位、LDH漏出率影响比较
注:与正常对照组比较:*P<0.05;与模型组比较:△P<0.05
4 讨论
心肌缺血再灌注时由于氧气的大量涌入,ROS生成增多,超过了抗氧化系统的清除能力,使体内氧化/抗氧化失衡发生氧化应激[7]。ROS可促进中性粒细胞、炎症主效应细胞的活化和募集,使内皮细胞与炎性细胞发生黏附,造成血管内微血栓形成,血流减少,最终导致心脏微血管“无复流”现象的发生[8];ROS还是引起细胞死亡的主要因素,因此抗氧化应激对于减少缺血再灌注造成的“无复流”现象具有重要作用。细胞缺氧时糖酵解增加,LDH生成增多,缺血再灌注可造成细胞损伤,细胞膜通透性增加,LDH从细胞内漏出增多;过氧自由基与细胞膜上的不饱和脂肪酸反应生成脂质氢过氧化物,脂质氢过氧化物可分解生成MDA[7],使细胞内MDA含量增多。ROS还能影响线粒体膜电位,心肌缺血再灌注时可造成线粒体膜电位下降[9]。减少氧化应激反应的发生,是抗心肌缺血再灌注造成的血管内皮细胞功能障碍的重要靶点。
传统中医理论认为,气虚血瘀是心肌缺血再灌注损伤的基本病机。在临床应用中,益气活血法常被用于改善心肌缺血再灌注后症状。何志明[10]等在观察自拟益气复脉通络方对冠心病介入治疗后心绞痛疗效中发现,益气复脉通络方可改善冠心病介入治疗后心绞痛症状,提高中医证候积分,并能降低其炎症反应。傅广[11]等在观察芪参益气滴丸对经皮冠状动脉介入治疗围手术期心肌损伤的影响中发现,芪参益气滴丸可降低PCI围手术期Tn1和CK-MB浓度,减轻稳定型心绞痛患者PCI围手术期心肌损伤。黄芪是传统的中医补气要药,黄芪多糖是黄芪的主要成分之一,既往研究报道黄芪多糖可通过抗氧化、抗炎、保护线粒体功能、减少内皮细胞-中性粒细胞相互作用、抑制内皮细胞凋亡发挥抗心肌缺血再灌注损伤作用。朱海燕等[12]发现,黄芪多糖可减少缺血再灌注损伤人心脏微血管内皮ICAM-1、VCAM-1的表达,抑制白细胞浸润,减轻心肌缺血再灌注损伤。范宗静[13-14]等在观察黄芪多糖对心肌线粒体影响研究中发现,黄芪多糖可减轻缺血再灌注损伤大鼠心肌细胞内钙超载,降低线粒体膜电位,抑制mPTP开放,减轻线粒体损伤,通过保护线粒体功能,从而保护缺血再灌注损伤心脏;黄芪多糖还可上调缺血再灌注损伤人心脏微血管内皮细胞Bcl-2的表达,抑制Bax的升高,减少微血管内皮细胞凋亡,发挥抗心肌缺血再灌注损伤作用,但对于内皮细胞的影响研究仍较少。
本研究结果表明,体外培养HUVEC缺氧4 h、复氧16 h后,模型组细胞活性下降,模型组细胞内MDA、ROS显著增多,LDH漏出率增高;当给予黄芪多糖干预后,细胞活性增加,LDH漏出率、细胞内MDA、ROS含量显著减少。既往研究中[15]有报道,黄芪多糖对乳鼠心肌细胞缺氧/复氧损伤存在保护作用, 可提高缺氧/复氧损伤乳鼠心肌细胞活性,减少LDH漏出和MDA含量,与本实验结果相符。此外从实验结果可以看出,黄芪多糖可显著提高缺血再灌注损伤HUVEC线粒体膜电位。但既往黄芪多糖抗心肌缺血再灌注损伤线粒体机制研究中发现,黄芪多糖可减少大鼠心肌细胞线粒体膜电位[14]。考虑到心肌缺血发生时电子传递链被抑制,线粒体膜电位下降;当再灌注发生时,电子传递链的恢复可使膜电位升高,但ROS增多诱导MPTP开放,线粒体内膜通透性增加,Ca2+超载,消散膜电位,会造成膜电位下降[16-17];黄芪多糖可能通过减少ROS生成,抑制线粒体通透性转换孔开放,从而减少Ca2+超载而升高膜电位。
内皮细胞功能障碍贯穿于心肌缺血再灌注损伤的起始和发展阶段,维护内皮细胞功能对抗心肌缺血再灌注损伤有重大意义。本研究结果表明,黄芪多糖可减少缺血再灌注损伤内皮细胞ROS、脂质过氧化产物的生成,减少氧化应激发生,通过抗氧化应激机制拮抗缺血再灌注造成的内皮细胞损伤,进而发挥抗MIRI的作用。
参考文献:
[1] IBANEZ B,HEUSCH G,OVIZE M,et al.Evolving therapies for myocardial ischemia/reperfusion injury[J].Journal CME activity,2015,65(14):735-1097.
[2] KLONER R A.Mitochondrial Protective Agents for Ischemia/Reperfusion Injury[J].Circulation:Cardiovascular Interventions,2017,10:1-3.
[3] HOFFMAN J W,GILBERT T B,POSTEN R S,et al.Myocardial reperfusion injury:Etiology,mechanisms,and therapies[J].The journal of the American society of extra-Corporeal technology,2004,36:391-411.
[4] VANHOUTTE PM.Endothelial dysfunction:the first step toward coronary arteriosclerosis[J]. Circ J,2009,73:595-601.
[5] 谢连娣,刘洋,周琨,等.心肌缺血再灌注损伤的中医病机浅识[J].中华中医药杂志,2015,30(9):3139-3141.
[6] 杨庆珍,刘德旺,田义新,等.黄芪多糖化学结构与药理作用研究进展[J].北方园艺,2015,7:168-175.
[7] BIRBEN E,SAHINERAL U M,SACKESEN C,et al.Oxidative Stress and Antioxidant Defense[J].WAO journal,2012:9-19.
[8] YANG Q,HE G Y,UNDERWOOD M J.Cellular and molecular mechanisms of endothelial ischemia/reperfusion injury:perspectives and implications for postischemic myocardial protection[J].Am J Transl Res,2016,8(2):765-777.
[9] SEIDLMAYER L K,JUETTNER V V,KETTLEWELL S, et al.Distinct mPTP activation mechanisms in ischaemia-reperfusion:contributions of Ca2+,ROS, pH,and inorganic polyphosphate[J].Cardiovascular Research,2015,106:237-248.
[10] 何志明,陈冬清,吕小强,等.自拟益气复脉通络方对冠心病介入治疗后心绞痛疗效及对VEGF、sICAM-1、MMPs-9、炎症因子表达的影响[J].中国中医急症,2017,26(7):1306-1308.
[11] 傅广,马丽霞,石顺华,等.芪参益气滴丸对经皮冠状动脉介入治疗围手术期心肌损伤的影响[J].中国循证心血管医学杂志,2014,6(1):71-73.
[12] 朱海燕,陈立新,朱陵群.黄芪多糖对缺氧复氧后人心脏微血管内皮细胞ICAM-1、VCAM-1表达的影响[J].辽宁中医杂志,2008,35(2):293-295.
[13] 范宗静,谢连娣,董巧稚,等.黄芪多糖抗心肌缺血再灌注损伤的线粒体机研究[J].中国中医基础医学杂志,2017,23(4):484-487.
[14] 范宗静,吴旸,刘洋,等.心肌缺血再灌注损伤引发的线粒体功能障碍与黄芪多糖的干预作用[J].辽宁中医杂志,2016,43(4):867-869.
[15] 闵清,白育庭,余薇,等.黄芪多糖对乳鼠心肌细胞缺氧/复氧损伤的保护作用[J].中国药理学通报,2010,26(12):1661-1664.
[16] SANDERSON T H,REYNOLDS C A,KUMAR R, et al.Molecular Mechanisms of Ischemia-Reperfusion Injury in Brain: Pivotal Role of the Mitochondrial Membrane Potential in Reactive Oxygen Species Generation [J].Mol Neurobiol,2012:1-15.
[17] HÜTTEMANN M,HELLING S,SANDERSON T H,et al.Regulation of mitochondrial respiration and apoptosis through cell signaling:Cytochrome c oxidase and cytochrome c in ischemia/reperfusion injury and inflammation[J].Biochimica et Biophysica Acta,2011,1817(2012):598-609.

