动脉粥样硬化患者NLRP3炎性体分子表达及临床意义
陈国伟 吴小兰 陈冬梅 沈荣兴 陈建忠
动脉粥样硬化多由脂肪代谢紊乱、神经血管功能失调引起,常导致血栓形成、供血障碍等,为老年人主要病死原因之一。局部及全身炎症反应在动脉粥样硬化的发生、发展中发挥重要作用[1],尤其是免疫应答介导的炎症反应[2-3]。炎性体是由模式识别受体如核苷酸结合寡聚化样受体(NLRs)识别配体如病原体相关模式分子(PAMPs)或危险相关模式分子(DAMPs)后与斑点样蛋白(ASC)、半胱天冬酶-1(caspase-1)等形成的大分子的复合物[4-5],炎性体形成后能激活caspase-1,活化的caspase-1继而通过酶切IL-1β和IL-18前体分子而生成具有生物学活性的IL-1β和IL-18,进而调节炎症反应。近年来有学者提出含热蛋白结构域3的核苷酸结合寡聚化样受体(NLRP3)介导的炎性体激活途径在动脉粥样硬化发生、发展过程中起着重要的作用[6-13]。本研究通过观察动脉粥样硬化患者NLRP3炎性体相关分子如NLRP3、ASC、IL-1β的表达及其并用胆固醇结晶诱导巨噬细胞活化产生IL-1β和TNF-α的水平,探讨NLRP3炎性体活化途径在动脉粥样硬化发病中的作用。
1 对象和方法
1.1 对象 收集2016年1月至2016年12月在桐乡市第二人民医院门诊及住院的动脉粥样硬化患者共40例设为实验组,其中男23例,女17例,年龄49~84岁(69.9±9.6)岁;均经超声检查确诊。入选标准:血管内膜增厚,内-中膜厚度1.0~1.2mm或管腔内粥样硬化斑块形成、管腔狭窄;排除标准:(1)有急性感染的临床表现;(2)严重肾功能衰竭;(3)患有痛风、类风湿疾病、糖尿病、恶性肿瘤或其他严重消耗性疾病;(4)长期服用激素或免疫抑制剂的患者。选取桐乡市第二人民医院同期健康体检者40例作为对照组,其中男24例,女16例,年龄50~80(68.6±11.1)岁。两组对象性别、年龄等基线资料比较差异均无统计学意义(均P>0.05),见表1。
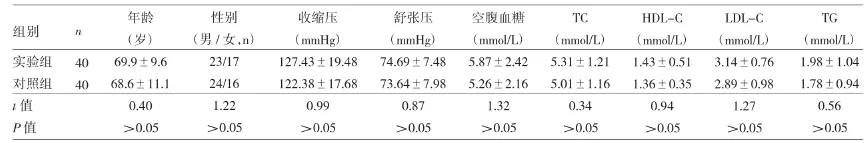
表1 两组对象的主要基线资料比较
1.2 方法
1.2.1 血浆细胞因子检测 采集清晨空腹静脉血5ml,肝素抗凝,收集血液后,以1 200r/min离心10min,分离血浆将血浆置于EP管(美国,Axygen,Y3700),置于-20℃冰箱保存。用ELISA试剂盒检测血浆中IL-1β(美国,eBioscience,85-88-7261-22)、IL-18(美国,e-Bioscience,85-BMS267-2) 和 IL-37(美国,Invitrogen 88-52103)浓度,按试剂盒说明书操作,酶标仪(Molecular Devices,SynergyMx M5) 测定 450nm 处吸光度(A)值,以试剂盒提供的标准品测定结果绘制标准曲线,计算细胞因子的含量。
1.2.2 定量PCR检测巨噬细胞(MDM)中NLRP3炎性体相关分子mRNA的表达 采集静脉血5ml,肝素抗凝,将细胞用PBS稀释1倍后,加入至含淋巴细胞分离液(挪威,Stemcell,LymphoprepTM,#07851)的离心管中,采用密度梯度离心法分离两组患者的单个核细胞,分化为MDM,根据TRIzol试剂盒(康为,CW0580S)说明书提取总RNA,加入20μl的DEPC水溶解,测定RNA的浓度和OD比值,符合要求后按SuperRT cDNA第一链合成试剂盒(康为,CW0741M)说明书进行逆转录反应,20μl反应体系中包括 dNTP mix 4μl,SuperRT 1μl,5×RTBuffer 4μl,RNA 2μl,引物 2μl,DEPC 水 7μl,反应物4℃储存待用。实时荧光定量PCR根据参考文献进行,20μl反应体系中含 SYBR Premix Ex TaqTMⅡ(2×)10μl,PCR上游和下游引物各1μl,逆转录反应液(cDNA溶液)2μl,DEPC 水 6μl,在定量 PCR 仪(Applied Biosystems,7900)上进行反应,反应条件为 95℃,30s;95℃,5s;60℃,34s,40 个循环,每个样品设定 3 个复孔,并使用溶解曲线分析引物特异性。用2-△△Ct法计算出每组样本的基因表达量,每种检测重复3次。引物根据文献报道设计和合成(上海生工生物工程技术有限公司),序列见表2。

表2 引物序列
1.2.3 胆固醇刺激MDM产生细胞因子的检测 用胆固醇结晶(美国,Sigma-Aldrich,C8667)刺激 MDM,收集MDM细胞上清液,用ELISA方法检测TNF-α(美国,eBioscience,85-88-7346-22)、IL-1β 的含量。实验按试剂盒说明书操作,酶标仪测定450nm处吸光度(A)值,以试剂盒提供的标准品测定结果绘制标准曲线,计算细胞因子的含量。
1.3 统计学处理 采用SPSS11.5统计软件,正态分布的计量资料以±s表示,两组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组对象血浆中细胞因子含量的比较见表3。由表3可见,实验组动脉粥样硬化患者的IL-1β和IL-18的水平显著高于对照组,差异均有统计学意义(P<0.05)。而IL-37水平略高于对照组,但差异无统计学意义(P>0.05)。
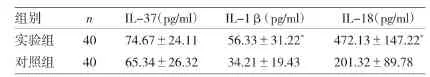
表3 两组对象血浆中细胞因子含量的比较
2.2 两组对象MDM NLRP3炎性体相关分子表达水平比较见表4。

表4 两组MDM NLRP3炎性体相关分子表达水平比较
由表4可见,实验组NLRP3、ASC、IL-1β的mRNA表达显著高于对照组,差异均有统计学意义(均P<0.05)。
2.3 两组对象MDM经胆固醇结晶刺激后产生细胞因子水平的比较见表5。

表5 两组对象MDM经胆固醇结晶刺激后细胞因子水平的比较
由表5可见,实验组分离的MDM经胆固醇结晶刺激后TNF-α、IL-1β的分泌水平均显著高于对照组,差异均有统计学意义(均P<0.05)。
3 讨论
动脉粥样硬化是一种以脂质沉积、白细胞浸润和血管平滑肌细胞增殖为主要特征的慢性炎症性疾病,但是到目前为止,动脉粥样硬化患者粥样损伤时炎症反应的发生机制尚未完全阐明[1],免疫应答引起的炎症反应与其密切相关[2-3]。近年来研究表明,损伤的组织和细胞产生的损伤/DAMPs能被模式识别受体(PRR)识别后介导炎症反应的发生。这些模式识别受体包括TLR、NLR、RLR和CLR等,其中NLR识别DAMPs后能形成由NLR、ASC、caspase-1等形成的称为炎性体的分子复合物[14]。炎性体形成后能激活caspase-1,活化的caspase-1继而通过酶切IL-1β和IL-18前体分子而生成具有生物学活性的IL-1β和IL-18,进而调节炎症反应。NLRP3炎性体[15]是研究最多的一种,NLRP3炎性体由NLRP3、ASC和caspase-1组成。多种内源性刺激物如胆固醇结晶、葡萄糖、游离脂肪酸、尿酸钠(MSU)结晶及胞质外ATP和外源性刺激物如细菌、病毒等成分能诱导NLPR3的活化,通过诱导促炎性细胞因子如IL-1β的产生,在如动脉粥样硬化[6-10]、糖尿病[16-17]等免疫炎症性疾病中的发病过程中起着重要的作用。如临床报告发现,血液中IL-1β和IL-18的升高程度与冠状动脉病的严重度密切相关。
动脉壁的慢性炎症是动脉粥样硬化发生的关键环节,单核细胞浸润是动脉壁中粥样斑块的发生的基本特征。近来研究发现固有免疫细胞如MDM、内皮细胞吞噬游离脂肪酸(FFA)、胆固醇结晶后,可激活炎性体途径,释放炎症因子如IL-1β、TNF-α等,在动脉粥样硬化的发生、发展中起重要的作用[6-10]。本研究显示,动脉粥样硬化患者血浆中的IL-1β和IL-18的水平显著高于对照组,提示动脉粥样硬化患者可能存在慢性低度炎症状态。IL-37是新近发现的具有抗炎症作用的细胞因子[18],本研究结果显示,动脉粥样硬化患者血浆中IL-37水平仅略高于对照组,但无统计学差异,提示IL-37可能是为了调节炎症应答而代偿性升高。IL-1β和IL-18的产生依赖于NLRP3炎性体的激活,而炎性体的激活需要二个阶段,即NLRP3炎性体相关分子的诱导表达阶段和激活阶段,研究发现修饰的LDL如氧化可被MDM的TLR和清道夫受体识别并作为初始信号诱导NLRP3和IL-1β的表达[8,9],本研究将外周血单个核细胞分离后进一步分化为MDM,采用实时荧光PCR检测MDM中NLRP3、ASC、IL-1 mRNA表达,同样发现动脉粥样硬化患者MDM 的 NLRP3、ASC、IL-1β的 mRNA表达显著高于对照组,与早期研究发现冠状动脉病患者外周血单个核细胞和皮下脂肪组织的NLRP3、IL-1β、IL-18等分子表达升高结果一致[19-21]。为进一步研究动脉粥样硬化患者MDM对胆固醇结晶刺激的敏感性,体外用一定浓度的胆固醇结晶刺激后发现动脉粥样硬化患者MDM的TNF-α、IL-1β分泌水平均显著高于对照组,提示动脉粥样硬化患者的MDM吞噬胆固醇或FFA后导致NLRP3炎性体的激活并促进IL-1β、TNF-α的产生,以上结果提示由胆固醇结晶刺激引起的炎性体激活途径可能在动脉粥样硬化硬化的发生、发展中起重要的作用。有关胆固醇结晶激活NLRP3炎性体的分子机制,有学者推测胆固醇结晶被巨噬细胞MDM吞噬后可导致吞噬溶酶体的不稳定性或破裂,引起溶酶体的组织蛋白酶B释放,组织蛋白酶B和钾离子外流、反应性氧代谢产物一起介导NLRP3炎性体的活化[8,9]。
近来研究发现炎性体活化途径抑制剂在炎性体相关疾病的治疗中取得较好的效果[22-23],最近文献报道常用于冠心病治疗的药物他汀类药物能抑制NLRR3炎性体的激活而发挥抗炎作用[10-24],这些发现为进一步研制开发有效的动脉粥样硬化治疗药物提供了一定的理论依据和实验基础。
[1]FredmanG, TabasI.Boosting Inflammation Resolution in Atherosclerosis:The Next Frontier for Therapy[J].Am J Pathol,2017,187(6):1211-1221.doi:10.1016/j.ajpath.2017.01.018.
[2]Gistera A,Hansson GK.The immunology of atherosclerosis[J].NatRev Nephrol,2017,13(6):368-380.doi:10.1038/nrneph.2017.51.
[3]Witztum JL,Lichtman AH.The influence of innate and adaptive immune responses on atherosclerosis[J].Annu Rev Pathol,2014,9:73-102.doi:10.1146/annurev-pathol-020712-163936.
[4]Sharma D,Kanneganti TD.The cell biology of inflammasomes:Mechanisms of inflammasome activation and regulation [J].J Cell Biol,2016,213(6):617-629.doi:10.1083/jcb.201602089.
[5]Broz P,Dixit VM.Inflammasomes:mechanism of assembly,regulation and signalling [J].NatRev Immunol,2016,16(7):407-420.doi:10.1038/nri.2016.58.
[6]Karasawa T,Takahashi M.Role of NLRP3 Inflammasome in atherosclerosis[J].J Atheroscler Thromb,2017,24(5):443-451.doi:10.5551/jat.RV17001.
[7]Hoseini Z,Sepahvand F,Rashidi B,et al.NLRP3 Inflammasome:Its Regulation and Involvement in Atherosclerosis[J].J Cell Physiol,2017,233(3):2116-2132.doi:10.1002/jcp.25930.
[8]Duewell P,Kono H,Rayner KJ,et al.NLRP3 inflammasomes are required for atherogenesis and activated by cholesterol crystals[J].Nature,2010,464:1357-1361.doi:10.1038/nature08938.
[9]Rajamaki K,Lappalainen J,Oorni K,et al.Cholesterol crystals activate the NLRP3 inflammasome in human macrophages:a novel link between cholesterol metabolism andinflammation [J].PLoS One,2010,5:e11765.doi:10.1371/journal.pone.0011765.
[10]Altaf A,Qu P,Zhao Y,et al.NLRP3 inflammasome in peripheral blood monocytes of acute coronary syndrome patients and its relationship with statins [J]. Coron Artery Dis,2015,26 (5):409-421.doi:10.1097/MCA.0000000000000255.
[11]罗彩云,丁家望,郑霞霞,等.NLRP3炎性小体、胆固醇结晶与动脉粥样硬化关系的研究进展[J].海南医学,2016,27(11):1837-1840.doi:10.3969/j.issn.1003-6350.2016.11.037.
[12]甘祥海,吕湛.NLRP3炎性小体在动脉粥样硬化发生发展中的作用[J].临床与病理杂志,2015,35(3):462-468.doi:10.3978/j.issn.2095-6959.2015.03.025.
[13]卞芳,金肆.NLRP3炎症小体在动脉粥样硬化相关细胞中作用的研究进展 [J].中国药理学通报,2016,32(2):163-169.doi:10.3969/j.issn.1001-1978.2016.02.004
[14]Mohamed Lamkanfi,Vishva M.Dixit.Mechanisms and functions of inflammasomes [J]. Cell,2014,157:1013-1022.doi: 10.1016/j.cell.2014.04.007.
[15]Jo EK,Kim JK,Shin DM,et al.Molecular mechanisms regulating NLRP3 inflammasome activation[J].Cell Mol Immunol,2016,13(2):148-159.doi:10.1038/cmi.2015.95.
[16]Vandanmagsar B,Youm YH,Ravussin A,et al.The NLRP3 inflammasome instigates obesity-induced inflammation and insulin resistance[J].Nat Med,2011,17(2):179-188.doi:10.1038/nm.2279.
[17]Lee HM,Kim JJ,Kim HJ,et al.Upregulated NLRP3 inflammasome activation in patients with type 2 diabetes[J].Diabetes,2013,62(1):194-204.doi:10.2337/db12-0420.
[18]Dinarello CA,Nold-Petry C,Nold M,etal.Suppression of innate inflammation and immunity by interleukin-37 [J].Eur J Immunol,2016,46(5):1067-1081.doi:10.1002/eji.201545828.
[19]Shi X,Xie WL,Kong WW,et al.Expression of the NLRP3 Inflammasome in Carotid Atherosclerosis[J].J Stroke Cerebrovasc Dis,2015,24(11):2455-2466.doi:10.1016/j.jstrokecerebrovasdis.2015.03.024.
[20]周洪琴,郭晶,陈鹏,等.动脉粥样硬化患者外周血单核细胞中NLRP3 mRNA表达及血浆IL-1β、IL-18水平变化[J].山东医药,2015,55(39):44-45.doi:10.3969/j.issn.1002-266X.2015.39.017.
[21]Bando S,Fukuda D,Soeki T,et al.Expression ofNLRP3 in subcutaneousadipose tissue isassociated with coronaryatherosclerosis [J].Atherosclerosis,2015,242 (2):407-414.doi:10.1016/j.jstrokecerebrovasdis.2015.03.024.
[22]Jesus AA,Goldbach-Mansky R.IL-1β blockade in autoinflammatory syndromes[J].Annu Rev Med,2014,65:223-244.doi:10.1146/annurev-med-061512-150641.
[23]Thacker SG,Zarzour A,Chen Y,et al.High-density lipoprotein reduces inflammation from cholesterol crystals by inhibiting inflammasome activation [J]. Immunology,2016,149 (3):306-319.doi:10.1111/imm.12638.
[24]Satoh M,Tabuchi T,Itoh T,et al.NLRP3 inflammasome activation in coronary artery disease:results from prospective and randomized study of treatment with atorvastatin or rosuvastatin [J].Clin Sci(Lond),2014,126(3):233-241.doi:10.1042/CS20130043.

