结直肠癌肺转移多学科综合治疗专家共识(2018版)
中国医师协会外科医师分会多学科综合治疗专业委员会,中国抗癌协会大肠癌专业委员会
一、结直肠癌肺转移概论和流行病学
结直肠癌(colorectal cancer,CRC)的发病率逐年上升,2015年,我国CRC发病率(376 300人)和死亡率(191 000人)均位于所有恶性肿瘤的第5位[1]。CRC发病率升高的特点在大城市尤为明显,已经上升为上海地区的第二高发肿瘤。近年来,随着胸部CT的广泛应用,被诊断为肺转移的结直肠癌患者比例也越来越多:法国1976年至2005年的数据显示,肺转移占所有转移性结直肠癌(metastatic colorectal cancer,mCRC)的 6.3%[2];意大利1994年至2010年的数据显示,初发肺转移的mCRC诊断比例已经上升到29.2%[3]。北京大学肿瘤医院1996年至2017年的回顾性资料显示,肺转移病例占所有mCRC的32.9%,而初发肺转移的患者达24.5%[4]。目前,肺脏已经成为了仅次于肝脏的第二常见转移部位。由于直肠癌患者更容易发生肺转移[2,5],且我国的直肠癌比例(近50%)明显高于欧美国家(约30%)[6-9],故结直肠癌肺转移的诊断和治疗对于我国而言是一个更为重要的临床问题。
与其他远处转移不同,肺转移病变相对生长较慢、总体预后较好[10],因而不能完全参考其他部位(肝、腹膜等)转移的治疗模式;但目前无论是国际还是国内,均无针对结直肠肺转移的指南规范或专家共识。因此,中国医师协会外科医师分会多学科综合治疗专业委员会和中国抗癌协会大肠癌专业委员会召集国内相关领域专家,结合国内外研究报道以及专家的临床实践经验和认识,充分进行讨论商榷,达成共识以便推荐结直肠癌肺转移的最佳多学科诊疗模式。
按照肺转移和原发灶的出现时间,肺转移可分为“同时性转移”和“异时性转移”。基于对肝转移预后的研究,通常将这一时间段界定为3~6个月,但这种界定在肺转移中充满争议[2,5,11-12]。法国一项30年的调查发现,对于所有肺转移人群而言,同时性肺转移的5年生存率稍高于异时性肺转移(以原发灶切除术后3个月为分界),分别为6.9%和4.6%[2];对于可切除性肺转移而言,异时性肺转移的预后似乎优于同时性肺转移[13-15]。本共识从临床可操作性的角度考虑,参考最新肝转移的治疗模式[16],将同时性肺转移定义为“在初始结直肠癌分期检查时发现的肺转移”;将异时性肺转移定义为“基线检查后发现的肺转移”。
按照肺转移和其他远处转移的先后顺序,肺转移分为“初发转移”和“非初发转移”。初发肺转移定义为肺脏作为首个远处转移脏器的情况,无论是否伴有其他远处转移,包括所有的同时性肺转移和初发异时性肺转移(原发灶切除术后出现的转移和术前新辅助治疗期间出现的肺转移),占所有肺转移的74.4%[4],是本共识的主要讨论范畴。非初发肺转移的患者则是在其他转移性疾病治疗过程中出现了肺转移,均属于异时性肺转移。
按照是否伴随肺外转移,肺转移分为“单纯性肺转移”和“非单纯性肺转移”;前者不伴肺外转移(无论是否存在原发灶),后者伴有肺外转移(无论是否存在原发灶)。
初发肺转移患者中,单纯性肺转移占37.7%~44.5%,其中仅有21.1%~32.5%患者可以接受肺转移灶的根治性治疗[3-4];其余的单纯性肺转移患者无根治性治疗机会,对于该部分人群,全身治疗如何选择、肺转移灶是否可行其他局部治疗、结直肠癌原发灶如何处理等问题均存在较大争议。非单纯性肺转移患者中,38.6%~55.5%为合并肝转移[3-4],其中绝大多数患者无法行所有转移灶的根治性治疗,仅对原发灶和/或肝转移灶进行局部治疗是否带来生存期获益?(不同肺转移定义参见附录1)这些常见的临床问题均未能得到很好的解答。本共识主要针对以上问题进行临床诊疗决策的推荐;此外,针对非初发肺转移中的一些特殊问题,如肝转移切除术后肺转移的处理,本共识也会涉及。
二、结直肠癌肺转移诊断与鉴别诊断
(一)影像学诊断
1.诊断方法
除非出现癌性淋巴管炎、大面积胸膜转移等,结直肠癌肺转移患者一般不会出现呼吸道症状和体征。因此,推荐高分辨率胸部CT检查,不建议采用其他影像检查方法,如胸片和MRI。推荐增强胸部CT扫描诊断纵隔及肺门淋巴结转移。
2.诊断指标与风险因素
直接影像诊断:位于双肺外带及下野,大于5 mm,边界清楚,分叶或短毛刺的实性或磨玻璃样结节[17-20]。
支持诊断危险因素:发病年龄>70岁、双肺多发结节、异时性肺内结节、胸膜增厚或积液、直肠癌(特别是中低位癌)、局部进展期结直肠癌(特别是侵犯肠壁外血管)、淋巴结分期较晚、原发灶血管淋巴管浸润、术前CEA水平升高、原发灶为KRAS突变、已存在肝脏转移或其他肺外转移灶等[2,5,12,14,19-25]。
癌性淋巴管炎:位于边缘的血管气管束不规则或结节样增厚,小叶间隔均匀或结节样增厚,但肺小叶形态正常呈多角形改变,区域淋巴结肿大;其他征象为肺内散在结节、胸膜肥厚及胸腔积液。
鉴别诊断:结直肠癌肺转移需与其他良恶性结节鉴别,如原发性肺癌、良性非特异性结节、感染性病变以及免疫性疾病。
3.胸部CT影像无法明确性质的肺结节(indeterminate pulmonary nodules,IPN)[19]
IPN的诊断:推荐由两名及以上的影像科专家进行阅片[20],并与临床医师讨论,结合风险因素、随访情况及病理检查等综合判断结节性质。
肺转移相关风险因素:同上。
IPN的随访:建议扫描设备和方法在随访中保持一致。危险因素较多时,每3个月行胸部CT扫描;危险因素较少时,频次与原发肿瘤保持一致;如确认为良性结节,不再密切随访。(1)经随访倾向肺转移瘤:肿瘤体积增大及增多;化疗期间,肿瘤体积缩小或数量减少,但不排除良性结节可能。(2)经随访倾向良性结节:化疗结束或未行化疗,IPN无变化。(3)经随访不能定性:推荐PET或PET/CT检查;但小于1 cm或磨玻璃样结节不推荐使用PET检查。(4)对于经密切的临床和影像学随访仍无法定性的IPN,如果其定性将改变临床治疗决策时,推荐行病理检查:可手术完全切除者,推荐多学科讨论后手术切除所有病灶;不可手术完全切除者,推荐支气管镜下活检(中心型病灶)或CT引导下活检(周围型病灶)。
4.肺外病灶的评估
肺脏是结直肠癌第二位转移靶标器官,而肝脏是第一位转移靶标器官,因而需首先明确是否存在肝脏转移。另外,确诊结直肠癌肺转移患者比其他患者更容易出现脑转移和骨转移[4,26-28],因而出现相关症状时,要进行相应检查排除脑转移或骨转移。
(二)病理学诊断及分子生物标记物检测
结直肠癌肺转移病理上:高中分化腺癌腺腔常较为宽大,被覆上皮常较高大,腺腔常包含细胞碎屑及坏死物,部分可形成筛状结构。肺原发浸润性腺癌以腺泡状生长方式居多,腺腔相对较小,被覆细胞常呈鞋钉样,周围常可见贴壁样生长的原位腺癌结构。对于分化差的转移性结直肠腺癌,以及特殊类型腺癌,如黏液腺癌、印戒细胞癌与肺原发低分化腺癌、黏液腺癌及印戒细胞癌形态学难以区分,可依赖免疫组化及详细临床病史加以鉴别。临床常用一组抗体来鉴别结直肠癌肺转移和原发性肺腺癌,其中结直肠癌肺转移阳性的抗体有:CK20、CDX-2、SATB2等,而原发性肺腺癌阳性的抗体有:CK7、TTF-1、Napsin-A等[29]。若基因检测显示出原发性肺癌的特异性突变,可能对鉴别诊断有所帮助。
根据2017版卫计委《结直肠癌诊疗规范》,推荐常规进行KRAS、NRAS、BRAF以及微卫星不稳定性(microsatellite instability,MSI)或错配修复(mismatch repair,MMR)蛋白的检测。因为KRAS突变参与到肺转移的发生,所以肺转移患者的KRAS突变频率较高[14],但需注意的是,在原发灶-肺转移灶的配对队列中,KRAS基因状态的一致率为67.6%~88.2%,低于原发灶与非肺转移灶的一致率[30-31],因而根据原发灶的KRAS状态决定靶向药物使用时可能存在偏差。肺转移人群的MMR蛋白缺失(dMMR)或高度微卫星不稳定(microsatellite instability-high,MSI-H)的比例缺少大规模数据:一项研究发现在66例肺转移患者中,无一例为MSI-H[32];另一项回顾性研究中,共有113例肺转移患者的MMR状态已知,其中dMMR比例为14.2%[4]。此外,考虑到肺转移者更容易出现HER2的高表达[33],且HERACLES和MyPathway研究中对于HER2扩增/过表达的患者使用双药抗HER2治疗的良好前景[34-35],也推荐常规进行HER2免疫组化检测。
对于肺转移患者,由于其分子特征与原发灶具有一定的差异,因而在有条件的情况下,可考虑进行肺转移灶的相关分子检测,以更好地帮助肿瘤医师制定治疗方案。但对于无法获得转移灶组织标本者,此时可考虑使用液体活检技术进行相关基因及分子标记物的检测[36]。但是,这一策略并没有获得大样本临床研究的验证,且其结果解读尚存在一定争议。
三、结直肠癌肺转移MDT综合治疗总则
(一)概述
由于肺转移数量、位置、大小、原发灶、肺外转移以及基因分型等多种因素均影响预后与治疗决策,因此需要在多学科讨论的模式下进行综合治疗。治疗手段包括全身药物治疗、根治性局部治疗(如R0手术切除、立体定向放疗、消融术等)和局部姑息性治疗。多学科讨论应结合患者临床特点和医疗资源可及性,确定治疗目的,从而制定合理有序的治疗综合策略;在治疗过程中,要关注肿瘤的生物学行为、对治疗的反应及肺外转移病灶情况,及时调整治疗预期和方案。因为目前尚缺乏高级别的临床证据,因而本共识鼓励各肿瘤中心在多学科团队的指导下开展前瞻性临床研究,并鼓励患者积极参与。
尽管肺转移本身的发展较慢,往往不是影响生存和预后的主要因素,但是MDT团队需要警惕肺内癌性淋巴管炎的可能。这种类型的肺内转移预后极差,通常这部分人群不推荐任何肿瘤病灶的局部治疗;全身系统药物治疗是主要治疗方案,应该根据患者病史、体力状态和基因状态决定使用何种药物,尽可能选择更有效的药物治疗方案。本共识在后续的讨论中,不包括此种特殊类型的肺转移。此外,在诊断治疗过程中,若原发灶或局部复发病灶存在出血、穿孔、梗阻等紧急并发症,建议对这些紧急并发症的处理后(处理手段可包含:手术切除、支架植入、结肠造口等),再按照无症状患者的处理流程进行治疗。后续讨论中,针对的均为无原发灶/局部复发紧急并发症的患者。
(二)同时性肺转移
同时性肺转移均为初发肺转移。这部分患者的治疗不仅需要考虑转移病灶的治疗,也要兼顾原发灶的处理。治疗初始阶段,首先由MDT判断各转移灶和原发灶是否可根治性切除,通常先给予全身系统药物治疗了解治疗反应及肿瘤的生物学行为,再综合决定是否对技术上可达到无肿瘤状态(no evidence of disease,NED)的患者进行所有病灶的根治性治疗。对于无法达到NED状态的患者,在全身疾病控制良好时,推荐在MDT的指导下决定是否行局部病灶的处理(图1)。
(三)初发异时性肺转移
异时性肺转移主要包括原发灶切除术后出现的转移,若肺转移同时伴有局部复发,在局部复发可再次行根治性治疗(如R0切除或根治性局部放疗)时,则可将局部复发病灶等同于原发灶进行处理,具体原则参考“同时性肺转移”;若局部复发无法行根治性治疗,则将其等同一处不可切除的转移灶进行处理。具体的综合治疗原则详见图2。
初发异时性肺转移也包括在术前新辅助治疗期间出现的肺转移(主要为直肠癌),此时的治疗原则参考“同时性肺转移”(图1)。
(四)非初发性肺转移
非初发性肺转移均为异时性转移,为异质性较大的一组疾病。与初发异时性转移不同的是,这部分患者既往已接受过前期药物的治疗,药物疗效相应较低,且肿瘤医师已经能够根据既往的治疗反应了解肿瘤的生物学行为。本共识推荐在MDT对患者的体力状态、既往治疗的疗效和不良反应、停药间隔以及肿瘤的生物学行为进行综合考量后,参考“异时性肺转移”的推荐流程制定最终决策(图2)。
四、同时性肺转移
(一)单纯性可切除性肺转移
约9.4%~12.2%的肺转移患者适合进行局部治疗[3-4],主要包括R0手术、放疗或消融术。尽管没有成熟的随机对照研究,但手术被认为是获益可能最明确的局部治疗方式。现有的大多数回顾性研究结论仍支持手术治疗优于单纯化疗:切除肺内病灶后,5年生存率为35%~70%,10年生存率为20%~30%[15,37-54];而单纯药物治疗患者5年总生存率仅有20%左右[55]。因而,推荐对可切除的肺转移患者应积极采取手术切除,若因肿瘤部位、预计残存肺功能、患者耐受性、患者意愿等因素综合考虑不适合手术切除,可考虑进行放射治疗和消融术作为替代手段[56]。
1.手术治疗
手术切除原则:一般来说,肺转移病灶的切除首选亚肺叶切除,例如楔形切除或肺段切除,但在少数情况下,由于肿瘤较深在或术中出血等情况,不得已行肺叶切除,这些患者的预后相对较差。即使R0手术,具有以下因素的患者预后也较差:多发肺转移、肺门或纵隔淋巴结转移、术前CEA水平升高、转移灶直径较大、无病间期(disease free interval,DFI)较短、高龄、原发灶分期晚、原发灶位于直肠、手术未达R0(表1)。
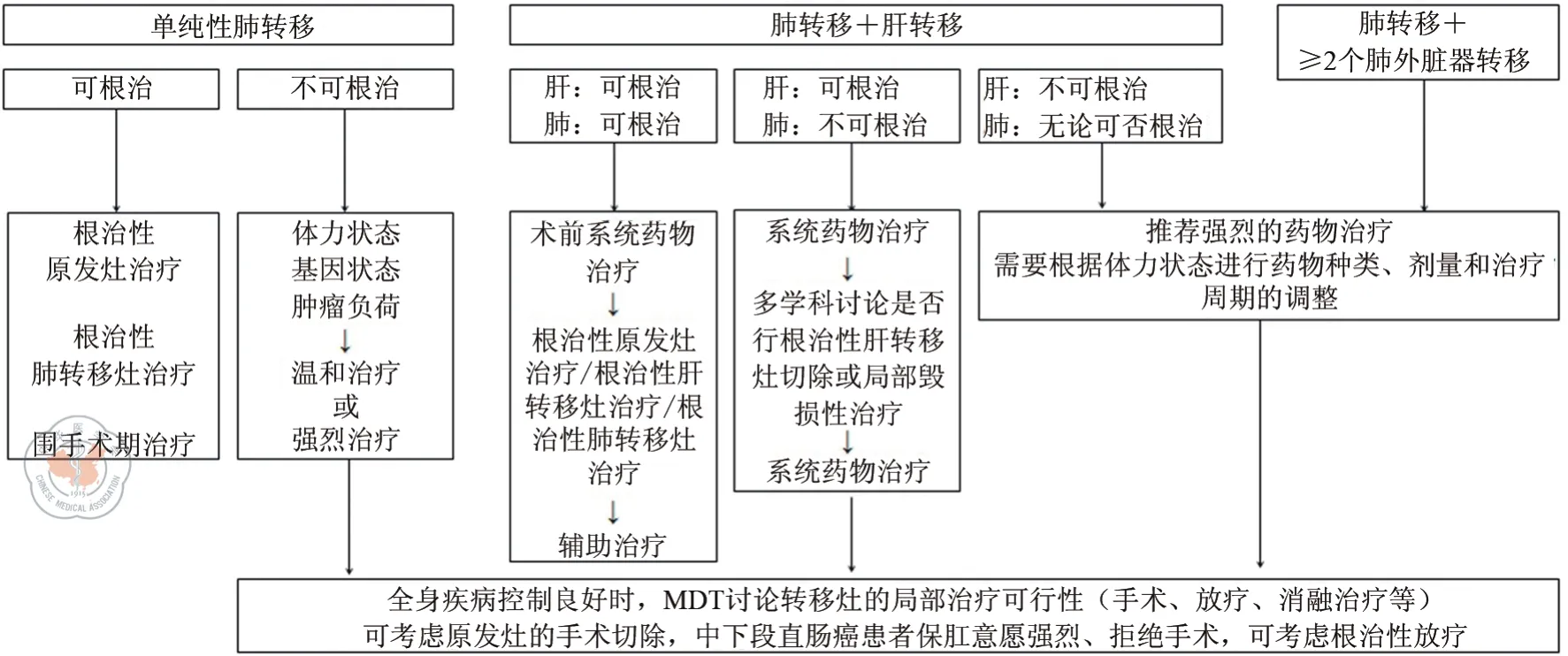
图1 同时性肺转移治疗原则

图2 异时性肺转移治疗原则
对于术前检查未怀疑肺门/纵隔淋巴结转移的患者,术中可不常规进行淋巴结的清扫;若怀疑淋巴结转移,术中可则考虑进行淋巴结活检或清扫。
围手术期药物治疗:对于可切除性肺转移,围手术期治疗的目的是提高R0切除率及降低术后复发风险。术前药物治疗还可以帮助判断肿瘤的生物学行为;若在术前药物治疗过程中出现进展,通常预后较差,即使行手术治疗也容易再次复发。因而术前药物治疗能够筛选出更加适合手术的患者;并且可以帮助判断药物的疗效,从而决定术后治疗的方案选择[57]。但是,目前尚缺乏结直肠癌肺转移相关的术前药物治疗的临床研究数据,其是否改善患者无疾病进展时间(disease free survival,DFS)及总生存(overall survival,OS)尚不明确。肺转移局部治疗时,最担心的问题是出现新发病灶,所以建议在首次发现肺转移时采用药物治疗2~3个月,来动态观察是否在治疗期间出现新发病灶,同时控制肿瘤、判断疗效;但在药物治疗期间有小部分患者可能出现疾病进展而错失手术治疗机会,故建议详细评估临床获益及进展风险后确定是否行术前药物治疗[58],治疗方案可选择以奥沙利铂或伊立替康为基础的的化疗联合靶向药物治疗。
对于直肠癌,目前并没有研究专注于同时性肺转移的围手术期治疗。对于T3-4或N+的中下段直肠癌患者,推荐原发灶及肺转移灶术前行充分的系统药物治疗和术前直肠新辅助放疗。术后根据对术前治疗的肿瘤应答和体力评分,完成整个围手术期不超过6个月的治疗;对于未行直肠癌术前治疗的患者,推荐术后进行6个月的以奥沙利铂为基础的联合化疗±放疗。具体实施方案应在多学科指导下完成。
2.非手术局部治疗手段(放疗、消融等)
对于肺转移瘤病灶能够切除但不适合或拒绝手术的患者,可考虑非手术局部治疗手段,主要包括立体定向放射治疗(stereotactic body radiation therapy,SBRT)和消融术。同手术治疗原则一样,拟行SBRT或消融术前,需评估原发灶情况,并在肿瘤整体控制良好的情况下进行;药物治疗原则同围手术期治疗。对于单发肺转移,若位于外带,首先考虑射频术,若位于中带,射频治疗和放疗均可考虑,若位于内带或靠近血管,首先考虑放疗[56];对于多发肺转移,则可在多学科的讨论下,决定相应的治疗手段。

表1 结直肠癌肺转移切除术后的预后因素
(1)肺转移灶放射治疗:放疗是针对肺转移病灶有效的局部治疗方式,随着放疗和影像技术的发展,SBRT在早期肺癌以及肺转移病灶治疗中的应用越来越广泛[59-60]。国际权威组织定义SBRT为高精度、高剂量、少分次的外放疗[61-63],SBRT区别于常规放疗最大的特征是在尽量少分次的治疗中给予较大的放疗剂量,以获得较好的肿瘤生物杀伤效果;为减小正常组织损伤,放疗范围与靶区高度一致以及靶区之外剂量迅速跌落非常关键。目前尚缺乏大宗病例的SBRT治疗结直肠癌肺转移的报道,但是已有回顾性单中心的数据或Ⅰ/Ⅱ期研究数据[64-76],所采用的剂量分割不一致,大部分集中在1~3分次,单次剂量5 Gy~30 Gy不等,2年的肿瘤局部控制率波动在53%~96%之间,但如果剂量足够高(生物等效剂量>94 Gy),局部控制可达到90%之上;与此同时,相应的1年、2年和5年的总生存率分别为83%~100%、43%~76%和39%~49%,这个数据与结直肠癌肺转移病灶切除后的生存率相似[77]。SBRT耐受性很好,发生3级的毒副反应概率<5%,4级以及之上的毒副反应罕有报道。目前仍然缺乏结直肠癌肺转移灶SBRT对比手术或消融治疗的前瞻性头对头的比较。

表2 肺转移初始可切除患者治疗策略
SBRT适应证:结直肠癌肺转移病灶是否采用放射治疗,需要考虑以下几个因素:1)肺转移病灶数目、大小和分布:肺转移灶SBRT需要尽量降低正常组织的损伤,特别是要求对正常肺组织进行保护[78]。因此转移灶个数不宜太多,以1~3个为宜,小病灶最多不超过5个;转移灶分布相对局限、集中在同侧肺是行SBRT的有利条件;转移灶体积不宜过大,以最大径≤5 cm为宜。肺部病灶的部位也是重要因素,区分肺的中央区和外周区具有重要作用,位于肺中央区的病灶被认为中央型病灶[79]。从肺癌的经验看,中央型较周围型病灶SBRT发生严重毒副反应的风险明显升高[80-82]。2)肺部是否合并基础疾病:研究显示合并间质性肺疾病患者接受肺部SBRT后2~5级的放射性肺炎发生率升高[83]。但是肺部SBRT通常对肺功能影响极小[84-86]。对于既往接受过胸部放疗的患者,肺部再程SBRT亦可获得较好的局部控制率,但3~5级的不良反应发生率显著增高,尤其是病灶大者和中央型病灶[87-90],因此再程SBRT不常规推荐。3)年龄:年龄并非制约SBRT使用的因素,已有多项研究证实SBRT在年龄超过75岁患者中的疗效和安全性[91-93],在这些高龄患者中,ECOG评分0~1分、预期寿命≥6个月者,可能从肺转移灶SBRT中获益。
需要强调的是,进行放疗的单位是否具备SBRT的仪器设备、进行精准放疗的技术与经验,如果以上设备与人员条件均不具备,则不建议进行肺转移灶的SBRT治疗,应进行常规分割的放疗。
SBRT原则:
1)SBRT的生物等效剂量≥100 Gy可获得更好的肿瘤控制;
2)对中心型肺转移病灶,≤3次的SBRT方案应当避免。对于极端中央型肺转移病灶(紧邻中央气道),可考虑6~15次的剂量分割方案或常规分割照射;
3)对于最大直径≥5 cm的肺转移病灶,慎重考虑使用SBRT;
4)肺部SBRT所涉及的危及器官包括正常肺组织、支气管树、食管、肋骨/胸壁、大血管、心脏、臂丛、脊髓等,需要精确勾画并加以限制剂量;
5)目前观察到的非常严重的SBRT治疗反应包括肺功能下降、细菌性肺炎、胸腔积液、大咯血等,虽然发生率极低,但需要谨慎对待;
6)推荐利用不同技术限制或追踪肺转移灶的动度,在每次SBRT前通过图像引导系统确认肺转移灶的准确位置,如有条件每次SBRT中监测肺转移灶的动度并调整;
7)对于潜在有发生严重不良反应可能的治疗计划,应与患者充分沟通,取得患者和/或家属的充分知情。
(2)消融治疗:在结直肠癌肺转移中主要有射频、微波、冷冻消融等治疗方法,激光消融与高强度聚焦超声消融很少用于肺部肿瘤[66]。
消融适应证:
根治性消融是指通过消融治疗,使局部肿瘤组织完全坏死,有可能达到治愈效果。对于结直肠癌肺转移灶,单侧肺病灶数目≤3个(双侧肺病灶≤5个),多发转移灶的最大直径≤3 cm,单侧单发转移灶的最大直径≤5 cm,且无其他部位的转移可考虑局部消融治疗。对于双侧肺转移灶,不建议双侧同时进行消融治疗。
消融治疗原则:
1)对于直径≤3 cm的肺转移病灶,三种主要消融方式(射频、微波和冷冻消融)治疗效果相似。射频消融电极的适形性好,可以通过调节消融电极来保护邻近脏器,但是受血流和气流的影响较大;
2)对于直径>3 cm的肺转移病灶,微波消融因其消融时间短、消融范围大,因此更加适合用于这类病例。且微波消融受到血流灌注的影响小,更加适合治疗邻近大血管的肿瘤。
3)冷冻消融形成的“冰球”边界清晰,可用于邻近重要脏器的肺转移。冷冻消融较少引起局部疼痛,对于肿瘤距离胸膜≤1 cm或有骨转移引起骨质破坏的病灶,冷冻消融明显优于微波消融和射频消融。但冷冻消融在治疗过程中消耗患者血小板,对于凝血功能差的患者,应避免使用。
消融禁忌证:
1)病灶周围感染性及放射性炎症控制不佳者,穿刺部位皮肤感染、破溃;
2)严重的肺纤维化,尤其是药物性肺纤维化;
3)有严重出血倾向、血小板小于50×109/L和凝血功能严重紊乱者。抗凝治疗和/或抗血小板药物应在经皮消融前至少停用5~7天;
4)消融病灶同侧恶性胸腔积液;
5)肝、肾、心、肺、脑功能严重不全者,严重贫血、脱水及营养代谢严重紊乱且无法在短期内纠正或改善者,严重全身感染、体温>38.5℃者;
6)ECOG评分>3分;
7)置入心脏起搏器的患者不建议使用射频消融。
(二)单纯性潜在可切除性肺转移
目前对于“潜在可切除的肺转移”无明确定义。对于大多数初始不可切除的肺转移患者而言,不可切除因素为肺转移灶分布广泛且数目较多;但是,有一小部分患者肺转移灶数目较少,但其因转移灶与重要结构关系紧密而不可切除,这部分患者有可能通过强烈的转化治疗而获得R0手术机会。小样本研究显示,肺转移灶的转化率为5.7%~7.1%[94-95]。目前缺乏肺转移转化治疗方案的有效率数据,推荐参考肝转移的治疗方案:选用FOLFOX/CapeOX或FOLFIRI/CapeIRI联合靶向治疗或FOLFOXIRI方案。靶向药物应该根据RAS/BRAF基因及原发灶部位选择。每6~8周由MDT团队评估疗效和可切除性,第一次评估的效果可作为转化能否成功的独立预测因子;转化成功的患者应尽早行根治性手术治疗。

表3 潜在可切除肺转移的临床策略
(三)单纯性不可切除性肺转移
不可切除肺转移患者应行姑息治疗,包括全身系统治疗和姑息性局部治疗。全身系统治疗原则应充分考虑治疗目的、药物毒性[4],可考虑联合化疗或单药化疗±靶向治疗;对于无症状的单纯性肺转移,尤其是转移瘤较小(例如:病灶直径<1 cm)、预后良好的患者,也可考虑定期观察。在一线、二线治疗失败后,瑞戈非尼是一种选择[96]。具体药物选择参见2017版卫计委《中国结直肠癌诊疗规范》。需要特殊说明的是,在使用抗血管类药物如瑞戈非尼[97]或呋喹替尼时,疗效的评价标准除肺转移病灶的大小外,还应该参考肿瘤密度的变化。此外,由于部分肺转移患者可能长期生存,在经过多线或较长时间治疗后,应注意转移灶基因状态是否会改变、进而影响系统治疗效果。对于有条件的患者,可考虑在疾病进展时对肺内病灶再次活检或使用液体活检技术充分了解肿瘤的基因改变情况[36]。
姑息性局部治疗:原发灶和肺内肺外转移灶无法全部根治性切除时,针对肺转移灶(全部或部分)的局部治疗手段。姑息性局部治疗所带来的生存获益尚不明确,目前其主要用于改善肺转移灶导致的相关症状,或由于肿瘤异质性导致部分肺转移病灶增大时尝试(其他肺内病灶稳定、甚至缩小)。北京大学肿瘤医院的回顾性分析发现,在治疗初始阶段采取积极的姑息性局部治疗是生存期延长的独立预后因素[4]。目前非手术的局部治疗手段多种且并发症大大减少,因此,专家组建议在多学科的指导下在系统治疗后,根据具体病情可谨慎考虑尝试行姑息性肺转移灶局部治疗。
(四)肺转移合并任意一处肺外转移
肺转移是常见转移类型中预后最好的亚型[10],因而当肺转移合并任意一处其他部位的远处转移时,除非肺转移负荷量较大而且有症状,通常将其他远处转移病灶作为治疗时的主要考量因素。故本共识以肝转移为例进行相应建议的推荐(表4);其他部位的转移参考肝转移。对于潜在可切除或不可切除的转移灶,若通过治疗转化为可切除,则纳入相应路径进行管理。
(五)肺转移合并≥2处肺外转移
若除肺转移外,还存在≥2处其他转移时,此时已不属于寡转移的范畴,本共识推荐以全身姑息性药物治疗为主,治疗过程中根据药物疗效及肿瘤生物学行为,在MDT讨论下决定是否加用局部治疗(表5)。
(六)多器官转移灶可切除性评估及手术时机选择及综合治疗原则
多器官(包括肺转移)转移结肠癌的多器官转移灶可切除性评估及手术时机选择及综合治疗需要经MDT讨论后决定治疗策略。
针对结直肠原发病灶和多器官转移病灶,评估方式见表6。
目前,通常推荐初治时即对可根治的肺转移灶和肺外转移灶进行手术切除,也可在术前新辅助化疗后进行手术切除。同时,可根治的肺转移灶和肺外转移灶,无论针对原发灶为同时性或异时性,根治性手术均可同时或者异时进行,通常推荐先进行所有病灶中手术难度较大的病灶,并且需要考虑患者的肺功能储备,以降低患者因肺转移灶切除后肺功能下降导致非技术性不可手术切除原发灶或肺外转移灶的风险。目前,针对初始不可切除的多器官(包括肺转移)转移,目前认为并不能通过化疗联合靶向治疗转化成可切除的多器官转移。但是,在少数对化疗或化疗联合靶向治疗特别敏感的患者中,也可能出现转化成功的病例。
(七)同时性肺转移直肠癌特殊情况处理
在局部进展期(T3-4或N+)的中下段(距肛缘≤10 cm)直肠癌接受术前的新辅助放化疗,尤其是全程新辅助治疗(total neoadjuvant therapy,TNT)的模式后,原发灶可以达到很好的长期控制,完全病理缓解率(pathological complete remission,pCR)在25%~30%。尽管对于转移性中低位直肠癌新辅助放化疗地位和全程管理策略尚缺乏大样本临床研究数据指引,但由于中下段直肠癌手术可能会明显地影响生活质量(术后并发症、造口护理等)。因此,针对局部可切除的中下段直肠癌伴同时性肺转移,本共识就原发灶的处理做如下推荐:当治疗目标为NED状态时,推荐行术前系统药物治疗和原发灶新辅助放疗,后行原发灶和转移灶的根治性切除,转移灶和原发灶的处理顺序需MDT讨论决定;若患者保肛意愿强烈、拒绝手术,可选择在TNT模式治疗后,行转移灶根治性治疗,密切随访观察原发灶情况。对于无法达到NED的患者,在全身药物系统治疗后疾病稳定阶段,多学科讨论及征求患者意愿后可考虑行原发灶放疗/切除[108-109]。

表4 肺转移合并肝转移的治疗策略

表5 肺转移合并两处及以上肺外转移的治疗策略

表6 结直肠原发灶及多器官转移灶评估方法
五、初发异时性肺转移
初发异时性肺转移主要包括在新辅助治疗期间出现的或原发灶切除术后出现的肺转移。对于前者,参考“同时性肺转移”的相应部分;对于后者,若同时伴有局部复发,当局部复发病灶可根治时,则将局部复发等同于“原发灶”、参考“同时性肺转移”进行处理,若局部复发病灶无法根治,则将其视为一处不可切除的转移病灶后,参考图2的路径进行处理。总体治疗原则与同时性肺转移相近,此处不做赘述,仅就单纯性可切除肺转移的围手术期治疗进行讨论。
由于无局部复发患者的围手术期治疗仅仅由肺转移灶决定,且可切除的异时性肺转移的预后优于同时性肺转移[13-15],因此理论上,应与同时性单纯性肺转移有所不同。但遗憾的是,目前有关围手术期治疗的研究并未将可切除性单纯同时性肺转移和单纯异时性肺转移区分开来。目前仅有一项小样本的研究单纯纳入了异时性肺转移的患者(中位Dfi29.1个月,范围5~132个月),发现辅助化疗组(N=44)和未辅助化疗组(N=17)的5年生存率分别为70%和29%(P=0.017),但多因素分析却未发现两组间存在统计学差异[110]。鉴于其他研究纳入的人群以异时性肺转移为主,因此可将这些研究作为异时性肺转移人群围手术期治疗的决策参考:辅助治疗的研究较多[38,41,47,51,111-112],但是其对于预后的改善仍没有得到完全的认同[14];新辅助治疗/围手术期治疗对于预后的影响也存在矛盾[54,58,113]。根据预后因素建立预后评分系统[13,110],筛选预后较差者进行围手术期化疗似乎是一种合理的选择,但是回顾性研究显示,能够从辅助治疗中获益的是肺转移术后复发风险低的患者而非风险高的患者[111],甚至无论何种复发风险的人群均无法获益于辅助治疗[112]。
鉴于以上研究,本共识推荐符合可切除标准的患者,在初治时即行手术治疗[3,58,113];因为围手术期药物治疗有可能优于单纯手术,所以术后可参照局部进展期结肠癌进行化疗方案的选择,推荐以奥沙利铂为基础的化疗。如术前新辅助行伊立替康为基础方案化疗,治疗有效患者术后可继续原方案辅助治疗。围手术期化疗总共不超过 6 月[24,43,58,110,114-115]
六、随访
结直肠癌肺转移所有病灶在根治性切除或局部毁损性治疗后达到无疾病状态时,一律推荐定期随访。
(一)病史和体检及CEA、CA199监测,每3个月1次,共3年,然后每6个月1次,总共5年,5年后每年1次。
(二)胸部平扫或增强CT,腹/盆增强CT或MRI每半年1次,共3年,然后每年一次共5年。
(三)原发灶切除术后1年内行肠镜检查;推荐术后3年后复查肠镜,之后每5年1次。如术前肠镜未完成全结肠检查,建议术后3~6个月行肠镜检查。随访过程中,一旦肠镜发现晚期腺瘤(绒毛状息肉,息肉>1 cm或高级别上皮内瘤变),则应1年内重复肠镜检查。如果患者发病年龄小于50岁则应该行更频繁的肠镜检查。
(四)PET-CT不是常规推荐的检查项目,对怀疑复发或远处转移的患者,可考虑行PET-CT检查以帮助判断。
七、附录1 结直肠癌肺转移分类
按照肺转移和原发灶的出现时间:
同时性肺转移:在初始结直肠癌分期检查时发现的肺转移;
异时性肺转移:基线检查后发现的肺转移。
按照肺转移和其他远处转移的出现顺序:
初发肺转移:肺脏作为首个远处转移脏器的情况,无论是否伴有其他远处转移,包括所有的同时性肺转移和初发异时性肺转移(原发灶切除术后出现的转移和术前新辅助治疗期间出现的肺转移);
非初发肺转移:在其他转移性疾病治疗过程中出现了肺转移。
按照是否伴随肺外转移:
单纯性肺转移:不伴肺外转移(无论是否存在原发灶/局部复发);
非单纯性肺转移:伴有肺外转移(无论是否存在原发灶/局部复发)。

附表 结直肠癌肺转移的分类
《结直肠癌肺转移多学科综合治疗专家共识(2018版)》
专家名单(排名不分先后,以姓氏拼音排序)
顾问:郑树 万德森 赫捷 汪建平
专家编委:巴 一 白春梅 白莉 白 威
毕 峰 蔡开灿 蔡木炎 蔡三军
陈 功 陈克能 陈 凛 池 畔
戴广海 邓艳红 丁克峰 樊青霞
方维佳 房学东 冯凤仪 傅琦涵
傅传刚 顾 晋 顾艳宏 何裕隆
贾宝庆 姜可伟 金 晶 来茂德
兰 平 李德川 李恩孝 李 健
李 进 李 明 李晔雄 李乐平
李永恒 李忠武 梁小波 梁智勇
林国乐 林 锋 刘洪俊 刘天舒
刘云鹏 柳建忠 潘宏铭 潘志忠
曲秀娟 裴海平 邱 萌 任 黎
沈 琳 申占龙 盛伟琪 孙建国
孙凌宇 宋 纯 宋丽杰 孙应实
陶 敏 王 畅 王海江 王 俊
王树滨 王晰程 王锡山 王 屹
王自强 汪建平 武爱文 吴 楠
夏立建 肖 毅 邢宝才 熊 斌
徐建明 徐 农 徐瑞华 徐忠法
许剑民 姚宏伟 杨 帆 杨 跃
叶颖江 于甬华 于跃明 袁 瑛
岳金波 张敬东 张 俊 张苏展
张 卫 张艳桥 张忠涛 章 真
赵 林 赵 任 周福祥 周 俭
朱 旭
秘书组:陈鹏举 李少雷 唐源 王正航参考文献(略),见我刊本期DVD-ROM光盘

