细胞传代对SD大鼠骨髓间充质干细胞衰老的影响
黄玉圣 吕辰菲 庄景燊 徐平 涂晨 吴迪峥 钟招明
(南方医科大学南方医院 1脊柱骨科,广东 广州 510515;2神经内科)
间充质干细胞(MSCs)是一类多能干细胞,主要存在于结缔组织和组织器官中,如骨、软骨、脂肪、内皮、肌肉和神经组织等,以骨髓组织中含量最为丰富,占骨髓细胞总数的0.001%~0.100%〔1〕。骨髓MSCs(BMSCs)具有自我复制能力和向成骨、成脂、成软骨等多向分化能力,可参与骨形成与骨吸收的动态平衡过程,维持组织和器官的内环境稳态及修复组织损伤等方面。衰老是生物界的普遍现象,BMSCs也可发生衰老变化。衰老的BMSCs不但形态上会发生变化,其增殖和多向分化能力也会发生不同程度的改变〔2〕。BMSCs的体外培养是其功能研究的重要途径。有研究表明体外培养的细胞会随着传代次数的增加而衰老,甚至丧失其特有的功能〔3,4〕。本实验拟通过体外分离培养大鼠BMSCs,探讨传代次数对BMSCs衰老的影响。
1 材料与方法
1.1实验动物 3~4周龄的SD雄性大鼠,由南方医科大学动物实验中心提供。动物许可证号:SCXK(粤)2016-0041,实验过程中对动物的处置符合中华人民共和国科学技术部2006年颁布的《关于善待实验动物的指导性意见》标准。
1.2主要试剂与器械 胎牛血清(FBS,Sigma),CO2培养箱(Thermo Fisher 公司),青-链霉素(PanEra Life Science),0.25%胰蛋白酶-乙二胺四乙酸(EDTA,PanEra LifeScience),MEM/F12(Hyclone公司),磷酸盐缓冲液(PBS),水平离心机(上海德洋意邦仪器有限公司),超净工作台(广州瑞智科学仪器有限公司),SpectraMax M5多功能酶标仪(MDS公司),倒置显微镜(德国Leica仪器股份有限公司,DM IL LED),电泳槽、转膜仪(Bio-RAD),化学发光仪(Tanon),细胞衰老β-半乳糖苷酶染色试剂盒(Beyotime),CCK-8试剂盒(Beyotime),兔抗大鼠单克隆抗体P53、P21(Abcam),大鼠Ig G二抗(Proteintech)。
1.3实验方法
1.3.1SD大鼠BMSCs的原代分离与培养 3~4周龄SD雄性大鼠脱颈处死,体积分数为75%酒精浸泡 5 min,无菌条件下取出大鼠双侧股骨和胫骨,浸泡于装有75%酒精的10 ml离心管中,带入超净台中,用高温消毒后的器械剔除肌肉和贴附骨面的纤维结缔组织,剪开股骨和胫骨的骨骺端,暴露出骨髓腔,用5 ml无菌注射器抽取PBS(含青-链霉素100 U/ml),反复柔冲骨髓腔 3~5次,直至骨髓腔呈白色。70 mm筛网过滤后,收集过滤液以800 r/min离心3 min,弃上清,加入红细胞裂解液,吹打混匀,冰上裂解3 min后,800 r/min 离心3 min,弃上清,按1×109/ml密度接种至100 mm的培养皿,置于37℃、体积分数为5%CO2饱和湿度培养箱中培养。
1.3.2BMSCs 的纯化与扩增 原代培养48 h半量换液,72 h后全量换液,全量更换培养基(不冲洗),可将其中未贴壁细胞去除,以后每3 d全量更换新鲜培养基,PBS冲洗两遍。待细胞铺满培养皿底,密度达80%融合时,用0.02%EDTA+ 0.25%胰酶消化,消化时间约2 min,加入全培终止消化,800 r/min 离心3 min,弃上清,用含10%胎牛血清的 MEM/F12培养基重悬细胞后,1∶2的比例进行传代培养。重复上述步骤进行 P2~9代的传代培养。
1.3.3BMSCs 的形态学观察 取各代细胞,每日用倒置相差显微镜观察其生长形态及特征并拍照记录。
1.3.4BMSCs表面标志物的鉴定 取第3代骨髓间充质干细胞,胰酶消化,收集细胞于5 ml离心管中,800 r/min离心3 min,除上清,PBS重悬,调整细胞密度为1×106个/L,取流式细胞仪专用试管4个,每管加入300 μl细胞悬液,加入荧光抗体CD29 FITC、CD45 PE-Cy5.5、CD90 PE及同型对照抗体各5 μl,孵育15 min,采用BDFACSEALIBUR流式细胞仪进行测定。
1.3.5BMSCs 细胞周期检测 取生长良好的P3 BMSCs,先收集培养液备用,用4℃预冷的PBS洗涤细胞2次,洗下的细胞也需收集,胰酶消化,加入收集的细胞培养液终止消化,以800 r/min离心 3 min富集细胞,弃上清,PBS洗涤细胞一次(2 000 r/min,5 min),收集并调整细胞浓度为1.0×106/ml,取1 ml细胞悬液,以800 r/min离心3 min富集细胞,弃上清,在细胞中加入体积分数为70%冷乙醇500 μl重悬,吹匀细胞,4℃过夜。次日离心收集细胞,再以1 ml PBS洗涤1次,除去固定液,1 000 r/min离心3 min,加入100 μl RNase A,37℃水浴30 min,再加入400 μl碘化丙啶(PI),4℃避光孵育30 min,离心弃上清,200 μl PBS 重悬后,流式细胞仪上机检测。
1.3.6BMSCs生长曲线的绘制 取P1、P3、P5、P7和P9代细胞,胰酶消化重悬后计数,以1×104个/孔接种于96孔板,分为8组,每组6个复孔,于第1~7天同一时间作相同检测,每孔加入10 μl CCK-8溶液,37℃,饱和湿度,5%CO2培养箱孵育2 h后,用酶联免疫检测仪于450 nm波长下检测吸光度值。以时间为横轴,吸光度值为纵轴绘制细胞生长曲线。
1.3.7细胞衰老β-半乳糖苷酶染色 细胞传代,分别取P1、P3、P5、P7和P9代细胞,PBS洗3次,加入β-半乳糖苷酶染色固定液,室温固定15 min,PBS洗3次,加上新配制的SA-β-gal 染色工作液,保鲜膜封口,37℃(无CO2)孵育过夜,PBS液清洗3次后,倒置显微镜下观察并拍照。
1.3.8免疫印迹检测 加入RIPA 细胞裂解液静置5 min,超声破碎仪裂解1 min,4℃ 12 000 r/min离心15 min,取上清,BCA法测定蛋白浓度,行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),转移至聚偏氟乙烯(PVDF)膜电转,5%脱脂奶粉室温封闭1 h,条带加入兔抗大鼠P53和P21单克隆抗体(1∶1 000),选取37 kD GAPDH作为内参,4℃ 20 r/min孵育过夜,TBST洗膜10 min x 3次,加入 HRP 标记的大鼠IgG二抗(1∶5 000),室温孵育1 h,TBST洗膜10 min×3次,化学发光,采用Image J计算目标各带灰度值。
1.4统计学分析 采用SPSS21.0软件进行t及χ2检验。
2 结 果
2.1SD大鼠BMSCs鉴定 流式细胞仪检测结果示,培养的P3 BMSCs均一表达CD29及CD90,阳性率分别为97.72%,98.23%;而CD45,呈阴性,阳性率为1.52%。
2.2BMSCs 细胞周期 流式细胞仪检测P3 BMSCs细胞周期,细胞100%为二倍体,其中G0/G1期87.37%,G2/M期4.06%,S期8.57%,提示绝大部分细胞处于静止休眠期,符合干细胞周期特征。
2.3不同代数细胞生长情况 分别对P1、P3、P5、P7和P9代细胞进行1~7 d连续培养测定发现,传代后1~2 d处于潜伏期,细胞增长不明显,3~5 d进入指数増长期,6 d后细胞增殖速度便有所减缓,进入平台期,增殖基本停滞,生长曲线见图1。从结果可发现P3~P5代的细胞增殖状况更良好。
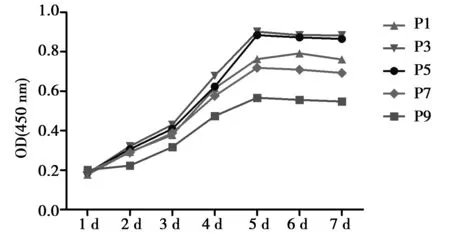
图1 CCK-8检测不同代数BMSCs 1~7 d的增殖能力
2.4不同代数细胞β-半乳糖苷酶染色阳性率 对不同代数的细胞行β-半乳糖苷酶染色,红色箭头标注的着深蓝色的细胞即为衰老细胞(图2)。随之进行β-半乳糖苷酶染色阳性细胞计数,其中P7(52.67%±7.93%)和P9(83.67%±3.27%)相较于P1(3.67%±1.25%)、P3(8.33%±3.11%)和P5(20.00%±5.35%),SA-β-gal阳性细胞比例明显增高(图2)。
2.5不同代数细胞P53和P21表达变化 随着传代次数的增加,衰老相关蛋白P53和P21的蛋白水平表达量也逐渐增高,Western印迹结果示:P53和P21在P9代的蛋白相对表达量分别为3.43±0.66和3.31±0.28,明显高于P1代,见图3,表1。

图2 倒置相差显微镜下观察β-半乳糖苷酶染色阳性细胞(×100)
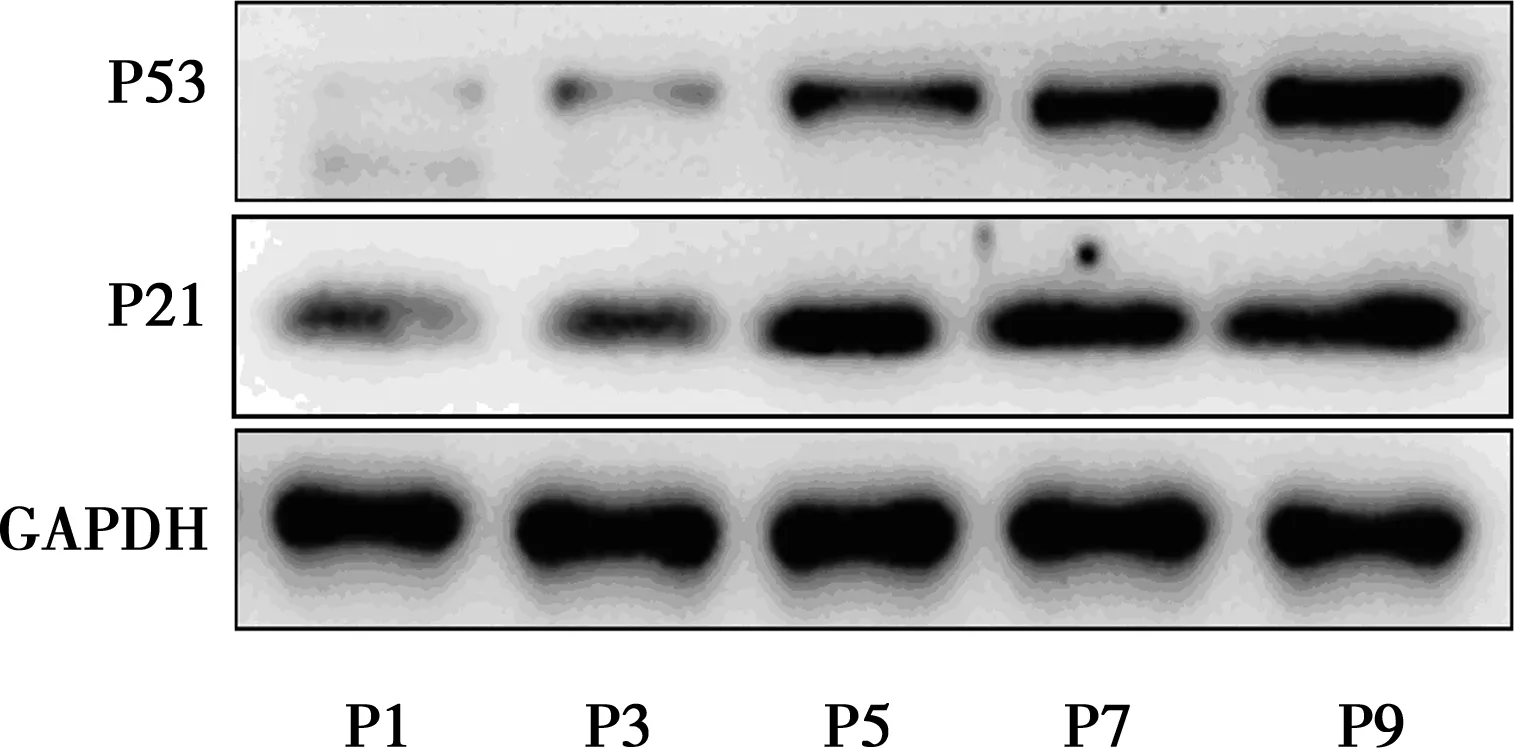
图3 细胞传代对衰老相关蛋白P53和P21表达的影响
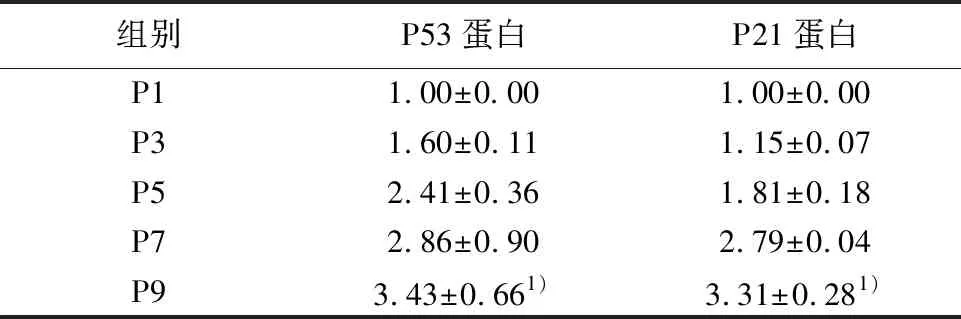
组别P53蛋白P21蛋白P11.00±0.001.00±0.00P31.60±0.111.15±0.07P52.41±0.361.81±0.18P72.86±0.902.79±0.04P93.43±0.661)3.31±0.281)
与P1代比较:1)P<0.05
3 讨 论
BMSCs是骨髓基质中的非造血系成体干细胞,具有多向分化潜能,现已成为医学研究的热点。虽然BMSCs 没有公认的独特的抗原表型,但其培养过程可表达细胞CD表型〔5,6〕。本实验培养的BMSCs 均一表达CD29,CD90,阳性率分别为97.72%,98.23%,均大于95.00%;而CD45,呈阴性,阳性率为1.52%,小于5.00%,符合文献报道MSCs表面抗原的表达〔7〕。前期研究表明干细胞大部分细胞处于静止休眠期,此实验的细胞周期检测结果发现G0/G1期占88.37%,符合干细胞周期特征。
骨髓细胞成分复杂,造血干细胞是骨髓中含量最丰富的细胞,而MSCs 仅占骨髓细胞的 0.001%~0.01%〔8〕。由于BMSCs在骨髓中丰度低、分选难、分离细胞活性弱、纯度低、生物学活性易改变等缺点,严重限制了BMSCs的应用。本实验采用全骨髓贴壁法体外培养BMSCs,具有操作简便、效果可靠、对细胞活性影响较小等优点〔9,10〕。
细胞增殖能力下降是机体衰老的重要影响因素。既往研究发现,年轻小鼠中获取的MSCs的数量、细胞增殖能力明显优于老龄小鼠MSCs〔11,12〕。MSCs发生衰老时,影响其分化潜能,成脂能力增加而成骨分化能力下降〔13~15〕。本研究证实随着体外细胞传代次数增加,可导致MSCs增殖能力的改变,从而发生复制性衰老。
体外培养细胞在pH为6时,其β-半乳糖苷酶染色的阳性率随代龄增加而增加,这种中性β-半乳糖苷酶被定义为衰老相关的β-半乳糖苷酶。衰老细胞产生的β-半乳糖苷酶可以催化底物X-Gal,生成深蓝色产物,被作为衰老细胞的生物标记〔16,17〕。研究表明衰老BMSCs细胞核膜内折,核染色质浓缩,线粒体数量减少,内质网扩张,体积增大或肿胀,并且高度表达β-半乳糖苷酶〔18〕。本研究证实随着体外细胞传代次数增加,β-半乳糖苷酶染色阳性率细胞增加。
细胞衰老与基因调控密切相关。研究发现具有细胞增殖调控功能的衰老相关基因包括抑癌基因P53、P21和P16、细胞周期素D1、周期素依赖性激酶(CDK)2、增殖细胞核抗原(PCNA)、转录因子(E2F)等,这些基因在调控细胞衰老的过程中发挥着重要作用〔19〕。本实验结果示,随着传代次数的增加,BMSCs表达衰老相关蛋白P53和P21增加,蛋白表达量明显高于低传代次数BMSCs。综上所述,体外培养传代次数的增加,BMSCs增殖能力明显下降,衰老细胞数量增加。为了避免复制性衰老对BMSCs功能研究的影响,建议使用P1-5代细胞。此外,深入研究BMSCs衰老的调控机制和作用靶点,可为延缓干细胞衰老及防治各种老龄化疾病提供重要的理论基础。

