白及提取物对流感病毒感染MDCK细胞基因表达的干预研究
陈江张兵冯燕徐昌平卢亦愚程东庆
1.浙江中医药大学 杭州 310053 2.浙江省疾病预防控制中心
甲型流感病毒是单股负链RNA病毒,常常引起全球范围内的流感爆发流行[1]。目前临床用于抗流感病毒的药物均以流感病毒为靶点,如奥司他韦与金刚烷胺类药物分别通过抑制流感病毒神经氨酸酶与病毒基质蛋白M2的离子通道来抑制流感病毒复制[2-3]。由于流感病毒极易产生抗原漂移和抗原转换,而且针对单一靶点的药物长期使用容易诱导相应耐药毒株产生[4-5],因此寻求新的多靶点包括以宿主细胞为靶点的抗流感药物,是一个新的研究方向[6],可有效避免流感病毒产生耐药性。
中药含有多种活性成分,具有多组分、多靶点作用的特点,在抗流感病毒的新药研究方面具有一定的优势。兰科植物白及(Bletilla striata)是我国的传统中药,具有消炎、止血、抗菌等药理作用[7]。已有研究证实,白及中联苄类化合物具有抑制流感病毒神经氨酸酶以及RNA聚合酶中内切酶的活性[8-9],而是否具有以宿主细胞为靶点的抗病毒活性尚不清楚。因此,本研究以流感病毒A/Sydney/5/97(influenza virus A/Sydney/5/97,H3N2)感染的考克斯班尼犬肾脏(Madin-Darby canine kidney,MDCK)细胞为模型,探讨白及水提物对流感病毒感染的宿主细胞基因表达的影响,进一步阐明其抗病毒作用机制。
1 材料和方法
1.1 实验材料
1.1.1 主要试剂与仪器 MEM培养基、胎牛血清、L-谷氨酰胺、青-链霉素双抗、0.25%的胰酶溶液、PBS缓冲液均购于美国 Gibco公司(批号:1917763、1872300、1967368、1728804、1737903、1864553);Trizol Reagent购于美国Invitrogen公司(批号:152104);PrimeScriptTMOne Step反转录试剂盒购于TaKaRa公司(批号:AK4801)。QuanStudio 12K Flex型荧光定量PCR仪购于美国Applied Biosystems公司。
1.1.2 流感病毒株与MDCK细胞 流感病毒株H3N2及MDCK细胞由浙江省疾病预防控制中心提供。MDCK细胞培养于含10%胎牛血清、1%双抗及1%L-谷氨酰胺的MEM培养基中;维持液为含1%双抗及1%L-谷氨酰胺的无血清MEM培养基。流感病毒接种于9日龄SPF鸡胚尿囊腔,连续传代3次后,血凝实验测得病毒原液血凝滴度为1:512,对MDCK细胞的半数组织培养感染量(50%tissue culture infective dose,TCID50)为 10-3.562·0.1mL-1。
1.1.3 白及提取物的制备 白及由浙江中医药大学丁志山教授提供并鉴定。白及块茎洗净后,35℃烘箱烘干,然后粉碎,过40目筛。准确称取200g白及粉末,以3 000mL蒸馏水回流提取2h,减压抽滤,再向滤渣中加入1 500mL蒸馏水回流提取并抽滤。将两次滤液合并,减压浓缩,干燥备用。白及提取物以PBS配制成生药质量浓度为0.8g·mL-1的储备液。测得其对MDCK细胞作用24h的最大无毒浓度(the maximum non-toxic concentration,TC0)为 40.0mg·mL-1。
1.2 实验方法
1.2.1 白及提取物对病毒感染细胞的影响 收集MDCK细胞,调整细胞密度为5×105个/mL,将细胞悬液按每孔1.0mL的体积接种于24孔板中,在37℃、5%CO2培养箱中培养。待24孔板中的MDCK细胞完全贴壁形成单层后,弃去培养基,以PBS洗涤3次后,在病毒对照组与药物处理组中分别接种1.0mL含100TCID50的病毒液,吸附1h后,弃去病毒液,再以PBS洗涤3次。分别向正常细胞组与病毒对照组加入1.0mL细胞维持液,药物处理组则加入1.0mL含有白及提取物的维持液,白及提取物终浓度为40.0mg·mL-1。各组细胞置于37℃、5%CO2的培养箱中继续培养。
1.2.2 细胞内总RNA的提取与完整性鉴定 培养24h后,吸去24孔板中的维持液,以PBS洗涤细胞2次,加入Trizol裂解液,以移液器反复吸打数次,待细胞层溶解完全后,-80℃保存备用。并采用Trizol法提取各组细胞内的总RNA[10],荧光定量PCR定量后并用琼脂糖甲醛变性凝胶电泳检测总RNA完整性。
1.2.3 基因表达谱分析以及最佳差异基因筛选 总RNA完整样品由北京博奥晶典生物技术公司进行表达谱分析。对表达谱散点图进行比对后,将发生差异变化的基因进行基因本体(gene ontology,GO)功能聚类分析,包括细胞组分(cellular component,CC)、分子功能(mlecular function,MF)、生物学过程(biological process,BP)3个方面,并采用京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)综合数据库分析甲型流感病毒通路、磷脂酰肌醇-3-激酶-蛋白激酶B(phosphoinositide-3-kinase-protein kinase B,PI3K-AKT)信号通路、视黄酸诱导基因-1样受体(retinoic acid inducible gene-1-like receptor,RIG-1-like)信号通路这3条细胞信号通路中的差异基因。差异基因筛选采用blindDe-scription 统计学模型,以变化倍数(fold change,FC)≥2或者≤0.5为筛选标准。FC≥2为上调基因,≤0.5为下调基因。
1.2.4 荧光定量PCR验证相关基因差异表达 对显著差异表达的基因设计引物,引物序列见表1。通过荧光定量PCR得到样品基因的CT值并计算ΔCT与ΔΔCT,ΔCT=目的基因的CT值-内参基因的CT值,ΔΔCT=药物处理组 ΔCT-病毒对照组 ΔCT。以 2∣ΔΔCT∣计算各组间基因差异表达倍数[11]。其中ΔΔCT<0表示基因上调;ΔΔCT>0表示基因下调。选取其中基因差异表达倍数>5倍的基因,比较白及提取物作用0、4、8、16、24h后其mRNA表达量。所有样品基因均经内参基因GAPDH的均一化处理。以2-ΔΔCT法计算目的基因的相对表达量[12]。

表1 引物序列Tab.1 Primer sequences
1.3 统计学分析 应用SPSS 18.0统计软件进行统计学分析,计量资料以±s表示,各组间差异采用单因素方差分析(one-way ANOVA),组间两两比较采用显著差异法(LSD-t)。以P<0.05为差异有统计学意义。
2 结果
2.1 白及提取物抑制流感病毒感染MDCK细胞的基因表达 利用基因表达谱芯片进行表达谱分析,以药物处理组荧光值与病毒对照组荧光值的比值表示差异表达。结果如图1所示。黑色散点表示没有发生显著变化的基因,红色散点表示表达上调2倍以上的基因,绿色散点表示下调0.5倍以上的基因。通过分析,获得856个上调基因,占总基因的2.62%;1 158个下调基因,占总基因的3.54%。
2.2 差异表达基因GO功能聚类分析 与病毒对照组比较,白及提取物处理后,与细胞的生理过程相关的基因出现显著上调或下调。其中涉及细胞组分的有:轴丝(axoneme)、睫状浆(ciliary plasm)、膜区(membrane region)、核亚端粒异染色质(nuclear subtelomeric heterochromatin)、轴膜(axolemma)等;涉及分子功能的有:鸟苷酸结合(guanyl nucleotide binding)、鸟嘌呤核苷酸结合(guanyl ribonucleotide binding)、细胞因子活性(cytokine activity)、白细胞介素-10受体活性(interleukin-10 receptor activity)和核心启动子近区DNA结合(core promoter proximal region DNA binding)等;涉及生物学过程的有:病毒基因组复制的负调控(negative regulation of viral genome replication)、对病毒的防御反应(defense response to virus)、病毒生命周期调控(regulation of viral life cycle)、蛋白质代谢过程的正调控(positive regulation of protein metabolic process)、细胞外调节蛋白激酶1(extracellular regulated protein kinase 1,ERK1)和ERK2的级联调控(regulation of ERK1 and ERK2 cascade)和细胞内信号转导的调控(regulation of intracellular signal transduction)。见图 2、3。
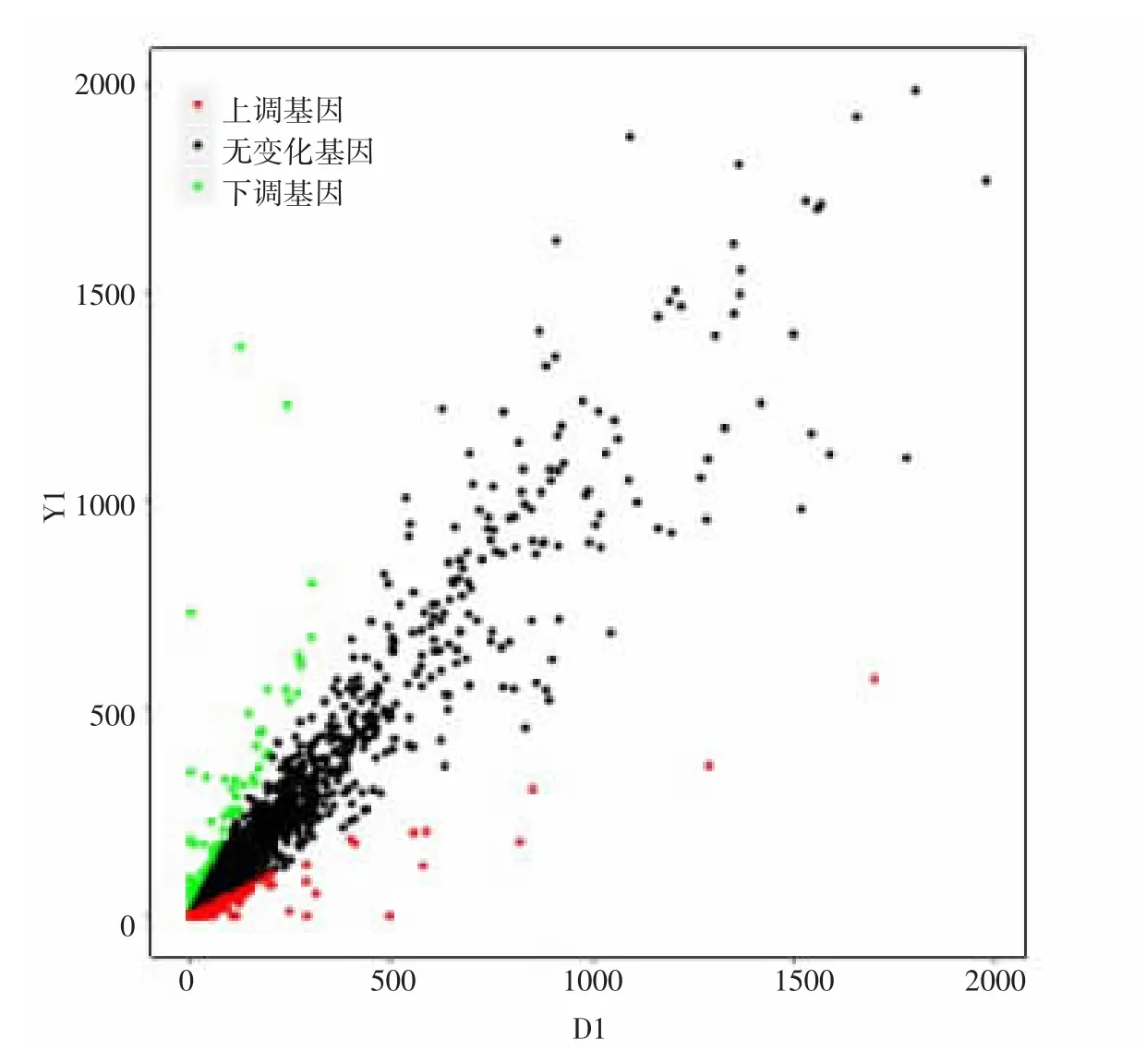
图1 白及提取物抑制流感病毒感染MDCK细胞的基因表达谱散点图Fig.1 Scatter diagram of gene expression profile of the extracts from the Bletilla Striata inhibit influenza virus infection of MDCK cells
2.3 差异基因的KEGG通路图结果 甲型流感病毒通路中有11个差异基因上调,分别是热休克蛋白70(heat-shock proteins 70,HSP70)、磷脂酰肌醇-3-激酶(phosphoinositide-3-kinase,PI3K)、核因子 κB 抑制因子(inhibitor of nuclear factor κB,IκB)、白细胞介素-1(interleukin-1,IL-1)等;15 个基因下调,分别是黑色素瘤分化相关抗原5(melanoma differentiationassociated antigen 5,MDA5)、双链 RNA 依赖的蛋白激酶(double-stranded RNA-dependent protein kinase,PKR)、Toll样受体 3(Toll-like receptor 3,TLR3)、干扰素调节因子 7(interferon regulatory factor 7,IRF7)、肿瘤坏死因子相关凋亡诱导配体(TNF-related apoptosis-inducing ligand,TRAIL)等。见图 4、5。PI3K-AKT信号通路中有15个基因上调,分别是受体酪氨酸激酶(receptor tyrosine kinase,RTK)、PI3K、P21、磷酸烯醇式丙酮酸羧激酶(phosphoenolpyruvate carboxykinase,PEPCK)、周期蛋白依赖性激酶(cyclindependent kinases,CDK)、细胞外基质(extracellular matrix,ECM)等;RIG-1-like信号通路中有9个基因下调,分别是MDA5、视黄酸诱导基因-1(retinoic acid inducible gene-1,RIG-1)、MEK 激酶 1(MEK kinase 1,MEKK1)、Fas相关死亡结构域(Fas-associated death domain,FADD)、干扰素 κ(interferon κ,IFN κ)、干扰素诱导蛋白-10(interferon-inducible protein-10,IP-10)等。见图 6、7。
2.4 荧光定量PCR的验证结果 荧光定量PCR检测证实,与病毒对照组比较,白及提取物作用24h后,MHCⅡ类转录激活因子(MHC classⅡ transactivator,CⅡTA)、HSP70、PI3K、IκB 等基因的表达上调,而IRF7、TLR3、RIG、MDA5、PKR 等基因下调。上调基因CⅡTA、HSP70、PI3K、IκB 表达分别上升 4.32 倍、12.13 倍、17.88倍、18.25 倍;下调基因 IRF7、TLR3、RIG、MDA5、PKR 表达分别下降 2.50 倍、1.83 倍、20.53倍、2.37倍、6.23倍。见表2。
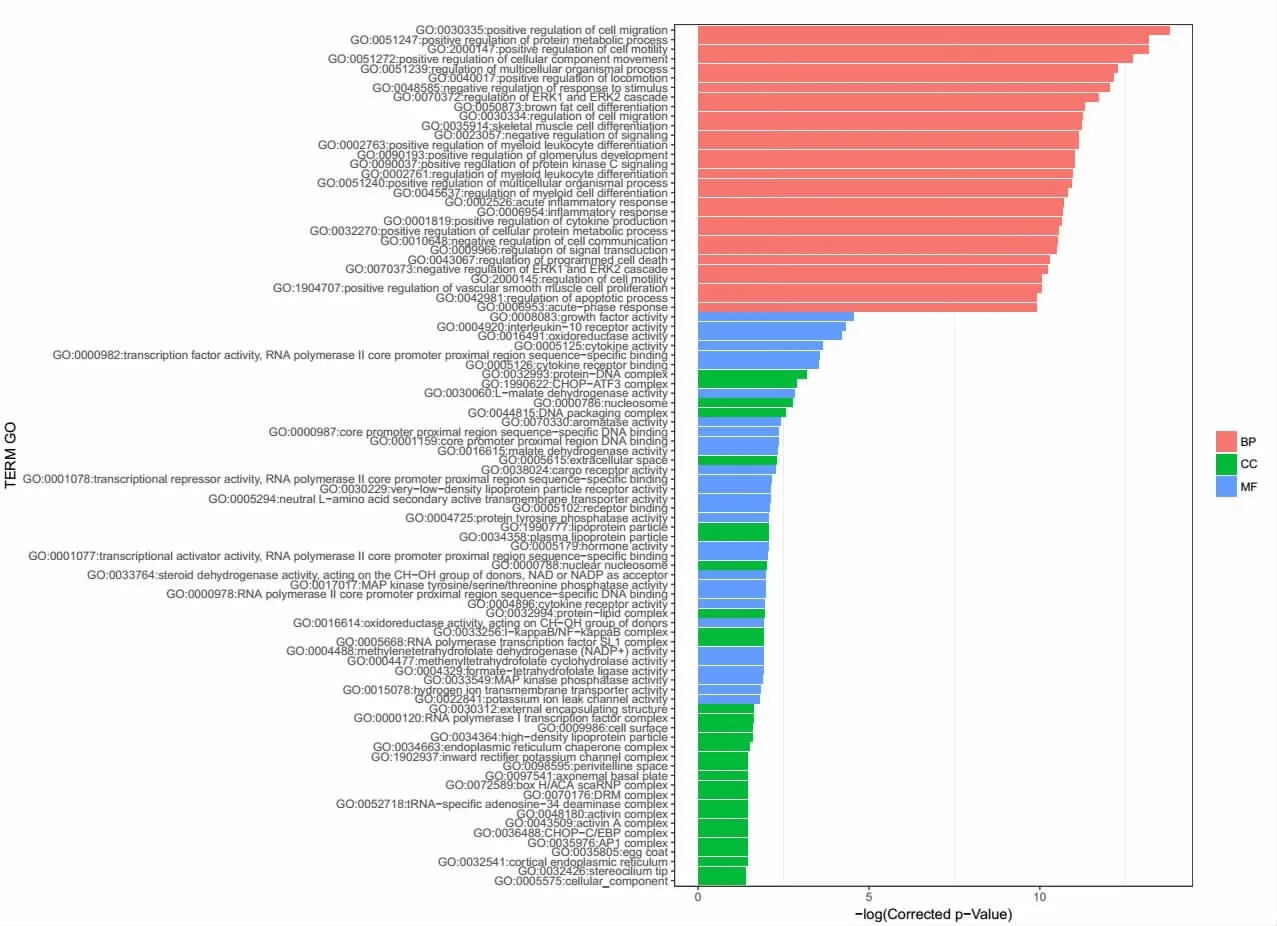
图2 GO功能聚类分析显示上调的基因条目Fig.2 Up-regulated genes on GO function luster analysis
依据差异表达倍数 2∣ΔΔCT∣≥5,来选择与抗流感病毒作用相关显著的基因。白及提取物作用后,基因HSP70、PI3K、IκB 表达上调,RIG、PKR4 表达下调,其差异表达倍数2∣ΔΔCT∣≥5,因此认为以上基因与以宿主细胞为靶点的抗病毒作用相关性显著;而基因CⅡTA上调以及基因IRF7、TLR3、MDA5下调,其差异表达倍数 2∣ΔΔCT∣<5,则认为与抗病毒作用相关性不显著。
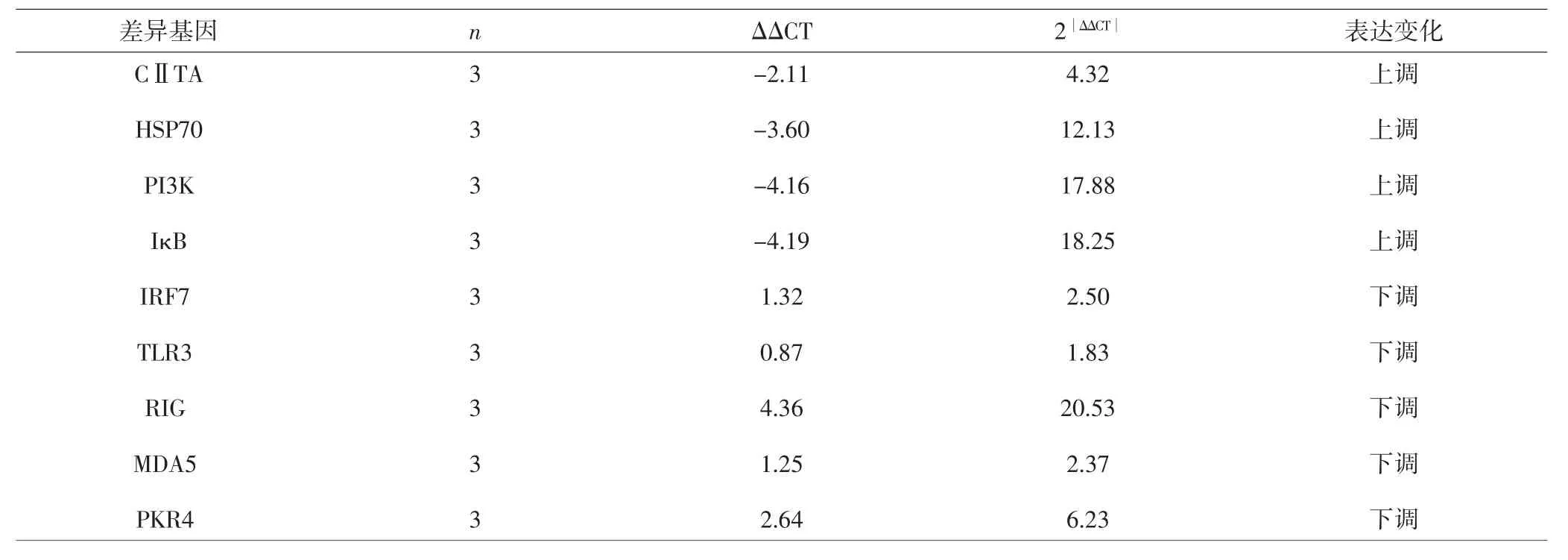
表2 不同差异基因ΔΔCT值以及表达倍数变化Tab.2 ΔΔCT values and expression fold changes of differential genes
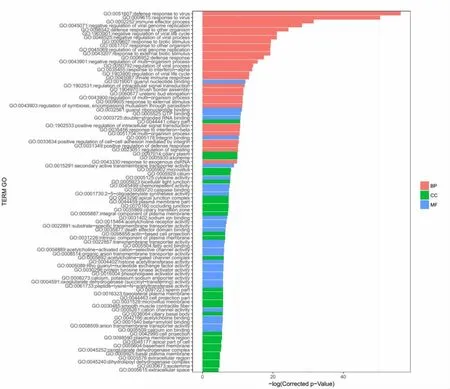
图3 GO功能聚类分析显示下调的基因条目Fig.3 Down-regulated genes on GO function luster analysis
进一步在不同时间点对相关性显著的基因进行的表达量分析。结果表明,与正常细胞组比较,病毒对照组基因HSP70、IκB和PI3K的相对表达量随着作用时间延长缓慢增高,差异无统计学意义(P>0.05);随着药物作用时间延长,药物处理组HSP70、IκB和PI3K基因的相对表达量明显增高,与同时点病毒对照组比较,差异有统计学意义(P<0.01)。与正常细胞组比较,病毒对照组基因RIG、PKR4的相对表达量随着作用时间延长逐渐增高,作用16、24h时,差异有统计学意义(P<0.01);随着药物作用时间延长,药物处理组RIG、PKR4的mRNA表达受到抑制,与同时点病毒对照组比较,差异有统计学意义(P<0.01)。表明荧光定量PCR的验证结果与基因表达谱相一致。见图8-12。
3 讨论
流感病毒复制过包括病毒的吸附、穿入、复制、颗粒的组装和释放等过程,流感病毒的复制增殖需要宿主蛋白、细胞因子和细胞信号通路的参与,根据流感病毒的这一复制特点,抗流感病毒的药物可从以下几个方面发挥作用:(1)阻断流感病毒血凝素(hemagglutinin,HA)吸附于宿主细胞膜上的糖蛋白唾液酸(sialic acid,SA)受体,禁止其通过SA受体介导的内吞作用进入细胞;(2)抑制流感病毒的转录和遗传物质复制;(3)抑制子代病毒从宿主细胞表面释放;(4)调节宿主细胞的信号通路。流感病毒感染后,可诱导宿主细胞内的信号通路发生一系列变化,而抗流感病毒药物,尤其是多组分多作用靶点的中药,可以通过调节宿主细胞的信号通路,从而干扰病毒与宿主间的相互作用来达到抗病毒的目的。
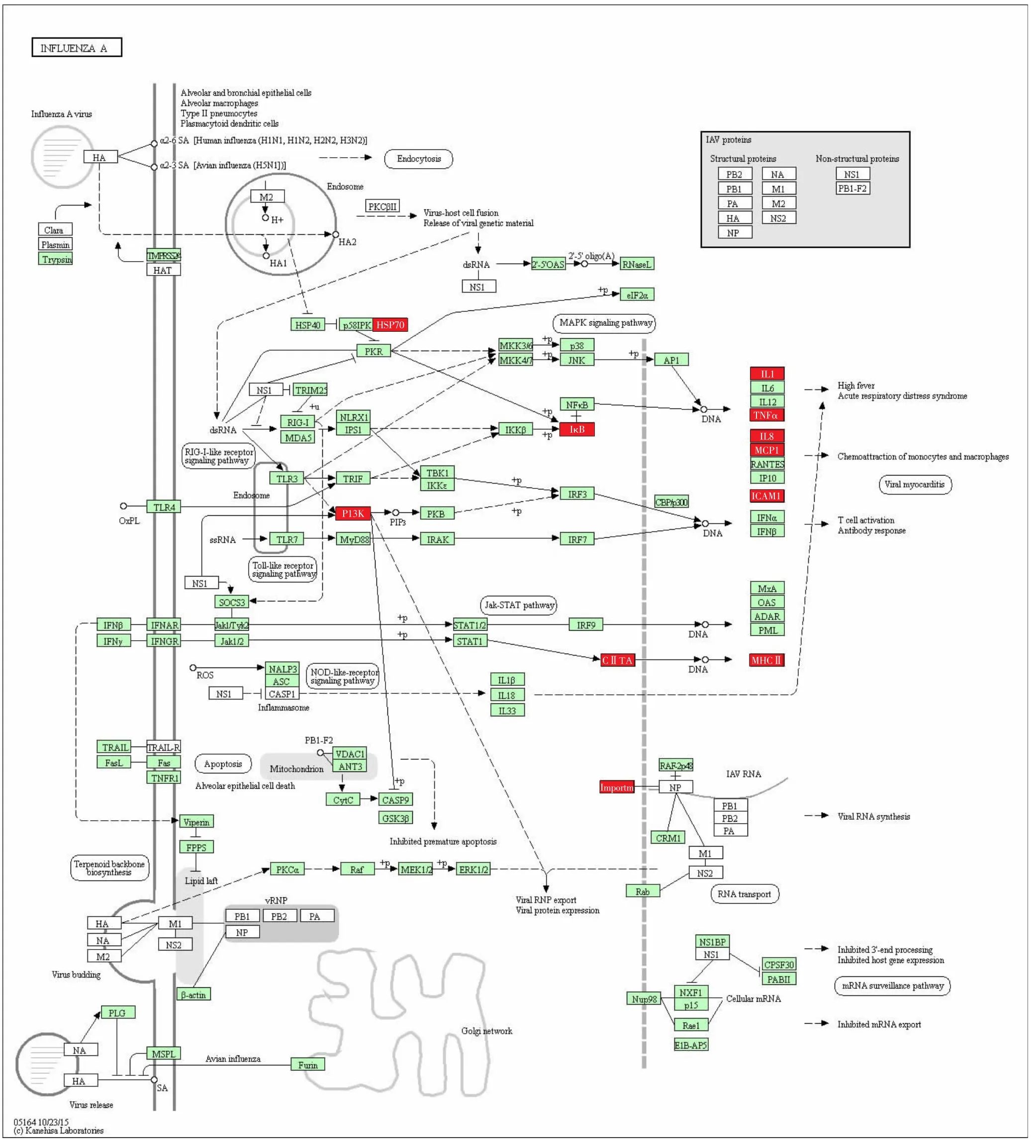
图4 甲型流感病毒通路中相关上调基因Fig.4 Up-regulated genes in influenza virus A pathway
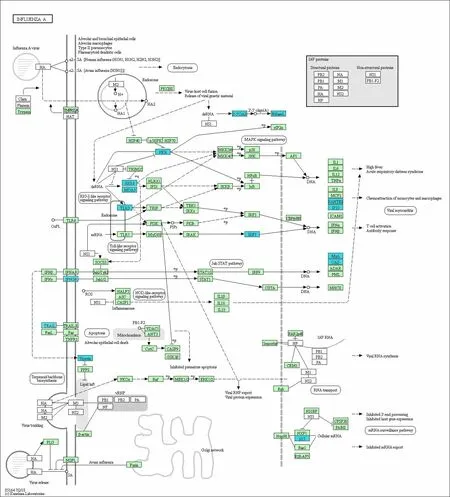
图5 甲型流感病毒通路中相关下调基因Fig.5 Down-regulated genes in influenza virus A pathway
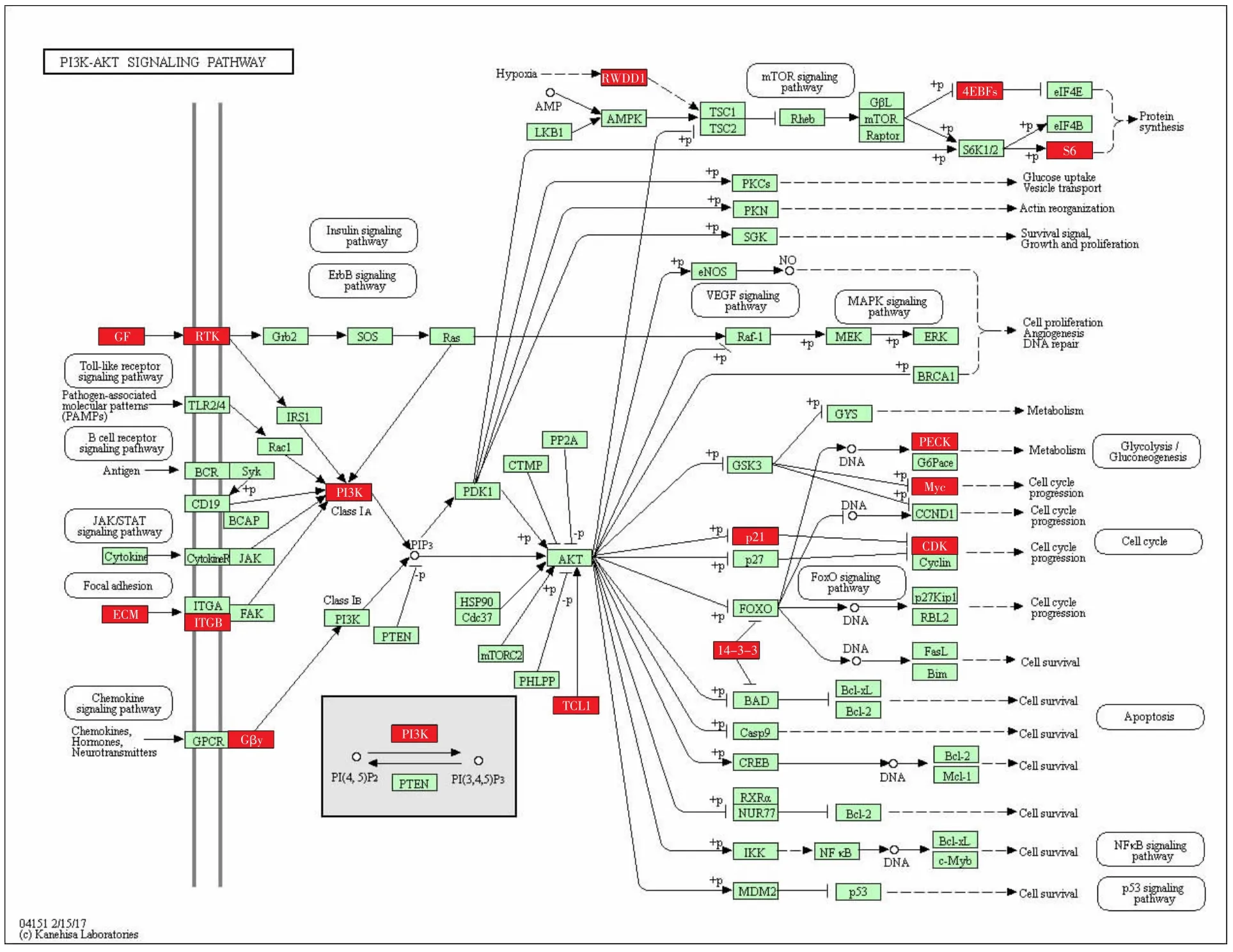
图6 PI3K-AKT信号通路中相关上调基因Fig.6 Up-regulated genes in PI3K-AKT signaling pathway

图7 RIG-1-like信号通路相关下调基因Fig.7 Down-regulated genes in RIG-1-like signaling pathway
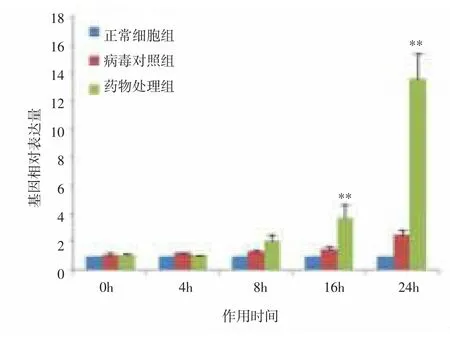
图8 PI3K基因mRNA表达水平变化Fig.8 Changes of mRNA expression level of PI3K gene
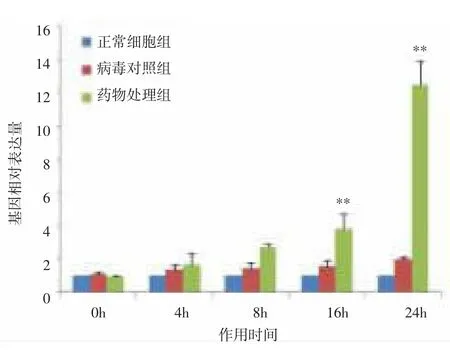
图9 IκB基因mRNA表达水平变化Fig.9 Changes of mRNA expression level of IκB gene
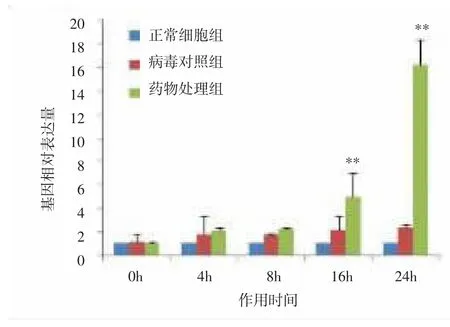
图10 HSP70基因mRNA表达水平变化Fig.10 Changes of mRNA expression level of HSP70 gene
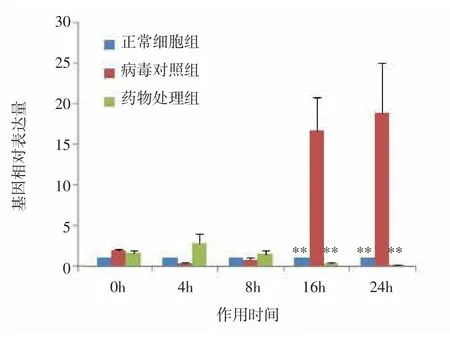
图11 RIG基因mRNA表达水平变化Fig.11 Changes of mRNA expression level of RIG gene
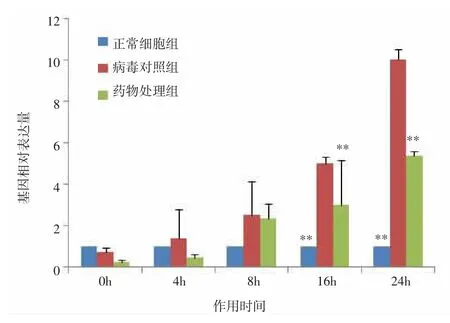
图12 PKR4基因mRNA表达水平变化Fig.12 Changes of mRNA expression level of PKR4 gene
相关研究表明,PI3K-AKT信号通路对流感病毒感染宿主细胞具有双向调控机制,激活PI3K可刺激干扰素产生,说明激活PI3K-AKT信号通路可以发挥抗病毒作用;而病毒感染晚期通过负向调节PI3K/AKT信号通路和c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)通路抑制感染细胞的凋亡,从而阻止病毒的扩散,同时还能够抑制流感病毒复制[13-14],因而通过调节PI3K/AKT信号通路中的相关基因表达可发挥抗流感病毒作用。另一重要信号通路为丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)信号通路,可分为Ras/ERK信号通路、JNK信号通路、p38信号通路几个部分。有研究表明,在细胞膜表面聚集流感病毒HA能促使MAPK信号通路的活化,使核蛋白有效运出,因此抑制MAPK级联反应的激活也是抑制流感病毒感染的一个重要途径[15-17]。核因子-κB(nuclear factor-κB,NF-κB)信号通路也与流感病毒感染相关,NF-κB抑制剂除了有直接的抗病毒作用外,还会抑制高致病性流感病毒感染细胞后细胞因子和趋化因子的过度产生[18]。
细胞表面的模式识别受体包括RIG-1和MDA5以及Toll样受体,其中RIG-1与病毒RNA聚合酶的PB2、PB1、PA三种亚基组成有关,调节RIG-1的表达量可以抑制流感病毒的复制[19-21]。此外,病毒的双链RNA可以与RIG-1和PKR结合并使之激活。PKR激活后,真核细胞起始因子2α(eukaryotic initiation factor 2α,eIF2α)也一并被激活,还可以磷酸化并激活NF-κB的抑制物IκB[22];从而进一步将信号传导至MAPK家族,激活MAPK-p38信号通路或MAPK-JNK信号通路,通过下调病毒感染后表达升高的p38和JNK,进而发挥抗病毒作用[23]。由此表明,RIG-1-like信号通路、PKR信号通路相关基因都可以成为抗流感病毒药物发挥抗病毒作用的靶点。
HSPs是一种应激蛋白,其中HSP70的基因结构最为保守,在病毒感染过程中作用也最为重要。HSP70在流感病毒生命周期各阶段均发挥一定的调控作用,其作用涵盖流感病毒的入侵、转录、核转位以及病毒粒子的形成过程,可与细胞凋亡蛋白激活因子-1(apoptosis protease-activating factor-1,Apaf-1)结合,进而抑制感染流感病毒的宿主细胞凋亡[22,24],抑制病毒扩散,从而达到抗流感病毒的效果。
本研究通过基因表达谱技术分析甲型流感通路、PI3K-AKT信号通路、RIG-1-like信号通路的差异表达基因,并利用荧光定量PCR进行验证,证实与病毒对照组和正常细胞组比较,白及提取物处理后差异表达基因 HSP70、IκB、PI3K 明显上调,RIG、PKR4 明显下调。已有研究证实,以上三条信号通路相关基因的表达水平与流感病毒感染有一定的相关性[25-27]。因此笔者推测,白及提取物可以通过调控宿主细胞相关基因通路中的基因表达水平来发挥抗流感病毒作用。
综上所述,本研究发现,白及提取物作用于甲型流感病毒H3N2感染的MDCK细胞,通过调控PI3KAKT信号通路、RIG-1-like信号通路、MAPK信号通路、Toll样信号通路以及NF-κB信号通路中的差异基因表达,进而发挥抗流感病毒作用。但由于上述信号通路涉及较多基因,且有关调控机制较为复杂,因此,白及提取物以宿主细胞为靶点抗流感病毒的深入机制有待进一步研究。

