光动力疗法联合拉帕替尼抑制人表皮生长因子受体-2阳性乳腺癌细胞的基础研究
孙蓓,张丽,刘晓东,佟仲生
人表皮生长因子受体-2(HER2)阳性表达的乳腺癌患者常治疗失败率及复发率高,预后较差。拉帕替尼(LAP)属于一类常见的表皮生长因子酪氨酸激酶抑制剂,其目前在抗肿瘤领域应用广泛,且在实际应用中表现出显著的抗肿瘤活性作用[1-3]。光动力疗法(PDT)对增生性疾病有很好的治疗效果,其在抗肿瘤治疗中表现出高效、毒副作用小等优点,其与化疗、靶向治疗等联合进行抗肿瘤治疗已经成为研究的热点,但是大部分研究主要集中在胸腹腔肿瘤,而其在乳腺癌中的研究报道较少,并且其抗肿瘤的机制尚不清楚[4-6]。5-氨基乙酰丙酸(5-ALA)是血红素合成过程中粪卟啉Ⅲ原卟啉IX(PpIX)的前体。氨基乙酰丙酸(ALA)-PDT实现了由外源光敏剂的直接输入到ALA在组织内内源性生成原卟啉光敏剂经光照射启动PDT的突破。本研究探讨新型光敏剂5-ALA用于PDT对HER2阳性乳腺癌细胞系SKBR3的抑制情况,并分析其具体机制,同时讨论PDT联合LAP对HER2阳性乳腺癌的治疗效果,以期为HER2阳性乳腺癌的治疗提供实验依据,为相关研究提供参考。
1 材料与方法
1.1 研究时间 本研究时间为2016年5月—2017年12月。
1.2 主要仪器及试剂 半导体激光光动力治疗仪(天津市雷意激光技术有限公司),5-ALA、MTT、Rhodamine 123(美国Sigma公司),LAP(英国葛兰素史克公司,批号:H201006493),胎牛血清、胰蛋白酶、细胞培养基(美国Gibco公司),流式细胞术检测试剂盒及抗体(美国BD公司)。
1.3 MTT法检测细胞生长抑制率 将对数生长期的HER2阳性乳腺癌细胞系SKBR3随机分为空白对照组、LAP组、PDT组、LAP+PDT组。每组设3个复孔。空白对照组:不做干预。LAP组:分别加入不同浓度梯度(0.50、1.00、2.00、5.00、10.00 µmol/L)的 LAP,孵育24 h;PDT组:分别加入不同浓度梯度(0.25、0.50、1.00、2.00、4.00 mmol/L)的5-ALA,孵育3 h给予激光照射;LAP+PDT组:分别加入不同浓度梯度(0.50、1.00、2.00、5.00、10.00 µmol/L)的LAP,孵育21 h,再加入不同浓度梯度(0.25、0.50、1.00、2.00、4.00 mmol/L)的5-ALA,孵育3 h给予激光照射。PDT组及LAP+PDT组光照能量密度为2.5 J/cm2,PDT治疗完毕后更换完全培养基,其他条件不变情况下继续培养16 h。通过光度计检测各组562 nm处的吸光度值,即细胞生长抑制率,绘制各组不同给药浓度下的细胞生长抑制率曲线。分别计算LAP和5-ALA的半数抑制浓度(IC50),确定最佳给药浓度及后续研究LAP组、PDT组、LAP+PDT组给药浓度。分别比较各组在最佳给药浓度下24、48 h时的细胞生长抑制率。
1.4 流式细胞术检测细胞凋亡情况 将对数生长期的HER2阳性乳腺癌细胞系SKBR3随机分为空白对照组、LAP组、PDT组、LAP+PDT组。每组设3个复孔。空白对照组:不做干预。LAP组:加入1.00 µmol/L的LAP,孵育24 h;PDT组:加入1.00 mmol/L的5-ALA,孵育3 h给予激光照射;LAP+PDT组:加入1.00µmol/L的LAP,孵育21 h,再加1.00 mmol/L的5-ALA,孵育3 h给予激光照射。PDT组及LAP+PDT组光照能量密度为2.5 J/cm2,PDT治疗完毕后更换完全培养基,其他条件不变情况下继续培养16 h。消化之后收集细胞,1 000 r/min离心5 min(离心半径6 cm),弃去上清液,磷酸盐缓冲液(PBS)充分冲洗细胞2遍;加入Annexin V-FITC 5 µl、PI 5 µl,避光孵育 15 min,加入缓冲液400 µl,采用流式细胞术检测试剂盒检测各组细胞凋亡情况。
1.5 Rhodamine123法检测绿色荧光强度及线粒体膜电位 将对数生长期的HER2阳性乳腺癌细胞系SKBR3随机分为空白对照组、LAP组、PDT组、LAP+PDT组。每组设3个复孔。各组细胞处理情况同1.4。加入线粒体探针Rhodamine123,终浓度为10 µg/ml,避光孵育30 min,弃培养基,加磷酸盐缓冲液(PBS)洗3遍。胰酶消化细胞,1 000 r/min离心5 min(离心半径6 cm),弃去上清液,PBS清洗细胞2次,倒置荧光显微镜下观察各组绿色荧光强度,采用流式细胞仪检测各组线粒体膜电位。实验独立重复3次,取平均值。
1.6 Western blotting法检测HER2表达水平 将对数生长期的HER2阳性乳腺癌细胞系SKBR3随机分为空白对照组、LAP组、PDT组、LAP+PDT组。每组设3个复孔。各组细胞处理情况同1.4。各组取5×106个细胞,加入500 µl预冷的细胞裂解液,置于冰浴中作用60 min,4 ℃ 1 200 r/m离心10 min(离心半径6 cm),吸出上清液,加入等体积的2×Loading buffer,沸水浴10 min,配置分离胶、积层胶,取电泳样品上样,每道20 µl,电泳,转膜。5%脱脂奶粉封闭处理2 h,加入一抗,4 ℃孵育12 h,洗膜,加入1∶20 000辣根过氧化物酶(HRP)标记的二抗,震荡孵育2 h,洗膜,加入化学发光底物(Luminol/Enhancer Solution和Stable Peroxide Solution按1∶1比例混合均匀),暗室孵育5 min。弃去发光底物,X线曝光显影。计算HER2表达水平。实验独立重复3次,取平均值。
1.7 统计学方法 采用SPSS 22.0统计学软件进行数据分析。计量资料以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验;采用金正均q值法[7]判断联合治疗的协同作用,Q=实际联合药效R'(A+B)/理论联合药效R(A+B),R(A+B)=RA+RB-RA×RB,RA、RB为单独用药药效,Q<0.85为拮抗,0.85≤Q<1.15为相加,Q≥1.15为协同。以P<0.05为差异有统计学意义。
2 结果
2.1 细胞生长抑制率 LAP的IC50为1.65 µmol/L,选取1.00 µmol/L(LAP组细胞的生长抑制率为40.12%)为后续研究LAP组、LAP+PDT组给药浓度(见图1)。5-ALA的IC50为1.57 mmol/L,选取1.00 mmol/L(PDT组细胞的生长抑制率为41.23%)为后续研究PDT组、LAP+PDT组给药浓度(见图2)。当LAP为1.00 mmol/L,5-ALA为1.00 µmol/L时,LAP+PDT组细胞生长抑瘤率为79.71%。联合治疗Q≈1.23,表明LAP与5-ALA联合治疗表现出良好的协同效果。
4组24、48 h细胞生长抑制率比较,差异有统计学意义(P<0.05);LAP组、PDT组、LAP+PDT组24、48 h细胞生长抑制率均大于空白对照组,差异有统计学意义(P<0.05);PDT组48 h细胞生长抑制率大于LAP组,差异有统计学意义(P<0.05);LAP+PDT组24、48 h细胞生长抑制率均大于LAP组、PDT组,差异有统计学意义(P<0.05,见表1)。
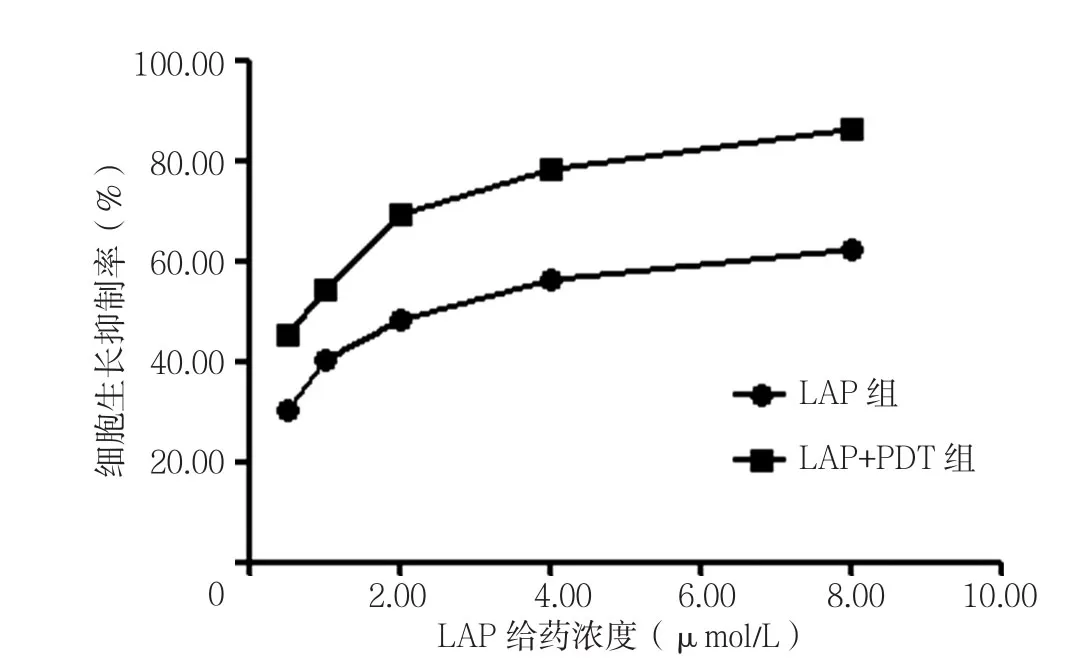
图1 LAP组与LAP+PDT组不同给药浓度下的细胞生长抑制率曲线(LAP+PDT组5-ALA为1.00 mmol/L)Figure 1 Cell growth inhibition rate curves at different concentrations in LAP group and LAP+PDT group(5-ALA used in LAP+PDT group was 1.00 mmol/L)
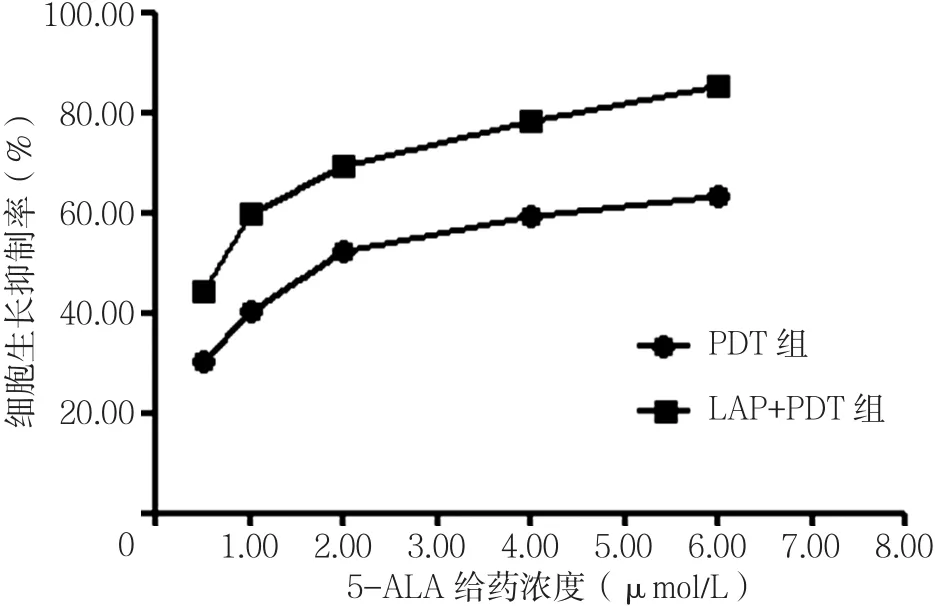
图2 PDT组与LAP+PDT组不同给药浓度下的细胞生长抑制率曲线(LAP+PDT组LAP为1.00 µmol/L)Figure 2 Cell growth inhibition rate curves at different concentrations in PDT group and LAP+PDT group(LAP used in LAP+PDT group was 1.00µmol/L)
表1 4组24、48 h细胞生长抑制率比较(±s,%,n=3)Table 1 Comparison of growth inhibition rates at 24,48 hours after intervention with the optima concentration in four groups

表1 4组24、48 h细胞生长抑制率比较(±s,%,n=3)Table 1 Comparison of growth inhibition rates at 24,48 hours after intervention with the optima concentration in four groups
注:LAP=拉帕替尼,PDT=光动力疗法;与空白对照组比较,aP<0.05;与LAP组比较,bP<0.05;与PDT组比较,cP<0.05
组别 24 h 48 h空白对照组 4.70±0.70 7.70±0.70 LAP 组 26.12±2.09a 45.12±3.42a PDT 组 32.46±4.12a 62.46±6.73ab LAP+PDT组 70.02±7.75abc 83.27±13.74abc F值 144.340 66.622 P值 <0.001 <0.001
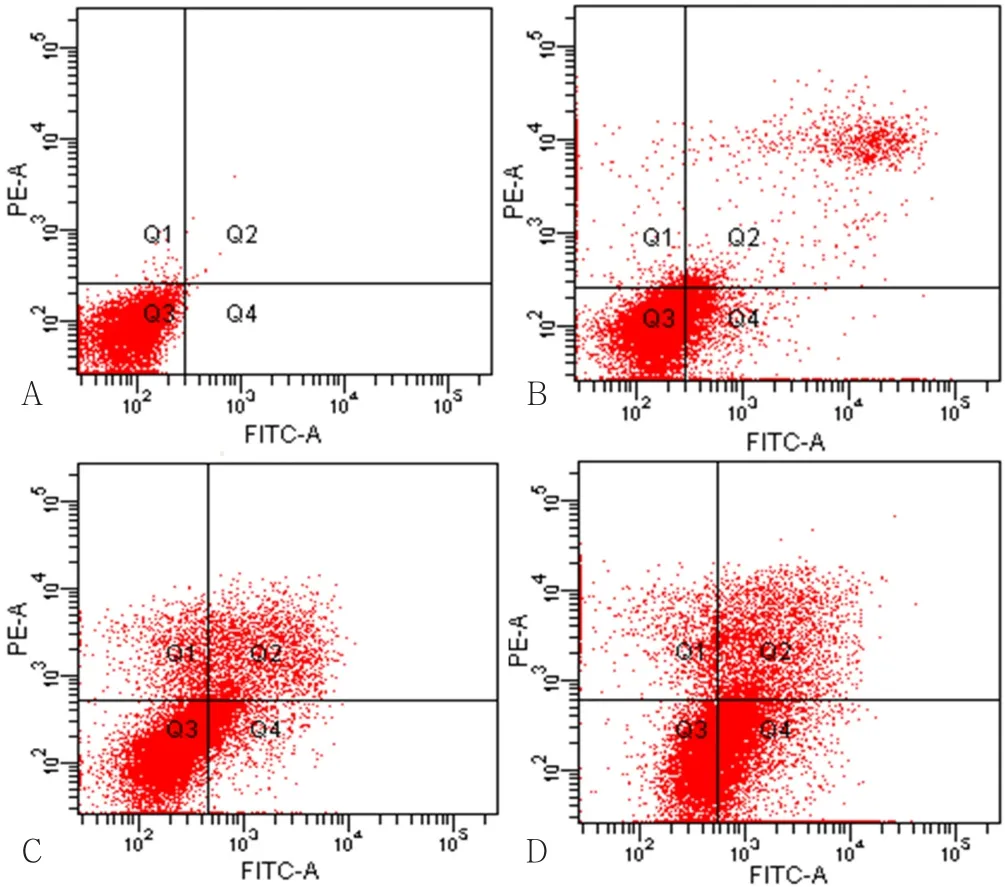
图3 流式细胞术检测各组细胞凋亡情况Figure 3 Apoptosis in each group detected by flow cytometry
2.2 细胞凋亡情况 空白对照组主要为活细胞;与空白对照组相比,LAP组、PDT组的细胞主要表现为凋亡,LAP+PDT组则出现了明显的凋亡和坏死,早期凋亡占比很低(见图3)。
2.3 绿色荧光强度及线粒体膜电位 绿色荧光强度:对照组细胞状态良好,细胞为绿色荧光,胞浆着色深;LAP组、PDT组荧光强度有所降低;LAP+PDT组的荧光强度降低最明显,提示活细胞减少(见图4)。线粒体膜电位:4组线粒体膜电位比较,差异有统计学意义(P<0.05);LAP组、PDT组、LAP+PDT组线粒体膜电位低于空白对照组,差异有统计学意义(P<0.05);PDT组、LAP+PDT组线粒体膜电位低于LAP组,差异有统计学意义(P<0.05);LAP+PDT组线粒体膜电位低于PDT组,差异有统计学差异(P<0.05,见图5、表2)。
2.4 HER2表达水平 4组HER2表达水平比较,差异有统计学意义(P<0.05);LAP组、PDT组、LAP+PDT组HER2表达水平均低于空白对照组,差异有统计学意 义(P<0.05);PDT组、LAP+PDT组 HER2表达水平均低于LAP组,差异有统计学意义(P<0.05);LAP+PDT组HER2表达水平均低于PDT组,差异有统计学意义(P<0.05,见图6、表3)。
3 讨论
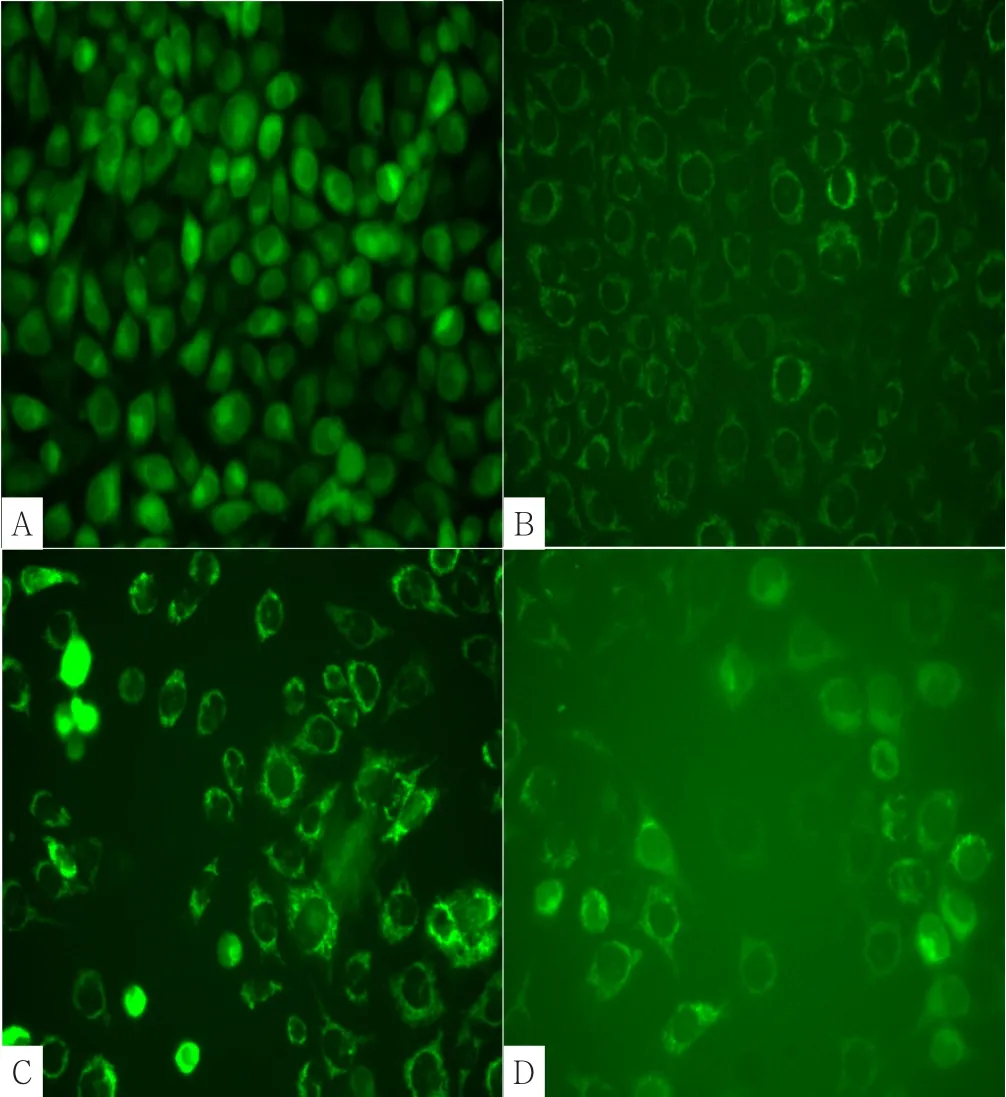
图4 各组绿色荧光强度(×200)Figure 4 Fluorescence intensity of green fluorescent protein in each group
表2 4组线粒体膜电位比较(±s,n=3)Table 2 Comparison of mitochondrial membrane potential in four groups

表2 4组线粒体膜电位比较(±s,n=3)Table 2 Comparison of mitochondrial membrane potential in four groups
注:与空白对照组比较,aP<0.05;与LAP组比较,bP<0.05;与PDT组比较,cP<0.05
组别 线粒体膜电位空白对照组 66.56±7.79 LAP组 49.16±9.38a PDT组 34.96±7.32ab LAP+PDT组 22.52±6.96abc F值 22.894 P值 <0.001
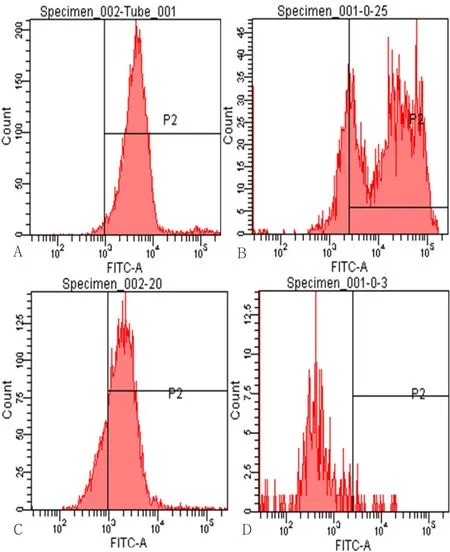
图5 Rhodamine123法检测各组线粒体膜电位Figure 5 Mitochondrial membrane potential in each group detected by Rhodamine123
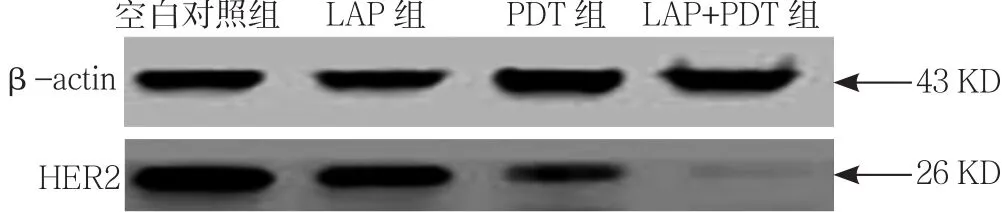
图6 Western blotting法检测各组HER2表达水平的凝胶电泳图Figure 6 Expression level of HER2 in each group by gel electrophoresis with Western blotting
表3 4组HER2表达水平比较(±s,n=3)Table 3 Comparison of expression level of HER2 in four groups

表3 4组HER2表达水平比较(±s,n=3)Table 3 Comparison of expression level of HER2 in four groups
注:HER2=人表皮生长因子受体-2;与空白对照组比较,aP<0.05;与LAP组比较,bP<0.05;与PDT组比较,cP<0.05
组别 HER2空白对照组 1.65±0.30 LAP组 1.24±0.11a PDT组 0.88±0.15ab LAP+PDT组 0.27±0.06abc F值 41.717 P值 <0.001
在乳腺癌患者中,HER2高表达是预后不良的重要因素,治疗的失败率及复发率高,生存时间短[8]。而在相关新技术的不断应用下,乳腺癌的治疗效果不断提高,且患者的预后也改善,不过有一部分患者在治疗过程中出现了一定的远处转移,导致治疗效果较差,其中约10%的胸壁复发[9]。严重者会出现皮肤溃烂、流血、化脓感染,极大影响患者的生活质量及预后。PDT对增生性疾病有很好的治疗效果,其在抗肿瘤治疗中表现出高效、毒副作用小等优点。多项实验证实,光动力治疗仪通过调节波长可以使光波穿透至皮下1~2 cm,其可以很好地治疗乳腺癌胸壁复发的表浅病灶,且治疗后的复发率低[10]。顾瑛等[11]研究发现,活性氧成分在血卟啉单甲醚诱导乳腺癌细胞的凋亡方面有很好的效果,且其可以生成单态氧而促使乳腺癌细胞坏死,同时还诱导乳腺癌细胞凋亡[12]。单态氧在PDT治疗过程中可以通过光敏性损伤起作用,可以破坏细胞脂质膜,进而影响细胞的通透性,导致细胞肿胀坏死,同时还影响细胞内多种酶活性。然而目前PDT与靶向治疗联用的协同效应还不是很明确。LAP属于一类很常用的酪氨酸激酶抑制剂,其目前在抗肿瘤靶向治疗领域有着广泛的应用,且表现出多方面的抗肿瘤活性[13-14]。本研究探讨新型光敏剂5-ALA用于PDT对HER2阳性乳腺癌细胞系SKBR3的抑制情况,并分析其具体机制,同时讨论PDT联合LAP对HER2阳性乳腺癌的治疗效果,以期为患者的治疗提供支持和依据。
KHDAIR等[15]发现,PDT联合阿霉素能够明显抑制耐药的肿瘤细胞增殖。CANTI等[16]将化疗与PDT治疗相结合,构建小鼠荷瘤模型,发现联合PDT治疗可使低剂量化疗药物抑瘤作用明显增强。本研究结果显示,当LAP为1.00 mmol/L,5-ALA为1.00 µmol/L时,LAP+PDT组细胞生长抑瘤率为79.71%;联合治疗Q≈1.23;表明LAP与5-ALA联合治疗表现出良好的协同效果。与空白对照组相比,LAP组、PDT组的细胞主要表现为凋亡,LAP+PDT组则出现了明显的凋亡和坏死,早期凋亡占比很低,这可能与二者联用引起细胞膜、线粒体及细胞器等损伤,导致细胞死亡有关。LAP组、PDT组、LAP+PDT组24、48 h细胞生长抑制率均大于空白对照组,PDT组48 h细胞生长抑制率大于LAP组,LAP+PDT组24、48 h细胞生长抑制率均大于LAP组、PDT组,提示PDT联合LAP对HER2阳性乳腺癌细胞系SKBR3可起到更好的抑制效果。
光敏剂在PDT治疗中的作用方式和其定位存在一定的相关性,而其定位于线粒体的比例较高。如苯卟啉衍生物单元酸A及亚甲蓝等在治疗过程中可以导致凋亡相关因子(Bcl-2家族、p53基因家族)的变化,进而引发细胞的凋亡和坏死[17-18]。本研究结果显示,与空白对照组相比,LAP组、PDT组荧光强度有所降低,LAP+PDT组的荧光强度降低最明显;LAP组、PDT组、LAP+PDT组线粒体膜电位低于空白对照组,PDT组、LAP+PDT组线粒体膜电位低于LAP组,LAP+PDT组线粒体膜电位低于PDT组;据此可判断出PDT治疗相关的肿瘤细胞凋亡作用与线粒体膜渗透性移位存在密切的关系,且PDT联合LAP治疗的效果更好。
LAP属于一类常见的小分子靶向药物,对HER2阳性乳腺癌患者的治疗效果明显,其主要以HER2基因为作用靶点,然而PDT联合LAP治疗HER2阳性乳腺癌的效果不是很确定。本研究结果显示,LAP组、PDT组、LAP+PDT组HER2表达水平均低于空白对照组,PDT组、LAP+PDT组HER2表达水平均低于LAP组,LAP+PDT组HER2表达水平均低于PDT组,说明PDT联合LAP能协同增强抗HER2治疗的效果。
综上所述,新型光敏剂5-ALA用于PDT对HER2阳性乳腺癌细胞系SKBR3具有明显的抑制作用,且PDT联合LAP的抑制作用更强,其机制与降低肿瘤细胞线粒体膜电位、HER2表达水平有一定关系。因此,PDT联合LAP有望改善HER2阳性乳腺癌患者生活质量,提高其生存率,具有良好的应用前景。
本研究局限性:
光动力疗法(PDT)联合拉帕替尼(LAP)是通过何种具体机制起到协同增效作用尚需进一步实验验证;由于PDT较难达到2 cm以下深层病灶,因此程度较深的胸壁复发治疗尚待进一步探索。
作者贡献:孙蓓进行文章的构思与设计、结果的分析与解释,撰写论文;张丽进行统计学处理、论文的中英文修订;刘晓东进行数据收集与整理;佟仲生进行研究的实施与可行性分析,负责文章的质量控制及审校,对文章整体负责、监督管理。
本文无利益冲突。

