代谢综合征与骨质疏松相关性及机制研究进展
1 前言
代谢综合征(metabolic syndrome,MetS)是以腹部肥胖、血脂异常[高甘油三酯、低密度脂蛋白(low-density lipoprotein,LDL)、胆固醇水平]、高血糖和高血压为特征的临床疾病。全世界约有四分之一的成年人患有MetS,这是一项重大的公共卫生挑战。
骨质疏松是一种代谢性骨病,易发于老年人中。其特征为骨量减少和骨微结构恶化,最终导致骨骼易碎和易发生骨折。由于高发病率(全球超2亿人)、高死亡率和高昂的医疗保健费用,骨质疏松症已成为一个主要的健康问题。
这2种疾病的发生基本取决于生活方式、遗传、代谢、营养和激素等因素。腹型肥胖、血脂异常、高血糖和高血压是骨质疏松症的相关因素,也是MetS的相关疾病[1]。腹部肥胖被认为与骨质减少和骨质疏松有关[2]。然而,也有研究表明,肥胖、超重和高体质量指数(body mass index, BMI)可以防止骨质流失,从而降低骨折风险[3]。此外,血脂异常与骨质疏松症之间关系也尚未确定,高血糖和高血压对骨骼健康的影响报道也是相互矛盾的。因此,本文综述了MetS动物模型和人类流行病学研究中骨丢失与MetS的证据,同时讨论了经体外研究证实的因MetS引起的骨丢失的发病机理。
2 MetS与骨质疏松症之间的关联
2.1 MetS动物模型研究 对动物饲喂西化饮食(高脂肪、高蛋白、高热量、低含量不饱和脂肪酸、低维生素),结果显示实验动物股骨、脊椎骨密度 (BMD)和骨骼矿物质含量(bone mineral content,BMC)水平均降低[4]。Li等[5]使用高脂(HF)饮食饲喂患MetS的C57Bl/6小鼠,结果显示MetS小鼠出现牙槽骨损失、破骨细胞生成和炎症等症状。
2.1.1 肥胖:Halade等[6]使用含10%玉米油的HF饮食诱导12个月大的雌性C57Bl/6J小鼠肥胖,6个月后小鼠体质量、内脏脂肪量、腹部脂肪量、空腹血糖、空腹血清胰岛素均升高,同时BMD降低。除此之外,骨组织形态学分析显示,肥胖小鼠出现股骨干骺端骨小梁分布稀疏,骨小梁变细及断裂,伴骨髓腔中有大量脂肪浸润[7]。最近的一项研究利用微型计算机断层扫描分析HF饮食喂养的肥胖小鼠,结果显示小鼠骨小梁体积和皮质骨生长减少[8]。
2.1.2 血脂异常:由于内脏脂肪的积累,肥胖和血脂异常通常同时发生。Graham等[9]报道,HF饮食能够引起小鼠高胆固醇血症,总胆固醇、LDL和未酯化胆固醇水平增高进一步影响骨质量,导致BMC、骨组织力学性能及骨小梁结构参数降低。Pirih等[10]后续实验发现,HF饮食诱导的高脂血症小鼠表现出血清胆固醇升高,血糖水平升高和高密度脂蛋白(HDL)水平降低。微型计算机断层扫描分析表明,小鼠骨表面和骨量减少,表明高脂血症小鼠发生骨质重塑。高脂血症小鼠血清生化指标分析显示,甲状旁腺激素(PTH)、肿瘤坏死因子-α(TNF-α)、1型胶原C-末端肽(CTX)(骨吸收标志物)、钙和磷增加,同时发现了较低水平的1型原胶原氨基-末端前肽(PINP)(骨形成标志物)。高胆固醇血症小鼠股骨和椎骨的皮质和骨小梁骨质流失,因此骨骼的机械强度显著下降[11]。
2.1.3 高血糖:高血糖是糖尿病的特征。Ward等[12]研究表明,与正常大鼠相比,糖尿病大鼠肾小球滤过率更高,尿钙增加,钙重吸收量减少,骨形成标志物骨钙素水平降低53%。Kianifard等[13]研究发现,与正常大鼠相比,糖尿病Cohen大鼠(2型糖尿病非肥胖大鼠)的股骨远端和椎骨的BMD显著降低。
2.1.4 高血压:已经有研究报道了钙代谢在高血压和骨质疏松症中的重要性。在比较高血压大鼠(SHR)和血压正常的Wistar-Kyotorats大鼠(WKY)的体内实验中,SHR大鼠BMD和骨镁含量均较低。在饮食中添加含钙食物,SHR和WKY大鼠中BMD和骨钙含量均增加,但骨镁含量均降低。此外,与WKY大鼠相比,SHR大鼠中存在低百分比的骨小梁面积和新形成的骨区域[13]。这些发现暗示了高血压和骨流失之间有显著的关系。
2.2 人类流行病学研究 与动物研究不同,人类流行病学研究中骨骼健康与MetS之间的关系并不确定。Li等[5]研究显示,女性MetS病人骨质疏松性非椎体骨折的发生率显著高于男性(OR=3.76,95%CI为1.27~11.13)。与没有MetS的病人相比,患有MetS的男性和女性全髋部的BMD均较低,这意味着MetS可能是骨质疏松性骨折的一个危险因素。一项队列研究显示,MetS和2型糖尿病与BMD之间存在负相关,男性MetS和糖尿病均与BMD降低和骨质疏松症患病率升高相关[14]。Kim等[2]在韩国人群中进行的横断面研究表明,与正常人相比,MetS病人的股骨颈BMD较低。腰围是所有MetS相关疾病中BMD最显著的预测因子。在Wang等[15]进行的一项包含9930例40岁以上中国成年人的研究中,患有MetS的女性骨质疏松性骨折的发生率较高(OR=1.22,95%CI为1.12~1.54),而男性则不然。
一些研究还报道了MetS与骨骼健康之间的正相关关系。 在美国的一项回顾性研究中,22%的受试者被发现患有MetS,与没有MetS的病人相比,患有MetS的受试者具有更高的股骨颈BMD[16]。
尽管MetS和骨质疏松症之间的关联已得到充分证实,但需要考虑这些研究的局限性。首先,这些队列研究受到选择偏倚的影响,因为受试者选自固定的人群,因此很难将研究结果推广到其他人群。其次,BMD的评估仅在骨骼的特定部位进行,但MetS和BMD的关系在其他部位可能不同。
3 由MetS相关疾病引起的骨质疏松症的潜在机制
传统观点认为,肥胖对骨骼具有保护作用。这归因于骨骼上的机械负荷以及脂肪细胞将雄激素转化为17-雌二醇的能力增加,从而导致BMD增加[17]。然而,体脂仅占人类正常总体质量的16%~25%,而剩余的身体成分是瘦体质量。脂肪量和瘦体质量对BMD的相对贡献尚无数据。
之后的研究也发现了与之矛盾的结果:肥胖引起过多的脂肪量和内脏脂肪堆积会导致骨质疏松症的风险增加。脂肪细胞和成骨细胞(源于共同的祖细胞)分化的平衡分布受各种信号通路的调节。脂肪组织起到能量储存的作用,也是激素和炎症介质的来源,如TNF-α、白细胞介素-1(IL-1)、IL-6、C-反应蛋白(CRP)、瘦素和脂联素[18]。高水平的促炎细胞因子可刺激破骨细胞分化和骨吸收[19]。瘦素的升高和(或)脂肪细胞分泌脂联素有助于巨噬细胞向脂肪组织的转运,而巨噬细胞是促炎因子的另一个来源,进一步促成促炎细胞因子对肥胖症骨代谢的不利影响[17]。
血脂异常与骨质疏松症之间的关联与肥胖相似,因为脂肪组织增多是两种病症的共同特征。脂质代谢紊乱可能导致高水平的脂质氧化。脂质氧化可刺激脂肪细胞分化,同时通过上调过氧化物酶体增殖物激活的受体-γ(PPAR-γ)来抑制成骨细胞分化。PPAR-γ是核激素受体亚家族的成员,其在脂肪细胞中表达以增强和介导脂肪细胞的分化和增殖[20]。已经确定PPAR-γ是用于检测脂肪酸衍生的信号分子的特异受体,暗示其对脂肪酸控制脂质代谢和炎症的敏感性。据报道,活化的PPAR-γ可增强脂肪细胞分化并抑制各种间充质细胞系和骨髓中的成骨细胞形成[21]。
骨代谢的另一种机制是由核因子(NF-κB)配体的受体激活剂(RANKL)/NF-κB(RANK)/骨保护素(OPG)和Wnt-catenin信号通路控制的脂肪细胞和成骨细胞增殖之间的转换,该过程由一系列级联事件和转录因子协调[22]。成骨细胞或活化的T细胞分泌RANKL,RANK是在破骨细胞质膜上表达的表面分子。RANKL和RANK之间的相互作用是破骨细胞生成的关键介质,并由OPG负调控[25]。OPG是一种蛋白质,属于由成骨细胞合成的TNF受体家族,能够与RANKL结合,从而抑制RANKL-RANK相互作用和破骨细胞生成[24]。Xu等[7]进行了全面的体外和体内研究,确定脂肪细胞降低了OPG/RANKL比例并增加了破骨细胞上RANK的表达。另一项研究表明,脂肪细胞分泌因子可刺激成骨细胞增加RANKL的表达,并减少OPG的产生[6]。
Wnt-catenin途径可调节细胞生物学的许多过程,例如脂肪细胞和成骨细胞分化之间的相互约束过程,该途径决定了间充质细胞的命运,其活化有利于成骨细胞生成。分泌的卷曲相关蛋白1(sFRP-1)通过与Wnt配体结合而成为Wnt-catenin信号通路的拮抗剂。 sFRP-1的过度表达通常通过Wnt-catenin途径抑制体外成骨细胞增殖[25]。Kang等[26]的一项研究证明,Wnt-catenin的激活下调C/EBP和PPAR-γ的同时上调Runx2,导致成骨细胞生成激活,脂肪生成抑制。因此,脂肪累积和肥胖会增加sFRP-1的表达,其阻断了Wnt-catenin蛋白信号通路,从而升高C/EBP和PPAR-γ增强脂肪细胞分化,同时下调Runx2抑制成骨细胞形成(图1)。
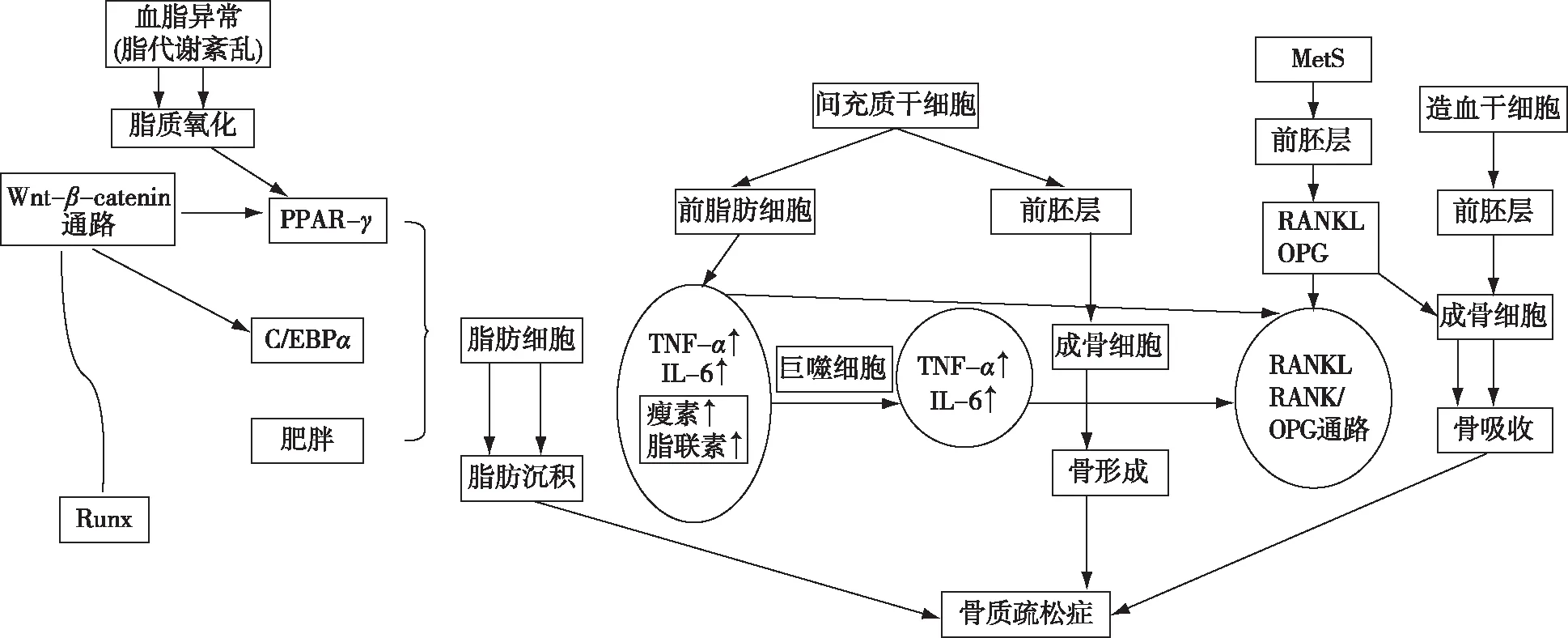
图1 炎症导致的骨丢失机制
高血糖导致骨流失的机制与升高炎症反应和钙代谢紊乱有关。糖尿病病人胰岛素分泌和(或)胰岛素作用受损,导致TNF-α和IL-6水平增加。STZ诱导的糖尿病小鼠的体内研究显示,TNF-α、巨噬细胞集落刺激因子和RANKL的mRNA表达显著升高,导致骨形成抑制和骨强度降低[27]。另一方面,体外实验表明,高葡萄糖浓度是导致骨质流失的原因,高血糖可导致骨钙素mRNA和Runx2的表达下降,同时促进PPAR-γ表达[28]。在糖尿病中,晚期糖基化终产物(AGEs)的积累导致骨质量和强度降低。AGE可增强小鼠未分割骨细胞的骨吸收,诱导间充质干细胞凋亡。据报道,胰岛素样生长因子(IGF)-1缺乏与低BMD、低骨量、骨生长障碍和骨质疏松症的发展有关[29]。
钙代谢异常是导致高血压和骨质疏松症的关键因素。高血压导致尿钙排泄增加,血液中的钙被肾小球过滤,而高钙水平可以增加对骨强度的保护作用,进而减少高血压病人骨质疏松相关的骨折。
4 总结和展望
了解MetS与骨质疏松症之间的关系,对这2种疾病的治疗和干预有重要意义。干扰钙稳态、诱导炎症反应和氧化应激、控制骨形成和骨吸收的耦合过程是治疗骨质疏松症的有效手段。同时,在预防骨质疏松性骨折时应考虑MetS的治疗。此外,在调查MetS与骨质疏松症之间的关系时,应考虑性别、年龄、种族、生活方式和饮食习惯的影响。

