不同电子载体对丙酮丁醇发酵的影响研究
罗壹艳,刘孟荧,方利敏,周智友,李汉广
不同电子载体对丙酮丁醇发酵的影响研究
罗壹艳,刘孟荧,方利敏,周智友,李汉广*
(江西农业大学 生物科学与工程学院/江西农业微生物资源开发与利用工程实验室/江西省菌物资源保护与利用重点实验室,江西 南昌 330045)
通过研究不同浓度的丁酸钠、乙酸钠、中性红及组合添加中性红与弱酸盐等电子载体对菌种ART18发酵木薯粉产丁醇的影响。结果表明,丁酸钠、乙酸钠以及中性红均可提高丁醇产量,其中中性红效果最为显著,当添加量为3.0 g/L时,丁醇产量可达到(11.3±0.23)g/L,较对照组相比提高了51.7%;当组合添加3.0 g/L中性红与3.0 g/L丁酸钠时,丁醇和总溶剂产量进一步提升,分别达到了(12.2±0.25)g/L和(17.4±0.18)g/L,较对照组分别提高了64.9%和33.8%,与单独添加丁酸钠和中性红相比,丁醇产量分别提高了32.6%和8.0%。说明组合添加中性红与弱酸盐对丁醇发酵有一定促进作用。
丁醇;丙醇丁醇梭菌ART18;电子载体
随着化石原料的快速消耗及全球环境的日益恶化,使寻找可替代化石能源的生物质能源在近年来成为能源领域研究的热点。丁醇是一种重要的基础平台化合物,在树脂、橡胶、油漆、涂料及医药等工业中应用广泛[1]。而利用微生物发酵生产丁醇在近年来逐渐成为能源可持续发展战略的重要组成部分[2-3],使得生物丁醇发酵研究得到全球科研工作者的广泛关注。同时,因其具有能量密度高、挥发性低、腐蚀性小、燃烧性能好、热值接近汽油等诸多优势[4],被认为是理想的第二代生物质能源[5]。
在传统丁醇发酵过程中,产物产量及转化率较低,原料成本过高等问题,是限制大规模生物丁醇发酵生产的关键因素之一。木薯因其适应性强,可在干旱、酸性或贫瘠土壤中生长[6],且淀粉含量高而被逐渐用于发酵生产丁醇[7-8]。目前,利用木薯粉作为单一发酵底物,发酵结束后往往产率较低,但可通过优化培养基和发酵条件提高底物利用率[9-11],进而实现木薯等薯类原料对玉米等粮食底物的替代,以降低发酵成本[12]。
在丁醇发酵代谢过程中,氢气的产生及醇类的合成均需要消耗NADH,若NADH供应不足,则导致溶剂产量较低,故而稳定NADH的合成速率才能满足菌种代谢过程的正常进行[13-16]。通过添加电子载体[17](中性红[18]、次甲基蓝[19]、卞精结晶紫(BV)[16]等)或加入氢化酶抑制剂[20],抑制H2产生电子,促进代谢流移动,加快NADH的合成,最终提高醇类物质的合成[21]。另一方面,某些弱酸盐在代谢过程中也起着不同的调控作用,有研究表明,丁酸钠在发酵过程中能够延缓菌种衰老,增强溶剂生产能力[17];乙酸钠通过促进乙酰-COA合成乙酰乙酰-COA[22],刺激乙酸激酶和丁酸激酶的活性[23],进而加强溶剂的合成。因此,抑制氢化酶活性、加速NADH的合成、延缓菌种衰老等均可使代谢流更大程度向丁醇合成方向流动,使溶剂产量大幅度提升。
本实验以丙酮丁醇梭菌ART18(ART18)为出发菌株,以木薯粉为主要发酵底物,通过研究丁酸钠、乙酸钠、中性红及组合添加中性红和弱酸盐等电子载体对丙酮丁醇发酵的影响,以期找到进一步提高丁醇产量的调控因子,为丁醇发酵工业化代谢调控提供一定价值的前期探索。
1 材料与方法
1.1 菌 种
本实验所用菌种丙酮丁醇梭菌ART18(ART18)由江西农业大学应用微生物研究室提供。
1.2 培养基
固体培养基(g/L):可溶性淀粉 40,葡萄糖 60,胰蛋白胨 3,酵母浸粉 2,CH3COONH43,FeSO4·7H2O 0.01,MgSO4·7H2O 0.2,K2HPO40.75,KH2PO40.75,琼脂 20,pH自然,121 ℃灭菌15 min。
种子培养基(g/L):葡萄糖 60,胰蛋白胨 3,酵母浸粉 2,CH3COONH43,FeSO4·7H2O 0.01,MgSO4·7H2O 0.2,K2HPO40.75,KH2PO40.75,pH自然,121 ℃灭菌15 min。
木薯发酵培养基(g/L):木薯粉 80,酵母浸粉 2,FeSO4·7H2O 0.01,MgSO4·7H2O 0.2,K2HPO40.5,KH2PO40.5,NaCl 0.01,对氨基苯甲酸 0.001,维生素B1 0.001,生物素0.000 01,121 ℃灭菌15 min。
1.3 方 法
1.3.1 原料的预处理 将木薯用小型粉碎机进行粉碎,并过60目筛网进行筛分以获得粒径一致的木薯粉,再将其按8%的比例加入到蒸馏水中,100 ℃条件下糊化10 min备用。
1.3.2 培养方法 孢子悬液100 ℃热激80~90 s,涂布固体培养基,37 ℃厌氧培养48 h。挑取固体平板菌落至种子培养基中,37 ℃厌氧培养18 h。将种子培养基以10%的接种量接入发酵培养基,于37 ℃条件下厌氧培养72 h。
1.3.3 不同浓度添加物对发酵的影响 向木薯发酵培养基中分别添加不同浓度的丁酸钠、乙酸钠和中性红,以及中性红与丁酸钠(或乙酸钠)的混合添加,以探究其对菌种ART18发酵产溶剂的影响。将不同浓度添加物过滤除菌,加入已经灭好菌的发酵培养基中,37 ℃厌氧培养72 h。
1.3.4 溶剂产量测定 发酵液经8 000 r/min离心5 min,取上清液过0.22 μm滤膜,与1.21 g/L异丁醇(异丁醇作为内标)按1:4的比例混匀,用于气相色谱检测。色谱条件如下:PEG20M毛细管柱(30 m×0.32 mm×0.4 μm),进样口温度:240 ℃,检测器温度:240 ℃,柱温:90 ℃,以氮气作载气,进样量0.4 μL。
2 结果与讨论
2.1 丁酸钠对丙酮丁醇发酵产溶剂的影响
在丙酮丁醇发酵过程中,丁酸盐除缓冲作用外,也可作为发酵底物促进丁醇合成,并提高丁醇代谢过程中关键酶酶活[24-25]。为探究其对菌种ART18发酵木薯粉产丁醇性能的影响,将不同浓度丁酸钠(1.0,2.0,3.0,4.0,5.0 g/L)添加到木薯发酵培养基中,以未添加的为对照,其实验结果如图1所示。
由图1可知,随着丁酸钠添加量的增加,丁醇和总溶剂产量先上升后下降,当丁酸钠的添加量为4.0 g/L时,丁醇和总溶剂的浓度达到最高,分别为(9.2±0.28)g/L和(14.6±0.25)g/L,与对照组相比,两者产量分别提高了24.3%和12.3%。当丁酸钠的添加量超过4.0 g/L时,溶剂浓度呈下降趋势,但相对于对照组而言仍有一定提高。与此同时,丁酸钠浓度越高,丁醇占比越大。谭秀花[26]研究发现当丁酸钠添加量为0.5%时丁醇占比最高为68.1%,本实验结果与这一结论一致。丁酸钠的添加能提高丁醇产量的原因可能与其能够促进丁酸以及其它代谢途径向丁醇的合成方向转变,减少代谢支路以及抑制乙醇和丙酮的合成有关,从而提高丁醇在总溶剂中的比例。

图1 不同浓度丁酸钠对Clostridium acetobutylicum ART18发酵的影响
2.2 乙酸钠对丙酮丁醇发酵产溶剂的影响
有研究表明,乙酸钠可以促进乙酰-COA合成乙酰乙酰-COA,并刺激乙酸激酶和丁酸激酶的活性,进而加强溶剂的合成[24]。此外,Hüsemann等[27]认为乙酸钠在发酵过程中起调节pH促进溶剂合成的作用;而Holt等[28]则认为过量的乙酸钠,会导致丁醇产量下降,但不影响丙酮的合成。因此,为探究其对菌种ART18发酵木薯粉产溶剂的影响,将不同浓度的乙酸钠(1.0,1.5,2.0,3.0,4.0 g/L)添加到发酵培养基中,以未添加的为对照,其结果如图2所示。
由图2可知,外源添加适当浓度的乙酸钠可以促进丁醇和总溶剂的合成。当乙酸钠的浓度为1.5 g/L时,丁醇和总溶剂的浓度分别达到(8.8±0.31)g/L和(14.5±0.20)g/L,两者较对照组相比分别提高了18.9%和11.5%。而当乙酸钠添加浓度为4.0 g/L时,丁醇和总溶剂的产量极速下降。此外,随着乙酸钠添加量不断增加,丁醇产量先上升后下降而丙酮的合成效果越好,从而导致丁醇占比先增加后极速下降。Qureshi等[29]报道,当向发酵培养基(MP2)中添加适当的乙酸钠可提高丁醇产量,与本实验结果一致。乙酸钠作为弱酸盐加入发酵培养基后,在发酵后期测得其pH有所上升(数据未显示),说明乙酸钠具有稳定pH的能力,可避免菌体因发酵液中的pH值较低而过早停滞。

图2 不同浓度乙酸钠对Clostridium acetobutylicum ART18发酵的影响
2.3 中性红对丙酮丁醇发酵产溶剂的影响
中性红作为电子载体能够抑制氢化酶的活性,改变电子流向,提高NADH水平。在丁醇发酵过程中,因其能代替铁氧化还原蛋白氧化还原酶传递电子和质子,其常被添加到发酵培养基中,以促进NAD(P)H合成,从而为丁醇和乙醇的合成提供充足的还原力[18]。图3为不同浓度的中性红(0.5、1.0、2.0、3.0及4.0 g/L)对菌种ART18发酵木薯粉产溶剂的影响。
由图3可知,在菌种的代谢过程中,中性红能够提高菌种ART18发酵木薯粉产丁醇的能力,但对丙酮和乙醇的合成均有抑制作用。当中性红的添加量为3.0 g/L时,丁醇和总溶剂的产量达到最高,分别为(11.3±0.23)g/L和(16.0±0.23)g/L,与对照组相比,分别提高了51.7%和23.5%。当中性红的添加量超过3.0 g/L时,丁醇和总溶剂的合成受到抑制,可能是电子载体本身是试剂染料,具有低毒性,当添加量达到一定时会影响菌体的生长及代谢产物的合成。本实验结果与谭秀花[26]所报道的随着中性红添加量不断增加丁醇的产量先上升后下降和丙酮产量一直下降结果一致,但与徐芳[22]所提出的随着中性红的不断添加,丁醇和总溶剂的产量均呈下降趋势的结论不一致。其可能原因是不同菌株对中性红的耐受性不同。
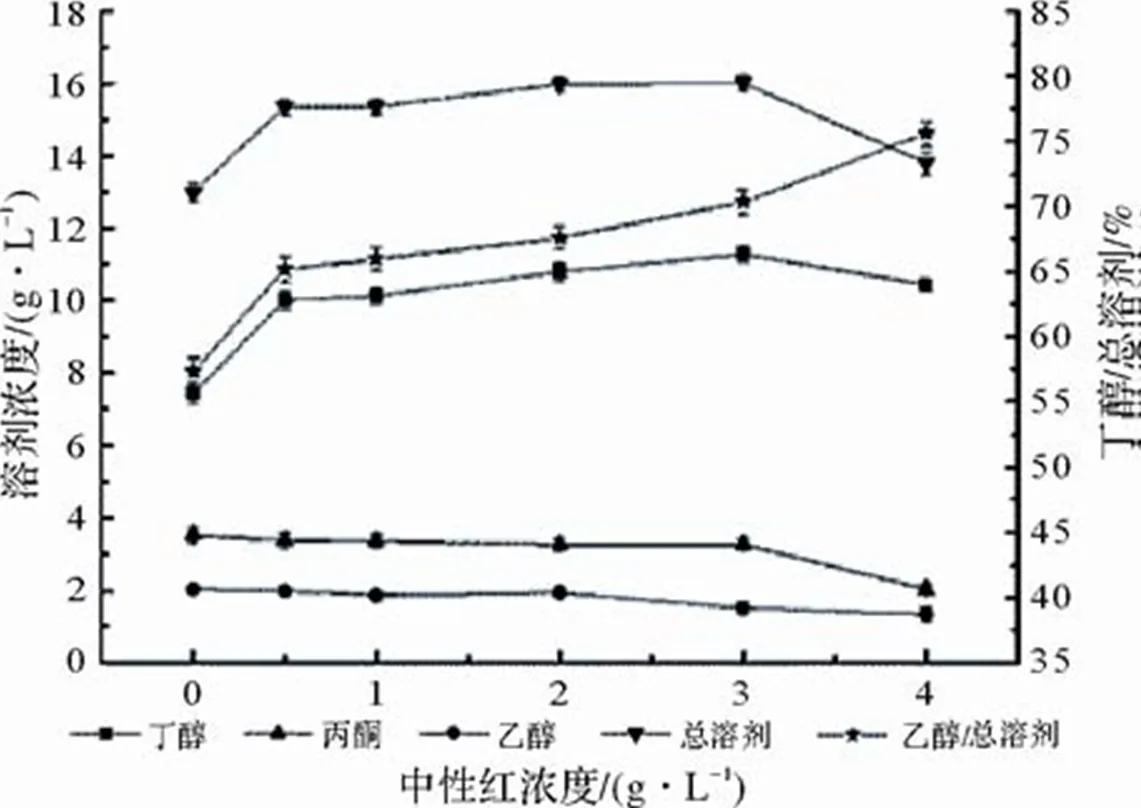
图3 不同浓度中性红对Clostridium acetobutylicum ART18发酵的影响
2.4 中性红与弱酸盐复合添加对丙酮丁醇发酵产溶剂的影响
上述结果表明,丁酸钠等弱酸盐可以改善发酵液的pH,延缓菌种的衰老,并提升菌种的发酵性能,而中性红对丁醇合成的促进作用也十分明显。为使菌种发酵产溶剂的性能进一步提升,本次实验在含有3.0 g/L中性红的发酵液中分别加入不同浓度的弱酸盐(乙酸钠、丁酸钠)(1.0,2.0,3.0,4.0,5.0 g/L),来探究复合添加弱酸盐和中性红对菌种ART18发酵木薯粉产溶剂的影响,其实验结果如图4所示。
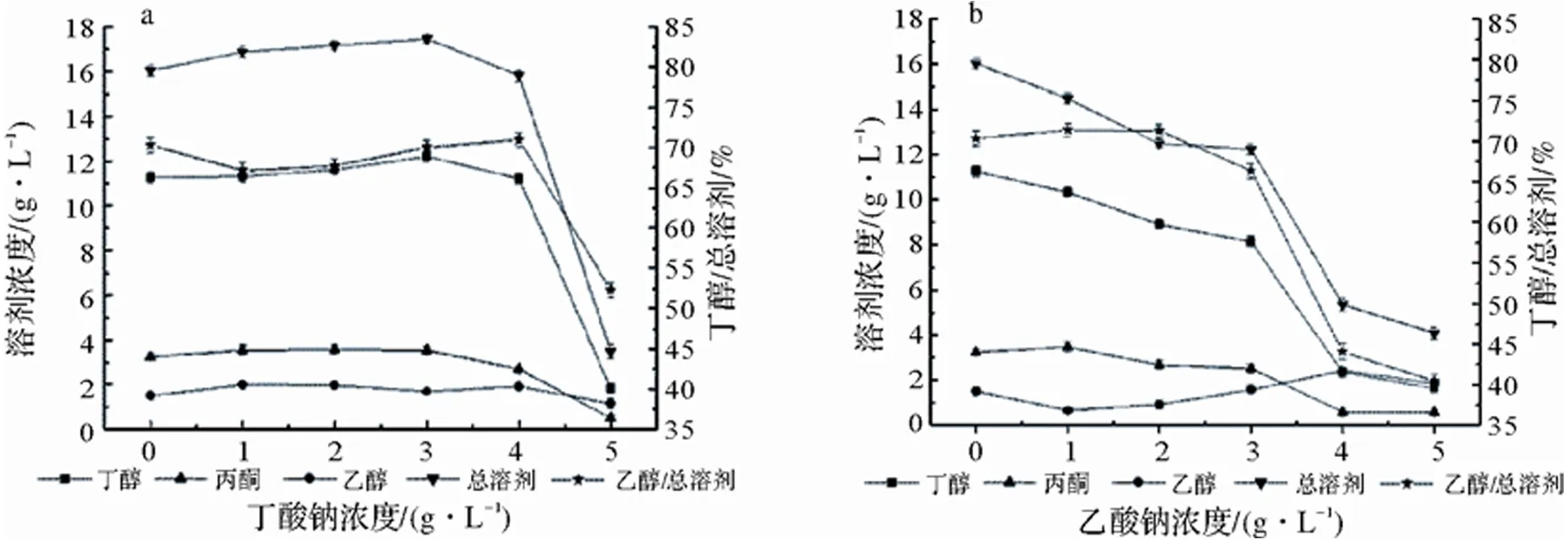
a:复合添加条件下不同浓度丁酸钠对丁醇发酵的影响;b:复合添加条件下不同浓度乙酸钠对丁醇发酵的影响
从图4可观察到,中性红与乙酸钠复合添加条件下,丁醇及总溶剂产量并没有提升,反而随着乙酸钠浓度的升高而下降,而中性红与丁酸钠复合添加能进一步提高丁醇和总溶剂的产量。当丁酸钠和中性红的添加量均为3.0 g/L时,丁醇和总溶剂的产量可达到(12.2±0.25)g/L和(17.4±0.18)g/L,与仅添加丁酸钠的相比分别提高了32.6%和19.2%;与对照组相比,分别提高了64.9%和33.8%。说明一定范围内中性红与丁酸钠复合添加具有协同作用,可促进菌种ART18发酵木薯粉产丁醇。
3 结 论
本研究主要探究了弱酸盐及中性红等电子载体的单独添加及复合添加对菌种ART18发酵木薯粉产丁醇的影响。结果发现3.0 g/L的中性红对丁醇的合成具有较大促进作用,丁醇与总溶剂的产量可到达(11.3±0.23)g/L和(16.0±0.23)g/L,与对照组相比,分别提高了51.7%和23.5%。且适宜浓度的丁酸钠与乙酸钠也可在一定程度上促进丁醇的合成。当复合添加3.0 g/L丁酸钠与3.0 g/L中性红时,菌种ART18发酵木薯粉产溶剂的能力可得到进一步提高,丁醇和总溶剂的产量分别为(12.2±0.25)g/L和(17.4±0.18)g/L,与对照组相比分别提高了64.9%和33.8%。本研究结果表明适量添加弱酸盐和中性红可提高菌种ART18发酵木薯粉产丁醇的能力,本实验结果可为通过代谢调控手段提高该微生物的工业适应性提供一定价值的前期探索。
[1] 林俊涵, 邱东凤, 林晨. 丁醇产生菌育种研究进展[J]. 中国生物工程杂志, 2014, (12): 118-128.
[2] Lee S Y, Park J H, Jang S H, et al. Fermentative butanol production by Clostridia[J]. Biotechnology and Bioengineering, 2008, 101(2): 209-228.
[3] Ezeji T C, Qureshi N, Blaschek H P. Butanol fermentation research: upstream and downstream manipulations[J]. The Chemical Record, 2004, 4(5): 305-314.
[4] 高越, 郭晓鹏, 杨阳, 等. 生物丁醇发酵研究进展[J]. 生物技术通报, 2018(8): 27-34.
[5] Guo T, Tang Y, Zhang Q, et al.mutant with high inhibitor tolerance obtained by low-energy ion implantation[J]. Journal of Industrial Microbiology and Biotechnology, 2012, 39(3): 401-407.
[6] 李乐. 木薯原料发酵生产丁醇过程中高丁醇/丙酮比特征的研究[D]. 无锡: 江南大学, 2013.
[7] 郑钧屏. 解除以木薯为原料的丁醇发酵相转型延迟并提高发酵效率的研究[D]. 无锡: 江南大学, 2012.
[8] 冀凤杰, 王定发, 侯冠彧, 等. 木薯渣饲用价值分析[J]. 中国饲料, 2016, 554(6): 41-44.
[9] 王文博. 木薯原料制生物丁醇发酵技术研究[D]. 杭州: 浙江大学, 2017.
[10] 李鑫. 使用木薯原料和外部代谢调控策略提高丁醇发酵的丁醇/丙酮比[D]. 无锡: 江南大学, 2014.
[11] 宋钢, 郑璞, 倪晔, 等. 木薯发酵产丁醇的研究[J]. 生物加工过程, 2012(2): 6-10.
[12] 华连滩, 王义强, 彭牡丹, 等. 生物发酵产丁醇研究进展[J]. 微生物学通报, 2014(1): 146-155.
[13] 姜成. 高产丁醇菌种的选育及代谢副产物对丁醇发酵影响的研究[D]. 哈尔滨: 哈尔滨工业大学, 2012.
[14] Petiedemange H, Cherrier C, Raval G, et al. Regulation of the NADH and NADPH-ferredoxin oxidoreductases in clostridia of the butyric group[J]. Biochimica et Biophysica Acta (BBA)-General Subjects, 1976, 421(2): 334-347.
[15] Honicke D, Janssen H, Grimmler C, et al. Global transcriptional changes ofcultures with increased butanol: acetone ratios[J]. New Biotechnology, 2012, 29(4): 485-493.
[16] Rao G, Mutharasan R. Altered electron flow in continuous cultures ofinduced by viologen dyes[J]. Applied and Environmental Microbiology, 1987, 53(6): 1232-1235.
[17] 周灿灿. 丙酮丁醇梭菌的选育及高强度丁醇发酵的研究[D]. 江南大学, 2012.
[18] Girbal L, Vasconcelos I, Saint-Amans S, et al. How neutral red modified carbon and electron flow ingrown in chemostat culture at neutral pH[J]. FEMS Microbiology Reviews, 1995, 16(2-3): 151-162.
[19] Ballongue J, Amine J, Petitdemange E H, et al. Enhancement of solvents production bycultivated on a reducing compounds depletive medium[J]. Biomass, 1986, 10(2): 121-129.
[20] Chou C J, Jenney Jr F E, Adams M W W, et al. Hydrogenesis in hyperthermophilic microorganisms: implications for biofuels[J]. Metabolic Engineering, 2008, 10(6): 394-404.
[21] 周灿灿, 唐波, 罗玮, 等. 电子载体对丁醇发酵的影响[J]. 生物加工过程, 2012(5): 1-6.
[22] 徐芳. 丙酮丁醇梭菌生产丁醇及代谢调控的初步研究[D]. 无锡: 江南大学, 2009.
[23] Chen C K, Blaschek H P. Acetate enhances solvent production and prevents degeneration inBA101[J]. Applied Microbiology and Biotechnology, 1999, 52(2): 170-173.
[24] Lee S M, Cho M O, Park C H, et al. Continuous butanol production using suspended and immobilizeNCIMB 8052 with supplementary butyrate[J]. Energy & Fuels, 2008, 22(5): 3459-3464.
[25] Salleh M M, Tsuey L S, Ariff A B. The profile of enzymes relevant to solvent production during direct fermentation of sago starch byP262 utilizing different pH control strategies[J]. Biotechnology and Bioprocess Engineering, 2008, 13(1): 33-39.
[26] 谭秀花. 丁醇高产菌的选育及小麦淀粉废水与木薯发酵生产丁醇的研究[D]. 无锡: 江南大学, 2010.
[27] Hüsemann M H, Papoutsakis E T. Effects of propionate and acetate additions on solvent production in batch cultures of[J]. Applied and Environmental Microbiology, 1990, 56(5): 1497-1500.
[28] Holt R A, Stephens G M, Morris J G. Production of solvents bycultures maintained at neutral pH[J]. Applied and Environmental Microbiology, 1984, 48(6): 1166-1170.
[29] Quershi N, Blaschek H P. Recent advances in ABE fermentation: hyper-butanol producingBA101[J]. Journal of Industrial Microbiology and Biotechnology, 2001, 27(5): 287-291.
Effects of Different Electronic Carriers on Acetone-butanol-ethanol Fermentation byART18
LUO Yi-yan, LIU Meng-yin, FANG Li-min, ZHOU Zhi-you, LIHan-guang*
(Jiangxi Key Laboratory for Conservation and Utilization of Fungal Resources/Jiangxi Engineering Laboratory for the Development and Utilization of Agricultural Microbial Resources, College of Bioscience and Bioengineering, Jiangxi Agricultural University, Nanchang 330045, China)
In order to improve the acetone-butanol-ethanol (ABE) fermentation performance, the effects of different concentrations of electronic carriers, such as odium butyrate, sodium acetate, neutral red, and the combination of neutral red and weak acid salts, on butanol production from fermented cassava powder by theART18 were investigated. The results showed that sodium butyrate, sodium acetate and neutral red could increase butanol production, of which, relatively speaking, neutral red contributed significantly to the synthesis of butanol; when the addition of neutral red was 3.0 g/L, the butanol production reached (11.3±0.23) g/L, which was 51.7% higher than that of the control group; when 3.0 g/L neutral red and 3.0 g/L sodium butyrate were added in combination, the butanol and total solvent production were further increased, reaching (12.2±0.25) g/L and (17.4±0.18) g/L, respectively, and the butanol production and the total solvent production were 64.9% and 33.8% higher than that of the control. Meanwhile, the yield of butanol increased by 32.6% and 8.0%, higher than that of the addition of sodium butyrate and neutral red alone, respectively. It was showed that the combination of neutral red and weak acid salt could promote the fermentation of butanol.
butanol;ART18; electronic carrier
TQ 223.12+4
A
2095-3704(2020)01-0085-05
2019-12-15
国家自然科学基金(21466014)、江西省教育厅科学研究(GJJ160388)、江西农业大学学生创新创业计划(201810410015)和江西农业大学博士启动基金(9232305387)
罗壹艳(2000—),本科生,主要从事生物技术研究,1985992996@qq.com;*通信作者:李汉广,副教授,博士,hanguangli@jxau.edu.cn。
罗壹艳, 刘孟荧, 方利敏, 等. 不同电子载体对丙酮丁醇发酵的影响研究[J]. 生物灾害科学, 2020, 43(1): 85-89.
10.3969/j.issn.2095-3704.2020.01.17

