Gasdermin 蛋白家族与细胞焦亡研究进展
史客松, 马臣杰, 马玲玲, 曾 瑾
( 1. 宁夏大学 西部特色生物资源保护与利用教育部重点实验室, 银川 750021;2. 宁夏大学 生命科学学院, 银川 750021)
细胞死亡是指生物细胞永久的中止执行生理功能的状态。细胞可能自发地出现个体程序性死亡,也可能由于疾病或创伤造成不可逆的损伤而死亡。而细胞死亡的方式一直是生命科学研究中的热点,细胞在受到各种外界的刺激或在生理的自然状态下,可以通过启动不同的死亡途径而进入死亡程序,进而产生不同的形态和生理结果。特别是在受到病原体感染时,宿主细胞会启动死亡机制,以响应微生物的感染。多细胞生物最本质的免疫防御机制之一是牺牲受感染的细胞以使剩余细胞受益[1];而另一方面,细胞死亡也可以使病原体受益,许多病原体的存活和扩散策略是诱导受感染宿主细胞死亡,细菌即可从宿主细胞逃逸,并扩散至邻近细胞。特别是能够在宿主细胞内侵入和繁殖的病原体,会通过多种机制来操纵宿主细胞的死亡和存活途径,以达到在宿主机体中的生存和繁衍的目的。
1965年,在对昆虫细胞的研究中,首次提出了细胞死亡是由一系列程序性的级联事件组成的,细胞可以在发育期间由于病原体入侵或细胞应激和代谢紊乱而启动程序性细胞死亡过程,从那时起对程序性细胞死亡的意义和机制进行了广泛的研究。细胞凋亡,坏死性凋亡和细胞焦亡是近年来被普遍接受的细胞程序性死亡途径[1]。
凋亡是程序性细胞死亡研究中第一个被广泛研究的。在大多数情况下,细胞的凋亡是由基因调控的细胞主动死亡方式,并保持免疫沉默。相反,坏死性凋亡和焦亡则是裂解细胞的被动死亡方式,并允许释放潜在的免疫刺激因子。多项证据表明,当这两种细胞死亡途径被激活时,可诱导体内炎症反应,并且由此可以造成多种炎症疾病的病理变化[2]。
1 细胞焦亡的发现
在细胞所具有的多种受感染后的死亡方式中,细胞凋亡可能是最早被定义并被广泛认可的细胞死亡程序,它在机制上是由半胱氨酸依赖性天冬氨酸特异性蛋白酶或半胱天氨酸酶-3(cysteine-aspartic proteases-3,Caspase-3)和Caspase-7执行一系列功能的。细胞中的Caspase活化后切割细胞中的PARP(poly ADP-ribose polymerase,DNA修复酶)等,导致一系列的细胞凋亡的特征,包括细胞质和核的固缩,DNA切割并维持完整的质膜,凋亡细胞的内容物被包被在膜封闭的凋亡小体中,进而被其他细胞吞噬并降解,整个过程并不伴随炎症的发生[3]。
Zychlinsky等[4]发现感染弗氏志贺杆菌的巨噬细胞的死亡并不依赖于Caspase-3,而是依赖于Caspase-1,但是他们没有对此现象作出解释。直到2001年Brennan和Cookson等发现鼠伤寒沙门氏菌感染的巨噬细胞中也出现了相似的情况,并对这种特别的程序性细胞死亡方式进行描述,提出这是一种新的死亡方式,并命名为“细胞焦亡(Pyroptosis)”[5]。Fink 等研究发现在细胞焦亡过程中,细胞质膜发生破损,内容物释放到细胞外,进而引起炎性反应,并产生脱氧核糖核酸碎片化[6]。2009年,细胞死亡命名委员会(Nomenclature Committeeon Cell Death, NCCD)根据细胞死亡的表观形态学,将其分为13种类型,其中就有细胞焦亡[7]。这对丰富和深入研究感染性疾病的致病机理和制订治疗策略具有重大的意义,而细胞焦亡(Pyroptosis)也成为最近几年细胞死亡研究领域的热点。
2 细胞焦亡的经典激活途径和非经典激活途径
细胞焦亡是由炎性小体引发的一种程序性细胞死亡方式,具有促使炎性因子加工成熟并分泌释放至细胞外的特点,是先天免疫系统对病原体产生的重要免疫反应。目前将细胞焦亡的激活途径分为两种——经典激活途径和非经典激活途径。
2.1 细胞焦亡经典激活途径
Martinon等提出当细胞受到某些病原体或毒素、RNA、DNA等免疫刺激物的影响后,可引起胞内模式识别受体(Pattern recognition receptors, PRR)的寡聚化,组装形成炎性复合体,含有Caspase-1的激活和募集结构域(Caspase recruitment domain, CARD)的炎症小体直接募集pro-Caspase-1,并使2 个相邻pro-Caspase-1发生水解,产生具有酶活性的Cleaved-Caspase-1,Cleaved-Caspase-1切割IL-1β 和IL-18 前体,并将其转化为活性形式[8];由于依赖Caspase-1的活化,细胞焦亡在发现之初的很长一段时间里被称为Caspase-1介导的单核细胞死亡。 Caspase-1属于在大多数真核生物中进化上保守的炎症Caspase家族成员,作为一种蛋白酶,最初被认为可以将白细胞介素1β(Interleukin 1β, IL-1β)和IL-18的无活性前体进行加工成熟,从而被称为IL-1β转换酶(Interleukin 1β converting enzyme, ICE);IL-1β是一种内源性热原,可刺激发热、白细胞组织迁移、多种细胞因子和趋化因子的表达; IL-18则诱导IFNγ的产生,对T细胞、巨噬细胞的激活很重要。 IL-1β和IL-18在一系列炎症和自身免疫疾病的发病机制中起着至关重要的作用。虽然这两种细胞因子并没有参与到细胞死亡过程中,但它们的产生可以解释细胞焦亡引起的炎症反应[9]。因此,可以将由炎性小体激活、Caspase-1介导的细胞焦亡称为经典细胞焦亡激活途径。
2.2 细胞焦亡非经典激活途径
Li等发现Caspase-1敲除小鼠对注射致死剂量的脂多糖(LPS)具有高度抗性[10]。有趣的是,缺乏Caspase-11的小鼠也能抵抗致命剂量的LPS注射。当致死剂量LPS注射至Caspase-11基因5-nt缺失的129型小鼠中(产生截短的Caspase-11),检测到IL-1β产生受阻。随后的研究发现,Caspase-11本身可以通过CARD与LPS中脂质A部分高亲和性结合识别LPS,进而触发Caspase-11寡聚化,并使其活化;Caspase-11也可以引发小鼠巨噬细胞死亡以应对各种革兰氏阴性菌感染。由于所引起的细胞死亡在形态上类似于Caspase-1诱导的细胞焦亡,所以这样的细胞死亡形式被称为非经典途径激活的细胞焦亡。在人类细胞中的Caspase-4和Caspase-5也具有相同的功能,并且也是通过直接与LPS结合而被激活;故由Caspase-4、Caspase-5和Caspase-11介导的细胞焦亡称为非经典细胞焦亡激活途径。Caspase-4不仅在单核细胞中表达,而且在包括上皮细胞和角质形成细胞在内的多种非单核细胞中也发挥作用[11]。
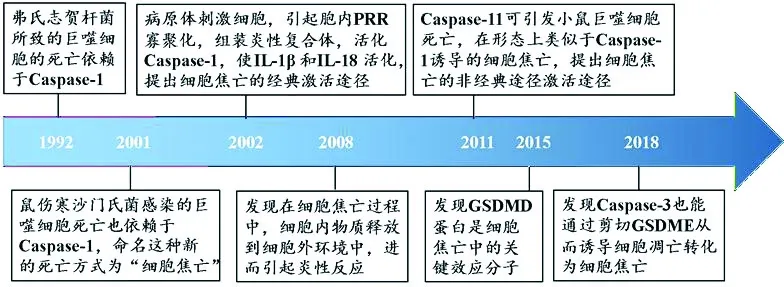
图1 细胞焦亡研究的发展历程
3 细胞焦亡的关键效应分子——Gasdermin 蛋白
3.1 Gasdermin D蛋白
Caspase-1和Caspase-11/4/5被激活后如何执行下游信号事件引发细胞焦亡?从1992年首次提出后的20多年,这个问题并没有受到太多关注。直到2015年,研究发现GSDMD(Gasdermin D, GSDMD)蛋白在细胞焦亡中扮演着关键效应蛋白的角色[7,12]。Kayagaki课题组发现具有乙基-N-亚硝基脲诱变小鼠的骨髓巨噬细胞在LPS刺激后显示IL-1β分泌受阻[13]。此外,GSDMD基因缺陷小鼠也可以免受致死剂量的脂多糖的影响。GSDMD在不同的组织和细胞类型中广泛表达,支持了细胞焦亡不限于巨噬细胞的观点[14]。近年的一些研究表明,细胞焦亡产生的主要效应分子IL-1β似乎在介导肠道炎症中发挥着主导作用,然而肠上皮细胞(Intestinal epithelia cell,IEC)本身不产生显著水平IL-1β,尽管在其他部位复层上皮则显示可以在感染激活NLRP3后,产生相当量的IL-1β;在肠道中,似乎固有层吞噬细胞构成肠道炎症IL-1β的主要来源[15]。
GSDMD名称来自于同源小鼠基因,该基因被发现在胃肠组织和皮肤中大量表达;GSDMD在哺乳动物中高度保守,含有约480个氨基酸,分为两个结构域,C-末端抑制结构域(RD)和N-末端效应结构域(PFD),它们通过中间的长环相连接。Shi等研究发现仅仅GSDMD的Gasdermin -N结构域在哺乳动物细胞中的表达即可在细胞膜表面形成小孔,释放出IL-1β,诱导细胞焦亡的发生[9];由于Gasdermin -C结构域对Gasdermin -N的抑制性结合,使得全长的GSDMD无活性。重组Gasdermin -N也显示出对4,5-二磷酸磷脂酰肌醇和心磷脂强烈的特异性结合[9]。有研究表明Gasdermin -N结构域对细菌也具有极高的毒性,鉴于4,5-二磷酸磷脂酰肌醇和心磷脂分别存在于哺乳动物细胞质膜和细菌内膜中,因此提出了一个假设,即Gasdermin -N结构域可以直接靶向与动物细胞和细菌的质膜结合并使其裂解[3]。至此,研究者勾画出细胞焦亡的更详细的过程,具体如图2所示:当细菌、病毒和毒素等感染细胞时,细胞通过一定途径促使炎症小体形成,激活依赖Caspase-1 的细胞焦亡经典信号通路或依赖Caspase-4/5/11的细胞焦亡非经典信号通路,活化后的Caspase-1或Caspase-11/4/5剪切Gasdermin D,将Gasdermin D 的C-末端抑制结构域(RD)和N-末端效应结构域(PFD)分开。而PFD可在细胞膜上寡聚化,即形成原聚体(聚合度更完整的蛋白质组装单元),约16个原聚体可在细胞膜上组成对称且规则的孔道,孔道的内径大多为10~16 nm,所以细胞中直径小于这个孔的内容物,如IL-18和IL-1β等因子就可以通过这个GSDMD孔道释放出去,而直径为25~30 nm的核糖体和较大的细胞器则不会通过这样的孔道泄漏出细胞。质膜上GSDMD孔道的形成破坏了细胞内外的渗透压,最终导致细胞膨胀溶解。而正是由于GSDMD的成孔作用,使细胞焦亡在细胞形态上出现质膜的破裂,从而与细胞凋亡和细胞坏死性凋亡有所区别[17]。Sarhan等将耶尔森氏菌毒力因子(YopJ)和一种转化生长因子激酶1(TAK1)抑制剂作用于小鼠巨噬细胞,发现两者均抑制了TAK1,并激活了Caspase-8,激活的Caspase-8剪切GSDMD和GSDME,从而导致细胞焦亡的发生;研究中还发现GSDMD的缺少可能延迟了质膜的破裂,从而使细胞死亡形态由焦亡回到凋亡[18]。
由此可见,Gasdermin 蛋白对于细胞焦亡发生的重要性不言而喻,所以细胞焦亡也可以理解为一种由Gasdermin 介导的程序性细胞死亡。此外,活化的GSDMD可在细菌膜上形成孔以杀死细菌,但仍需要进一步的体内功能证据来支持细菌膜上GSDMD孔的形成,进而确定GSDMD蛋白如何通过细胞壁进入细菌内膜并发挥作用。
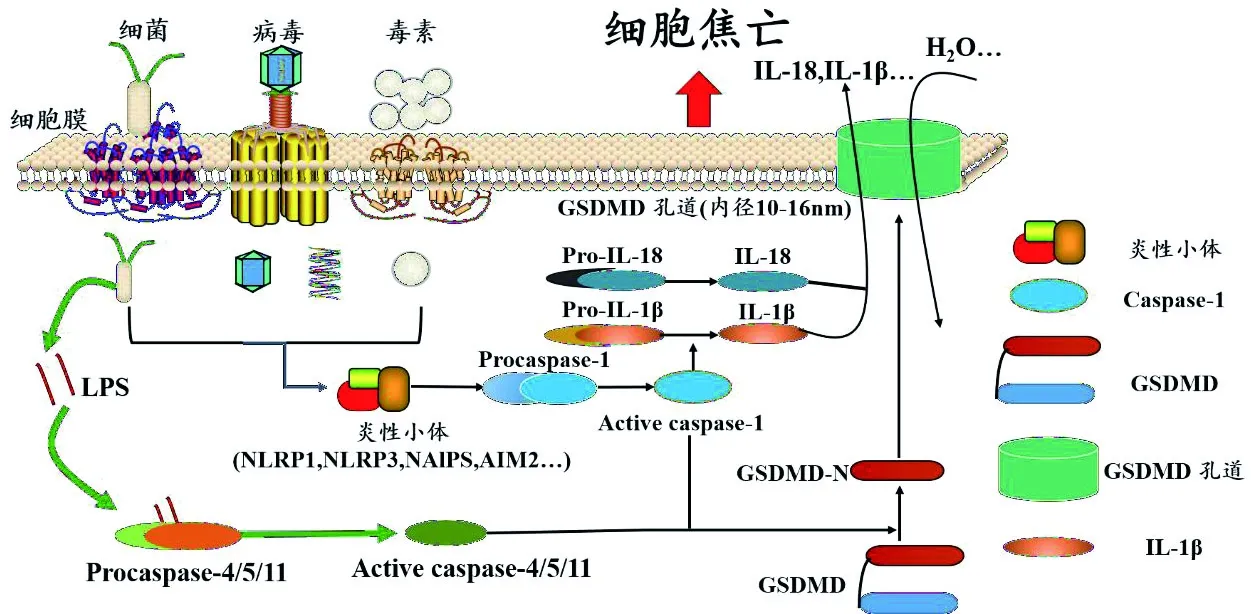
图2 细胞焦亡的Caspase-1依赖的经典和 Caspase-4/5/11依赖的非经典诱导激活机制Figure 2 Canonical Caspase-1-dependent and non-canonical Caspase-4/5/11-mediated pyroptosis pathways
研究表明当志贺毒素作用THP-1细胞时,除了Caspase-4被活化剪切Gasdermin D蛋白,导致细胞焦亡,剪切的Gasdermin D蛋白所形成的Gasdermin D的N端还可以导致线粒体活性氧(ROS)的增加,促成NLRP3炎性小体的组装,进而导致pro-IL-1β的剪切,说明NLRP3可能还参与到细胞焦亡的非经典诱导途径中[19]。所以NLRP3有可能是细胞焦亡经典诱导途径和非经典诱导途径的中间连接点。但是NLRP3炎性小体的具体激活机制尚不清晰,恰巧的是有研究发现不同的NLRP3刺激物可导致反式高尔基体网络(TGN)的解体,分解后的TGN(dTGN)具有带负电荷的磷酸脂酰肌醇-4-磷酸,而NLRP3可通过其自身保守的多碱性区域与dTGN上带负电荷的磷脂酰肌醇-4-磷酸(PtdIns4P)发生键合,使NLRP3招募到dTGN中;此时dTGN充当NLRP3的支架,募集细胞凋亡相关斑点样蛋白(Apoptosis-associated speck-like protein containing a CARD, ASC),以此激活Caspase-1,从而激活经典性细胞焦亡[20]。
3.2 Gasdermin 蛋白家族
Gasdermin (GSDM)家族由Gasdermin A(GSDMA)、Gasdermin B(GSDMB)、Gasdermin C(GSDMC)、Gasdermin D(GSDMD)、Gasdermin E(GSDME)和Pejvakin(PJVK)组成[21]。除PJVK外,所有GSDMs都由保守的两个结构域组成:C-末端抑制结构域(RD)和N-末端效应结构域(PFD),其中N-末端结构域具有细胞毒性,而全长结构则不具有细胞毒性,这表明GSDMs蛋白家族的C-末端(GSDMs-C)具有自身抑制和保护作用,而正由于C末端的存在,GSDM蛋白在未被裂解的情况下不会导致细胞死亡。而RD一旦被水解去除,其PFD便可与脂质组分结合,在细胞膜上形成孔洞[11]。目前研究发现除PJVK外,几乎所有GSDMs的N端结构域都具有在质膜上形成孔道的能力;GSDMs中只有GSDMD诱导细胞焦亡的机制比较明确。人类基因组可编码单个GSDMA,而小鼠基因组可编码GSDMA1、GSDMA2和GSDMA3。小鼠不携带GSDMB的基因。人类有一个编码GSDMC基因的单拷贝,而小鼠基因组中则有4个拷贝;人和小鼠中都有可编码GSDMD、GSDME和PJVK的基因,其中小鼠中GSDMD、GSDME和PJVK各有一个同源物。研究发现GSDMA、GSDMB、GSDMC和GSDMD在食道和胃中都有所表达,GSDMA和GSDMC在皮肤中有所表达,而GSDMB、GSDMC和GSDMD都能在肠道中表达,PJVK在内耳的毛细胞和听觉系统的其他细胞中有所表达[22]。目前研究发现GSDMD可由Caspase-1/4,5/11激活,GSDME可由Caspase-3激活,GSDMB可被Caspase-3, Caspase-6, Caspase-7切割,其切割方式类似于GSDMD,而GSDMA、 GSDMC和PJVK还不清楚由哪些炎性Caspase家族蛋白激活,激活后的Gasdermin 蛋白的N端会在与质膜中的脂质结合并形成大的由16个原聚体组成的GSDM孔道,导致IL-1β和IL-18等炎性因子的释放和细胞死亡(图3)[23]。
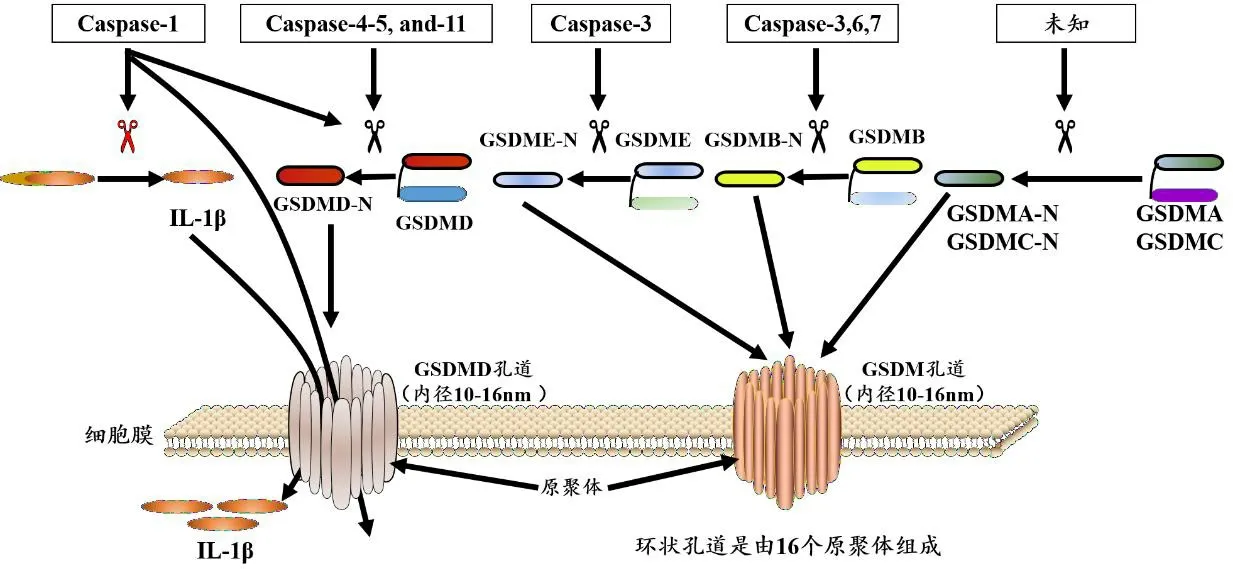
图3 Gasdermin蛋白家族成员在细胞焦亡中的作用[23]
研究发现 GSDMA3的表达可使Caspase-3表达上调,意味着GSDMA3可能诱导细胞凋亡。在人胚胎肾细胞293(Human embryonic kidney cells 293)细胞中,以及携带相同突变的小鼠GSDMA3中还可以通过自噬诱导细胞死亡,与此同时GSDMA3也可能在细胞焦亡中发挥一定的作用,但是尚未鉴定出切割人或小鼠的GSDMA蛋白酶,同时GSDMA3在质膜上成孔的机制尚不清楚[24]。
GSDMB 与质膜结合的偏好不同于其他GSDM。全长的GSDMB和N末端结构域都可以与4,5-二磷酸磷脂酰肌醇和糖脂硫苷脂结合。GSDMB与人类免疫疾病有关,但详细的分子机制尚未清楚。最近有研究发现,GSDMB 通过直接结合Caspase-4的CARD结构域促进Caspase-4活性,此研究可能会发现一种新型的GSDMB 介导的非经典诱导途径细胞焦亡的调节机制,并提出了治疗炎性疾病的潜在新策略[25]。此外,子宫颈癌和乳腺癌患者的GSDMB表达量有所增加,也暗示GSDMB可能和这些疾病有关。
关于GSDMC的功能知之甚少,研究发现GSDMC在正常上皮细胞中不表达,但 GSDMC在恶性黑色素瘤中表达增加,而又在食管癌和胃癌中受到抑制;但是目前还没有研究发现Gasdermin C在人和小鼠疾病中发挥作用[22]。
目前,在GSDM蛋白家族中,GSDMD诱导细胞焦亡的机制较为清楚,但是对于GSDMD在引发细胞焦亡的过程中,如何识别炎性相关的Caspase的分子机制还不是非常清楚。Rühl等人发现在GSDMD活化后,质膜重塑机制中的内体分选复合物Ⅲ会被募集到质膜,对GSDMD-N端的穿孔作用进行调整,在一定程度上会使IL-1β的分泌下调。此研究对细胞焦亡期间的细胞存活机制具有十分重要的意义[26]。
GSDMD与很多疾病有关,其中GSDMD还可以引起脓毒症。新的研究表明,GSDMD还可以促进中性粒细胞胞外陷阱的形成,这可能为治疗炎性疾病开辟新的治疗途径[27]。有趣的是,剪切后GSDMD除了会导致受感染的宿主细胞发生焦亡,同时还能杀死宿主细胞外面的细菌。这些研究都丰富了人们对GSDM家族蛋白的认识[28]。
人类GSDME在结直肠癌细胞系和原发性结直肠癌组织中被甲基化,说明GSDME可能是肿瘤抑制因子,并通过在癌细胞中诱导程序性细胞死亡而起作用。也有研究表明,GSDME与耳聋有关。Lu等研究发现GSDME在各种肺癌细胞系中都有表达,而在肺癌细胞中也发现有细胞焦亡和细胞凋亡的发生,证明了GSDME与细胞焦亡和细胞凋亡都有密切的联系,而且可能在特定的情况下发生相互转换[29]。同时,Wang等研究发现Caspase-3功能的丧失并没有阻止由Caspase-7激活引起的细胞凋亡,还发现Caspase-3也能通过剪切GSDME诱导细胞凋亡,首次揭示了GSDME将化疗药物诱导的胃癌细胞中Caspase-3依赖性细胞凋亡转化为细胞焦亡[30]。这样证明了GSDME和癌细胞之间关系密切,也表明由GSDME诱导的细胞焦亡机制可能为抗肿瘤治疗提供新的研究方向。
PJVK(也称为DFNB59)是一种与人和小鼠听力损伤相关的蛋白质。人类PJVK 在毛细胞、中枢神经系统、神经节、内耳和神经元的细胞中都有表达[31]; PJVK定位在过氧化物酶体膜上,是HepG2细胞中氧化应激诱导的过氧化物酶体增殖所必需的。而缺乏PJVK的耳蜗中的细胞会导致过氧化物酶体功能障碍和抗氧化防御能力受损。有研究表明Pejvakin基因的突变导致常染色体隐性听力损失,也证明PJVK和听力损伤有关。目前有研究证明了毛细胞中PJVK的丢失,会导致严重的听力损失,而神经元中的PJVK基因的丢失不会导致这种情况,这说明PJVK基因在其他器官细胞中和毛细胞中的作用机制不同[31]。而PJVK所引起的听力相关的这些生理现象是否与细胞焦亡有关,目前还未见报道。但是PJVK对于人工耳蜗的研究会有很大的帮助,同时对治疗听力损失可能是一个新的研究靶点。
4 展望
由于在正常生理条件下,GSDMs蛋白的N-端成孔结构域被C-末端结构域所抑制,只有被炎性Caspase切割活化后才会发挥作用,而完整的GSDMs对细胞维持正常的生理活动没有影响,因此,科学家推测GSDMs蛋白作为多种疾病,特别是炎性疾病的治疗靶点更为安全有效。也有一些科学家则关注GSDMs蛋白所引起的细胞焦亡可能对侵入机体中的病原体具有杀伤作用,而将GSDMs蛋白作为治疗感染性疾病的切入点;随着近年来对GSDMs蛋白家族各蛋白的深入研究,发现由其介导的细胞焦亡与多种疾病 (如肿瘤、耳聋、脱发、炎症性肠病以及哮喘等) 有密切联系。最近的研究发现GSDMs蛋白家族在中风中也起着重要的作用,GSDMs作为中风治疗的潜在靶标具有可行性[24]。
随着细胞焦亡的机制逐渐清晰,科学家愈加认识到它在细胞炎性程序死亡机制中的重要作用。目前细胞焦亡与传染性疾病、慢性炎症以及自身免疫性疾病、神经退行性疾病、心脑血管疾病、癌症、艾滋病等都有一定的联系。因此,对于细胞焦亡机制的研究不仅有助于我们进一步了解细胞程序性死亡的多样性,而且为细胞焦亡所导致的相关疾病的治疗和药物开发提供新的研究靶标。

