药物载体用埃洛石纳米管的大鼠免疫安全性评价
黄郑隽韩文迪刘天翔王 莹林新华刘爱林翁少煌*
1.福建医科大学 药学院,福州 350122;2.福建医科大学附属第一医院 药学部,福州350005
纳米材料在缓控释药物体系和医用传感元件等方面发挥巨大作用,其潜在风险的评估也愈加受到医药界的关注。埃洛石纳米管(HNTs)是一种化学组成和结构类似于硅酸盐、内径为12~15 nm内腔小管的纳米材料[1]。这样的特殊结构使得HNTs能够以载体包埋或键合方式有效避免药物被酶所降解,从而起到控制药物定点释放、增加药物体内循环时间和提高药物疗效的作用[2]。因此,建立针对HNTs的生物安全性评价具有显著的必须性和实用性。然而,HNTs的安全性研究至今仍未受到关注,比如HNTs对免疫、循环、呼吸、神经和生殖等系统是否产生不利影响暂未见文献报道。免疫系统作为机体抵抗外来物侵入的首道屏障,由免疫器官、免疫细胞及各种细胞因子所组成,能够由不同层面共同完成机体的免疫应答。因此,针对HNTs安全性评价的匮乏,本研究首选其最可能引起的机体免疫反应,利用实验大鼠模拟口服和吸入两种摄入方式,通过对脾和胸腺两个免疫器官,以及外周血血清中重要免疫指标的检测,探讨HNTs对实验大鼠免疫系统产生的影响及作用机制,评价其免疫安全性,为HNTs的深入应用提供实验依据,也为其应用可能存在风险及防范提供有效的理论基础。
1 材料与方法
1.1 实验动物及分组
清洁级SD大鼠48只,雌雄各半,体质量180~200 g,由福建医科大学实验动物中心提供,许可证号:SCXK(闽)2012-0001。大鼠适应性喂养1周后,按体重随机分为8组,即仿口服摄入低、中、高剂量组及其空白对照组,和仿吸入摄入低、中、高剂量组及其空白对照组,每组6只。
1.2 主要药物与试剂
1.2.1 HNTs混悬液
HNTs购买自西格玛奥德里奇(上海)贸易有限公司。根据课题组前期实验结果[2]和纳米材料分散液浓度选取方式[3],结合毒理学中规定由实验动物外推至人的安全系数[4],以生理盐水作溶剂,将HNTs配制成低(0.062 5 g/m L)、中(0.125 g/m L)、高(0.5 g/m L)浓度,60 Hz超声振荡5 min,制成混悬液,于4℃保存备用。
1.2.2 ELISA检测试剂盒
谷胱甘肽(GSH),丙二醛(MDA),超氧化物歧化酶(SOD),肿瘤坏死因子-α(TNF-α),γ干扰素(IFN-γ)和白细胞介素1(IL-1)的ELISA检测试剂盒均由天津安诺瑞康生物技术有限公司提供。
1.3 方法
1.3.1 摄入
大鼠每周称体质量,按体重调整剂量。在仿口服组中,灌胃摄入作为仿口服的方式,灌胃体积10 m L/kg,空白对照组按体重给予相应剂量的生理盐水,低(0.625 g/kg)、中(1.25 g/kg)、高(5 g/kg)剂量组按体重分别给予相应剂量;在仿吸入组中,非暴露式气管滴注作为仿吸入的方式,滴注体积0.2 m L/只,空白对照组给予生理盐水,低(12.5 mg/只)、中(25 mg/只)、高(100 mg/只)剂量组分别给予相应剂量。连续8周,1次/2 d。
1.3.2 样品采集
末次摄入后24 h,对大鼠行颈动脉采血,以3 000 r/min、4℃离心15 min,收集上清液,-20℃保存备检。解剖大鼠腹腔和胸腔,取部分脾、胸腺组织称重,冰生理盐水冲洗数遍后通过组织匀浆机制备质量分数为10%的组织匀浆,以3 000 r/min、4℃离心15 min,取上清液-20℃保存备检。
1.3.3 免疫相关标志物检测
GSH、MDA和SOD的含量变化用于考察HNTs对脾脏和胸腺组织的氧化损伤作用,TNF-α、IFN-γ和IL-1用于考察HNTs对外周血血细胞因子的影响。按ELISA试剂盒说明书操作。
1.3.4 组织病理学检查
采集各组大鼠脾脏和胸腺,固定于体积分数为4%多聚甲醛浓液,不同梯度乙醇逐级脱水,石蜡包埋,切片,HE染色,行组织镜检和评估。
1.4 数据统计与处理
实验数据以()表示,用SPSS软件进行方差分析处理和q检验,P<0.05为差异具有显著性。
2 结果
2.1 HNTs仿口服组大鼠的免疫安全性评价
2.1.1 仿口服组大鼠脾脏和胸腺氧化损伤的比较与空白对照组相比,脾脏各剂量组GSH含量无显著性差异,低、中剂量组SOD 活力增高但无明显差异,高剂量组显著降低(P<0.05),低剂量组MDA含量显著性降低(P<0.05),而中剂量组显著升高(P<0.01),高剂量组无明显差异;胸腺各剂量组GSH含量均未出现变化,SOD活力随剂量的增大而显著降低(P<0.01),低、高剂量组MDA含量升高(P<0.05),而中剂量组MDA则降低(P<0.05)。见表1。
2.1.2 仿口服组大鼠外周血细胞因子含量的比较各剂量组TNF-α、IL-1含量较对照组无统计学意义,低、中剂量组IFN-γ含量与对照组相比均降低(P<0.01),而高剂量组则升高(P<0.01),见表2。
2.1.3 仿口服组大鼠脾脏和胸腺组织形态学观察
HE 染色,显微镜下观察仿口服组大鼠脾脏和胸腺组织切片,不同放大倍数下(100×,400×)显示脾脏和胸腺组织染色均匀。并且,HNTs仿口服摄入高剂量组与空白组相比,淋巴细胞的数量和形态未见明显不同,组织形态结构未见显著差异。
2.2 HNTs仿吸入组大鼠的免疫安全性评价
2.2.1 仿吸入组大鼠脾脏和胸腺氧化损伤的比较
较空白对照组而言,脾脏各剂量组GSH、SOD和低、中剂量组MDA含量均无统计学差异,但高剂量组MDA含量明显升高(P<0.05);胸腺各剂量组GSH含量均无显著性差异;低、中剂量组SOD活力显著升高(P<0.01,P<0.05),高剂量组SOD活力无明显变化,低剂量组MDA含量无统计学差异,但中、高剂量组MDA则显著性降低(P<0.05,P<0.01)。见表3。
表1 仿口服组大鼠脾脏和胸腺氧化损伤的比较(n=6,±s)
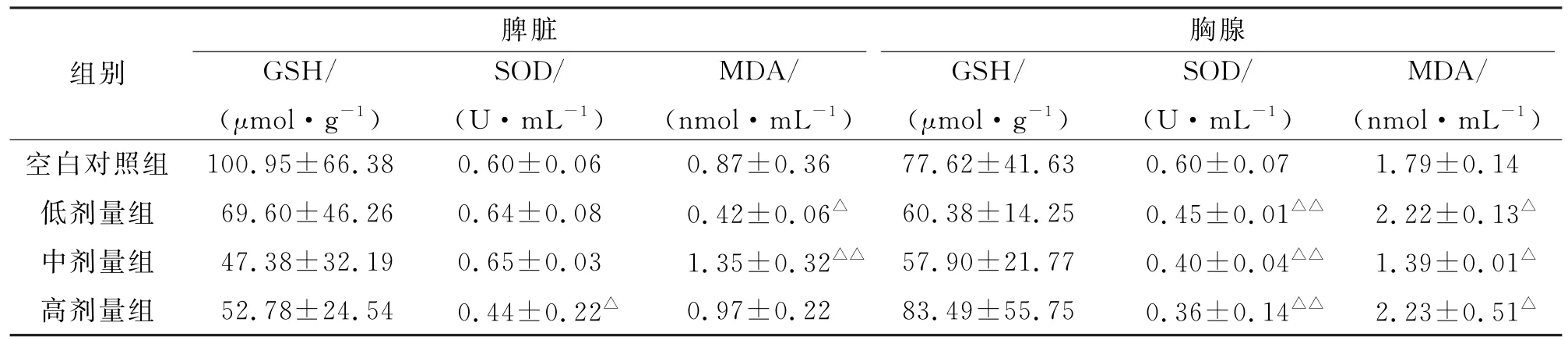
表1 仿口服组大鼠脾脏和胸腺氧化损伤的比较(n=6,±s)
与空白组比较:△P<0.05;△△P<0.01
表2 仿口服组各大鼠外周血清细胞因子含量的比较(n=6,±s)

表2 仿口服组各大鼠外周血清细胞因子含量的比较(n=6,±s)
与空白组比较:△P<0.05;△△P<0.01
表3 仿吸入组大鼠脾脏和胸腺氧化损伤的比较(n=6,±s)

表3 仿吸入组大鼠脾脏和胸腺氧化损伤的比较(n=6,±s)
与空白组比较:△P<0.05;△△P<0.01
表4 各大鼠外周血清细胞因子含量的比较(n=6,±s)

表4 各大鼠外周血清细胞因子含量的比较(n=6,±s)
与空白组比较:△P<0.05;△△P<0.01
2.2.2 仿吸入组各大鼠外周血细胞因子含量比较各剂量组TNF-α含量较对照组均无显著性差异;低、中剂量IFN-γ含量与对照组相比显著性降低(P<0.05),高剂量无明显变化;低、中剂量组IL-1含量较对照组无影响,而高剂量组升高且具有统计学差异(P<0.01)。见表4。
2.2.3 仿吸入组大鼠脾脏和胸腺组织形态学考察HE 染色,显微镜下观察仿吸入组大鼠脾脏和胸腺组织切片,不同放大倍数下(100×,400×)显示脾脏和胸腺组织染色均匀。并且,HNTs仿吸入摄入高剂量组与空白组相比,淋巴细胞的数量和形态也未见明显不同,组织形态结构未见显著差异。
3 讨论
机体在正常情况下产生的氧自由基(ROS)处于氧化与抗氧化的动态平衡,而SOD和GSH 是机体和细胞内ROS清除过程中的2种关键酶。其中SOD能清除ROS,降低或阻止生物膜脂质过氧化损伤[5]。GSH作为ROS清除酶的还原性底物,能及时清除自由基对其氧化损伤并保护组织、细胞,增强免疫。MDA 是细胞发生脂质过氧化反应中的代表性产物,其含量可预示机体脂质过氧化的速率和强度,对细胞及其成分产生毒性效应[6]。本研究发现,HNTs仿口服组大鼠脾脏中剂量组和胸腺低、高剂量组MDA 含量显著升高,脾脏高剂量和胸腺各剂量组SOD活力显著降低,表明机体清除自由基的能力有所下降,处于氧化应激状态;HNTs仿吸入组大鼠脾高剂量组MDA含量显著升高,胸腺中、高剂量组MDA含量显著降低,胸腺低、中剂量组SOD显著升高,表明其未处于氧化应激状态。说明口服一定剂量的HNTs能够影响机体清除自由基的能力,同时HNTs造成的氧化损伤情况可能在免疫系统的整体调节中得到一定的平衡。而仿口服和仿吸入HNTs影响大鼠氧化损伤所表现出的差异性,应该是由于机体对仿口服和仿吸入HNTs的吸收、转运和代谢途径不同造成的。
细胞因子网络的平衡在维持机体免疫反应方面发挥着重要作用,而外周血血清中细胞因子(如IL、TNF-α)的含量反映机体整体免疫功能[7]。干扰素IFN-γ主要由活化T细胞和NK细胞产生,具有促进自身免疫和刺激TNF-α分泌的作用[8]。本研究显示,仿口服组和仿吸入组的低、中剂量HNTs均可通过抑制IFN-γ的分泌来减弱机体免疫调节功能,而高剂量的HNTs则可增强IFN-γ的分泌来增强机体的免疫调节。仿吸入高剂量组也可刺激IL-1的分泌而促使机体免疫功能增强。说明不同剂量、不同摄入途径的HNTs启动机体的免疫调控机制时,发挥作用的细胞因子并不完全一致。大鼠在HNTs的刺激下首先表现出免疫抑制,随着剂量的增加,继而表现出免疫刺激。表明HNTs对细胞免疫功能的影响可能呈双向性,当低剂量时呈抑制作用,而高剂量则表现一定的刺激作用,具体效应机制有待进一步研究。大鼠脾脏和胸腺组织切片显示,HNTs仿口服和仿吸入高剂量组与相应空白组相比均未见明显差异,说明HNTs未引起免疫器官显著的病理变化,这也验证了之前的实验结果。
综上所述,HNTs通过灌胃和非暴露式气管滴注进入大鼠体内后,可引起免疫系统部分炎性反应和氧化损伤,从而启动免疫调节机制。而细胞因子网络调节的紊乱应该是由于HNTs不同摄入途径对细胞毒性的大小和方式不同,而且不同摄入途径的HNTs对不同组织、器官的敏感程度有关。因此,本研究初步揭示了大鼠对HNTs免疫应答的表现及其机制,结果表明HNTs对机体具有较高的免疫安全性,说明剂量的科学、合理设计是HNTs进一步应用的前提要素。

