氯膦酸二钠脂质体清除肝内巨噬细胞对CCl4诱导的慢性肝损伤大鼠门脉高压的影响*
李 爽,刘金玉,武晓玉,王宏雅,刘慧萍,赵 欣,蔡大勇
门脉高压(portal hypertension, PHT)是慢性肝病常见的并发症,发病率和病死率高,缺乏特异性治疗药物[1,2]。门脉高压的病机主要是肝脏纤维组织增生和再生小结导致肝内结构重塑,使肝内门脉血流阻力增加。巨噬细胞广泛分布于全身各组织[4],在组织修复、代谢和免疫调节过程中起关键作用[5]。肝脏内巨噬细胞主要有两种,一种是肝脏固有的巨噬细胞,又称为Kupffer细胞;另一种是外周募集而来的单核细胞所衍生的巨噬细胞。有研究发现肝内巨噬细胞活化与门静脉压力升高有关[7]。因此,本实验建立门脉高压大鼠模型,经尾静脉注射氯膦酸二钠脂质体(clodronate liposomes,CL)清除肝内巨噬细胞,观察巨噬细胞对大鼠门脉高压的影响。
1 材料与方法
1.1 动物、试剂和仪器 SPF级、雄性Wistar大鼠48只,体质量为200~240 g,购于北京斯贝福生物技术有限公司【实验单位使用许可证号:SYXK(京)2013-0023,实验动物质量合格证号SCXK(京)2016-0002】,充足饮食饮水(25℃±0.2℃,12 h光照:12 h黑暗)。橄榄油(批号:20171017)、四氯化碳(carbon tetrachloride,CCl4,批号:20170326)购于北京国药集团试剂有限公司;诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS,bs-0162R)、兔抗CD163多克隆抗体(bs-2527R)购于北京博奥森生物技术有限公司;羊抗兔二抗(BA1003),即用型兔抗IgG SABC-AP 试剂盒(SA1022)、DAB显色试剂盒(AR1002)均购于武汉博士德生物工程有限公司;大鼠CD163分子ELISA检测试剂盒购于北京永泽浩嘉生物技术发展有限公司;氯膦酸二钠购于随州佳科生物有限公司,磷脂酰胆碱(批号:CL29132802)、胆固醇(批号:CC29123217)购于北京酷来搏科技有限公司。BL-420F生理机能实验系统(成都泰盟科技有限公司),SVC-2000VA单相全自动交流稳压器(华通机电有限公司),AE160型电子天平(METTLER TOLEDO公司),Multiskan MK3酶标仪[(芬兰)热电(上海)仪器有限公司],MPS/P2型石蜡包埋机(德国SLEE医疗),CUT6062型石蜡切片机(德国SLEE医疗),KF-PRO-005数字病理扫描系统(宁波江丰生物信息技术有限公司),RE-2000A型旋转蒸发仪(上海亚荣生化仪器厂),DLSB-5/20型低温冷却循环泵(上海振捷有限公司),90-5型磁力搅拌器(上海振荣科学仪器有限公司),KQ-250DE型数控超声波清洗器(昆山市超声仪器有限公司),HC-3618R型低温高速离心机(安徽中科中佳科学仪器有限公司)。
1.2 脂质体制备 参照文献制作CL和磷酸盐缓冲液脂质体(phosphate buffered solution liposomes, PL)[8],准备磷脂酰胆碱氯仿(100 mg/ml)和胆固醇氯仿溶液(10 mg/ml),磷脂酰胆碱氯仿溶液-20℃避光保存。取5.4 ml磷脂酰胆碱氯仿溶液和5.0 ml胆固醇氯仿溶液于1000 ml圆底烧瓶,40℃低真空旋转蒸馏除去氯仿,在圆底烧瓶内壁形成均匀的乳白色磷脂薄膜。将磷脂薄膜分散在25 ml PBS中(制备PL,30 min)或0.7 M氯膦酸二钠(制备CL,15 min)。室温100 r/m离心。将乳白色混悬液室温放置2 h,在水浴声波震荡器中震荡25 min,室温下保存2 h,使脂质体膨胀。在22 000g,10℃离心60 min除去未被包裹的氯膦酸二钠,使用无菌PBS清洗脂质体3次。将沉淀脂质体悬浮于PBS 10 ml中。检测得到脂质体粒径为170~190 nm,包封率为5.4%。
1.3 动物门脉高压模型的制备 随机将动物分为对照组和模型组,每组24只。在对照组,给予橄榄油3 ml·kg-1皮下注射,2次/w;在模型组,给予40% CCl4/橄榄油3 ml·kg-1皮下注射,2次/w;在d70~105,将每组动物再分为2个亚组,即巨噬细胞未清除组和清除组,分别在半数动物经尾静脉注射PL 0.3 ml·kg-1,1次/w,在另一半数动物经尾静脉注射CL 15 mg.kg-1,1次/w。在d105,处死动物前禁食12 h,称量体质量(w,g),观察各组体质量变化。将大鼠麻醉后,沿腹中线切口打开腹腔,暴露门静脉主干,分离肠系膜前静脉,结扎远离门静脉的一端,用血管夹夹住近端,沿肠系膜上静脉插入充满肝素钠的PE管至门静脉正中,固定,连接压力传感器(成都泰盟科技有限公司),使用BL-420F生理机能实验系统(成都泰盟科技有限公司)测定大鼠肝脏在体门静脉压力[9]。经腹主动脉取血,灌注并固定,取出大鼠肝脏和脾脏,称量质量(wg/p,g),按[(wg/p÷w)×100]×100%,计算每100 g体质量的脏器指数。
1.4 组织病理学检查 取大鼠左叶肝脏,常规石蜡包埋,3 μm切片,HE染色,使用数字病理扫描系统(宁波江丰生物信息技术有限公司)获取图片,观察大鼠肝脏病理学变化。在10倍物镜下,随机选择每张切片5个视野,视野下总面积为1,计数肝小叶(假小叶)个数(n),计算平均肝小叶面积比[S=1/n],平均肝小叶体积比[V=S3/2],以5个视野的平均值为统计数据。
1.5 肝功能和血清sCD163检测 使用全自动生化分析仪(美国贝克曼)测定血清丙氨酸氨基转移酶(alanine aminotransferase, ALT)和天冬氨酸氨基转移酶(aspartate amino transferase, AST);采用ELISA法检测血清sCD163水平。
1.6 肝组织蛋白检测 采用sABC法检测肝组织CD163和iNOS表达。

2 结果
2.1 各组大鼠体质量、脏器系数和门静脉压力比较 在PL和CL处理大鼠,模型组大鼠体质量均显著性轻于对照组(P<0.05),模型组肝脏和脾脏指数显著性大于对照组(P<0.05);CL处理大鼠体质量和脾脏指数显著大于PL处理组(P<0.05),肝脏指数显著小于PL处理组(P<0.05);CL处理组大鼠门静脉压力显著低于PL处理组(P<0.05,表1)。
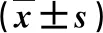
表1 各组大鼠体质量、肝脏系数、脾脏系数和门静脉压力比较
与PL组比,①P<0.05
2.2 各组大鼠肝组织病理学变化 见图1。
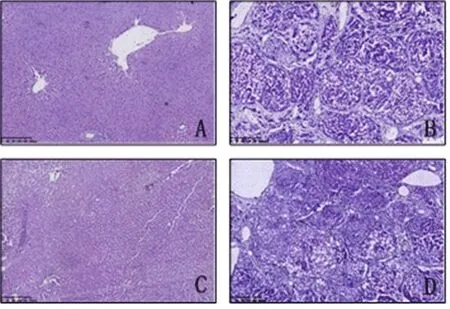
图1 各组大鼠肝组织病理学表现(HE,100×)A:PL处理对照组;B:PL处理模型组;C:CL处理对照组;D:CL处理模型组
2.3 各组大鼠血清指标比较 在PL和CL处理大鼠,模型组血清ALT和AST水平均显著性高于对照组(P<0.05),CL处理大鼠ALT和AST水平均显著低于PL处理大鼠(P<0.05);CL处理大鼠血清sCD163水平显著低于PL处理组(P<0.05,表2)。
2.4 各组大鼠肝组织蛋白表达情况 CD163阳性表达主要分布于肝小叶Kupffer 细胞和汇管区巨噬细胞;CL处理组大鼠CD163阳性表达量均较PL处理组大鼠有不同程度的减弱(图2);iNOS阳性表达在对照组大鼠主要分布于肝小叶Kupffer细胞,在模型组大鼠主要分布于汇管区巨噬细胞。CL处理组大鼠肝组织iNOS阳性表达量较PL处理组大鼠有不同程度的减弱(图3)。
表2 各组大鼠肝小叶体积比和血清指标比较
与PL组比,①P<0.05

图2 各组大鼠肝组织CD163蛋白表达情况(sABC,200×) A:PL处理对照组;B:PL处理模型组;C:CL处理对照组;D:CL处理模型组
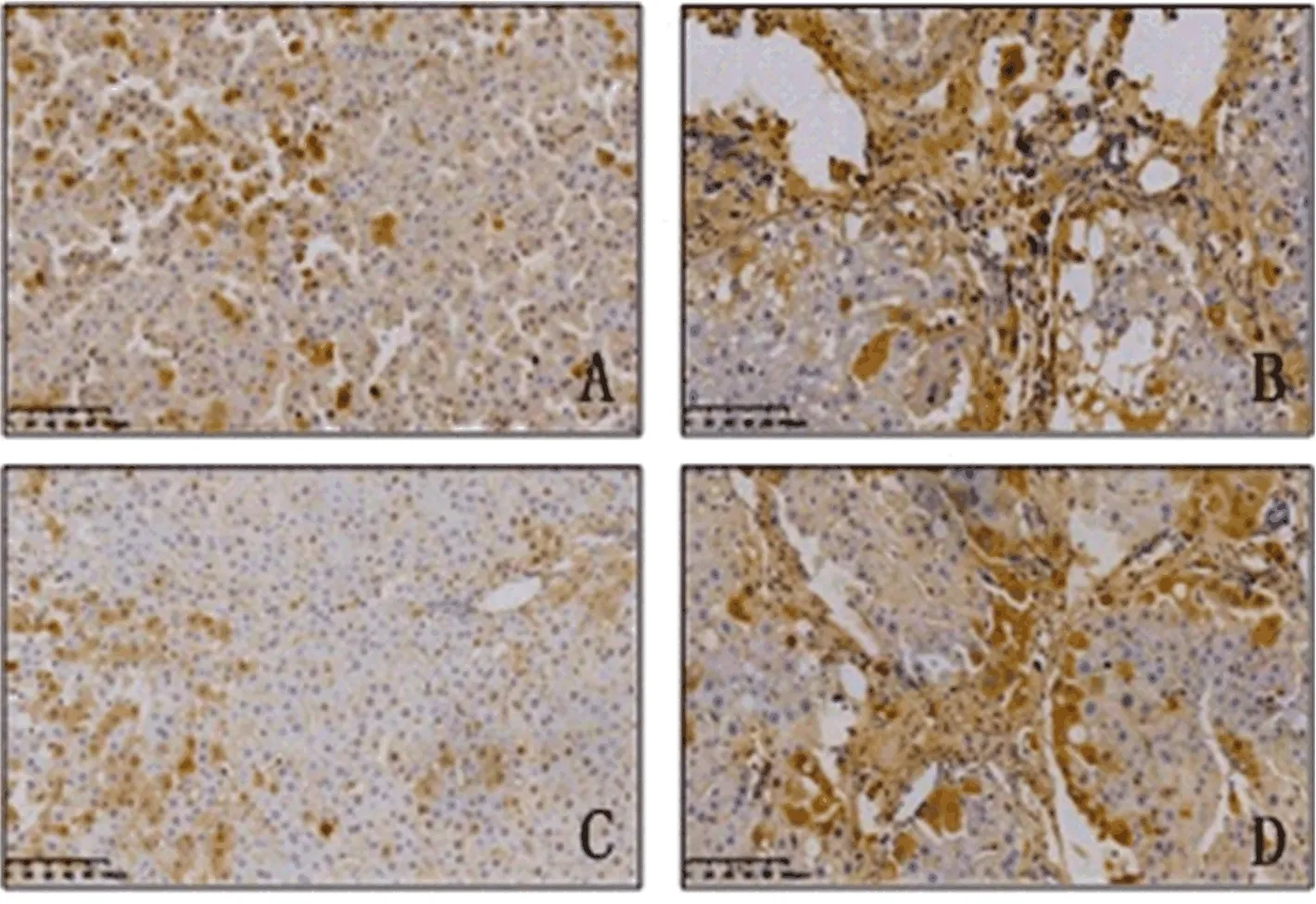
图3 各组大鼠肝组织iNOS蛋白表达情况(sABC,200×) A:PL处理对照组;B:PL处理模型组;C:CL处理对照组;D:CL处理模型组
3 讨论
肝脏正常组织结构被破坏,一氧化氮(nitric oxide, NO)等舒张物质活性降低,内皮素等收缩物质活性增高,导致门静脉压力升高。近期有研究表明,肝脏内巨噬细胞过度活化参与门脉高压进展[8-10]。氯膦酸二钠脂质体被广泛用于清除巨噬细胞,其主要作用机理为巨噬细胞将脂质体吞噬后,氯膦酸二钠释放,可诱导巨噬细胞凋亡[11-16]。本实验以CCl4诱导大鼠肝损伤复制门脉高压模型,经尾静脉注射氯膦酸二钠脂质体清除大鼠肝脏巨噬细胞,PBS空白脂质体作为对照,通过检测肝脏病变、门脉压力和CD163等指标,观察巨噬细胞对门脉高压的影响。
实验结果显示,巨噬细胞清除与未清除大鼠比,发现巨噬细胞清除组大鼠门静脉压力、肝脏病变、血清ALT、AST和sCD163水平均比巨噬细胞未清除组有显著降低和改善。
CD163又称血红蛋白清道夫受体,是富含半胱氨酸的清道夫受体超家族中一员,其表达于单核/巨噬细胞,是巨噬细胞活化的标志物。CD163在体内有两种存在方式:一种是以跨膜大分子的形式存在单核/巨噬细胞上;另一种sCD163是CD163的脱落形式,可溶于血清和多种组织液中,具有多种生物学功能[17]。在门脉高压患者,血清sCD163水平升高,在临床上作为门脉高压预后的预测分子。本实验中,与PBS脂质体模型组大鼠比较,氯膦酸二钠脂质体清除巨噬细胞后,模型大鼠在体门静脉压力降低,血清sCD163水平和免疫组化检测的CD163阳性表达均降低,以上结果提示巨噬细胞参与肝损伤大鼠门脉高压的发生和发展[18-21]。巨噬细胞活化,过表达iNOS,iNOS催化L-精氨酸生成NO,NO与超氧阴离子反应,形成过氧亚硝酸盐,使NO的生物利用度降低,导致门静收缩,压力升高,进而引起门脉高压。本实验在巨噬细胞清除大鼠,肝组织iNOS阳性表达较未清除大鼠有不同程度的减弱。

