脐带间充质干细胞联合双重血浆分子吸附治疗慢加急性肝衰竭患者临床效果初步观察
陈 曦,陈照林,董 静,宋海燕,刘 波,张骏飞,陈从新
慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)是在急性因素的作用下,由肝功能相对稳定的慢性肝病迅速发展为肝衰竭综合征,以凝血功能障碍、肝性脑病、重度黄疸为主要临床表现,致死率高[1]。双重血浆分子吸附(double plasma molecular absorption system,DPMAS)是新的非生物型人工肝治疗的组合方法。通过吸附器可在特异性地吸附胆红素和胆汁酸的同时清除血清内毒素、细胞因子和炎症因子,延缓肝衰竭的进展[2]。最新的研究发现间充质干细胞(mesenchymal stem cells,MSCs)在治疗ACLF患者方面效果显著。MSCs 是来自骨髓、脐带和外周血等,具有巨大的自我更新和多向分化潜能,其免疫原性低,可能被诱导分化为肝细胞,促进肝细胞再生[3-5]。脐带间充质干细胞(human umbilical cord-derived mesenchymal stem cells,UC-MSCs)较骨髓MSCs有易取材、数量充足等优点,成为临床上治疗ACLF患者的理想选择细胞[6]。本研究应用UC-MSC联合DPMAS治疗ACLF患者,观察了治疗的临床效果以及安全性。
1 资料与方法
1.1 临床资料 2016年1月~2019年5月解放军联勤保障部队第901医院感染病科诊治的ACLF患者45例,男性35例,女性10例;年龄为29~67(45.5±5.8)岁。诊断符合《肝衰竭诊治指南(2012年版) 》[7]的标准,其中早期22例,中期23例;乙型肝炎病毒(HBV)感染32例,HBV合并丙型肝炎病毒(HCV)感染4例,HBV合并甲型肝炎病毒(HAV)感染2例,HBV感染伴随酒精性肝炎6例,HBV感染伴药物性肝损伤1例。排除标准:妊娠期或哺乳期妇女、自身免疫性肝炎、恶性肿瘤、存在精神疾病或认知障碍。将患者分为观察组25例和对照组20例。给予所有患者护肝、退黄、抗病毒、输注白蛋白等支持治疗。在对照组,使用DPMAS治疗,在观察组,在对照组治疗的基础上,给予UC-MSC肝内移植治疗。本研究通过901医院医学伦理委员会批准,患者签署知情同意书。
1.2 DPMAS治疗 使用DPMAS治疗仪(珠海健帆生物科技有限公司),包括胆红素吸附器BS330、HA330-II型树脂血液灌流器和德国费森尤斯提供的Plasma Flux P2 dry血浆滤过器。血浆置换量为2500ml,血浆置换率为20~25 ml/min,治疗时间为3 h,在治疗过程中常规抗凝,监测血压、脉搏、心率等生命指标。
1.3 UC-MSCs的分离、培养、表型鉴定和治疗方法 治疗所需的脐带来自解放军联勤保障部队第901医院妇产科经剖宫术分娩的健康足月胎儿(产妇自愿捐赠,并签署知情同意书)。采用贴壁法分离UC-MSCs,培养。当培养至第3代时,用磷酸盐缓冲液洗2遍,调整细胞数为1×106/mL,与抗CD44、抗CD29、抗CD34、抗CD45(美国PEPROTECH公司,Cat#200-04)抗体室温反应30 min。磷酸盐缓冲液洗涤2次,与荧光标记的二抗(兔抗人IgG, LifeHolder)避光反应15 min。细胞洗涤2次,重悬于磷酸盐缓冲液,上流式细胞仪(美国贝克曼库尔特公司,CytoFLEX)检测细胞表面抗原表达,鉴定细胞表型,检测结果显示细胞CD44和CD29阳性率分别为99.1%和99.7%,而CD34和CD45均为阴性。同时行细菌、真菌培养及支原体和内毒素检测。检测合格且细胞存活率大于99.0%,制成间充质干细胞(UC-MSCs)悬液10 ml(约含4×108个UC-MSCs)。根据患者病情特点,经外周静脉18例、股动脉插管15例或超声引导下门静脉左右支穿刺12例,注入UC-MSCs悬液。
1.4 临床检测 使用日立7600自动生化仪和上海长征医学科技有限公司提供的试剂检测血生化指标;使用贝克曼库尔特ACL200全自动凝血分析仪和南京碧云天生物检测公司提供的试剂检测凝血酶原时间(PT),计算终末期肝病模型评分(MELD)[8];使用BD公司FACScaliber流式细胞仪检测外周血CD3+T细胞、CD3+CD4+T细胞和CD3+CD8+T细胞百分比;采用ELISA法检测血清白细胞介素6(IL-6)、IL-10和肿瘤坏死因子α (TNF-α)水平。

2 结果
2.1 两组血生化指标和MELD评分变化的比较 在治疗8周末,观察组血清TBIL和MELD评分显著低于对照组,而血清ALB和PTA水平显著高于对照组,差异有统计学意义(P<0.05,表1)。
2.2 两组外周血淋巴细胞亚群比较 在治疗8周末,观察组外周血CD3+CD8+T细胞百分比显著低于,而CD3+T细胞和CD3+CD4+T细胞百分比显著高于对照组,差异有统计学意义(P<0.05,表2)。
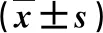
表1 两组血生化指标和MELD评分比较
与对照组比,①P<0.05
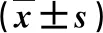
表2 两组外周血淋巴细胞亚群百分比比较
与对照组比,①P<0.05
2.3 两组血清细胞因子水平比较 在治疗8周末,观察组血清TNF-α和IL-6水平显著低于对照组,差异有统计学意义(P<0.05,表3)。
2.4 转归情况 在治疗8周末,两组并发症发生率比较无统计学差异(P>0.05,表4)。在随访观察中,对照组生存12例(60.0%)例,死亡8例(40.0%),其中4例死于肝肾综合征,2例死于上消化道出血,2例死于肝性脑病;观察组患者生存22例(88.0%,P<0.05),死亡3例(12.0%),其中2例死于肝肾综合征,1例死于上消化道出血。
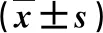
表3 两组血清细胞因子水平比较
与对照组比,①P<0.05

表4 两组并发症发生率(%)比较
3 讨论
在我们团队前期的研究中发现,通过上肢前臂浅静脉行UC-MSCs移植与通过股动脉插管行肝动脉UC-MSCs移植的疗效相差无几[9-11],但更方便。因此,本研究在进行UC-MSCs移植时,根据患者身体状况合理选择移植途径。在治疗期间,观察组和对照组均未发生严重的不良反应和并发症,表明UC-MSCs联合DPMAS治疗ACLF患者很安全。国内外研究显示MSCs可通过多种途径发挥治疗肝衰竭的作用。体外细胞实验研究和体内临床研究均表明MSCs能分化为肝细胞以改善肝功能,亦有研究显示MSCs进入外周血后,可通过血液循环抵达受损的肝组织处,进入肝小叶,或在信号分子的引导下定向迁移至受损伤的肝组织,发挥后续修复肝细胞和促进肝细胞再生的作用[12-15]。同时,MSCs旁分泌机制在抗肝纤维化和肝组织修复过程中发挥积极的作用[16]。
有研究显示CD8+T细胞和NK细胞参与的炎症反应可损伤肝细胞,导致肝细胞坏死[17]。MSCs不仅能分化为肝样细胞,改善肝功能,而且可在免疫调节和炎症反应方面发挥重要作用。本研究观察了两组患者治疗前后外周血CD3+T和CD8+T淋巴亚群以及血清IL-6、IL-10和TNF-α等炎症因子的变化。在小鼠实验发现,经过MSCs注射后的小鼠其外周血CD4+和CD8+T细胞显著降低[18]。本研究发现经过MSCs治疗后,观察组患者CD3+CD8+T细胞低于对照组,差异有统计学意义,表明MSCs治疗后可改善患者的免疫功能紊乱。
我们团队在为期8周的随访研究过程中,发现两组患者各种并发症发生率无统计学差异,说明干细胞移植是安全的,而观察组生存率显著高于对照组,差异有统计学意义,提示UC-MSC联合DPMAS治疗ACLF患者能提高短期生存率,值得进一步研究[19]。

