酸汤中乳酸菌的鉴定及其耐酸、耐胆盐和抗氧化活性
王祎然,韦明明,张 涵,周天瑞,姜 梅
(南京农业大学食品科技学院,江苏南京 210095)
酸汤是我国贵州地区的一种传统发酵调味品,也是贵州黔东南最具影响力的支柱产业。酸汤品种可根据原料(米酸汤、鱼酸汤、毛辣角酸汤等)、地域、色泽、风味等来划分。著名的凯里市红酸汤就是以野生毛辣果(番茄)、鲜红辣椒、木姜子、糯米、大蒜等为原料,经清洗、破碎、加水、加盐、入坛发酵而制成[1]。发酵后的酸汤富含多种有机酸(乳酸、乙酸、柠檬酸等)、矿物质(钙、磷、铁等)、氨基酸和维生素,具有散寒消胀、止泻抑菌、延缓细胞衰老的功效[2]。酸汤发酵的主要功能菌为乳酸菌,其发酵产生的鲜味氨基酸和醇、醛、酸等物质,赋予酸汤醇香清爽的独特风味[3-4]。乳酸菌还能提高酸汤中番茄红素和酚类等天然抗氧化物的含量,通过糖苷水解酶提高其抗氧化活性及消化率,在人体内发挥整肠[5]、抑菌[6]、抗肿瘤[7]、抗氧化[8-10]等保健功效。研究表明,乳酸菌功能性食品的功效作用与其能否适应胃肠转运过程中低pH和高胆盐浓度的环境密切相关[5]。
目前我国对贵州酸汤的研究不多,仅局限于对其营养成分[1-3]、发酵工艺[11]和微生物区系[3]的探讨,对酸汤源乳酸菌的研究较少。国内外学者对其他发酵蔬菜中乳酸菌的益生特性进行了研究。龚加路等[12]对四川泡菜中1株高产酸的戊糖乳杆菌进行了人工肠液、胃液和胆盐耐受试验。Khan等[13]研究了韩国泡菜中1株植物乳杆菌的抑菌活性及机理,并测定其耐酸、耐胆盐特性。近年来,具有良好胃肠道耐受性的乳酸菌发挥抗氧化活性的能力引起了学者的关注。Pourramezan等[14]对21株乳品源乳杆菌进行耐酸、耐胆盐试验,并以清除活性氧和DPPH自由基的指标评估其体外抗氧化能力。Xu等[15]对我国发酵食品中的乳酸菌进行pH、胆盐和过氧化氢耐受试验,对其细胞的胆盐水解酶和抗氧化活性进行了体外评估。但对发酵蔬菜中的乳酸菌进行此类研究的学者还较少[16],对酸汤源乳酸菌同时进行耐酸、耐胆盐和抗氧化能力的研究目前还没有。
本文对酸汤中筛选出的6株产酸能力强、发酵性能优良的乳酸菌进行形态观察和生物学鉴定;对6株菌进行耐酸、耐胆盐试验,并分析其作为益生菌的潜在能力;以清除1,1-二苯基-2-苦基肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和羟基自由基为指标进行体外抗氧化研究,以期为我国益生菌资源的研究和酸汤源乳酸菌的开发利用提供理论支持。
1 材料与方法
1.1 材料与仪器
乳酸菌(共6株,分别为JMST-1、JMST-2、JMST-5、JMST-7、JMST-8、JMST-9)筛选自贵州酸汤产品的乳酸菌 南京农业大学食品科技学院微生物实验室选育并保藏;溶菌酶、蛋白酶K、细菌16S rDNA通用引物、dNTP、酵母26S rDNA的通用引物、Loading Buffer、琼脂糖、核酸染料、DNA Buffer、TaqDNA 聚合酶 分析纯,北京全式金试剂有限公司;DPPH自由基清除活性测定试剂盒 南京建成生物工程研究所;其他常规生化试剂 分析纯。
IS128 pH计 上海仪迈仪器科技有限责任公司;64RL离心机 美国Beckeman公司;DYY-2C电泳仪、电泳槽 北京市六一仪器厂;Mycycler PCR扩增仪、Dcode System梯度凝胶生成设备 美国Bio-rad公司;CDS8000凝胶成像分析系统 上海培清科技有限责任公司;722S可见分光光度计 上海菁华科技仪器有限责任公司。
1.2 实验方法
1.2.1 形态观察和生化鉴定 将6株菌以3%接种量接种于新鲜配制的 MRS 液体培养基中,于37 ℃培养 24 h,活化两次备用。取活化后的菌液于MRS培养基上划线,37 ℃ 培养24 h,观察菌落颜色、形状大小、光滑程度、边缘状况等特征;挑取单菌落进行过氧化氢酶试验和革兰氏染色,显微镜下观察菌株颜色、形状、排列方式等特征。
1.2.2 分子生物学鉴定 菌株的DNA提取采用十六烷基三甲基溴化铵(cetyl trimethyl ammonium bromide,CTAB)-溶菌酶法[17]。采用细菌16S rDNA通用引物进行扩增:正向引物27F(5′-AGA GTT TGA TCC TGG CTC AG-3′),反向引物1492R(5′-GGT TAC CTT GTT ACG ACT T-3′)。反应体系为:DNA模板1 μL、dNTP 2 μL、引物27F 1 μL、引物1492R 1 μL、10×DNA Buffer 2.5 μL、Taq DNA 聚合酶 0.1 μL、去离子水17.4 μL。扩增程序为:94 ℃预变性5 min;94 ℃变性1 min、56 ℃退火1 min、72 ℃延伸2 min,循环30次;72 ℃终延伸10 min;于4 ℃保存。用0.8%的琼脂糖凝胶电泳对PCR扩增产物进行检测,目标片段约在1500 bp左右处。将PCR 扩增产物送至生工生物工程(上海)有限公司测序,在 NCBI 网站GenBank中进行 BLAST 分析,同时在 EzBioCloud数据库选取参考菌株进行同源性比对,一般将序列相似度在99%~100%之间的菌株判定为同一个种。选取适宜的参考菌株序列,采用MEGA 6.0 软件的Neighbor-Joining 法进行1000次步长构建系统发育树。
1.2.3 益生特性试验
1.2.3.1 耐酸能力测定 用盐酸制备pH为2.5的MRS液体培养基,取100 μL活化后的菌液接种于10 mL MRS盐酸培养基中,置于37 ℃培养箱,于0、3 h进行活菌平板计数,平行试验3次。
1.2.3.2 耐胆盐能力测定 配制猪胆盐含量为0.3%的MRS液体培养基,取100 μL活化后的菌液接种于10 mL MRS胆盐培养基中,置于37 ℃培养箱,于0、3 h进行活菌平板计数,平行试验3次。
1.2.3.3 存活率计算
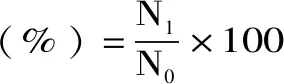
式(1)
式中:N1表示3 h测定的活菌数,lg CFU/mL;N0表示0 h测定的活菌数,lg CFU/mL。
1.2.4 抗氧化能力试验
1.2.4.1 菌悬液制备 取活化后的菌液于5000 r/min离心15 min,用磷酸缓冲液清洗重悬,重复2次。用分光光度计调整菌体浓度为108CFU/mL(A600=0.5±0.05对应菌体浓度×108CFU/mL),作为菌悬液待用。
1.2.4.2 DPPH自由基清除能力测定 测定方法参考Lin等[18],并略有改进:取2 mL菌悬液,加入2 mL(0.4 mmo1/L)DPPH自由基-无水乙醇溶液,混匀,室温下避光反应30 min,6000 r/min离心10 min,取上清液于517 nm处测定吸光度,平行试验3次。DPPH自由基清除率计算如下:
式(2)
式中:SADPPH表示样品的DPPH自由基清除率,%;As表示2 mL样品与2 mL DPPH溶液的吸光度;Ab表示2 mL样品与2 mL无水乙醇的吸光度;Ac表示2 mL纯水与2 mL DPPH溶液的吸光度。
1.2.4.3 羟基自由基清除能力测定 测定方法参考He等[19],并略有改进:配制9 mmo1/L的FeSO4溶液、9 mmo1/L的水杨酸-乙醇溶液和8.8 mmo1/L的H2O2溶液。取1 mL的菌悬液,依次混匀加入1 mL的FeSO4溶液、水杨酸-乙醇溶液、H2O2溶液,于室温下反应20 min,在510 nm处测定吸光度,平行试验3次。羟基自由基清除率计算如下:
式(3)
式中:SAhydroxyl表示样品的羟基自由基清除率,%;As表示样品与混合溶液的吸光度;Ab表示以同体积纯水代替H2O2溶液的混合体系的吸光度;Ac表示以同体积纯水代替样品的混合体系的吸光度。
1.3 数据处理
实验重复3次取平均值,实验结果以平均值±标准差表示。采用MEGA 6.0软件构建系统发育树,SPSS 22.0数据软件和Excel进行统计分析和作图,组间数据采用方差比较分析,显著水平为P<0.05。
2 结果与分析
2.1 形态观察和分子鉴定
2.1.1 形态观察 酸汤中分离出的6株菌的菌落形态见图1。6株菌菌落为白色或乳白色圆形,表面凸起、光滑有光泽,菌落边缘齐整,菌落直径在0.5~2 mm。
图1 六株分离菌的菌落形态Fig.1 Colony characteristic morphology of six strains注:a、b、c、d、e、f分别为菌株JMST-1、JMST-2、JMST-5、JMST-7、JMST-8、JMST-9;图2同。
6株菌革兰氏染色镜检结果见图2。由图2可知,菌株染色结果均为阳性,细胞形态为杆状,无芽孢,单个、成对或成簇排列。菌株的过氧化氢酶实验结果为阴性。

图2 六株分离菌的细胞显微形态(×10000)Fig.2 Microscopic cell morphology of six strains(×10000)
2.1.2 分子生物学鉴定 6株待测菌的16S rDNA片段PCR扩增产物的凝胶电泳图见图3。由图3可见,1500 bp左右处出现荧光带,且无明显拖尾现象,可知PCR扩增成功。

图3 六株分离乳酸菌PCR扩增产物电泳图Fig.3 Electrophoresis of amplified PCR from six strains注:M:1 kb DNA Marker;1~6分别为菌株JMST-1、JMST-2、JMST-5、JMST-7、JMST-8、JMST-9。
将6株菌的 DNA送检测序,结果在 NCBI 中GenBank进行 BLAST 分析,同时将此序列提交到 EzBioCloud数据库,选取参考菌株进行同源性比对,各菌株与参考菌株的同源性均达到99%以上(表1)。选取适宜的参考菌株序列,使用MEGA 6.0构建系统发育树以显示菌株间亲缘关系(图4)。

表1 6株分离乳酸菌16S rDNA 基因序列分析结果Table 1 Homologous alignment analysis results of 16S rDNA gene sequences from six isolates

图4 基于16S rDNA序列的6株分离菌的系统发育树Fig.4 Phylogenetic tree based on 16S rDNA sequences of six isolates
如图4所示,6株菌与植物乳杆菌(Lactobacillusplantarum)的菌株有较近亲缘关系,且与参考菌株LactobacillusplantarumATCC 14917(ACGZ01000098) 的同源性达到99.7%以上,说明6株菌均为植物乳杆菌(L.plantarum)。植物乳杆菌是乳酸杆菌的一种,乳酸杆菌是酸汤发酵最主要的功能菌,与醋酸杆菌、明串珠菌和酵母菌等构成酸汤特有的微生物区系[3]。在酸汤发酵后期,植物乳杆菌通常繁殖成为优势菌种,通过大量产酸缩短发酵时间,并降低酸汤中亚硝酸盐的含量,完成乳酸发酵的终止阶段[20-21]。
2.2 耐酸和耐胆盐能力测定
2.2.1 耐酸能力测定 植物乳杆菌的生长在pH小于 4.0的环境下会受到明显抑制[22],但酸汤中的乳酸菌需要耐受发酵过程中pH在3.0~4.0之间的波动[4]。人体胃液中胃酸的主要成分为盐酸,其pH通常为3.0左右,在空腹情况下可达2.5,比酸汤发酵的酸度更低[23]。因此,只有少数具有良好耐酸能力的乳酸菌可以通过胃酸屏障,以活菌形式到达胃肠道并发挥作用。由于一般食物通过胃的时间低于3 h,液体通过的时间更短,本实验用盐酸对6株植物乳杆菌的生长环境进行调节,观察其在pH2.5的环境下存活3 h的情况,结果如表2所示。
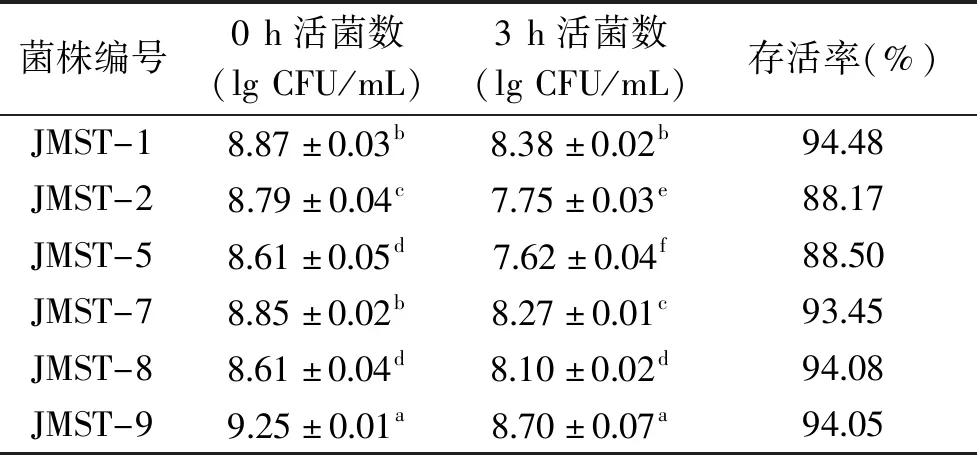
表2 乳酸菌对酸的耐受性(n=3)Table 2 Acid-tolerant of lactic acid bacteria(n=3)
如表2所示,在pH2.5条件下,3 h后6株植物乳杆菌的存活率范围在88.17%~94.48%之间,活菌数保持在107CFU/mL以上。研究显示,乳酸菌发挥益生作用的最低活菌数目为106CFU/mL[24]。本实验6株菌在pH2.5环境下3 h后活菌数高于发挥益生作用的最低值,说明6株菌均具有良好的耐酸性。Guesh等[25]自56株益生菌中筛选出4株耐受pH2.5的乳酸菌,其存活率最低为77%,最高为91%,略低于本实验中6株菌的存活率但相差不大,其他研究[26-28]也得到了类似结果。国内学者温贺等[29]自酸菜中分离的1株植物乳杆菌在pH3.0的条件下存活率为55%,可见本实验6株菌具有更强的耐酸能力,其良好的耐酸能力可能与菌体内多种生物酶参与的代谢途径有关[30],具体机理有待进一步研究。
2.2.2 耐胆盐能力测定 食物在经过胃液的消化后会进入十二指肠与具有抑菌作用的胆盐接触。胆盐能改变细胞膜的通透性,通过破坏细胞膜的完整度造成细胞死亡[31]。因此,乳酸菌对人体胃肠道中高浓度胆盐的耐受能力是衡量其潜在益生特性的重要指标。研究表明[32-33],小肠内胆盐的含量范围在 0.3%左右,一般食物通过需要1~4 h,因此本实验选取0.3% 的胆盐浓度对6株植物乳杆菌进行3 h培养,存活情况见表3。
如表3所示,在0.3% 胆盐浓度下,3 h后6株菌的存活率在87.37%~92.65%之间,活菌数均维持在107CFU/mL以上,说明6株菌具有良好的胆盐耐受性。其中JMST-1、JMST-7和JMST-9对胆盐的耐受性较高,活菌数的对数值均保持在8以上,存活率大于91%,与Sakandar等[28]对L.plantarumATCC 14917的研究结果一致。其他学者也在相同的胆盐浓度下对发酵蔬菜源乳酸菌进行了研究,胡斌等[31]对8 株植物乳杆菌培养2 h,菌株存活率在24.1%~91.1%之间,仅有2株菌的活菌数达到107CFU/mL;Azat等[34]的研究中,6株乳酸菌3 h后的活菌数下降到106CFU/mL。可以看出,本实验中6株菌对胆盐的耐受性更强,可能与6株植物乳杆菌菌体中脂肪酸的构成[31]和胆盐水解酶的数量[35]有关。

表3 乳酸菌对胆盐的耐受性(n=3)Table 3 Bile-tolerant of lactic acid bacteria(n=3)
2.3 抗氧化能力测定
2.3.1 DPPH自由基清除能力测定 DPPH自由基清除试验是目前乳酸菌的抗氧化研究中最常用的方法,一般使用分光光度计进行评估。本实验以清除DPPH自由基为指标对6株菌进行抗氧化能力测定,结果如图5所示。

图5 乳酸菌对DPPH自由基的清除能力(n=3)Fig.5 DPPH radical scavenging activity of lactic acid bacteria(n=3)
由图5可知,6株植物乳杆菌具有一定的DPPH自由基清除能力,清除率范围在23.25%~34.91%之间。 其中JMST-2、JMST-7的清除率最高,分别为32.20%和34.91%。国内学者张香美等[36]对8株乳酸菌进行了同样的测定,其结果为15%~34%;刘少敏等[37]的实验中3株菌的清除结果在5%~17%之间。相较而言,本实验中6株菌对DPPH自由基的清除能力更强。此外,一些学者的研究结果与本实验相近,例如,陆婧婧等[38]得到了2株清除结果为28%和33%的乳酸菌;Das等[39]的研究中3株菌的清除结果在25%~40%之间。针对植物乳杆菌种的相关研究中,刘少敏等[37]测得L.plantarumATCC 14917的DPPH自由基清除率为16.55%,低于本实验6株菌的清除结果;Hashemi等[40]的实验中植物乳杆菌LS5表现出49.6%的DPPH自由基清除率,Xu等[15]的研究中清除率最大值在52%左右,均高于本实验结果。可以看出,即使同一种属的植物乳杆菌对DPPH自由基的清除能力也不同,这或许由于菌株个体的抗氧化活性物质的含量和分布等存在差异。
2.3.2 羟基自由基清除能力测定 本实验对6株菌体浓度为108CFU/mL的植物乳杆菌进行了羟基自由基清除能力测定,其结果如图6所示。

图6 乳酸菌对羟基自由基的清除能力(n=3)Fig.6 Hydroxyl radical scavenging activity of lactic acid bacteria(n=3)
由图6可知,6株植物乳杆菌对羟基自由基有一定的清除能力。JMST-8对羟基自由基的清除能力最低,其余5株菌对羟基自由基的清除率在9%~16%之间,其中JMST-1、JMST-2的清除能力最好,分别为15.44%和14.67%。侯保朝等[41]从酸菜中筛选出3株益生特性良好的乳酸杆菌,在菌体浓度为109CFU/mL时测定其羟基自由基清除率小于5%,低于本实验结果。在对乳酸菌的抗氧化能力测定中,本实验6株菌的羟基自由基清除能力低于DPPH自由基清除能力,这与Das等[39]、Tang等[42]及Arasu等[43]的研究结果一致,与刘少敏等[37]和陆婧婧等[38]的研究结果不同。原因可能是不同乳酸菌中抗氧化物质存在差异,且不同物质对两种自由基的清除效果不同。有报道显示,乳酸菌对羟基自由基的清除机制可能与胞外多糖[44]以及发酵过程中产生的乳蛋白肽[45]等有关。
3 结论
从贵州酸汤中筛选出的6株发酵性能优良的乳酸菌,通过菌落形态观察和16S rDNA序列相似性分析,鉴定为植物乳杆菌(Lactobacillusplantarum)。6株植物乳杆菌的耐酸、耐胆盐能力良好,在pH2.5或0.3% 胆盐的环境下存活率高于87%,活菌数达到107CFU/mL以上。其中JMST-1、JMST-7、JMST-9的耐受能力较好,在耐酸和耐胆盐试验中存活率均在90%以上,活菌数达到108CFU/mL。体外抗氧化试验结果显示6株菌的自由基清除能力因菌株个体差异较大。当菌体浓度为108CFU/mL时,6株菌对DPPH自由基的清除率在23%~35%之间,对羟基自由基的清除率为6%~16%。比较发现,JMST-1耐低酸和高浓度胆盐的能力较好,且具有一定抗氧化能力,在耐酸和耐胆盐试验中存活率分别达到94.48%和91.09%;对DPPH和羟基自由基的清除结果分别为28.60%和15.44%。
研究结果反映了6株酸汤源植物乳杆菌的耐酸、耐胆盐和抗氧化能力,6株菌均具有良好的耐低酸和高浓度胆盐的能力,可以作为潜在的益生菌进行深入研究。其中JMST-1具有较好的耐酸、耐胆盐、清除DPPH自由基和羟基自由基的能力,可作为酸汤源乳酸菌功能性食品开发的备选菌株,其潜在的益生特性和抗氧化能力有待进一步研究。

