石榴瓤多糖提取工艺的优化及其抑制透明质酸酶活性
王占一,廖成斌,公金艳,赵春林,孙晓梅,向 兰
(1.枣庄学院食品科学与制药工程学院,山东 枣庄 277160;2.山东大学药学院,山东 济南 250012)
石榴Punica granatumL.是石榴科石榴属多年生木本植物[1],在我国栽培历史悠久,拥有丰富的资源。石榴瓤为石榴果实的内果皮,存在于石榴籽假种皮外部间隙,《全国中药炮制规范》规定石榴皮炮制方法为“除去杂质,去除残留的内瓤及种子,洗净,切块,干燥,或洗净,干燥后粉碎”[2],可见在此过程中石榴瓤通常作为废物被丢弃,造成资源浪费[3]。国内已有关于石榴皮多糖[4-6]、石榴叶多糖[7]、石榴籽多糖[8]的研究,但石榴瓤作为石榴果实结构的一部分,其所含的该成分鲜有关注。
多糖具有抗过敏[9]、调节免疫[10]、抗氧化[11]等多种生物活性,以及抑制酶活性的作用[12-13],但关于石榴瓤多糖对透明质酸酶的抑制作用尚无报道。因此,本实验采用Box-Behnken 设计优化石榴瓤多糖提取工艺,并测定它对透明质酸酶的抑制作用,以期为其开发利用提供参考依据。
1 材料
1.1 仪器 HN-CQY 低温超声波萃取仪(上海汗诺仪器有限公司);XFB-200 小型多功能粉碎机(永康市小宝电器有限公司);FA1104 电子分析天平(上海越平科学仪器有限公司);UV-2000 紫外-可见分光光度计(上海尤尼柯仪器有限公司);HH-S6 数显恒温水浴锅(常州普天仪器制造有限公司);SHZ-D(Ⅲ)循环水式真空泵(巩义市予华仪器有限责任公司);RE52CS-2 旋转蒸发仪(上海亚荣生化仪器厂);WFZ 真空冷冻干燥机(上海高致精密仪器有限公司)。
1.2 试剂与药物 石榴于2018 年10 月采自山东省枣庄市峄城区“万亩石榴园”主产区,经枣庄学院闫志佩教授鉴定为石榴科石榴属多年生木本植物石榴Punica granatumL,将新鲜样品洗干净后手工撕取瓤部分,阴干,粉碎后过60 目筛,备用。D-无水葡萄糖对照品(纯度≥98%,上海源叶生物科技有限公司);透明质酸酶(5 000 U/g)、透明质酸钾(上海联迈生物工程有限公司);Ehrlich 试剂(上海如吉生物科技发展有限公司);乙酰丙酮(西陇科学股份有限公司);DNS 显色剂(上海誉宇新材料科技有限公司);抗坏血酸(天津市河东区红岩试剂厂)。3,5-二硝基水杨酸、苯酚、浓盐酸、浓硫酸、氯仿、正丁醇等均为分析纯(国药集团化学试剂有限公司);水为蒸馏水,由枣庄学院生物学省级教学示范中心提供。
2 方法与结果
2.1 多糖提取与纯化 精密称取干燥的石榴瓤粉末10.0 g,置于500 mL 干燥锥形瓶中,加水至一定料液比,保鲜膜、橡皮筋封住瓶口后置于超声波提取器中,设定超声功率为300 W,在一定超声温度下提取一段时间后减压抽滤,滤液定容至100 mL(滤液超过100 mL 时,旋转蒸发仪将其浓缩至80 mL 左右后再定容),加入1/4 倍体积的氯仿-正丁醇混合溶剂(比例4∶1)搅拌30 min,3 000 r/min离心15 min,取上清液,重复3 次以除去蛋白质。将粗多糖溶液置于透析袋(截留分子量3 500 Da)中透析36 h 以除去小分子杂质,完毕后加入3 倍量无水乙醇,封口膜封好,静置冷藏过夜,于第2 天过滤,滤饼复溶于水,再加入3 倍量无水乙醇,重复3 次以除去色素,得到白色多糖沉淀,真空冷冻干燥,即得精多糖,称定质量。将精多糖用蒸馏水溶解并定容至50 mL,作为供试品溶液,测定得率、纯度,公式分别为得率=(样品中多糖含有量/样品质量)×100%、纯度=(样品中多糖含有量/精多糖质量)×100%。
2.2 总糖含有量测定
2.2.1 对照品溶液制备 精密称取干燥至恒重的D-无水葡萄糖对照品50 mg,蒸馏水定容至100 mL,即得(0.5 mg/mL)。
2.2.2 方法学考察
2.2.2.1 线性关系考察 采用苯酚-硫酸法[14]。将“2.2.1”项下对照品溶液依次稀释至10、20、30、40、50、60、70 μg/mL,各取1 mL,置于10 mL具塞试管中,加入0.5 mL 5%苯酚溶液,摇匀,滴加5.5 mL 浓硫酸,摇匀,室温下静置30 min,在490 nm波长处测定吸光度。以溶液质量浓度为横坐标(X),吸光度为纵坐标(A)进行回归,得方程为A=0.079 2X-0.005 5(r=0.999 5),在1.43~10 μg/mL 范围内线性关系良好。
2.2.2.2 精密度试验 精密量取“2.2.1”项下对照品溶液,按“2.2.2.1”项下方法测定6 次,测得总糖含有量RSD 为1.26%,表明仪器精密度良好。
2.2.2.3 重复性试验 精密称取干燥的石榴瓤粉末适量,按“2.1”项方法制备6 份供试品溶液,按“2.2.2.1”项下方法测定,测得总糖含有量RSD 为1.48%,表明该方法重复性良好。
2.2.2.4 稳定性试验 精密称取干燥的石榴瓤粉末适量,按“2.1”项下方法制备供试品溶液,室温下于0、2、4、8、12、16 h 按“2.2.2.1”项下方法测定,测得总糖含有量RSD 为0.85%,表明溶液在16 h 内稳定性良好。
2.2.2.5 加样回收率试验 精密称取含有量已知的干燥石榴瓤粉末适量,按“2.1”项下方法制备6 份供试品溶液,精密加入“2.2.1”项下对照品溶液0.5 mL,按“2.2.2.1”项下方法测定,测得总糖平均加样回收率为101.12%,RSD 为0.92%。
2.3 还原糖含有量测定 采用DNS 显色法[14]。精密量取“2.2.1”项下对照品溶液0.1、0.2、0.4、0.6、0.8、1.0 mL 于具塞刻度试管中,不足1.0 mL 的蒸馏水补足1.0 mL,加入3,5-二硝基水杨酸(DNS)显色剂2.0 mL,沸水浴5 min 后用自来水冷却,蒸馏水补至10 mL,于540 nm 波长处测定吸光度。以溶液质量浓度为横坐标(X),吸光度为纵坐标(A)进行回归,得方程为A=0.017 2X-0.186 2(r=0.999 3),在5~50 μg/mL范围内线性关系良好。
2.4 多糖含有量测定 按“2.2”项下方法测定总糖含有量,按“2.3”项下方法测定还原糖含有量,多糖含有量=总糖含有量-还原糖含有量。
2.5 提取工艺优化
2.5.1 单因素试验
2.5.1.1 料液比 精密称取石榴瓤粉末3.0 g,固定超声时间35 min、超声温度45 ℃,考察粉末与水比例(料液比)1∶8、1∶12、1∶16、1∶20、1∶24、1∶28 对多糖得率的影响,结果见图1。由此可知,随着提取溶剂用量增加,多糖得率呈先升后降的趋势,料液比为1∶20 时达到最大;进一步加大提取溶剂用量后,多糖得率反而略呈下降趋势,其原因是溶剂量过多会增加该成分损失。因此,确定料液比为1∶20 左右。
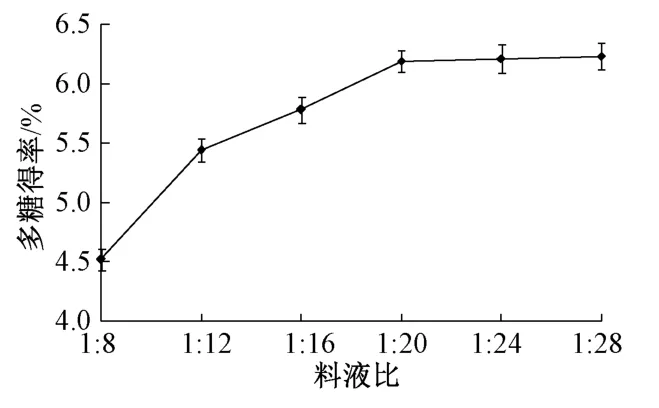
图1 料液比对多糖得率的影响Fig.1 Effect of solid-liquid ratio on polysaccharides yield
2.5.1.2 超声时间 精密称取石榴瓤粉末3.0 g,固定料液比1∶20、超声温度45 ℃,考察超声时间20、25、30、35、40、45 min 对多糖得率的影响,结果见图2。由此可知,提取20~35 min 时,多糖得率升高趋势明显;超过35 min 后,多糖得率反而略有下降,其原因是超声时间过长时该成分结构会发生改变。因此,确定超声时间为35 min左右。
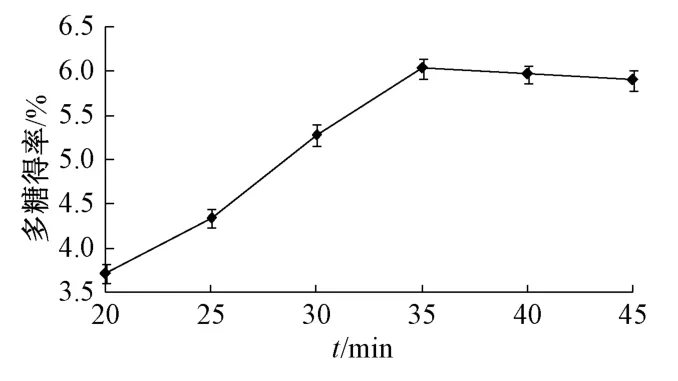
图2 超声时间对多糖得率的影响Fig.2 Effect of ultrasonic time on polysaccharides yield
2.5.1.3 超声温度 精密称取石榴瓤粉末3.0 g,固定料液比1∶20、超声时间35 min,考察超声温度25、35、45、55、65、75 ℃对多糖得率的影响,结果见图3。由此可知,在25~45 ℃下,多糖得率升高趋势明显;超过45 ℃后,多糖得率反而呈下降趋势,其原因是温度过高时该成分会氧化变质或水解损失。因此,确定超声温度为45 ℃左右。
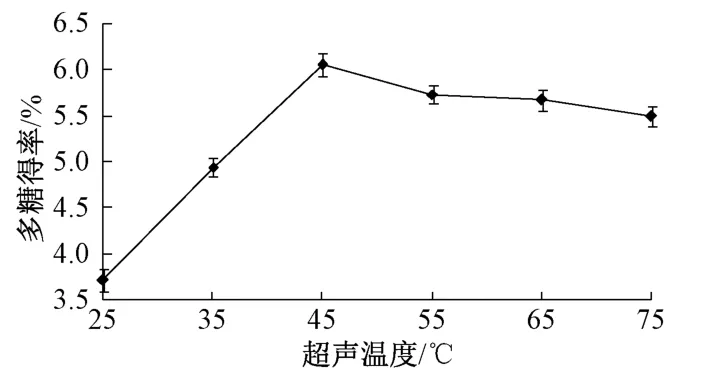
图3 超声温度对多糖得率的影响Fig.3 Effect of ultrasonic temperature on polysaccharides yield
2.5.2 Box-Behnken 设计 在单因素试验基础上,以料液比(A)、超声时间(B)、超声温度(C)为影响因素,多糖得率为评价指标(Y),应用Design-Expert 8.0.6 软件进行Box-Behnken 设计,优化提取工艺。因素水平见表1,结果见表2。
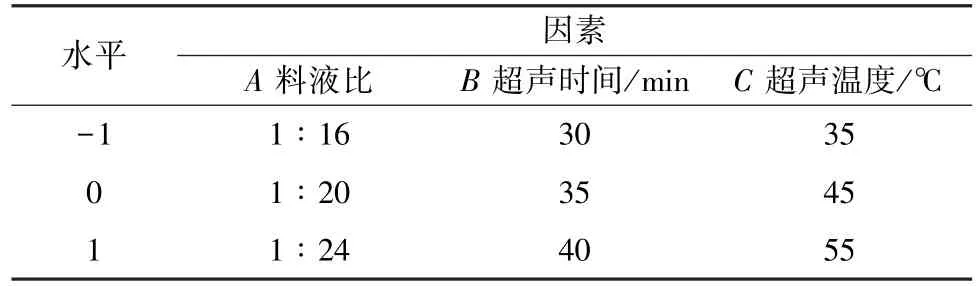
表1 因素水平Tab.1 Factors and levels
将表2 数据进行多元回归拟合,得到方程为Y=7.09+0.13A+0.090B+0.083C-0.15AB+0.28AC+0.090BC-0.18A2-0.27B2-0.37C2,方差分析见表3。由此可知,模型P<0.000 1,表明模型达到极显著水平;失拟项P>0.05,表明未知因素对实验结果影响较小;R2为98.96%,表明模型拟合程度良好,可代替真实点进行分析;各因素及其交互项、二次项均达到显著(P<0.05)或极显著(P<0.01)水平。
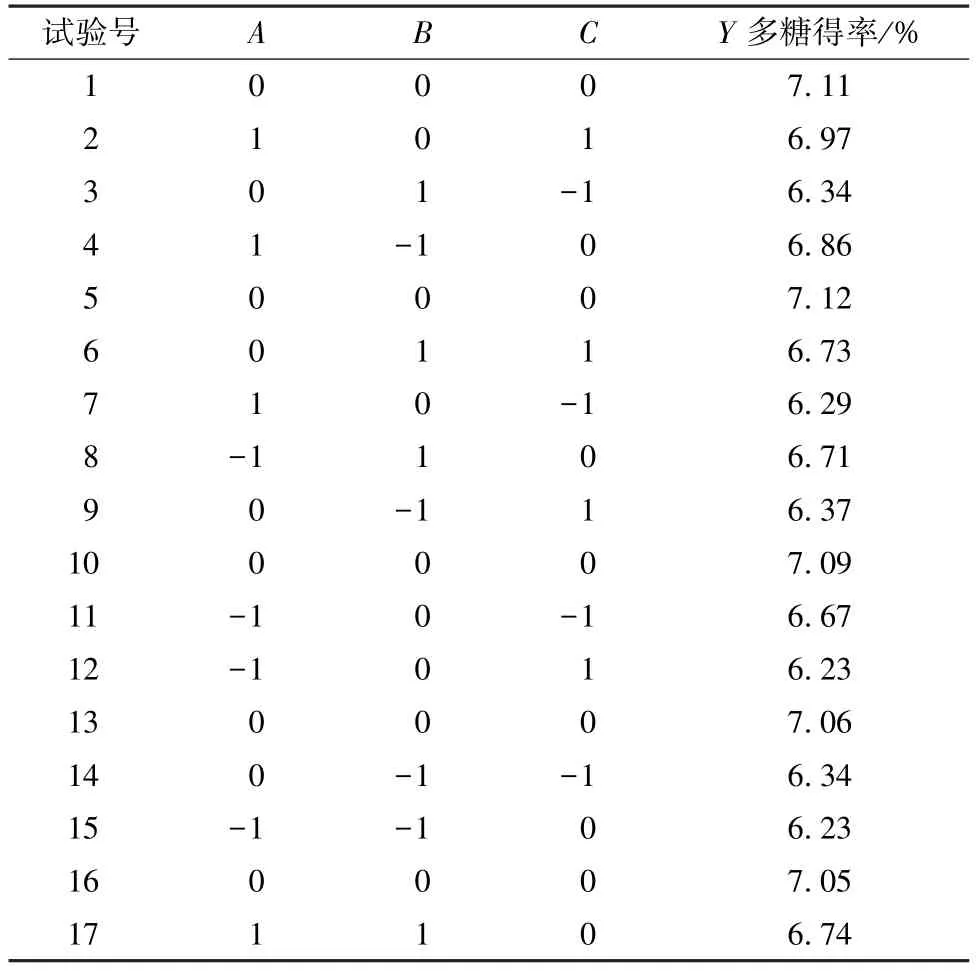
表2 试验设计与结果Tab.2 Design and results of tests
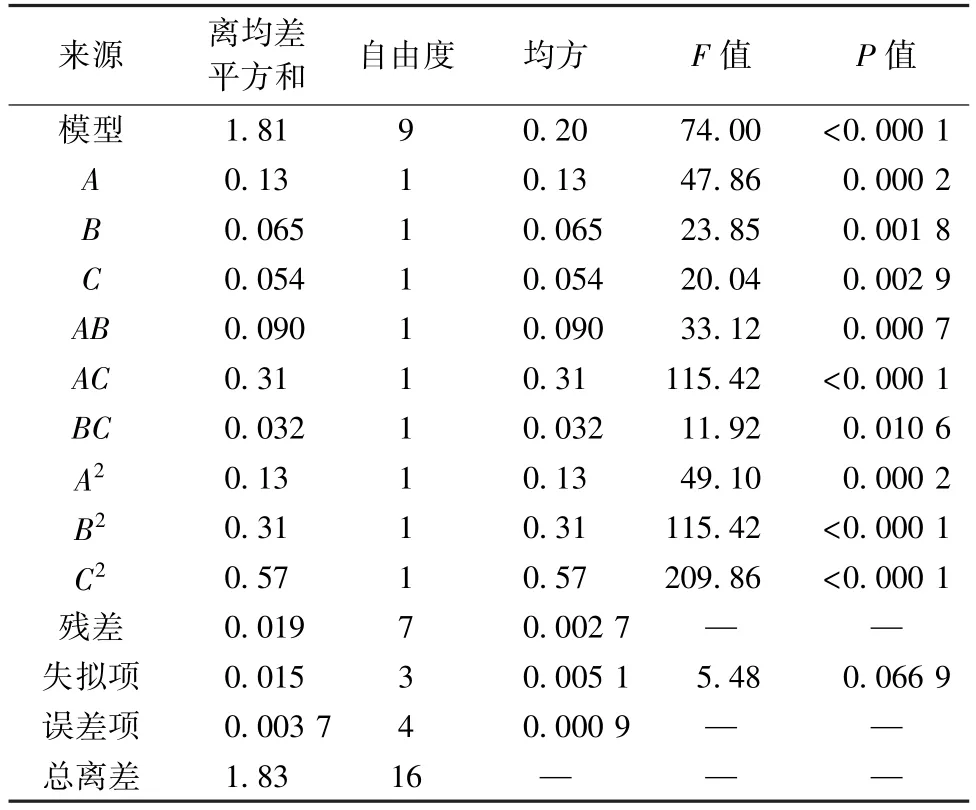
表3 方差分析Tab.3 Analysis of variance
响应面分析见图4。由此可知,固定超声温度(C)时,因素A(料液比)、B(超声时间)对多糖得率的影响均呈倒U 型变化;A对响应面坡度的改变程度大于B,表明前者影响较大。同理,其他因素影响程度为A>C、B>C。
通过Design Expert 8.0.6 软件对表3 数据进行分析,得到最优工艺为料液比1∶22.44,超声时间35.30 min,超声温度48.50 ℃,多糖得率为7.14%,考虑到实际生产条件,将其修正为料液比1∶22,超声时间35 min,超声温度48.5 ℃。在此优化工艺下进行3 批验证试验,测得多糖得率分别为7.14%、7.12%、7.13%,平均7.13%,与预测值7.14%接近,表明模型具有较好的稳定性。

图4 各因素响应面图Fig.4 Response surface plots for various factors
2.6 抑制透明质酸酶活性检测
2.6.1 抑制率测定 采用Elson-Morgan 法[15]。按“2.1”项下方法测得精多糖纯度约为75%,通过含有量换算,将其依次配制成0.1、0.2、0.4、0.8、1.2、1.6、2.0、2.4、2.8、3.2 mg/mL 溶液,各精密量取0.5 mL 至10 mL 试管中,加入0.5 mL 透明质酸酶(500 U/mL)混匀,37 ℃下水浴20 min,取出试管,加入0.1 mL CaCl2溶液(2.5 mol/L)混匀,37 ℃水浴20 min,取出试管,加入0.5 mL 透明质酸钾溶液(0.5 mg/mL)混匀,37 ℃下水浴40 min,取出试管,静置5 min,加入2 滴NaOH 溶液(5 mol/L)、0.5 mL 乙酰丙酮溶液混匀,沸水浴15 min 后冰水浴冷却5 min,取出试管,静置10 min后加入蒸馏水0.5 mL、Ehrlich 试剂0.5 mL、浓HCl 2 mL,补加无水乙醇至10 mL,振摇混匀,静置30 min后在530 nm 波长处测定吸光度,以相同质量浓度的抗坏血酸为阳性对照,计算透明质酸酶抑制率(R),公式为R=[(A0-A)/A0]×100%,其中A0为对照组吸光度(以不加样品、酶液、透明质酸钾为空白对照),A为样品组吸光度(以加样品,不加酶液、透明质酸钾为空白对照)。抑制曲线见图5。
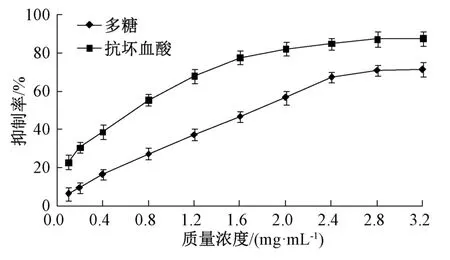
图5 多糖对透明质酸酶活性的抑制曲线Fig.5 Inhibitory curves for polysaccharides on hyaluronidase activity
由此可知,在0.1~2.4 mg/mL 质量浓度范围内多糖对透明质酸酶活性的抑制率明显增加,在2.4 mg/mL 时最大,达67.2%,但超过2.4 mg/mL后其升高程度趋缓;多糖溶液质量浓度(X)与抑制率(Y)之间呈正相关,方程为Y=26.12X+4.99(R2=0.998 2),IC50为1.723 mg/mL;抗坏血酸IC50为0.816 mg/mL,表明其作用强于多糖。
2.6.2 酶抑制动力学分析
经前期预实验得知,反应体系透明质酸酶反应初速率维持时间≥36 min。本实验固定多糖溶液质量浓度为2.4 mg/mL,底物透明质酸钾浓度为3.0 mmol/L,选择透明质酸酶活性2.5、5.0、7.5、10.0、12.5 U/mL。研究分为2 组,1 组为实验组,加入多糖;另1 组为空白对照组,不加入多糖而以空白溶液代替,测定反应初速率(V),以加入反应体系前的透明质酸酶活性为横坐标,初速率为纵坐标绘图,以确定多糖对透明质酸酶的抑制作用是否属于可逆性抑制类型[16],结果见图6。由此可知,无论加或未加抑制剂,曲线均通过原点,表明多糖对透明质酸酶的抑制作用属于可逆性抑制[17]。
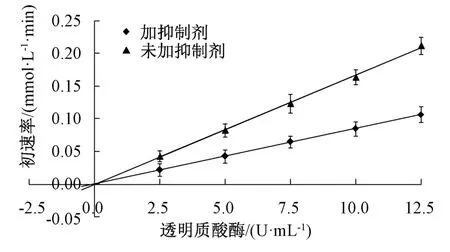
图6 透明质酸酶活性-反应初速率曲线Fig.6 Curves for hyaluronidase activity-initial reaction rate
以1.0、2.0、3.0、4.0、5.0 mmol/L 透明质酸钾为底物,加入0.8、1.2、1.6、2.0、2.4 mg/mL多糖溶液,测定其在18 min 时的吸光度。以反应速率的倒数(1/V)为纵坐标,加入反应体系前底物透明质酸钾浓度的倒数(1/[S])为横坐标绘图,以确定多糖对透明质酸酶抑制作用类型[18],结果见图7。由此可知,曲线在X轴的负半轴几乎交于一点,属于非竞争性抑制类型[19],表明底物浓度升高不能降低多糖对透明质酸酶的抑制活性。
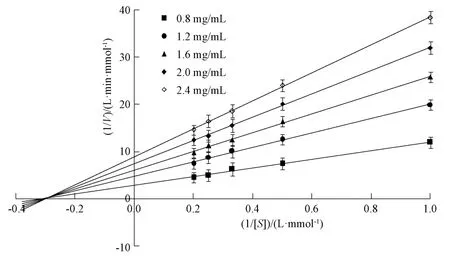
图7 多糖Lineweaver-Burk 曲线Fig.7 Lineweaver-Burk curves for polysaccharides
3 讨论
本实验在单因素试验的基础上采用Box-Behnken 设计优化石榴瓤多糖提取工艺,得到最佳条件为料液比1∶22 g/mL,超声时间35 min,超声温度48.5 ℃,多糖得率为7.13%,与预测值7.14%接近,表明工艺准确可靠。
透明质酸能在具有一定活性透明质酸酶的条件下水解,产生β-N-乙酰葡糖胺,后者可在碱的催化下与乙酰丙酮缩合而形成生色原,它在酸性条件下与Ehrlich 试剂缩合显色,缩合产物在530 nm波长处有最大吸收,故通过可见分光光度法测定β-N-乙酰葡糖胺含有量可得知透明质酸被水解的程度,进而间接判断透明质酸酶活性,该成分含有量越高,酶活性也越高,反之则越低,上述方法即为国际通用的Elson-Morgan 法。本实验采用该方法测定石榴瓤多糖体外抑制透明质酸酶活性,发现其IC50为1.723 mg/mL,表明其抑制作用较强。
由此推测,石榴瓤多糖对透明质酸酶的抑制机理可能是前者作用于后者上的活性位点,并优先以非共价键结合,使后者无法再作用于底物透明质酸,导致其活性暂时丧失;或两者以共价键的形式结合而发生反应,使后者结构改变,丧失其催化透明质酸水解的活性位点,从而永久性失活。

