氢溴酸樟柳碱对血液流变学、微循环和血小板聚集的影响
许 欣,潘 媛,谢晓芳,唐光梅,彭 成
(成都中医药大学药学院 西南特色中药资源重点实验室,四川 成都 611137)
氢溴酸樟柳碱(Anisodine Hydrobromide,AH)是从茄科(Solanaceae)植物唐古特山莨菪Anisodus tanguticaMaxim[Anisodus tanguticus(Maxim)Pascher 中提取得到的一种中枢性抗胆碱药[1]。其药理活性广泛,具有散大瞳孔、对抗乙酰胆碱降压、松弛平滑肌痉挛、缓解有机磷中毒与预防组织胺性哮喘的效果,通过离体兔耳灌流实验发现对血管呈现低剂量(5 μg/kg)时有扩张血管的作用,和高剂量时(2 000 μg/kg)收缩血管作用[2]。已开发的成药如氢溴酸樟柳碱注射液可用于治疗偏头痛型血管性头痛[3]、视网膜血管痉挛[4]、青光眼[5]和缺血性脑卒中[6]等疾病。可见,氢溴酸樟柳碱对血管性疾病具有一定的预防和治疗作用,这与其具有血管活性有关。此外,以往的报道证明氢溴酸樟柳碱具有改善微循环障碍作用[7]。现代研究发现,中医血瘀证的病理生理基础与血管痉挛、血液流变学改变和微循环障碍等有关[8]。然而氢溴酸樟柳碱对血液或血管的作用缺乏较系统的研究。
研究团队前期研究表明氢溴酸樟柳碱对缺血性脑卒中大鼠有保护作用,有效剂量为0.3~2.4 mg/kg[9-13]。本实验从局部微循环和整体血流变以及血小板上研究氢溴酸樟柳碱对血瘀证的影响。选择经典的盐酸肾上腺素复加冰水浴的方法复制血瘀症模型、肾上腺素致小鼠耳廓微循环障碍模型和Dextran T-500 致小鼠脑膜微循环障碍模型,及体外ADP 诱导的血小板聚集法,研究氢溴酸樟柳碱对血液系统中在血液流变学、微循环和血小板聚集的影响,为临床应用提供依据。
1 材料
1.1 动物 KM 小鼠,SPF 级,雌雄各半,体质量(20±2)g,购自成都达硕实验动物有限公司,生产许可证号SYXK(川)2015-30;SD 大鼠,SPF 级别,雌雄各半,体质量(200±20)g,成都达硕实验动物有限公司,生产许可证号SCXK(川)2015-30;实验兔,雌雄各半,体质量(2~2.5)kg,成都达硕实验动物有限公司,生产许可证号SCXK(川)2018-17。
1.2 药物与试剂 氢溴酸樟柳碱(高效液相色谱,纯度>98.5%,批号140903)购自成都第一药业有限公司,临用前用蒸馏水配制成实验所需浓度;尼莫地平注射液(规格10 mL∶10 mg,拜耳医药保健有限公司广州分公司,批号BXHP921),临用前用生理盐水配成0.05 mg/mL 备用;阿司匹林[西格玛奥德里奇(上海)贸易有限公司,批号MKBQ8 444 V];阿魏酸钠(源叶生物科技有限公司,批号H26M6L1);腺苷-5′-二磷酸钠盐[西格玛奥德里奇(上海)贸易有限公司,批号SLBL1 267 V];盐酸肾上腺素注射液[规格1 mL∶1 mg,远大医药(中国)有限公司提供,批号170902],临用前配成0.1 mg/mL 备用;Dextran T-500(规格为10 g,北京索莱宝科技有限公司,批号826C052),临用前用蒸馏水配成10%溶液备用。
1.3 仪器 PeriFlux 6000(瑞典Perimed AB 公司);BL-420 医学图像分析系统(成都泰盟科技公司);UB203 型正置生物显微镜(重庆澳浦光电技术有限公司);SA-6000 自动血流变测试仪(厦门海菲生物技术有限公司);血小板聚集仪(北京赛科希德科技发展有限公司)。
2 方法
2.1 大鼠血瘀证实验 取SD 大鼠56 只,雌雄各半,待适应环境后,按体质量随机分为正常组、模型组、阿司匹林组(16 mg/kg)及氢溴酸樟柳碱高、中、低、极低剂量(2.4、1.2、0.6、0.3 mg/kg),每组8 只。连续尾静脉给药7 d,在第8 天,除空白组外,其余各组均颈背部皮下注射1 mg/kg 盐酸肾上腺素溶液,2 h 后大鼠在冰水(4 ℃)游泳5 min;2 h 后,再次皮下注射盐酸肾上腺素溶液(1 mg/kg)。禁食20 h 后,腹主动脉取血,采用SA-6000自动血流变测试仪器检测全血黏度切变率1、全血切变率5、全血切变率30、全血切变率200、血浆黏度、压积、全血高切相对指数、全血低切相对指数、红细胞聚集指数、全血低切还原黏度、全血高切还原黏度、红细胞刚性指数、红细胞变形指数TK 和血浆纤维蛋白原等血液流变学指标。
2.2 小鼠微循环障碍实验
2.2.1 小鼠软脑膜微循环实验 取KM 小鼠70 只,雌雄各半,待适应环境后,按质量随机分为正常组、模型组、尼莫地平组(0.5 mg/kg)及氢溴酸樟柳碱高、中、低、极低剂量组(2.4、1.2、0.6、0.3 mg/kg),每组10 只。小鼠用10%水合氯醛腹腔注射进行麻醉后,剪开头部顶骨处的皮肤,将多普勒血流仪的激光光纤探头置于两侧颞骨正中位置,用胶水固定。观察多普勒显示器所显示的血流灌溉量和灌溉曲线的变化,待血流灌溉曲线稳定,然后,各组小鼠尾静脉注射相应药物预防给药,给药15 min 后测得给药后的血流灌溉量(a1)。再除正常组外,其余各组尾静脉注射10% Dextran T-500 溶液,正常组给予等体积生理盐水,记录造模后15 min 时的血流灌溉量(a2),计算并比较不同组的血流灌溉量变化率(A)。
A=[(a1-a2)/a1]×100%。
非洲猪瘟病毒和经典猪瘟病毒若要通过饲料传播,饲料需被病毒污染且以传染性形式存活。不幸的是,在跨境运输中,仅少数饲料原料做了病毒存活性评估,来自美国多个委员会的一份关于饲料原料安全性的联合文件给出了用于评估原料传播风险的决策树。
2.2.2 小鼠耳廓微循环实验 按照“2.2.1”项下分组。采用10%水合氯醛腹腔注射小鼠进行麻醉,将麻醉后的小鼠耳廓平整的铺在载玻片上,滴加一两滴液体石蜡固定,在透射光下用100 倍镜下,用BL-420 医学图像分析系统观察小鼠正常状态下的耳廓微循环,用全自动图像分析仪上的显微镜微尺测量记录血管输入直径、血管输出直径,并观察记录血管数目和血管交叉网数目。待图像稳定后,在耳廓表面滴加0.1 mL 盐酸肾上腺素溶液进行造模,15 min后,用吸水纸吸去剩余的盐酸肾上腺素溶液,同前法测量并记录各指标的值;随后各组立即尾静脉注射相应药物,模型组和正常组注射等剂量的生理盐水,阳性对照组注射等剂量的尼莫地平溶液,观察并记录给药后15、30、45、60 min 时耳廓微循环各指标的值。
2.3 ADP 诱导的兔体外血小板聚集实验
2.3.1 富血小板血浆(PRP)贫血小板血浆(PPP)的制备 正常家兔心脏取血20 mL,3.8%枸橼酸钠(1∶9)抗凝,上下轻轻颠倒摇晃,使抗凝剂与血液均匀混合,血液第1 次以800 r/min 离心10 min,分离上层血浆;再以相同的转速和时间进行第2 次离心,取出上层血浆,即得PRP。取第1 次离心的下层血液,以3 500 r/min 离心10 min,取上层血浆即得PPP。
2.3.2 最大聚集率的测定和抑制率的计算 取上述两种血浆,用PPP 调零,以PRP 为血小板供体。受试药物每个浓度设六个平行样本。取7 个比浊管,加入280 μL PPP,正常组PPP 中加入10 μL 生理盐水,阿魏酸钠Ⅰ组PPP 中加入10 μL 100 mmol/L 阿魏酸钠溶液,阿魏酸钠Ⅱ组PPP 中加入10 μL50 mmol/L 阿魏酸钠溶液,阿魏酸钠Ⅲ组PPP 中加入10 μL 25 mmol/L 阿魏酸钠溶液;氢溴酸樟柳碱Ⅰ组PPP 中加入10 μL 100 mmol/L 氢溴酸樟柳碱溶液,氢溴酸樟柳碱Ⅱ组PPP 中加入10 μL 50 mmol/L 氢溴酸樟柳碱溶液,氢溴酸樟柳碱Ⅲ组PPP 中加入10 μL 25 mmol/L 氢溴酸樟柳碱溶液。另取7 个比浊管,加入280 μL PRP,在PRP 中加入10 uL 上述各组溶液,作为待测溶液。将血小板聚集仪预热至37 ℃后,先在各自的空白溶液中加入10 μL 生理盐水,放入测试孔中调零。然后换成相对应的待测溶液,预热60 s,加入10 μL 腺苷-5′-二磷酸钠盐溶液,按比浊法(光学法)用血小板聚集仪测定血小板最大聚集率。按公式计算提取物或阳性药血小板聚集的抑制率。重复上述操作六次。聚集抑制率=(对照组血小板最大聚集率-给药组血小板最大聚集率)/对照组血小板最大聚集率。
2.4 统计学分析 采用SPSS 22.0 软件进行数据资料的统计分析,正态计量资料以()表示,多组间比较采用单因素方差分析。以P<0.05 表示差异具有统计学意义。
3 结果
3.1 氢溴酸樟柳碱对血瘀证大鼠血液流变学的影响 从表1~4 可知。与正常组相比较,模型组除血浆黏度外的其他血液流变学参数均升高(P<0.01)。与模型组相比,阿司匹林组和氢溴酸樟柳碱各组可降低全血黏度切变率、全血还原黏度(低切、高切)、全血相对指数(高切、低切)及红细胞聚集指数、红细胞刚性指数、红细胞变形指数(P<0.05,P<0.01)。
表1 氢溴酸樟柳碱对急性血瘀证大鼠全血黏度的影响(,mPa·s,n=8)
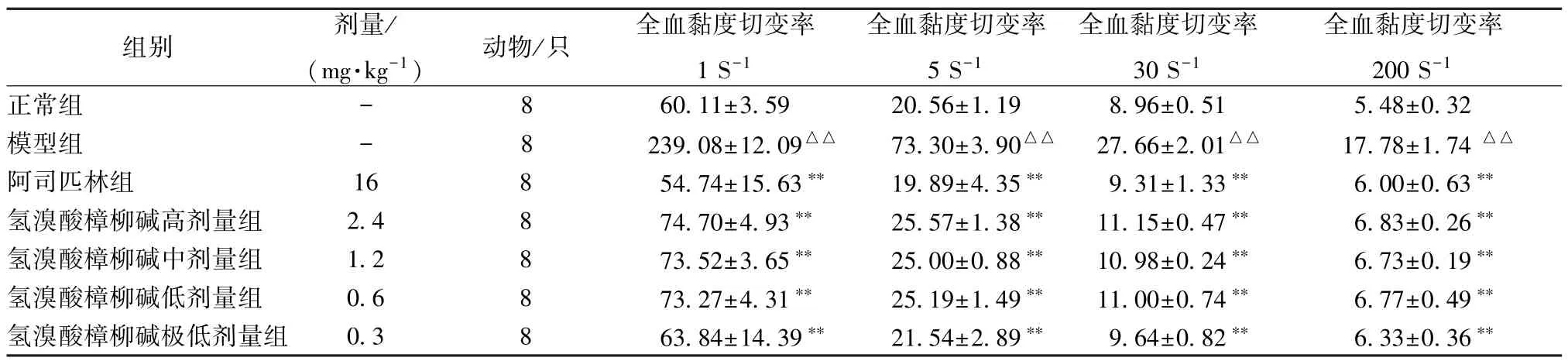
表1 氢溴酸樟柳碱对急性血瘀证大鼠全血黏度的影响(,mPa·s,n=8)
注:与正常组比较,△△P<0.01;与模型组比较,**P<0.01。
表2 氢溴酸樟柳碱对急性血瘀证大鼠血浆黏度、还原黏度的影响(,mPa·s,n=8)
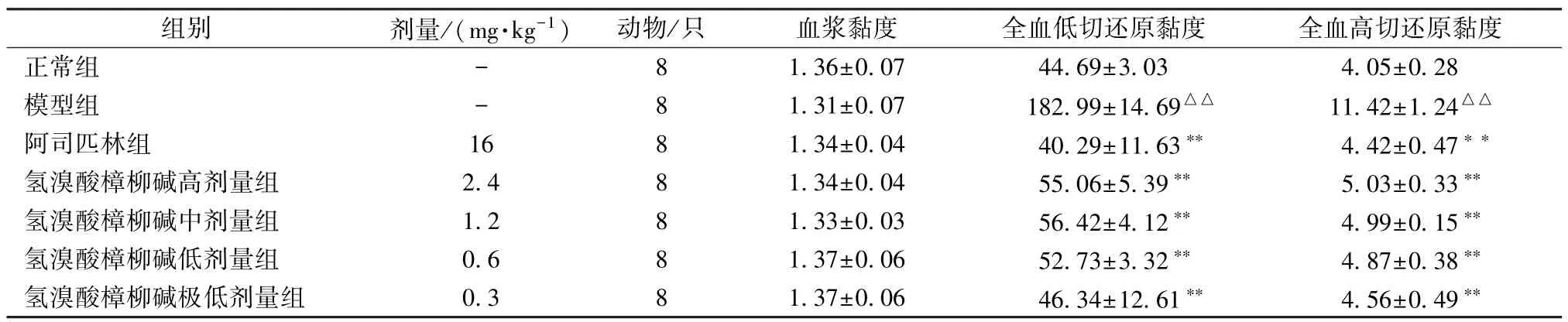
表2 氢溴酸樟柳碱对急性血瘀证大鼠血浆黏度、还原黏度的影响(,mPa·s,n=8)
注:与正常组比较,△△P<0.01;与模型组比较,**P<0.01。
表3 氢溴酸樟柳碱对急性血瘀证大鼠压积、全血相对指数及红细胞聚集指数的影响(,n=8)
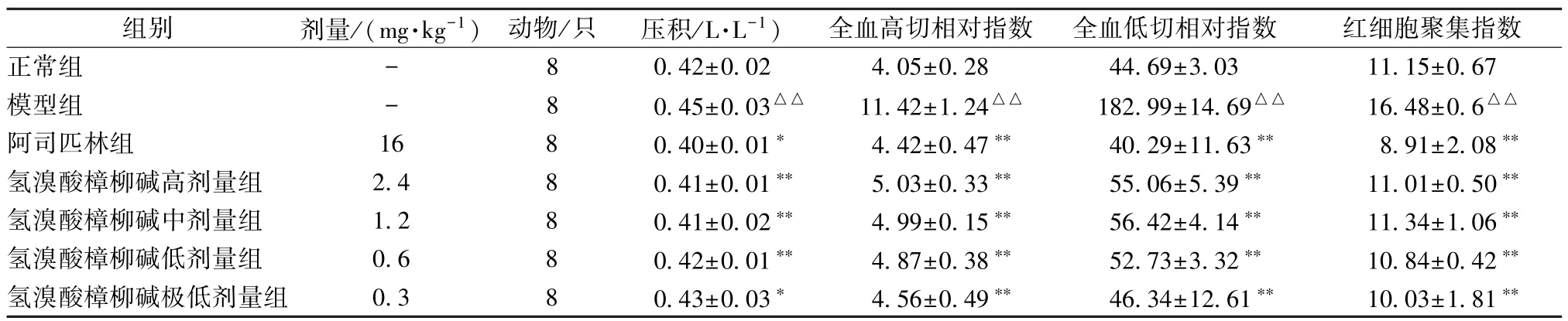
表3 氢溴酸樟柳碱对急性血瘀证大鼠压积、全血相对指数及红细胞聚集指数的影响(,n=8)
注:与正常组比较,△△P<0.01;与模型组比较,*P<0.05,**P<0.01。
表4 氢溴酸樟柳碱对红细胞刚形指数、红细胞变形指数TK 及血浆纤维蛋白原的影响(,n=8)
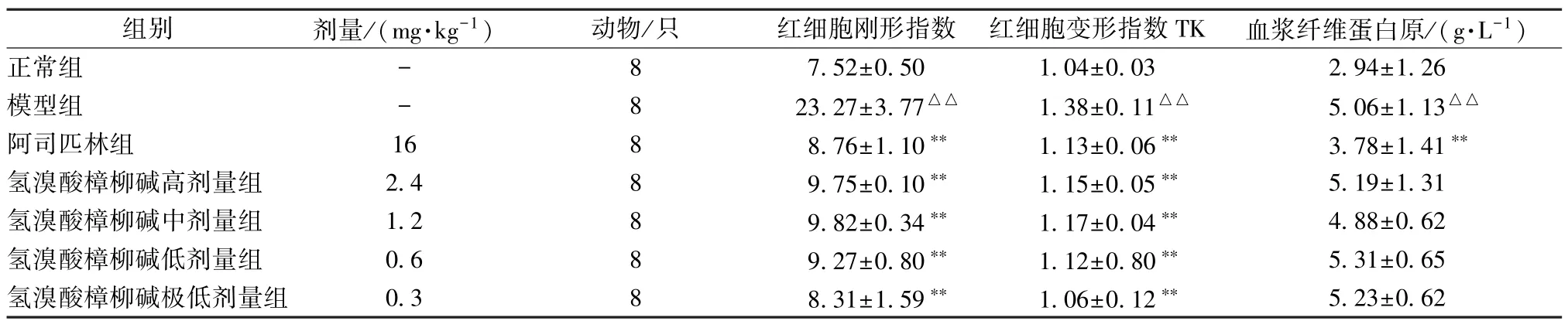
表4 氢溴酸樟柳碱对红细胞刚形指数、红细胞变形指数TK 及血浆纤维蛋白原的影响(,n=8)
注:与正常组比较,△△P<0.01;与模型组比较,**P<0.01。
3.2 氢溴酸樟柳碱对脑膜微循环障碍的影响 在软脑膜微循环实验中,正常小鼠造模前后,血流灌溉曲线平稳,波动较小,而模型组小鼠在尾静脉注射10% DextranT-500 溶液后,血流灌溉曲线迅速下降,溉灌量变化率升高(P<0.05)。与模型组比较,氢溴酸樟柳碱各剂量和尼莫地平均能减少血液灌溉量的变化率,其中以氢溴酸樟柳碱高剂量组和尼莫地平组最明显(P<0.05)。各组小鼠的脑部微血管的血流灌溉量的变化结果见图1、表5。
3.3 氢溴酸樟柳碱对耳廓微循环障碍的影响 正常小鼠耳廓微血管轮廓清晰、供血丰富、呈树状分布,毛细血管较多,且红细胞呈线性流动,无血流淤滞现象。模型组耳廓微血管轮廓模糊不清,血管直径减小,毛细血管减少,红细胞呈粒性流动,偶见血流淤滞现象。氢溴酸樟柳碱各剂量组和尼莫地平组均能改善小鼠的耳廓微循环障碍(图2~3)。
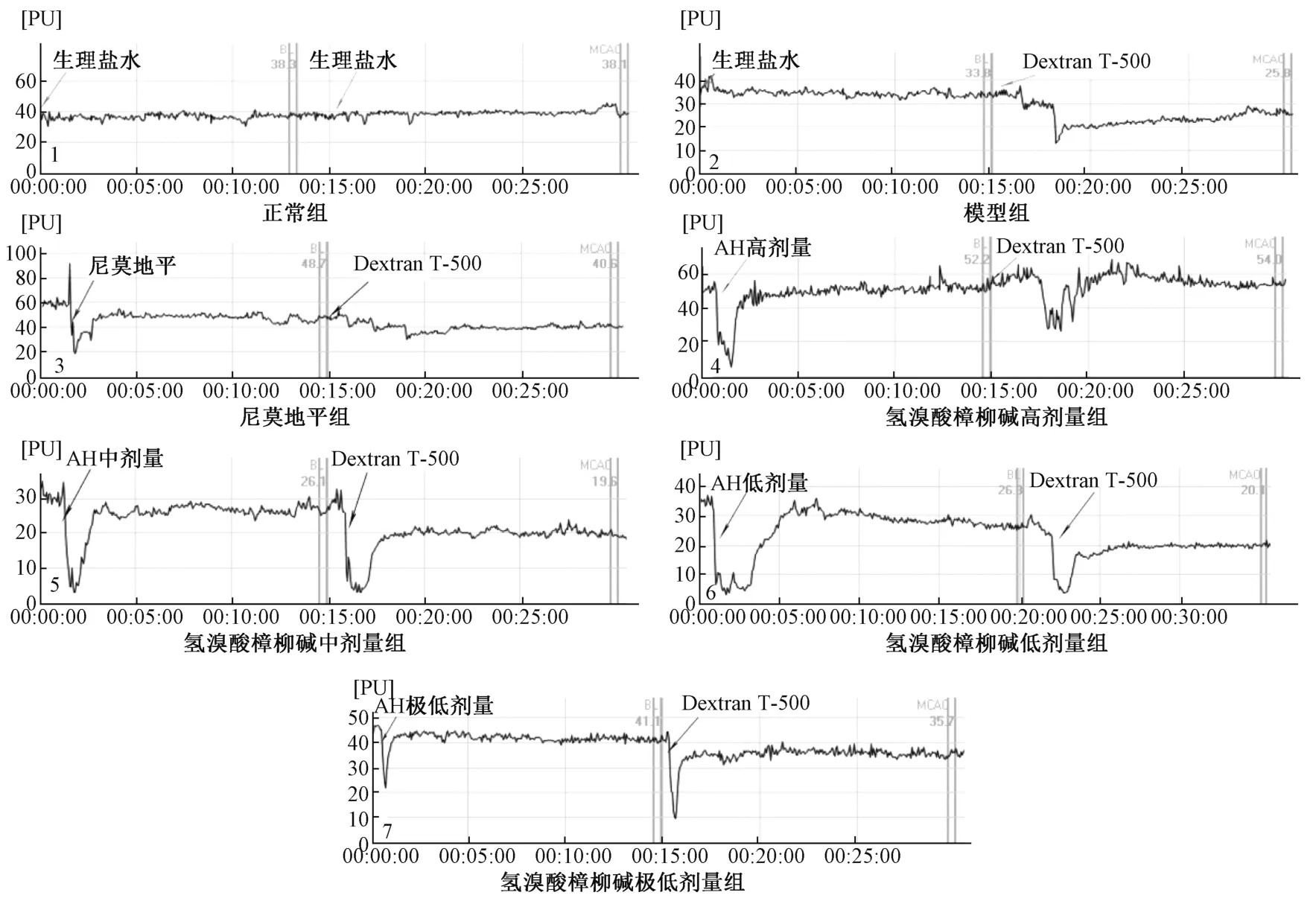
图1 氢溴酸樟柳碱对脑膜微循环障碍小鼠脑膜血流灌溉曲线的影响

图2 氢溴酸樟柳碱对小鼠耳廓微循环障碍的影响(输入/输出血管直径,60 min)
3.3.1 氢溴酸樟柳碱对耳廓微循环障碍小鼠血管输入直径的影响 模型组小鼠耳廓血管输入直径减小,且持续至60 min仍低于正常组(P<0.01)。与模型组比较,尼莫地平组给药15 min 后,血管输入直径开始恢复,给药45 min时,血管输入直径增加(P<0.01);氢溴酸樟柳碱高剂量组给药后15 min 血管输入直径开始恢复,(P<0.05,P<0.01)。氢溴酸樟柳碱中剂量组给药后15 min 血管输入直径也开始恢复(P<0.01)。氢溴酸樟柳碱低剂量组给药15 min后血管输入直径开始恢复,但极低剂量组在各阶段并无明显增加。见表6。

图3 氢溴酸樟柳碱对小鼠耳廓微循环障碍的影响(血管数目/血管交叉网,60 min)
表5 氢溴酸樟柳碱对脑膜微循环障碍小鼠脑膜血流灌溉量的影响(,n=10)
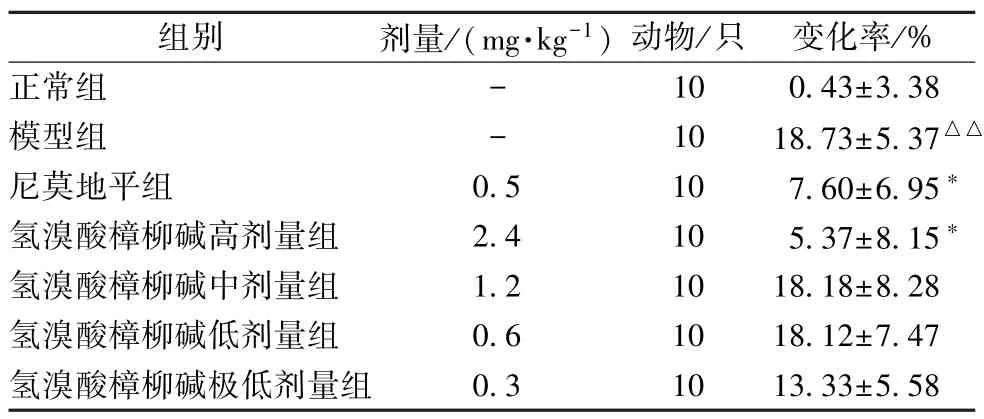
表5 氢溴酸樟柳碱对脑膜微循环障碍小鼠脑膜血流灌溉量的影响(,n=10)
注:与正常组比较,△△P<0.01;与模型组比较,*P<0.05。
3.3.2 氢溴酸樟柳碱对耳廓微循环障碍小鼠血管输出直径的影响 正常组小鼠血管输出直径在实验时间内无明显变化。与正常组比较,模型组小鼠耳廓血管输出直径减小,且持续至60 min 仍低于正常组。与模型组比较,氢溴酸樟柳碱高、中、低剂量组在给药60 min 内的各个时间点的血管输出直径均与模型组无明显差异尼莫地平组在给药后各阶段血管输出直径显著升高(P<0.05)但氢溴酸樟柳碱极低剂量组的血管输出直径较模型组进一步减小,且随着给药时间的增加变化不大。见表7。
表6 氢溴酸樟柳碱对耳廓微循环障碍小鼠血管输入直径的影响(,μm,n=10)

表6 氢溴酸樟柳碱对耳廓微循环障碍小鼠血管输入直径的影响(,μm,n=10)
注:与正常组比较,△P<0.05,△△P<0.01;与模型组比较,*P<0.05;**P<0.01。
3.3.3 氢溴酸樟柳碱对耳廓微循环障碍小鼠血管数目的影响 正常组小鼠血管数目在实验时间内无明显变化。与正常组比较,模型组小鼠造模后其耳廓血管数目明显减少,并持续至60 min 后(P<0.01)。与模型组比较,尼莫地平组和氢溴酸樟柳碱高、中、低剂量组给药15 min 后,血管数目显著性增加,且随着给药时间延长和剂量的增加开放数目不断增加,甚至大于正常组,呈明显量-时-效正相关(P<0.01);氢溴酸樟柳碱极低剂量组无明显作用。结果见下表8。
3.3.4 氢溴酸樟柳碱对耳廓微循环障碍小鼠血管交叉网的影响 正常组小鼠血管交叉网在实验时间内无明显变化。与正常组比较,模型组小鼠在造模后耳廓血管交叉网数目显著减小(P<0.01),且持续至60 min 仍低于正常组。与模型组比较,尼莫地平组和氢溴酸樟柳碱高、中、低剂量能明显增加血管交叉网数目,自给药15 min 时即有显著作用(P<0.01),且呈明显量-时-效正相关,作用与对血管数目的影响一致;氢溴酸樟柳碱极低剂量无明显作用。见表9。
表7 氢溴酸樟柳碱对耳廓微循环障碍小鼠血管输出直径的影响(,μm,n=10)
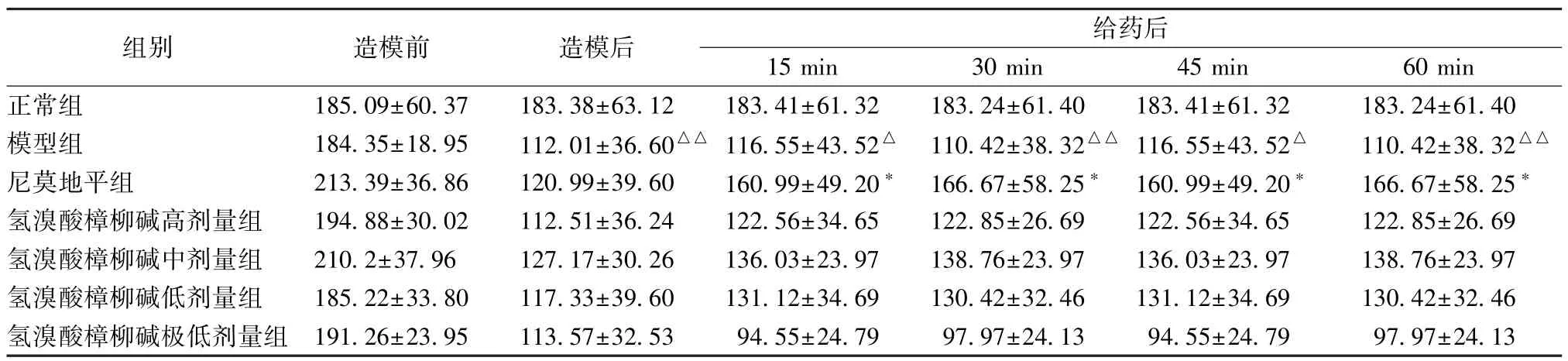
表7 氢溴酸樟柳碱对耳廓微循环障碍小鼠血管输出直径的影响(,μm,n=10)
注:与正常组比较,△P<0.05,△△P<0.01;与模型组比较,*P<0.05。
表8 氢溴酸樟柳碱对耳廓微循环障碍小鼠血管数目的影响(,个,n=10)
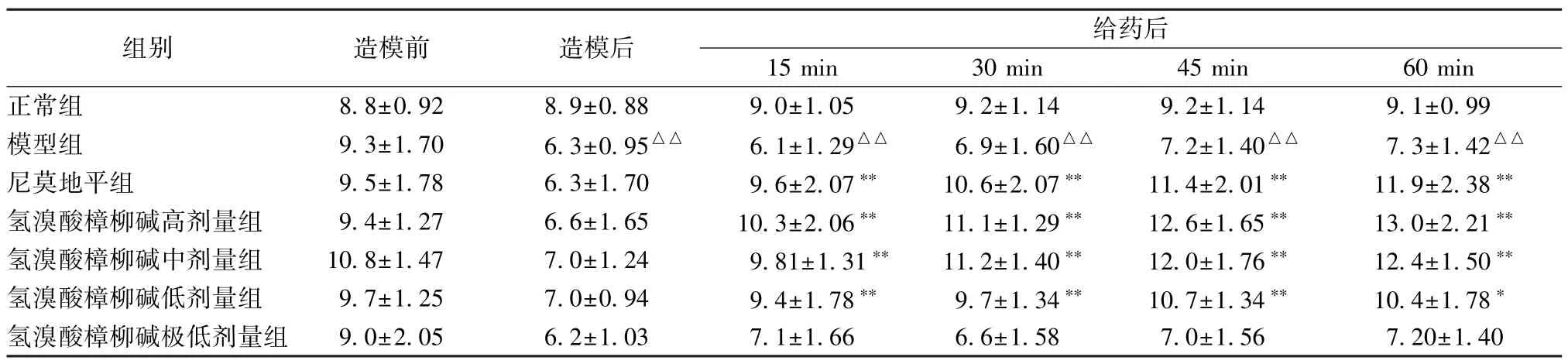
表8 氢溴酸樟柳碱对耳廓微循环障碍小鼠血管数目的影响(,个,n=10)
注:与正常组比较,△△P<0.01;与模型组比较,**P<0.01。
表9 氢溴酸樟柳碱对耳廓微循环障碍小鼠血管交叉网的影响(,个,n=10)
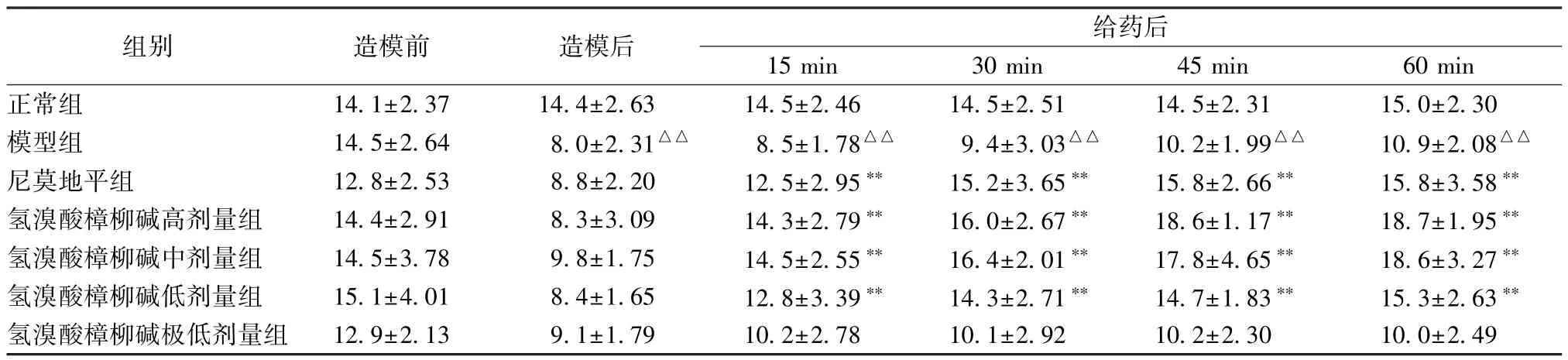
表9 氢溴酸樟柳碱对耳廓微循环障碍小鼠血管交叉网的影响(,个,n=10)
注:与正常组比较,△△P<0.01;与模型组比较,**P<0.01。
3.4 氢溴酸樟柳碱对ADP 诱导体外血小板最大聚集率的影响 从表10 可知,与正常组比较,阳性药阿魏酸钠呈剂量依赖性抑制ADP 诱导的家兔血小板聚集,差异具有显著性(P<0.01);给药组氢溴酸樟柳碱Ⅰ组、Ⅱ组和Ⅲ组能明显的抑制ADP 诱导的家兔血小板聚集(P<0.01),没有明显的剂量依赖性。
表10 氢溴酸樟柳碱对ADP 诱导下的血小板聚集的影响(,n=6)

表10 氢溴酸樟柳碱对ADP 诱导下的血小板聚集的影响(,n=6)
注:与正常组比较,**P<0.01。
4 讨论
血瘀会造成血流灌溉量的减少,营养物质和氧气不能满足组织细胞氧化代谢的需要,CO2等新陈代谢废物不能及时排除,氧气不能及时的更替,引起组织细胞损伤,导致相应器官的功能紊乱,严重者造成器官功能衰退[14]。血瘀发生期间,去甲肾上腺素、肾上腺素和儿茶酚胺分泌量会显著升高,通过与α2肾上腺素受体结合,血小板被激活,联合其他的刺激因素会导致红细胞聚集指数增强、全血黏度增加[15]。
高分子右旋糖苷[16]或盐酸肾上腺素[17]复制血瘀证模型为经典的复制血瘀证的方法,动物静脉注射高分子右旋糖苷会造成动脉和静脉血流速度减慢,血流灌溉量降低,部分微血管内可以观察到红细胞聚集[18]。氢溴酸樟柳碱的适应症中如偏头痛、缺血性脑卒中等,在中医临床上常有血瘀的病理表现,故本文采用经典的盐酸肾上腺素溶液复加冰水浴诱导的大鼠急性血瘀证大鼠模型;另外,氢溴酸樟柳碱主治的病症多与脑部血管和微循环有关,故本文在采用经典的盐酸肾上腺素致小鼠耳廓微循环障碍模型的基础上,还选用了尾静脉注射高分子右旋糖酐法复制小鼠脑膜微循环障碍模型,从预防和治疗两方面探究氢溴酸樟柳碱对微循环障碍的作用,使其更加符合本药的临床应用特点。ADP 诱导的兔体外血小板聚集实验也是也是经典而稳定的方法,适用于本文的研究目的。通过上述模型和方法,从血液流变学、微循环和血小板三个方面探讨氢溴酸樟柳碱对血流的影响。
血液流变学是研究循环血液流动性、变形性、凝固性、黏弹性以及心血管黏滞性的的科学,现代研究表明,但人体患心血管疾病时,血液的流变性发生异常,从而引起全身或局部循环或微循环障碍[19]。而血液的黏、浓、凝、聚是临床上造成心血管疾病的重要原因。全血黏度主要取决于红细胞数量的多少和性能,血浆的黏度主要取决于血浆蛋白的含量[20]。全血黏度的增高会引起红细胞变形性降低和聚集性增高,使黏度进一步增高、使血流进一步变慢,这样有利于血小板的粘附和聚集,最终导致心血管疾病[21]。本研究也进一步验证了血瘀证会使大鼠全血的的高切黏度、中切黏度、低切黏度、压积、全血高切还原黏度、全血低切还原黏度、全血高切相对黏度、全血低切相对黏度、红细胞变形指数、红细胞聚集指数、红细胞刚性指数均显著性的升高;软脑膜微循环障碍和耳廓微循环障碍会导致小鼠软脑膜血流灌溉量显著性的减少、血流速度变慢、血管变窄、血管数目变少、血管交叉变少和血细胞变形,导致血液瘀滞。
本实验研究发现,氢溴酸樟柳碱能改善急性血瘀证模型大鼠的大部分血流变指标,以及改善微循环障碍小鼠的病理状态。氢溴酸樟柳碱能减低血瘀证模型大鼠的全血黏度、压积、全血还原黏度、全血相对黏度、红细胞变形指数、红细胞聚集指数、红细胞刚性指数的值,而对血浆纤维蛋白原、血浆黏度的值无明显作用。氢溴酸樟柳碱能改善减低微循环障碍造成的血流灌溉量的减低,以及通过舒张血管、增加微血管数目、增加血管交叉点的数目改善小鼠的耳廓微循环障碍。体外实验证明,氢溴酸樟柳碱能抑制ADP 诱导的血小板聚集,降低血小板最大聚集率。
综上所述,氢溴酸樟柳碱能改善急性血瘀证和微循环障碍模型的血液血流和血管状态,及抗血小板聚集,结合本药的适应症,提示氢溴酸樟柳碱治疗缺血性脑卒中、视网膜病变、偏头痛等疾病的机制之一可能与血液系统和血管活动有关。
——护肾

