产低温几丁质酶菌株的筛选、鉴定与产酶条件优化
陈立功,吴家葳,张庆芳,迟乃玉,王晓辉,*
(1.大连大学生命科学与技术学院,辽宁大连 116622;2.辽宁省海洋微生物工程技术研究中心,辽宁大连 116622)
几丁质(chitin)是自然界含量十分丰富的生物多糖,是N-乙酰氨基葡萄糖单体的天然多聚体[1-2]。几丁质在自然界中广泛存在,真菌、昆虫外骨骼及节肢动物外壳中都含有几丁质成分。它是海洋中虾蟹壳的主要成分,主要是作为结构物质起支撑和保护的作用[3-4]。几丁质主要来源于海洋,但每年有超过8万吨几丁质被视为废物丢弃[5-6]。近些年来随着人们对海洋的不断探索,对海洋资源的不断开发利用,以及在环境保护、能源利用等领域的研究进展,人类越来越认识到几丁质作为地球上含量丰富的天然多糖,具有被变废为宝的潜力。研究显示,几丁质降解后产生的不同聚合度的几丁寡糖或几丁单糖,具有良好的诱导植物抗病性及抗菌等作用,被广泛地应用于农业、保健及化妆品等行业[7-10]。
几丁质酶(chitinase,EC 3.2.1.14)通过水解β-(1→4)糖苷键降解几丁质,广泛存在于各种真菌、细菌、动植物中[10-11]。因几丁质酶能够通过降解真菌细胞壁及昆虫外骨骼中的几丁质成分,对其产生杀伤作用,故在农业中可用来抑菌和杀虫[12-15]。几丁质的生物降解主要是通过几丁质酶来实现的,相比于物理降解法和化学降解法,生物降解法具有高效绿色等优势[16-17]。
近些年来,微生物几丁质酶系的研究已经较为系统,但海洋来源的几丁质酶的相关研究较少[18]。报道发现的几丁质酶大多为中高温酶,需要在40~50 ℃温度下充分发挥作用,限制了其应用范围,增加了生产成本[19-20]。海洋微生物产生的低温酶由于其特殊的晶体结构使其比中温酶、高温酶更有优势。该酶具有低温下高酶活力及高催化效率、结构高效柔顺性和热不稳定性(经过温和的热处理,在不影响产品品质的情况下即可使低温酶的活力丧失)等生物学特性[21-23]。目前,国内外研究中未见发光杆菌属菌株产低温几丁质酶的发酵条件优化的相关报道。
本研究选取具有低温、低光照等特点的海洋环境[24-25]为菌株来源库,以渤海海域海泥为样品,经平板筛选得到产低温几丁质酶的菌株,对其进行了形态学鉴定、分子生物学鉴定及最佳产酶条件的单因素优化。
1 材料与方法
1.1 材料与仪器
菌种来源 中国辽宁大连渤海海域海底泥(123°391′E,39°6972′N);筛选培养基 胶体几丁质1.0 g/L,蛋白胨10.0 g/L,K2HPO45.0 g/L,KH2PO45.0 g/L,NaCl 5.0 g/L,MgSO4·7H2O 5.0 g/L,ZnSO4·7H2O 5.0 g/L,FeSO4·7H2O 5.0 g/L,琼脂1.5%~2.0%,海水,pH7.0;发酵培养基、2216E种子培养基 参考王晓辉等[26]的配方;几丁质 生工生物工程(上海)股份有限公司;蛋白胨 北京奥博星生物技术有限责任公司;其它试剂 均为国产分析纯。
LTI-700低温恒温培养箱 上海爱朗仪器有限公司;CRY-2112恒温摇床 上海茸研仪器有限公司;Thermo Multiskan1510酶标仪 芬兰Labsystems公司;CI-L型显微镜 日本Nikon公司。
1.2 实验方法
1.2.1 胶体几丁质 根据王晓辉等[26]的方法进行1%胶体几丁质的制备。
1.2.2 筛选方法 菌株初筛:取海泥样品加入无菌水中,轻微振荡使其完全溶解。梯度稀释后按梯度(10-4、10-5、10-6)涂布于筛选培养基上培养,挑取产生透明圈的菌株进行划线纯化。菌株复筛:1%接种量将菌株接种至发酵培养基进行发酵培养,20 ℃、160 r/min培养2~3 d后进行酶活验证,取发酵液10000 r/min离心10 min,取上清液检测酶活。
1.2.3 酶活测定 取上清0.5 mL,与0.5 mL 1%胶体几丁质混合,35 ℃下水浴保温15 min,10000 r/min离心5 min,取上清200 μL煮沸5 min,冷却后,加入200 μL DNS溶液煮沸5 min,冷却后加入600 μL超纯水,10000 r/min离心10 min,取200 μL于96孔板中测定OD520,三组平行实验[27]。酶活单位定义(U):在上述条件下,催化产生l μmol N-乙酰-D-氨基葡萄糖所需的酶量。
1.2.4 菌株鉴定 形态学鉴定:参考《常见细菌系统鉴定手册》进行形态学鉴定;分子生物学鉴定:将菌株送往上海京通生物科技有限公司进行16S rDNA鉴定。
1.2.5 生长曲线与产酶曲线 5 mL种子培养基中接种纯化菌株的单菌落,并于20 ℃、160 r/min的摇床中培养24 h。
生长曲线测定:1%接种量将种子液接种至100 mL 2216E培养基,20 ℃、160 r/min发酵,4 h检测一次OD600。三组平行实验。
产酶曲线测定:1%接种量将种子液接种至100 mL发酵培养基,20 ℃、160 r/min发酵,4 h检测一次酶活。三组平行实验。
1.2.6 发酵产酶条件优化试验 碳源种类优化:碳源种类为胶体几丁质、粉状几丁质、k-卡拉胶、褐藻酸钠、壳聚糖、淀粉、发酵用麸皮、发酵用秸秆粉、微晶纤维素、羧甲基纤维素钠,碳源添加量为5.0 g/L,胰蛋白胨5.0 g/L,发酵温度20 ℃,装液量100 mL/250 mL,接种量1%,于160 r/min摇床中培养80 h,检测酶活。
碳源添加量优化:胶体几丁质添加量为2.0、4.0、6.0、8.0、10.0、12.0、14.0 g/L,胰蛋白胨5.0 g/L,发酵温度20 ℃,装液量100 mL/250 mL,接种量1%,于160 r/min摇床中培养80 h,检测酶活。
氮源种类优化:氮源种类为胰蛋白胨、酵母粉、酵母膏、玉米浆、牛肉膏、硫酸铵、硝酸钾、硝酸铵、尿素,氮源添加量为5.0 g/L,胶体几丁质12.0 g/L,发酵温度20 ℃,装液量100 mL/250 mL,接种量1%,于160 r/min摇床中培养80 h,检测酶活。
氮源添加量优化:酵母膏添加量为2.0、4.0、6.0、8.0、10.0、12.0 g/L,胶体几丁质12.0 g/L,发酵温度20 ℃,装液量100 mL/250 mL,接种量1%,于160 r/min摇床中培养80 h,检测酶活。
发酵温度优化:胶体几丁质12.0 g/L,酵母膏6.0 g/L,发酵温度为5 ~50 ℃,梯度间隔为5 ℃,装液量100 mL/250 mL,接种量1%,于160 r/min摇床中培养80 h,检测酶活。
发酵初始pH优化:胶体几丁质12.0 g/L,酵母膏6.0 g/L,发酵温度为15 ℃,初始pH为3.0~12.0,装液量100 mL/250 mL,接种量1%,于160 r/min摇床中培养80 h,检测酶活。
装液量优化:胶体几丁质12.0 g/L,酵母膏6.0 g/L,发酵温度为15 ℃,初始pH7.0,装液量为(25、50 、75、100、125、150、175 mL)/250 mL,接种量1%,于160 r/min摇床中培养80 h,检测酶活。
接种量优化:胶体几丁质12.0 g/L,酵母膏6.0 g/L,发酵温度为15 ℃,初始pH7.0,装液量为75 mL/250 mL,接种量为0.4%、0.8%、1%、2%、3%、4%、5%、6%,于160 r/min摇床中培养80 h,检测酶活。
发酵转速优化:胶体几丁质12.0 g/L,酵母膏6.0 g/L,发酵温度为15 ℃,初始pH7.0,装液量为75 mL/250 mL,接种量1%,发酵转速为80~240 r/min,梯度间隔为20 r/min,培养80 h,检测酶活。
发酵时间优化:胶体几丁质12.0 g/L,酵母膏6.0 g/L,发酵温度为15 ℃,初始pH7.0,装液量为75 mL/250 mL,接种量1%,发酵转速220 r/min,每隔12 h检测酶活。
所有实验均为三组平行。
1.3 数据分析
使用GraphPad Prism 8.0.1软件对发酵条件优化数据进行处理,所有实验均为三组平行。
2 结果与分析
2.1 菌株筛选与鉴定结果
筛选培养基培养3 d后,平板上长出带有透明圈的菌株,挑取该菌株进行三区划线纯化。纯化后得到单菌落接种于发酵培养基,发酵后进行酶活检测复筛,确定该菌株为产几丁质酶菌株,命名为LG-1。
形态学鉴定结果:将菌株LG-1划线在固体发酵培养基上,20 ℃生长2 d后观察菌落形态,单个菌落呈白色或淡黄色,不透明,表面光滑且边缘整齐,中间略厚,易挑取;挑取单菌落染色后进行显微形态观察,该菌株为两端圆的短杆状,无芽孢;简单染色及革兰氏染色结果表明,该菌为革兰氏阴性杆菌,参考《常见细菌系统鉴定手册》可以初步判断为发光杆菌属,具体判断需要进一步进行16S rDNA序列测定,如图1。
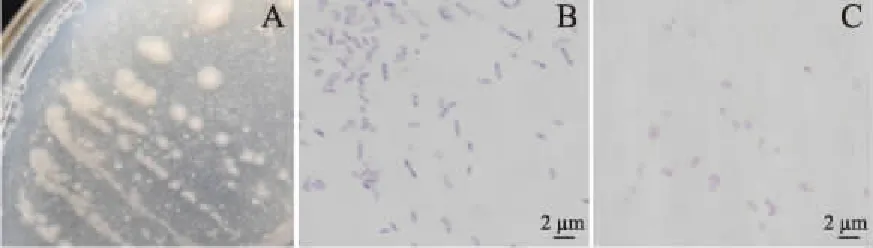
图1 菌株LG-1的菌落形态和显微形态
分子生物学鉴定结果:将16S rDNA测序结果与GenBank数据库基因序列进行比较,搜索得到同源性达到99%以上的菌株,均为发光杆菌。结合形态学特征综合比较,确定菌株LG-1为发光杆菌属,图2为Photobacteriumsp. LG-1的系统发育树。

图2 Photobacterium sp. LG-1的16S rDNA的序列系统发育树
2.2 生长曲线与产酶曲线测定
如图3所示,菌株LG-1在该条件下培养时,接种后发酵培养8 h内为延滞期,此阶段菌株生长缓慢,酶活性较低;此后菌株进入对数生长期,此阶段增殖加快,发酵液内菌体浓度迅速增加,这一阶段几丁质酶活性亦快速升高;大约52 h时菌株生长进入稳定期,此阶段菌株代谢活动减慢,增殖速度随之降低,发酵液内菌体浓度相对稳定;菌株生长进入72 h后,缓慢进入衰亡期,此阶段菌株增殖速度小于死亡速度,可能因为发酵进入此时期时,发酵液内营养物质消耗过多,不能满足大量菌体生长繁殖需要。菌株LG-1在发酵培养及中培养80 h时几丁质酶活达到最大值,为0.932 U/mL。确定该菌株产酶最适培养时间为80 h。
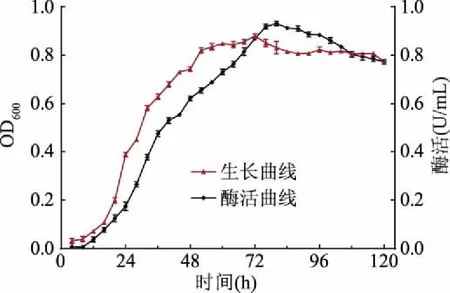
图3 几丁质酶产生菌LG-1生长曲线及产酶曲线
2.3 菌株LG-1产酶条件优化
2.3.1 碳源种类优化结果 由图4可以看出,几丁质是该菌株生长产酶的优良碳源,且胶体几丁质比晶体粉状几丁质对菌株产酶有更好的诱导能力,确定胶体几丁质是诱导菌株LG-1产酶的最优碳源。k-卡拉胶、褐藻酸钠、淀粉、发酵用麸皮、发酵用秸秆粉有一定的诱导产酶能力。
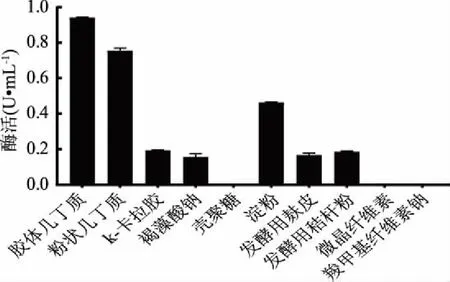
图4 碳源种类对酶活的影响
2.3.2 碳源添加量优化结果 在一定浓度范围内,胶体几丁质浓度与几丁质酶活性呈正比例关系(如图5),且当胶体几丁质浓度处于较低浓度时,其浓度的改变会对几丁质酶活性产生明显影响;当发酵液中胶体几丁质浓度为12 g/L时,几丁质酶的酶活达到最高,超过12 g/L后几丁质酶活下降。因此,确定最佳胶体几丁质浓度为12 g/L。
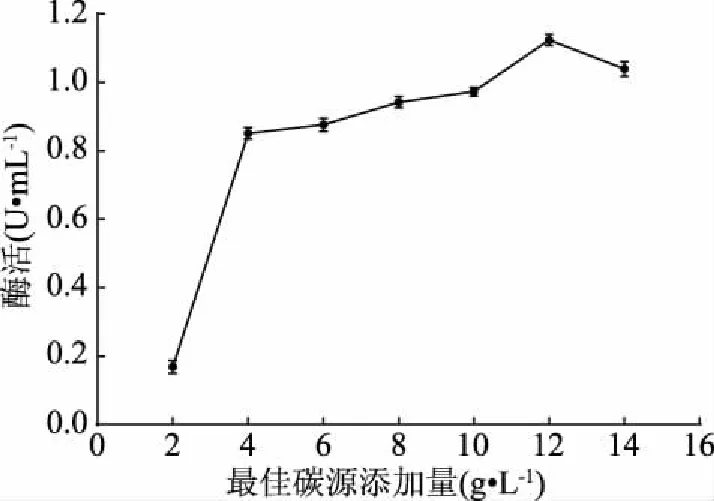
图5 胶体几丁质浓度对酶活的影响
2.3.3 氮源种类优化结果 结果如图6所示,酵母膏是菌株LG-1产几丁质酶的最优氮源,且胰蛋白胨、牛肉膏对菌株产几丁质酶亦有较好的诱导作用;相比而言,硝酸钾、酵母粉及硫酸铵诱导菌株产酶的能力相对较弱;而有机氮源中的玉米浆、无机氮源中的硝酸铵和尿素则不能诱导菌株产生几丁质酶。
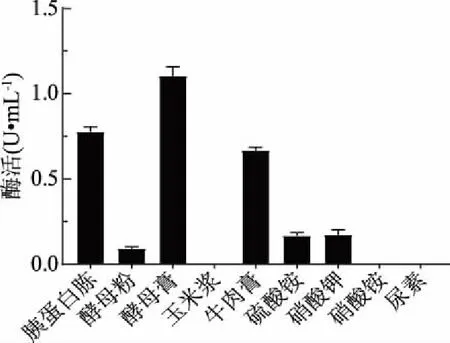
图6 氮源种类对酶活的影响
2.3.4 氮源添加量优化结果 由图7可知,低浓度和高浓度的酵母膏都不利于菌株LG-1产几丁质酶,随着酵母膏浓度增加,几丁质酶活性先升高后下降,几丁质酶的活性在酵母膏浓度为6 g/L时达到最大。因此,确定最佳酵母膏浓度为6 g/L。
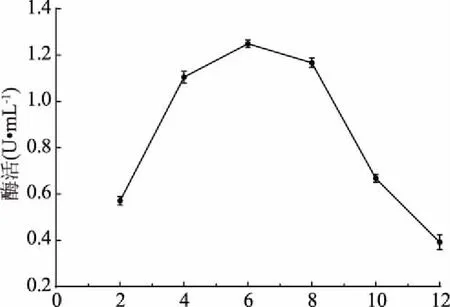
图7 酵母膏浓度对酶活的影响
2.3.5 发酵温度优化结果 由图8可知,当发酵温度为15 ℃时,菌株LG-1发酵液中的几丁质酶活性最高,且当发酵温度为5 ℃时,此时温度较低,大多数菌株在此温度下生长代谢缓慢或处于休眠状态[4],而菌株LG-1却仍能生长产酶;当发酵温度增加至30 ℃后,几丁质酶活性很低,相比较而言,该菌株在相对较低温度下更利于产酶。因此,最佳发酵温度为15 ℃。
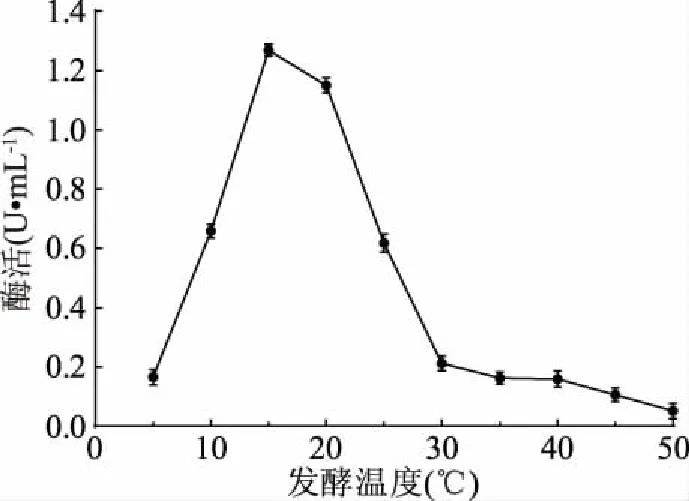
图8 发酵温度对酶活的影响
2.3.6 初始pH优化结果 如图9所示,菌株LG-1在pH7.0时产酶活力最高,表明菌株在偏中性的环境中更易生长产酶,在pH6~8范围内菌株产酶能力较高,环境过酸过碱都会影响几丁质酶的活性。因此,确定最佳发酵培养基初始pH为7.0。
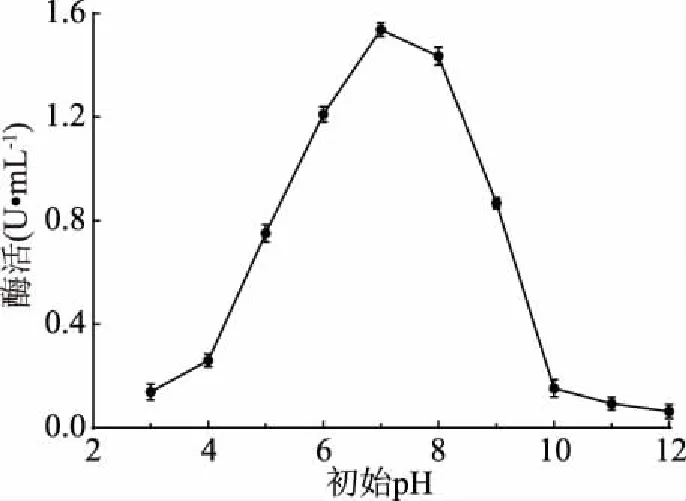
图9 初始pH对酶活的影响
2.3.7 装液量优化结果 由图10可知,当装液量为75 mL/250 mL时菌株LG-1产酶最高,增大或减少装液量都会使酶活性降低,较高的装液量直接影响培养基中的溶氧,说明菌株LG-1为需氧发酵。因此,确定最适装液量为75 mL/250 mL。
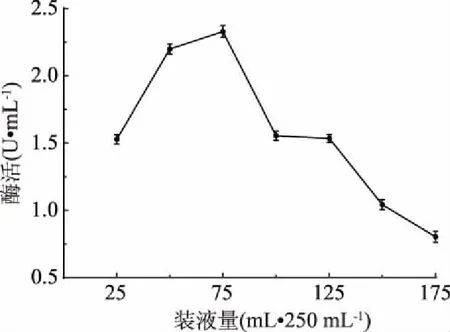
图10 装液量对酶活的影响
2.3.8 接种量优化结果 如图11所示,接种量为1%时,几丁质酶活性最高,几丁质酶活性随着接种量的增大而降低,这可能是因为过高的接种量会使培养基中物质急剧消耗,较高的菌浓度会大量消耗培养基中的氧气。故1%为菌株LG-1的最佳接种量。

图11 接种量对酶活的影响
2.3.9 发酵转速优化结果 结果如图12所示,较低转速菌株LG-1产酶能力较低,随着发酵转速的增加,几丁质酶活性增加,当转速为220 r/min时,酶活达到最高点,增大转速可以增加培养基中的溶氧量,结合装液量和接种量优化结果,说明菌株LG-1发酵对溶氧量要求较高。因此,确定最适发酵转速为220 r/min。

图12 转速对酶活的影响
2.3.10 发酵时间优化结果 由图13可知,相比于优化前,菌株快速产酶时间有所推迟,从48 h开始酶活性急剧增加,在96 h时酶活达到最高,为4.566 U/mL。
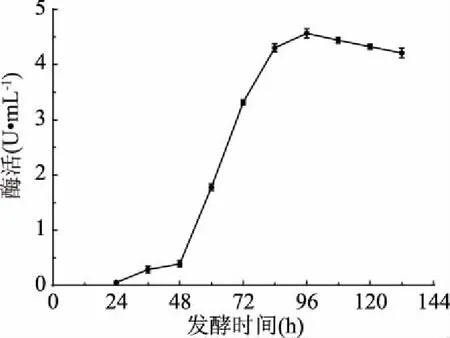
图13 发酵时间对酶活的影响
3 结论与讨论
从“适者生存”的观点出发,能够在海洋这种低温、低光照环境中生存的微生物,其自身及其产生的酶极有可能具备耐低温和低温下仍然具有较高活力的特点。所以,本研究以海洋底泥为样品,筛得1株产几丁质酶活力较高的菌株,经形态学鉴定及分子生物学鉴定为革兰氏阴性发光杆菌,命名为Photobacteriumsp. LG-1,酶活复筛证明该菌株对几丁质有较好的降解作用。
本实验筛选到的产几丁质酶细菌LG-1对胶体几丁质及晶体粉状几丁质有很好的降解作用,且两者诱导产酶相差不大,自然状态下,几丁质以晶体形式存在,胶体几丁质需要通过在粉状几丁质中加入强酸并通过一定过程才能制成,增加了生产成本且造成了环境污染及资源浪费[28-30]。LG-1对晶体几丁质的降解能力使得其完全可以直接以虾蟹壳为原料,进行低温几丁质酶的诱导分泌,大大降低了成本。同时LG-1还有较好的淀粉酶活性,对k-卡拉胶、褐藻酸钠、发酵用麸皮、发酵用秸秆粉有一定降解能力,具有广阔的工业应用前景。
为了获得更多高活性、高质量的低温几丁质酶,对菌株LG-1最佳产酶条件进行了单因素优化,实验结果表明,菌株LG-1在不同培养条件下产酶能力有很大差异,胶体几丁质和酵母膏能够大量诱导菌株产酶;菌株在较低温度下产酶能力明显强于高温,这可能与菌株来源和低温几丁质酶特性有关;装液量、接种量及发酵转速结果表明,较低的装液量和较高的转速更利于菌株产酶,说明菌株发酵产酶对溶氧量需求较高。发酵条件优化结果为:胶体几丁质12.0 g/L、酵母膏6.0 g/L、初始pH7.0、装液量75 mL/250 mL、接种量1%、海水1 L,在15 ℃,220 r/min培养96 h,酶活力达4.566 U/mL,相比于未优化前的酶活0.932 U/mL,提高了389.91%。且该菌所产几丁质酶在低温下仍有很高活性,若应用于工业生产会大大降低生产成本,具备较大的应用潜力。
本研究从产低温几丁质酶菌株筛选开始,对所获得菌株Photobacteriumsp. LG-1进行了发酵条件的单因素优化,大大提高了菌株Photobacteriumsp. LG-1的产酶活性。下一步研究方向会在单因素优化的基础上,对菌株产酶活性进行响应面的优化,完成系统性的产酶优化过程,进一步提高其产酶活性,并对其发酵条件进行5 L放大,满足基本实验需求的同时,逐渐向工业化发酵产酶迈进。本实验为下一步几丁质酶的酶学性质研究及产业应用提供参考。

